乌拉尔甘草离体再生与遗传转化技术的研究
2016-12-06胡海英张芮段艳慧谢应忠
胡海英,张芮,段艳慧,谢应忠*
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
乌拉尔甘草离体再生与遗传转化技术的研究
胡海英1,张芮2,段艳慧2,谢应忠1*
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学生命科学学院,宁夏 银川 750021)
研究乌拉尔甘草离体再生受体系统和遗传转化技术方法,为甘草基因工程育种提供前期实验基础。以乌拉尔甘草茎段为外植体,试验筛选最适不定芽分化培养基和增殖壮苗培养基; 以乌拉尔甘草茎段为受体,利用农杆菌介导法对乌拉尔甘草进行GUS和GFP基因的遗传转化研究。结果表明,以乌拉尔甘草去腋芽茎段为外植体,其不定芽最适分化和增殖培养基配方为MS+0.1 mg/L TDZ+0.1 mg/L 6BA+0.1 mg/L IBA,不定芽分化率达38.8%,增殖倍数3.67,适宜的壮苗培养基为MS+0.5 mg/L NAA。与去腋芽茎段相比,带腋芽茎段的不定芽分化率达100%,能够在含抗生素的选择培养基MS+0.1 mg/L TDZ+0.1 mg/L 6BA+0.1 mg/L IBA+50 mg/L Kan+250 mg/L Car上存活,确定为最适转化受体;带腋芽茎段在分化培养基上预培养7 d后,经OD600=0.6的菌液侵染10 min,共培养3 d,在选择培养基上培养20 d,其不定芽分化率为43.75%,经GFP荧光检测可得到78.88%的GFP基因瞬时表达率;随机选取5株再生转化植株,经PCR检测,均有GFP和GUS基因的目的条带,GFP基因表达较强烈,初步获得了5个株系的阳性转化植株。
乌拉尔甘草;茎段;不定芽分化;遗传转化;绿色荧光蛋白
乌拉尔甘草(Glycyrrhizauralensis)属于豆科(Leguminosae)甘草属(Glycyrrhiza)多年生草本植物,也是荒漠半荒漠地区重要的防风固沙植物和大宗道地药材[1];此外,还广泛用于食品、饮料、卷烟业和化妆品工业[2-4],具备生态和经济的双重价值。在宁夏境内主要分布在盐池县、同心县、灵武市等干旱、半干旱风沙区。近年来,随着对甘草需求量的增大,野生甘草资源日渐减少,市场上主要以人工栽培甘草为主来取代野生甘草,但现有甘草品种在长期栽培过程中只种不选,感染病毒、品种混杂现象严重,导致药材的产量和质量下降,这些问题制约着宁夏甘草产业的发展。因此,运用基因工程开展甘草遗传转化、性状改良和优良品种选育研究是当前保证高质量甘草药材生产亟待解决的关键理论和技术问题[5-6]。目前,利用Ti质粒将目标基因成功转化甘草的研究报道较少,均存在甘草再生率低,再生系统和转化条件不稳定等制约问题[5-9],多集中在应用发根农杆菌Ri质粒转化药用植物建立的毛状根培养体系研究方面[5-7]。资料显示,以甘草子叶节、侧芽茎段为外植体,可得到较高的不定芽分化率[10-11];以甘草下胚轴、子叶为外植体,不定芽分化较为困难[12]。绿色荧光蛋白(green fluorescent protein, GFP)是来源于发光生物水母(Aequoreavitoria)体内的一种发光蛋白,能够自身催化形成生色团并在蓝光或紫外光激发下发出绿色荧光,能在活细胞内稳定表达,GFP基因作为新型的报告基因在植物遗传转化的研究中得到了广泛应用[13-14]。为研究GFP在甘草中的表达,进一步优化甘草离体再生和遗传转化技术方法,研究了甘草茎段离体再生和增殖壮苗技术方法,并应用于以农杆菌介导的GFP基因的遗传转化,筛选出了最适转化条件,得到了经PCR检测为阳性的转化植株,为甘草基因工程育种提供前期实验基础。
1 材料与方法
1.1 材料与处理
供试材料为乌拉尔甘草种子,由宁夏盐池沙标子甘草种植基地提供。农杆菌菌株为EHA105,携带GUS/GFP基因的农杆菌双核质粒pKAFCR21表达载体由宁夏大学生命科学学院陈任教授提供。培养基采用MS基本培养基,其中琼脂6 g/L,蔗糖30 g/L,pH值5.8,添加植物激素有6-苄基氨基嘌呤(6-benzyladenine, 6-BA)、噻苯隆(thidiaxuron, TDZ)、α-萘乙酸(α-naphthalene acetic acid, NAA)和吲哚乙酸(indole-3butyric acid, IBA)。诱导培养基添加乙酰丁香酮(acetosyringone, AS),选择培养基添加卡那霉素(kanamycin, Kan)和羧卞青霉素(carbenicillin, Car)。消毒液选用上海宇涵生物科技公司生产的新一代无毒级杀菌消毒剂爱立克。RNAprep Pure 多糖多酚植物总RNA提取试剂盒购自北京天根生物科技有限公司。
2014年5月开始乌拉尔甘草种子的无菌培养试验,乌拉尔甘草种子经75%酒精(无菌水配制)浸泡40 s,消毒液浸泡20 min去菌后无菌播种,获得甘草无菌实生苗。
1.2 乌拉尔甘草去腋芽茎段不定芽分化、增殖及壮苗培养基的筛选
经无菌播种获得的甘草试管苗切成1.0 cm长去腋芽茎段,接种到含有不同浓度的6-BA、TDZ、IBA正交设计[L9(33)]的培养基中(表1),30 d后统计不定芽的分化情况。得到的再生不定芽进行增殖培养后,在5种培养基配方中筛选适宜的壮苗培养基,培养基分别为MS+0.5 mg/L IBA;1/2 MS;1/2 MS+0.5 mg/L IBA; 1/2 MS+0.5 mg/L NAA;MS+0.5 mg/L NAA。培养条件:光照16 h/d,光强:2000 lx,培养温度为(25±1) ℃。每个培养基处理重复3次。
1.3 乌拉尔甘草遗传转化条件的筛选
1.3.1 最适转化条件的试验筛选 无菌条件下,将无菌苗茎段切成0.5~1.0 cm长,平放于筛选出的分化培养基中,预培养时间7 d。培养条件:黑暗培养,温度(25±1) ℃。
将准备好的转化菌培养物于6000 r/min离心5 min,弃去上清液,用液体培养基悬浮,使其OD值分别为OD600=0.4,0.6,0.8,1.0。将经过预培养的材料分别投入4种不同浓度的菌液中进行侵染,每个浓度的菌液分别设4个侵染的时间梯度,分别为5,10,15,20 min,将外植体取出后,用无菌的滤纸吸去多余的菌液,然后将外植体放入诱导培养基(筛选出的分化培养基添加20 mg/L AS)中进行共培养3 d,以未感染的茎段作对照,培养条件:黑暗培养,温度(25±1) ℃。然后转接到选择培养基(筛选出的分化培养基添加50 mg/L Kan和250 mg/L Car)进行选拔培养,培养条件为:每天光照16 h, 光照强度2000 lx,温度(25±1) ℃。每个处理重复3次。
1.3.2GFP表达荧光检测 选择培养基上培养20 d后,利用徕卡荧光显微镜DM2500检测转化外植体和再生不定芽GFP基因的瞬时表达。
1.3.3 转化再生植株PCR检测 获得的乌拉尔甘草转化苗在筛选出的壮苗培养基(添加50 mg/L Kan+250 mg/L Car)培养4周后,随机提取5株再生植株进行PCR检测。将待检测植株和对照植株的叶片用CTAB(十六烷基三甲基溴化胺,cetyltrimethyl ammonium bromide)法[15]提取总DNA,因农杆菌双核质粒pKAFCR21表达载体携带GFP和GUS基因,分别设计引物,sGFP-F:5′-AGCTGGACGGCGACGTAAA-3′,sGFP-R:5′-CAGGACCATGTGATCGCGCTT-3′,GUS-F:5′-TTTAACTATGCCGGGATCCATCGC-3′,GUS-R:5′-CCAGTCGAGCATCTCTTCAGCGTA-3′,对获得的转化植株中GFP和GUS基因的表达分别进行PCR检测。预期片段大小为610 bp,用1%琼脂糖凝胶电泳检测PCR结果。反应体系25 μL,反应条件:95 ℃预变性5 min, 95 ℃ 1 min、60 ℃ 1 min、74 ℃ 2 min,30个循环,74 ℃延伸7 min,4 ℃反应结束。
1.4 数据统计
不定芽分化率(%)=(产生不定芽的外植体数量/接种的外植体数量)×100
愈伤组织诱导率(%)=(形成愈伤组织的外植体数量/接种的外植体数量)×100
GFP基因瞬时表达率(%)=(检测有荧光表现的不定芽数/产生的不定芽总数)×100
采用SAS软件对统计所得数据进行标准误及多重比较检验,SPSS软件进行方差分析。
2 结果与分析
2.1 乌拉尔甘草去腋芽茎段不定芽分化、增殖及壮苗培养
在预实验中,将6-BA和KT(kinetin,激动素)配合使用无法诱导出甘草去腋芽茎段的不定芽,只产生愈伤组织。故在正交设计的9个配方中,均添加了具有细胞分裂素作用的TDZ,其能诱导离体培养材料的多种途径形态发生,尤其在离体分化不定芽、胚状体等试验研究中常被用到[6-9]。从表1可知,添加TDZ、6BA、IBA不同激素浓度配比的培养基对甘草去腋芽茎段分化不定芽效果有一定的差异。但方差分析表明3种激素各水平之间差异不显著(表2),处理5的不定芽分化率最高(图1A),为38.8%。每个处理的材料均有不同程度的愈伤化,愈伤组织诱导率较高的处理(图1B),其未分化或未愈伤化的外植体很少有褐化或坏死现象,说明外植体材料处于良好分化潜能和状态。要保证接种外植体材料的良好状态,茎段粗壮、节间较长的外植体比较适合。因此,在分化不定芽前进行试管苗的壮苗培养非常必要。
将乌拉尔甘草带腋芽茎段与去腋芽茎段分别置于5号培养基培养,其带腋芽茎段不定芽分化率达100%,去腋芽茎段只有30.8%。经重复试验,选择5号培养基(MS+0.1 mg/L TDZ+0.1 mg/L 6BA+0.1 mg/L IBA)为最适不定芽分化培养基。得到的不定芽继续在5号培养基进行增殖培养,20 d后产生了密集丛生芽(图1C),增殖3.67倍。在培养基MS+0.5 mg/L NAA中壮苗培养30 d,不定芽伸长生长明显,节间长,叶片嫩绿,生根明显(图1D),其为最适壮苗培养基。
表1 不同激素配比对诱导乌拉尔甘草去腋芽茎段分化不定芽的影响
TDZ: Thidiaxuron噻苯隆; 6-BA: 6-benzyladenine 6-苄基氨基嘌呤; IBA: Indole-3butyric acid吲哚乙酸。下同 The same below.

表2 方差分析(F检验)结果
a.R2=0.555 (AdjustedR2=-0.186).
2.2 农杆菌介导的乌拉尔甘草遗传转化
乌拉尔甘草去腋芽茎段在分化培养基中预培养1周,经不同浓度侵染菌,侵染不同时间,共培养3 d后,经荧光显微镜检测在茎段切口处有加强荧光点,但选择培养1周后,其不定芽分化率几乎为零,且材料陆续失去活性而死亡,在有选择压和侵染菌液的条件下去腋芽茎段分化不定芽比较困难。经多次重复试验,去腋芽茎段在选择培养后无法分化不定芽而失活,不能完成转化全过程,而带腋芽茎段能够在选择培养基培养20 d后存活,且能保证较高的不定芽分化率。因此,选择带腋芽茎段作为转化受体。
乌拉尔甘草带腋芽茎段在分化培养基中预培养7 d,再经侵染菌侵染过程。GFP表达的荧光检测显示,在未转化茎段中都没有检测到荧光(图2A),转化茎段中能检测到GFP的瞬时表达(图2B),转化再生不定芽中也有GFP表达(图2C),且荧光带(点)明显。
如表3所示,甘草带腋芽茎段不定芽分化率和瞬时表达率随着侵染菌液浓度和时间的不同效果不一。在浓度为OD600=0.6的菌液侵染10 min后,共培养3 d,其不定芽分化率为43.75%,瞬时表达率达78.88%。方差分析可知不同处理得到的瞬时表达率之间有显著差异(P<0.05),而不定芽分化率差异不显著(P>0.05)。经多重比较检验,侵染菌OD600=0.6、侵染10 min条件下,其GFP瞬时表达率差异极显著,而不定芽分化率差异不显著;经重复试验,确定“预培养(图3A)7 d后,用侵染菌OD600=0.6侵染10 min,共培养(图3B)3 d”为最适侵染转化条件,在选择培养(图3C)20 d后,得到具有GFP荧光反应的不定芽(图3D)长成小植株(图3E)24株。

图1 乌拉尔甘草去腋芽茎段不定芽分化、增殖及壮苗生长过程Fig.1 The process of adventitious buds differentiation, propagation and elongation from stem without axillary buds of G. uralensis A:诱导不定芽分化; B:诱导愈伤组织形成;C:不定芽增殖培养; D:丛生芽壮苗培养。A: Differentiated adventitious buds; B: Induced callus; C: Adventitious buds propagation; D: Elongation
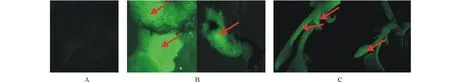
图2 GFP 在乌拉尔甘草组织中的瞬时表达Fig.2 Transient expressing of GFP gene in G. uralensis A:没有经过浸染的对照的荧光图像; B:培养20 d后的茎段伤口处GFP的瞬时表达(箭头所示); C:培养20 d后GFP在不定芽(箭头所示)中表达A: Fluorescence image of an untransformed control; B: Transient expression of GFP gene at the wounding edge (showed by arrow); C: Stable GFP expression in putative transformed bud (showed by arrow).
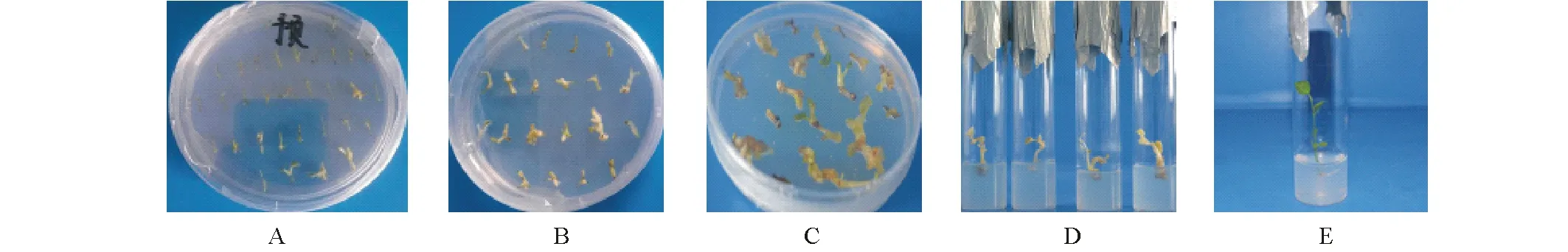
图3 农杆菌介导乌拉尔甘草茎段遗传转化获得再生转化植株的过程Fig.3 Obtaining transformed plants from stem of G. uralensis mediated by Agrobacterium A: 预培养;B:共培养; C:选择分化培养;D:转基因再生不定芽;E: 转基因再生植株。A: Pre-culturing; B: Co-culturing; C: Selective culture of adventitious buds differentiation; D: Transformed adventitious buds; E: Transformed plant.
2.3 乌拉尔甘草转基因再生植株的检测与分析
取5株乌拉尔甘草转化苗经PCR扩增反应,电泳分析结果表明,转化植株可扩增到610 bp的特异性条带,而未转化的植株中无该片段的产生,从而初步证明这5个株系的再生植株为转基因阳性植株(图4)。
3 讨论
通过组织培养和植株再生来实现遗传转化是目前最主要的方法。以根癌农杆菌介导的药用植物遗传转化体系需有较高的转化植株再生率和感染率,在这2个先决条件中,植株高效再生体系的建立非常关键,直接影响后续的遗传转化。通过不定芽或胚状体发生通常被认为是少数细胞或单细胞起源的植株再生途径,对转基因是有利的,可以避免产生嵌合体[16]。而分生组织及伴有活跃细胞分裂的外植体如茎尖、胚芽、顶芽、腋芽等作为转化受体容易出现嵌合现象,但其再生能力强大。有研究表明在含较高浓度的细胞分裂素培养基中对不定芽进行切割增殖,可能会降低嵌合体产生的比例[17]。
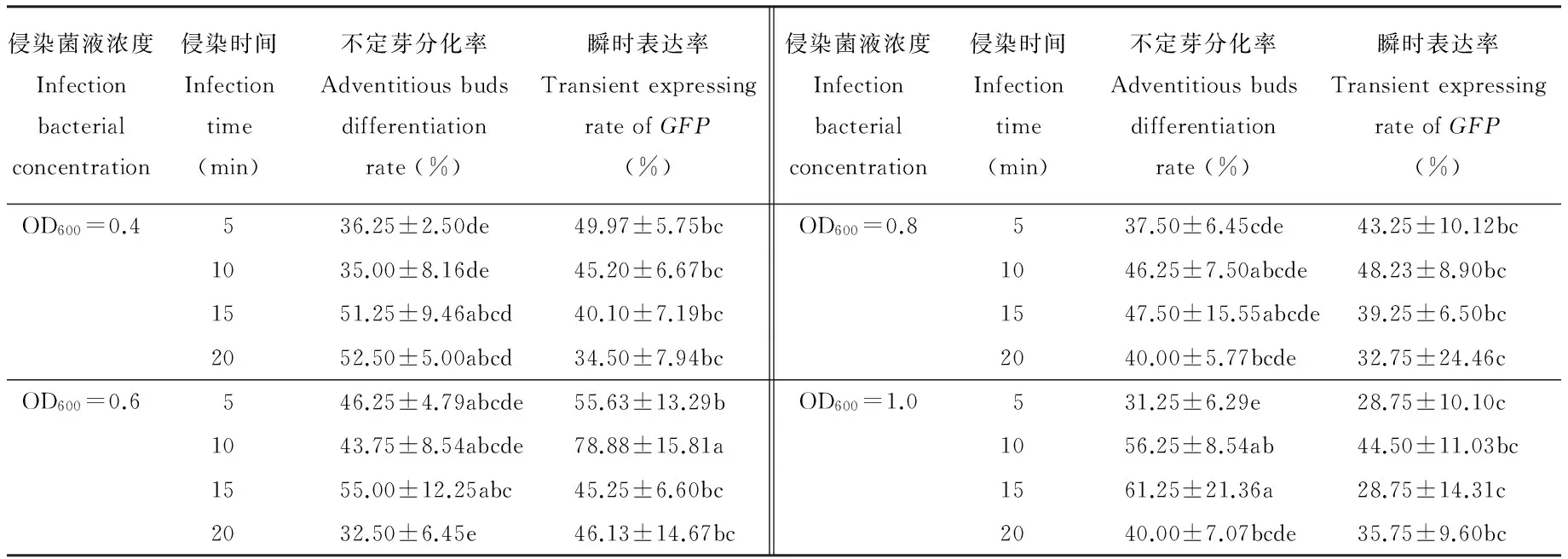
表3 不同侵染条件对乌拉尔甘草不定芽分化和GFP基因瞬时表达的影响
注: 不同小写字母代表P<0.05水平显著。
Note: Different small letters represent significant differences atP<0.05 level.
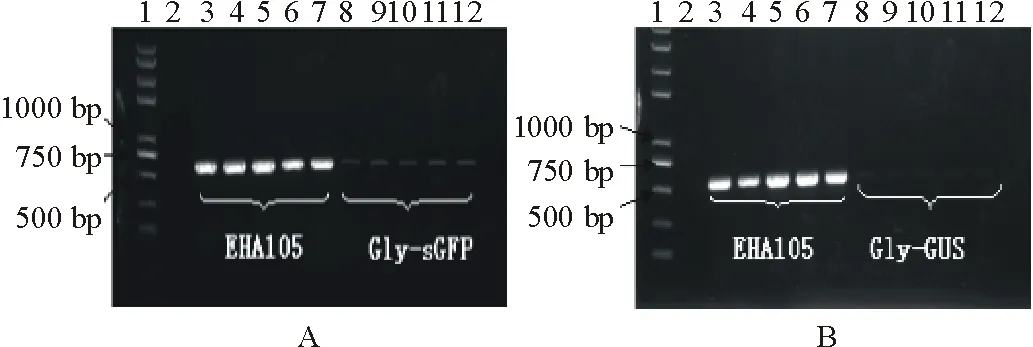
图4 转基因植株PCR 检测Fig.4 PCR identification of transformed plants A: Gly-GFP基因PCR检测电泳图;B: Gly-GUS基因PCR检测电泳图。1为Marker,2为阴性对照,3~7为阳性对照,8~12为转化植株。A: The fragment of Gly-GFP gene; B: The fragment of Gly-GUS gene. 1: Marker; Lane 2: Control; Lanes 3-7: Plasmid; Lanes 8-12: Transformed plants.
葛淑俊等[11]、雷呈[18]认为乌拉尔甘草的子叶茎段和侧芽茎段诱导的丛生苗数量多,计巧灵[10]认为甘草愈伤组织诱导比较容易,但通过愈伤组织分化不定芽较为困难,用下胚轴、子叶或去腋芽茎段均很难直接分化不定芽,分化率低,李兴欣等[9]研究认为甘草去子叶胚的不定芽分化能力最强,试管苗生根顺利,是进行甘草遗传转化的适宜外植体。从这些研究中可以看出较容易得到再生不定芽的是甘草子叶茎段、去子叶胚、带腋芽茎段,而以不带芽器官或组织(如子叶、胚轴、去芽茎段、愈伤组织等)的植株再生培养体系不稳定,重复性差,致使后续转化程序无法进行。本研究用甘草的去腋芽茎段作为外植体,在MS+0.1 mg/L TDZ+0.1 mg/L 6BA+0.1 mg/L IBA培养基上无菌培养,得到了较好的不定芽分化率,最高达38.8%;但去腋芽茎段经侵染菌液浸泡,在添加抗生素的选择培养基上培养后,无法得到稳定的不定芽分化率,且分化的不定芽存活困难,无法继续下一步的遗传转化操作试验。而带腋芽茎段不定芽分化率为100%,虽然受侵染菌液和选择培养基的影响,其分化的不定芽能够存活,且具有78.88%的GFP瞬时表达率,且GFP基因能够在甘草植株的器官和组织中充分表达,这与李兴欣等[9]的研究结果相似。
因此,本研究认为选择转化受体时,应该将来源稳定且可以大量供应的带芽组织或器官作为转化受体,其具有高效稳定的再生能力,在获得一定数量的再生转化不定芽后,采用切割增殖等方法,结合转基因PCR检测、Southern杂交、Northern杂交、RT-PCR等检测方法,可以获得非嵌合体的转基因再生植株。
[1] Zheng Y F, Wei J H, Leng K,etal. Research advances in resource chemistry and utilization of genusGlycyrrhiza. Modern Chinese Medicine, 2015, 15(10): 1096-1108.
[2] Liu Y Y, Liu C S, Zeng B F,etal. Research progress on germplasm resources ofGlycyrrhizaeRadixetRhizoma. Chinese Traditional and Herbal Drugs, 2013, 44(24): 3593-3598.
[3] Zhu X M, Di Y T, Peng S L,etal. Chemical constituents from root ofGlycyrrhizauralensis. Chinese Traditional and Herbal Drugs, 2003, 34(3): 198-201.
[4] Yang S H, Liu X F, Guo D A,etal. Effects of media and culture conditions on callus growth and flavonoid production inGlycyrrhizauralensisCalli. Journal of Jilin Agricultural University, 2005,27(3): 289-292.
[5] Huo Y Q, Ge S J, Meng Y J,etal. The progress of tissue culture of the Chinese liquorice (GlycyrrhizauralensisFisch). Chinese Agricultural Science Bulletin, 2005, 121(9): 64-66, 78.
[6] Yang R, Wang L Q, Liu Y. Research progress on tissue culture ofGlycyrrhizaeRadixetRhizoma. Chinese Traditional and Herbal Drugs, 2014, 45(6): 1796-1802.
[7] Yang S H, Liu X F, Shen X,etal. Ri plasmid transformation ofGlycyrrhizauralensisand effects of some factors on growth of hairy roots. China Journal of Chinese Materia Medica, 2006, 31(11): 875-878.
[8] Chen Z L, Liang Y L, Xianyu L Y,etal. Agrobacterium tumefaciens-mediated genetic transformation ofGlycyrrhizainflatacallus. Biotechnology, 2014, 24(2): 64-68.
[9] Li X X, Meng Y J, Luo W J,etal. Establishment of genetic transformation system ofGlycyrrhizauralensisFisch. based onGFPmarker. Crops, 2014, 4: 52-58.
[10] Ji Q L. Regenerated plantlet from salt-tolerant callus ofGlycyrrhizauralensis. Chinese Traditional and Herbal Drugs, 2006, 37(2): 265-268.
[11] Ge S J, Li G M, Ma C Y,etal. Establishment of micropropagation system ofGlycyrrhizauralensis. Acta Prataculturae Sinica, 2007, 16(6): 107-112.
[12] Fu C H, Lei C, Deng H,etal.Invitroregeneration ofGlycyrrhizahypocotyl. Journal of Huazhong Agricultural University, 2007, 26(2): 239-242.
[13] Wu R, Zhang S Z. Green fluorescent protein and its application in plant molecular biology. Molecular Plant Breeding, 2005, 3(2): 240-244.
[14] Kim C K, Chung J D, Park S H,etal.Agrobacteriumtumefaciens-mediated transformation ofRosahybrid using the green fluorescent protein (GFP) gene. Plant Cell Tissue and Organ Culture, 2004, 78: 107-111.
[15] Joseph S, Rusell D W. Molecular Cloning: A Laboratory Manual[M]. 3rd Edition. Beijing: Science Press, 2002: 487-510.
[16] Liu J P, Zheng C M. Application ofinvitroselection and somaclonal variation in improvement of disease resistance. Hereditas, 2002, 24(5): 617-630.
[17] Liu J P. Selection of gene receptor in plant transformation. Agriculture & Technology, 2003, 23(4): 97-100.
[18] Lei C. Rapid propagation of medicinalGlycyrrhizainvitro. Pharmaceutical Biotechnology, 2012, 19(1): 49-51.
[1] 郑云枫, 魏娟花, 冷康, 等. 甘草属GlycyrrhizaL.植物资源化学及利用研究进展. 中国现代中药, 2015, 15(10): 1096-1108.
[2] 刘洋洋, 刘春生, 曾斌芳, 等. 甘草种质资源研究进展. 中草药, 2013, 44(24): 3593-3598.
[3] 朱绪民, 邸迎彤, 彭树林, 等. 乌拉尔甘草中的化学成分. 中草药, 2003, 34(3): 198-201.
[4] 杨世海, 刘晓峰, 果德安, 等. 培养基及培养条件对甘草愈伤组织生长和黄酮类化合物合成的影响. 吉林农业大学学报, 2005, 27(3): 289-292.
[5] 霍云谦, 葛淑俊, 孟义江, 等. 中国甘草的组织培养的研究进展. 中国农学通报, 2005, 121(9): 64-66, 78.
[6] 杨瑞, 王礼强, 刘颖. 甘草组织培养的研究进展. 中草药, 2014, 45(6): 1796-1802.
[7] 杨世海, 刘晓峰, 沈昕, 等. 甘草Ri质粒转化及不同理化因子对甘草毛状根生长的影响. 中国中药杂志, 2006, 31(11): 875-878.
[8] 陈子龙, 梁玉玲, 鲜于梁艳, 等. 农杆菌介导的胀果甘草愈伤组织遗传转化. 生物技术, 2014, 24(2): 64-68.
[9] 李兴欣, 孟义江, 罗婉娇, 等. 基于绿色荧光标记的甘草遗传转化体系的建立. 作物杂志, 2014, 4: 52-58.
[10] 计巧灵. 甘草耐盐性愈伤组织的诱导及植株再生研究. 中草药, 2006, 37(2): 265-268.
[11] 葛淑俊, 李广敏, 马峙英, 等. 乌拉尔甘草组培再生体系的研究. 草业学报, 2007, 16(6): 107-112.
[12] 付春华, 雷呈, 邓慧, 等.甘草下胚轴离体再生体系的建立. 华中农业大学学报, 2007, 26(2): 239-242.
[13] 吴瑞, 张树珍. 绿色荧光蛋白及其在植物分子生物学中的应用. 分子植物育种, 2005, 3(2): 240-244.
[16] 刘进平, 郑成木. 体外选择和体细胞无性系变异在抗病育种中的应用. 遗传, 2002, 24(5): 617-630.
[17] 刘进平. 植物遗传转化中基因受体的选择. 农业与技术, 2003, 23(4): 97-100.
[18] 雷呈. 药用甘草离体快速繁殖体系的建立. 药物生物技术, 2012, 19(1): 49-51.
Invitroresearch on receptor regeneration and genetic transformation inGlycyrrhizauralensis
HU Hai-Ying1, ZHANG Rui2, DUAN Yan-Hui2, XIE Ying-Zhong1*
1.AgriculturalCollege,NingxiaUniversity,Yinchuan750021,China; 2.LifeScienceCollege,NingxiaUniversity,Yinchuan750021,China
A study has been undertaken to investigate the system of receptor regeneration and genetic transformation ofGlycyrrhizauralensisinvitro, in order to provide a preliminary experimental basis for breedingG.uralensisvia genetic engineering. Using stem segments as explants, tests were done to select the most appropriate medium formula for adventitious bud differentiation, propagation and elongation. Furthermore, GUS and GFP genes were transferred intoG.uralensisthroughAgrobacteriumtumefaciens-mediated transformation methods. The results showed that the optimum formula for bud differentiation and proliferation was a Murashing and Skoog (MS) medium supplemented with 0.1 mg/L thidiaxuron, 0.1 mg/L 6-benzyladenine and 0.1 mg/L indole-3butyric acid. Using this formula, the differentiation rate of adventitious buds was 38.8% and the rate of multiplication 3.67. The most suitable formula for bud elongation was a MS medium containing 0.5 mg/L α-naphthalene acetic acid. Compared to stems without axillary buds, the differentiation rate of adventitious buds reached 100%. Moreover, these buds can survive in antibiotic containers and so become the optimal transformation explants. Stems with axillary buds were pre-cultured for 7 days in the differentiation medium, then infected by an Agrobacterium tumefaciens solution (OD600=0.6) for 10 min and co-cultured for 3 days, following which the explants were transferred to a selective medium based on the differentiation medium and supplemented with 50 mg/L kanamycin and 250 mg/L carbenicillin. After 20 days, theGFPtransient expression rate reached 78.88% andGFPexpressed strongly byGFPdetection. 5 transformed plants were selected randomly for testing and the presence ofGUSandGFPgenes in the genome were confirmed by polymerase chain reaction, indicating that 5 transformed plantlets had been successfully produced.
Glycyrrhizauralensis; stem segments; adventitious bud differentiation; genetic transformation; green fluorescent protein (GFP)
10.11686/cyxb2015590
http://cyxb.lzu.edu.cn
2015-12-31;改回日期:2016-03-07
宁夏自然科学研究基金项目(NZ13034)资助。
胡海英(1976-),女,宁夏平罗人,副教授,在读博士。E-mail: haiying@nxu.edu.cn*通信作者Corresponding author. E-mail: xieyz@nxu.edu.cn
胡海英,张芮,段艳慧,谢应忠. 乌拉尔甘草离体再生与遗传转化技术的研究. 草业学报, 2016, 25(11): 50-56.
HU Hai-Ying, ZHANG Rui, DUAN Yan-Hui, XIE Ying-Zhong.Invitroresearch on receptor regeneration and genetic transformation inGlycyrrhizauralensis. Acta Prataculturae Sinica, 2016, 25(11): 50-56.
