金黄色葡萄球菌肠毒素A在免疫应答中的作用*
2016-12-06王元元胡艺丹兰景斌吴明波
王元元,胡艺丹,陈 冬,兰景斌,吴明波
成都医学院 生物医学系(成都 610500)
·论 著·
金黄色葡萄球菌肠毒素A在免疫应答中的作用*
王元元,胡艺丹,陈 冬,兰景斌,吴明波△
成都医学院 生物医学系(成都 610500)
目的 获得重组表达、纯化金黄色葡萄球菌肠毒素A(SEA),并研究其免疫增强作用。方法 利用基因工程法从金黄色葡萄球菌中克隆肠毒素A基因(sea),构建重组表达载体pET32a-sea,转化大肠杆菌(Rosetta)进行表达,并对其进行纯化;纯化后的SEA在白细胞介素2(IL-2)参与下,与半胱氨酸蛋白酶抑制剂C(CysC)进行动物免疫实验,检测其免疫增强效果。结果 纯化后的SEA产量大约为40 mg/L菌液,SDS-PAGE分析在27 kD处有单一的目的条带;与对照组相比,SEA在IL-2的参与下与抗原共同免疫,抗体效价提高2.5倍。结论 SEA能够明显增强抗原的免疫应答效果。
肠毒素A;基因工程;纯化;免疫应答
金黄色葡萄球菌肠毒素A(SEA)是由金黄色葡萄球菌分泌产生的一种特殊蛋白质,是引起细菌性食物中毒及肠胃炎的主要作用因子,按其抗原性的差异,目前可以分为11个血清型[1-3]。最早对肠毒素的研究主要集中在其抗体的制备以及检测上,但随着研究深入,发现肠毒素具有强大的免疫活化作用,无需抗原呈递细胞的加工,在极低浓度下(<0.1 pg/mL)就可以大量激活免疫细胞,使机体产生严重的免疫应答反应,因此它又被称作超抗原[4-5]。SEA被认为具有很强的促白细胞增殖、抑制肿瘤的作用,现阶段在肿瘤治疗中具有很好的应用前景[6-8]。有研究[8]证实,SEA在特定的条件下能够激活细胞的免疫系统,从而杀伤肿瘤细胞。
鉴于超抗原强大的刺激T、B淋巴细胞活化的能力,最近有研究[9]认为,超抗原在抗体制备过程中可能会增强免疫效果,但也有研究[10]发现,SEA在体外并不能直接激活T、B淋巴细胞,SEA对B淋巴细胞特异性的激活需要白细胞介素2(IL-2)的参与。为了研究超抗原对免疫反应的增强作用,本研究通过基因工程法,将超抗原A 在大肠杆菌中表达,经纯化后,获得了高纯度高产量的重组SEA,并将纯化的SEA在白细胞介素2(IL-2)存在的条件下进行免疫试验,以评估其对免疫反应的增强效应。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌、E.coilDH5α菌株、Rosetta菌株来自成都医学院实验室保存,质粒pET32a来自成都学院实验室保存,限制性内切酶EcoRI、XhoI购买自Fermentas,T4DNA连接酶购买自NEB,DNA纯化回收试剂盒购买自TIANGEN,弗氏完全、不完全免疫佐剂购买自Sigma,半胱氨酸蛋白酶抑制剂C(CysC)来自实验室纯化,CysC ELISA检测试剂盒为正能生物赠送(成都)。
1.2 方法
1.2.1 目的基因的获取 以金黄色葡萄球菌为模板,设计引物。通过PCR的方法获取SEA的目的基因。本研究利用的载体是pET32a,设计上游引物序列为GAATTC-ATGAGTAACCGATTGATT TT,下游引物序列为CTCGAG-TTGGCACAAGC CAT(斜体字母表示附加的酶切位点序列),94 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,34个循环。用限制性内切酶EcoRI、XhoI酶切载体pET32a以及PCR产物,37 ℃双酶切5 h。将处理后的载体与PCR产物胶回收。回收后产物载体与PCR产物按1∶3比例混合,用T4DNA连接酶在室温下连接10 min后,转化DH5α。涂含有氨苄青霉素的平板,37 ℃培养过夜后,挑取单克隆提质粒,送公司测序。
1.2.2 SEA的表达与纯化 将测序正确的重组质粒转化大肠杆菌Rosetta菌株,涂含有氨苄青霉素的平板,37 ℃培养过夜后,挑取单克隆接种于含有氨苄青霉素的LB培养基中,于37 ℃,220 r/min,离心半径15 cm的培养条件下,培养至OD600值约为0.6时,加入终质量浓度为0.4 mmol/L的IPTG,相同条件下诱导4 h后,8 000 r/min,离心半径15 cm,离心15 min,收菌。
将收集的菌体用Buffer A(1×PBS+10 mM咪唑)重悬,在4 ℃条件下,用高压均质机(15 000 psi)破4次,破碎后,4 ℃条件下,18 000 r/min,离心半径15 cm,离心30 min。收集上清,将上清用蛋白纯化仪(利穗,10D)过Ni2+亲和层析柱,用Buffer B(1×PBS+500 mM咪唑)梯度洗脱。
1.2.3 烟草花叶病毒酶(TEV)酶切去除组氨酸标签 重组质粒pET32a带有N末端组氨酸标签,在组氨酸标签与目的蛋白间带有TEV的酶切位点序列。因此,将亲和层析纯化后的SEA透析,用1×PBS缓冲液透析,去除缓冲液中的咪唑,然后与TEV按照200∶1的比例混合,在4 ℃条件下,酶切12 h。经酶切后的SEA蛋白中,加入10 mM咪唑,再次过组氨酸亲和层析柱纯化,收集穿透,纯化后蛋白用1×PBS缓冲液透析,用于下步免疫试验。
1.2.4 超抗原免疫活性的测定 为了研究SEA在免疫中发挥的作用,选取了CysC作为免疫抗原,以4~6周龄的BALB/c小鼠作为免疫对象(每组10只), 通过ELISA法检测免疫后小鼠血清中CysC抗体的效价,评估SEA对免疫反应的增强效应。将各组注射蛋白等体积混匀弗氏完全佐剂,制成油包水的乳化液皮下多点注射小鼠,设置加入IL-2的对照组。以后每隔1周用同样剂量蛋白与弗氏不完全佐剂等体积混匀皮下多点注射,加强免疫3次。第3次免疫时,不加佐剂,腹腔注射,1周后眼球取血,ELISA试剂盒检测血清中产生的CysC抗体效价。另外,设置只注射弗氏佐剂的阴性对照组以及未做任何处理的空白对照组(表1)。

表1 动物免疫实验分组与蛋白注射量
1.3 统计学方法

2 结果
2.1 目的基因 PCR 扩增
PCR产物电泳后可见700 bp左右的DNA片段,与预期一致。构建好的质粒测序结果与sea在NCBI数据库中收录的序列一致(图1)。
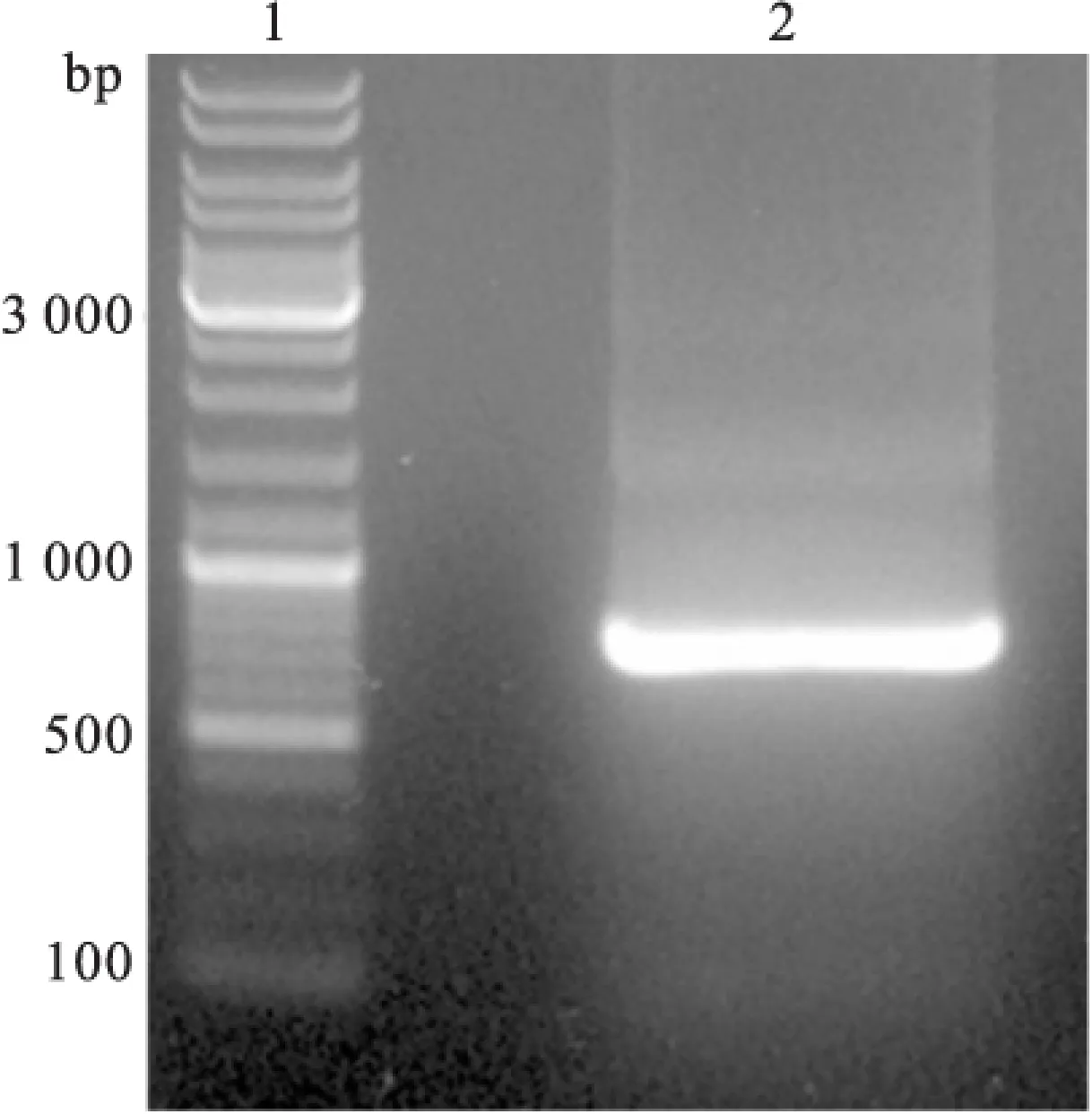
图1 PCR 后电泳结果
注:1为DNA marker;2为SEA PCR扩增结果
2.2 蛋白纯化结果
洗脱峰出现在咪唑浓度为110~220 mM时,将洗脱峰透析后,用TEV酶切,经12%SDS-PAGE电泳验证,可以获得纯度较高的SEA重组蛋白,蛋白纯度基本达到电泳纯,且其分子量在27 kD处,其大小与超抗原分子量相符(有单一的目的条带)。最终,经发酵及纯化后,每升菌液可以获得约40 mg去除标签的重组SEA蛋白(图2)。

图2 12%SDS-PAGE电泳结果
注:1.蛋白marker;2.均质机破碎后上清;3.穿透;4.亲和层析后蛋白(2.46 mg/mL);5.TEV酶切后蛋白(1.21 mg/mL)
2.3 超抗原的免疫增强活性
与单独注射CysC组比较,在超抗原同时免疫时,其免疫后抗体的效价并没有明显变化(P>0.05);在IL-2的参与下,用CysC与IL-2联合注射小鼠,与CysC组相比,其抗体效价提高近2倍(P<0.05);用SEA、IL-2以及CysC共同免疫时,单位血清内抗体效价最高,约是CysC组的2.5倍(P<0.05)(图3)。

图3 SEA免疫增强活性的ELISA测定结果
注:与CysC组比较,*P<0.05
3 讨论
SEA是现阶段研究最为广泛的超抗原,其在肿瘤治疗中具有广泛应用。在我国已有相关的SEA用于临床治疗的药物,但是此类药物是直接从金黄色葡萄球菌中提取的,产量低且还具有一定毒性。因此,获得高产量的低毒性的SEA具有重要意义。利用基因工程法,从金黄葡萄球菌中克隆sea基因,构建表达载体,并利用大肠杆菌进行表达,具有操作简单、成本低、易于纯化、产量高、低毒性等优点,有利于超抗原的大批量生产与应用。
Haffner等[9]曾报道,SEA在IL-2的参与下,可以特异性地激活B淋巴细胞,在抗体制备中也具有较好的应用前景,但是对其在动物体内的免疫研究并没有明确报道。为了研究SEA对动物体内免疫的增强作用,在本研究中,将纯化后的SEA用于CysC抗体的制备,结果显示,SEA本身对CysC作为抗原的免疫增强作用并不明显。SEA在激活B细胞时,需要IL-2的参与。本研究检测了在IL-2参与的条件下, SEA对免疫效果的增强作用,结果显示,IL-2本身也能够提高抗原的动物免疫反应,与单独注射CysC组相比,能够提高血清中CysC抗体效价将近2倍,说明IL-2在单独存在的情况下也可以增强免疫效应;在SEA与IL-2同时注射的情况下,免疫增强效果最为明显,与CysC组相比,单位血清中抗体效价提高约2.5倍。本研究为SEA后续在抗体制备中的应用提供了基础,但是鉴于前期用于免疫研究的抗原蛋白仅选取了1种,后续实验需要对其他抗原蛋白在SEA作用下的免疫效果进行研究。
[1]Abe J, Ito Y, Onimaru M,etal. Characterization and distribution of a new enterotoxin related superantigen produced by Staphylococcus aureus [J]. Microbiol Immunol, 2000, 44(2): 79-88.
[2]Shaikh N, Leonard E, Martin J M. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis [J]. Pediatrics, 2010, 126(3): e557-e564.
[3]Johnson D R, Kurlan R, Leckman J,etal. The human immune response to streptococcal extracellular antigens: clinical, diagnostic, and potential pathogenetic implications [J]. Clin Infect Dis, 2010, 50(4): 481-490.
[4]White J, Herman A, Pullen A M,etal. The V beta-specific superantigen staphylococcal enterotoxin B: stimulation of mature T cells and clonal deletion in neonatal mice [J]. Cell, 1989, 56 (1): 27-35.
[5]Sundberg E J, Deng L, Mariuzza R A. TCR recognition of peptide/MHC class II complexes and superantigens [J]. Semin Immunol, 2007, 19(4): 262-271.
[6]鲍行豪, 桑贤辈,陈建立,等.超抗原制剂提升白细胞的应用研究[J].浙江预防医学,2003, 15(7):1-3.
[7]吉晓滨, 臧林泉,谢景华,等.超抗原活化淋巴细胞对喉癌Hep-2细胞系的抑制作用[J].广东医学, 2007, 28(12): 1897-1899.
[8]Dauwalder O,Thomas D,Ferry T,etal. Comparative inflammatory properties of staphylococcal superantigenic enterotoxins SEA and SEG: implications for septic shock [J].Leukoc Biol, 2006, 80 (4): 753-758.
[9]Haffner A C,Zepter K,Elmets C A.Major histocompatibility complex class I molecule serves as a ligand for presentation of the superantigen staphylococcal enterotoxin B to T cells[J].Proc Natl Acad Sci USA, 1996, 93(7): 3037-3042.
[10] 廉慧锋, 马兴元.B细胞超抗原及其免疫学特性[J].免疫学杂志, 2005, 21(3): 65-69.
The Role of Staphylococcal Enterotoxin A in the Immune Response
Wang Yuanyuan, Hu Yidan, Chen Dong, Lan Jingbin, Wu Mingbo△.
School of Biomedical Sciences, Chengdu Medical College, Chengdu 610500, China
Objective To recombine and purify the Staphylococcal enterotoxin A (SEA) gene and detect the immune activity of the recombinant SEA. Methods The Staphylococcal enterotoxin A (SEA) gene was cloned into the prokaryotic plasmid pET32a-sea by means of the genetic engineering method. The recombinant protein was expressed in E.coli Rosetta strains and purified by nickle affinity chromatography column. Interleukin-2 (IL-2) and Cystatin C (Cys C) were used to detect the immune activity of the purified SEA. Results The SEA was expressed in E.coli Rosetta successfully and purified with a production rate of 40 mg/L. SDS-PAGE analysis showed a molecular weight of approximately 27 kDa for a subunit of the protein. The immune experiments showed that the SEA enhanced the immune activity by nearly 2.5 times. Conclusion SEA can significantly enhance the immune effect of antigen.
Staphylococcal enterotoxin A; Genetic engineering; Purify; Immune response
http://www.cnki.net/kcms/detail/51.1705.R.20161027.1708.062.html
10.3969/j.issn.1674-2257.2016.05.007
大学生创新项目(No:201513705015);大学生创新项目(No:201513705054)
Q512
A
△通信作者:吴明波,E-mail: wumingboscu@163.com
