免疫抑制剂对酵母聚糖诱导巨噬细胞Dectin-1、Toll样受体2及肿瘤坏死因子-α表达的影响
2016-12-06毛亚男王雯王东张波
毛亚男,王雯,王东,张波
(1.安徽医科大学,安徽 合肥 230032;2.空军总医院呼吸内科,北京 100142)
免疫抑制剂对酵母聚糖诱导巨噬细胞Dectin-1、Toll样受体2及肿瘤坏死因子-α表达的影响
毛亚男1,王雯2,王东2,张波1
(1.安徽医科大学,安徽 合肥 230032;2.空军总医院呼吸内科,北京 100142)
目的研究霉酚酸酯和环孢素A对酵母聚糖(Zymosan A)诱导小鼠RAW264.7巨噬细胞模式识别受体Dectin-1、Toll样受体2(TLR2)表达及细胞因子肿瘤坏死因子-α(TNF-α)释放的影响。方法体外培养RAW264.7巨噬细胞,分别给予不同浓度的霉酚酸酯、环孢素A预处理细胞24 h,再利用100μg/ml Zymosan A单独刺激细胞,逆转录聚合酶链反应和流式细胞术检测细胞Dectin-1、TLR2 mRNA和蛋白水平的变化,酶联免疫吸附试验检测上清液中TNF-α浓度的变化。结果Zymosan A单独作用巨噬细胞Dectin-1、TLR2 mRNA和蛋白水平明显上调,TNF-α浓度升高(P<0.05)。Zymosan A作用于霉酚酸酯或环孢素A预处理24 h的巨噬细胞Dectin-1、TLR2 mRNA和蛋白水平较Zymosan A单独作用组明显下调,TNF-α分泌量减少(P<0.05)。结论霉酚酸酯和环孢素A抑制巨噬细胞Dectin-1和TLR2的转录和翻译,并下调TNF-α的释放,降低机体对真菌病原体的清除能力,这可能是应用霉酚酸酯和环孢素A引起难控性真菌感染的机制之一。
霉酚酸酯;环孢素A;酵母聚糖;模式识别受体;细胞因子
免疫抑制剂被广泛应用于自身免疫病及移植抗宿主病的预防和治疗,目的在于控制免疫反应的加剧[1]。然而长期接受大剂量免疫抑制剂治疗,机体免疫功能遭到严重破坏,对外界病原菌的抵抗力减弱,极易发生难以控制的感染性疾病,尤其是侵袭性真菌感染,严重威胁免疫抑制患者的生存。巨噬细胞等固有免疫细胞通过模式识别受体(pattern-recognition receptors,PRRs)区分自我和非我,识别并结合微生物表面病原相关分子模式(pathogen-associated molecular patterns,PAMPs)启动快速的天然免疫防御反应,进而触发持久的特异性的适应性免疫反应[2],介导机体对致病真菌的杀灭和清除。环孢素A和霉酚酸酯是临床最常用的两种免疫抑制剂,与真菌感染的发病率和死亡率有着密切的联系。本研究通过体外模拟真菌感染试验,观察环孢素A和霉酚酸酯对酵母聚糖(Zymosan A)诱导的RAW264.7巨噬细胞Dectin-1、Toll样受体2(Toll-like receptors 2,TLR2)及肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)表达的影响,从模式识别水平探讨环孢素A、霉酚酸酯与真菌感染之间的关系。
1 材料与方法
1.1细胞培养
小鼠RAW264.7巨噬细胞购自南京凯基生物公司细胞库。复苏细胞,用含10%新生牛血清的洛斯维·帕克纪念研究所(roswell park memorial institute,RPMI)1640培养基在37℃、5%二氧化碳CO2孵箱中培养,0.25%乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)胰蛋白酶消化传代2~3次后,以1×105个/ml密度接种于35 mm培养皿。
1.2主要试剂
Zymosan A购自美国Sigma公司,超纯RNA提取试剂盒、HiFi-MMLV cDNA第一链合成试剂盒、PCR Mixture购自北京康为世纪生物科技有限公司,抗小鼠PE-Dectin-1抗体、抗小鼠PE-TLR2抗体购自德国美天旎生物技术有限公司,TNF-α酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)试剂盒购自美国R&D公司,霉酚酸酯、环孢素A购自大连美仑生物技术有限公司。
1.3实验分组
实验分霉酚酸酯+Zy组、环孢素A+Zy组、阳性对照组(Zy组)和空白对照组,其中霉酚酸酯+Zy组、环孢素A+Zy组又分为低浓度、中浓度和高浓度3个组别。具体步骤如下:①向各实验组的培养皿中分别加入霉酚酸酯(0.10、0.25和0.50μg/ml)或环孢素A(2.5、5.0和10.0μg/ml)预处理;阳性对照组和空白对照组加入等量完全培养基,24 h后弃净原培养基。②空白对照组给予等量完全培养基,其余各组分别加入100μg/ml Zymosan A刺激细胞[3]。
1.4逆转录聚合酶链反应检测Dectin-1、TLR2 mRNA表达
Zymosan A干预后4 h后,按照超纯RNA提取试剂盒说明书提取细胞总RNA,紫外分光光度计检测RNA纯度和浓度。按照世纪康为HiFi-MMLV cDNA第一链合成试剂盒要求进行反转录,聚合酶链反应扩增条件为:95℃预变性5 min,95℃变性15 s,60℃退火1 min,共40个循环。引物合成由上海生物工程股份有限公司设计完成,序列如下:①Dectin-1正向引物:5'-AGACTTCAGCACTCAAGACATCCA-3',反向引物:5'-CAGGATTCCTAAACCCACTGCAA-3';②TLR2正向引物:5'-CCCACTTCAGGCTCTTTGAC-3',反向引物:5'-GCCACTCCAGGTAGGTCTTG-3';③脾酪氨酸激酶(spleen tyrosine kinase,Syk);④髓样分化因子(myeloid differentiation factor 88,MyD88);⑤β-actin正向引物:5'-TGAAGATCAAGATCATTGCT CCTCC-3',反向引物:5'-CTAGAAGCATTTGCGGTG GACGATG-3'。待反应结束后,采用2-△△CT进行相对定量分析。
1.5流式细胞术检测Dectin-1、TLR2蛋白的表达
Zymosan A作用细胞3和6h后,用0.25%EDTA-胰蛋白酶消化细胞并转移至流式管中,磷酸盐缓冲溶液(phosphate buffer saline,PBS)漂洗后重悬细胞,分别加5μl抗小鼠PE-Dectin-1抗体和抗小鼠PE-TLR2抗体,室温避光20min进行荧光标记染色,PBS漂洗离心,弃掉残余抗体,上机检测各组细胞的平均荧光强度(mean fluorescence intensity,MFI)。
1.6ELISA检测TNF-α的表达
Zymosan A作用细胞12 h后收集上清液,按照TNF-α试剂盒说明书,检测各组上清液中TNF-α的浓度。
1.7统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较用独立样本t检验,多组间比较用单因素方差分析,多组间的两两比较用Bonferroni法检验,P<0.05为差异有统计学意义。
2 结果
2.1霉酚酸酯、环孢素A对Zymosan A诱导小鼠RAW264.7巨噬细胞Dectin-1和TLR2 mRNA表达的影响
Zymosan A单独RAW264.7巨噬细胞4 h后Dectin-1(1.757±0.020)和TLR2(2.970±0.649)表达水平与空白对照组(1.000±0.000)比较,经t检验,差异有统计学意义(t=99.546和74.816,P=0.000),Zymosan A上调巨噬细胞Dectin-1和TLR2的转录。就Dectin-1和TLR2 mRNA表达水平而言,霉酚酸酯0.10μg/ml+Zy组、霉酚酸酯0.25μg/ml+Zy组、霉酚酸酯0.50μg/ml+Zy组、Zy组4组比较,经方差分析,差异有统计学意义(F=12.652和54.953,P=0.000)。环孢素A 2.5μg/ml+Zy组、环孢素A 5.0μg/ml+Zy组、环孢素A 10.0μg/ml+Zy组、Zy组Dectin-1和TLR2 mRNA表达水比较,经方差分析,差异有统计学意义(F=138.202和34.434,P=0.000)。应用中、高浓度的霉酚酸酯和环孢素A预先处理RAW264.7巨噬细胞再受到Zymosan A刺激后,与单独应用Zymosan A刺激组比较,经Bonferroni法检验,Dectin-1 mRNA表达降低(P<0.05);3种浓度的霉酚酸酯和环孢素A预处理细胞后均能下调Zymosan A诱导的TLR2 mRNA的表达水平(P<0.05)。见图1和表1、2。
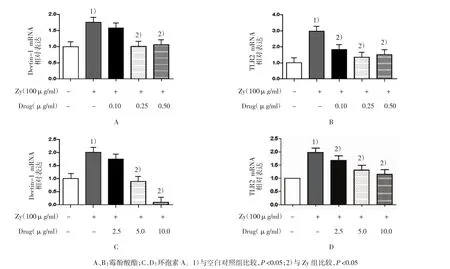
图1 霉酚酸酯、环孢素A对Zymosan A诱导RAW264.7细胞Dectin-1、TLR2 mRNA表达的影响(n=6±s)
2.2霉酚酸酯、环孢素A对Zymosan A诱导小鼠RAW264.7巨噬细胞Dectin-1和TLR2蛋白表达的影响
空白对照组Dectin-1蛋白免疫荧光强度为(32.483±2.597),ZymosanA单独刺激小鼠RAW264.7巨噬细胞3 h后Dectin-1蛋白免疫荧光强度为(47.060±3.310),经t检验,差异有统计学意义(t= 6.746,P=0.003),Zymosan A促进细胞表面Dectin-1蛋白表达。霉酚酸酯0.50μg/ml+Zy组、环孢素A 10.0μg/ml+Zy组、Zy组的Dectin-1蛋白MFI比较,经方差分析,差异有统计学意义(F=49.109,P=0.000)。预先给予0.50μg/ml霉酚酸酯或10.0μg/ml环孢素A处理后,再受到Zymosan A刺激的RAW264.7细胞表面Dectin-1蛋白荧光强度分别为(22.967±2.098)和(23.193±2.852),低于Zymosan A单独刺激组(P<0.01)。给予Zymosan A单独作用6 h后,巨噬细胞表面TLR2免疫荧光强度(776.453±29.847)高于空白对照组(549.153±35.424),差异有统计学意义(t= 15.018,P=0.003);霉酚酸酯0.50μg/ml+Zy组、环孢素A 10.0μg/ml+Zy组、Zy组的TLR2蛋白MFI比较,经方差分析,差异有统计学意义(F=34.434,P= 0.000)。MMF 0.50μg/ml+Zy组和CsA10.0μg/ml+ Zy组的TLR2免疫荧光强度分别为(578.697±25.382)和(597.763±25.113),与Zymosan A单独作用组比较,经Bonferroni法检验,差异有统计学意义。见图2和表3、4。
表1 霉酚酸酯对Zymosan A诱导Dectin-1、TLR2 mRNA表达的影响(n=6±s)
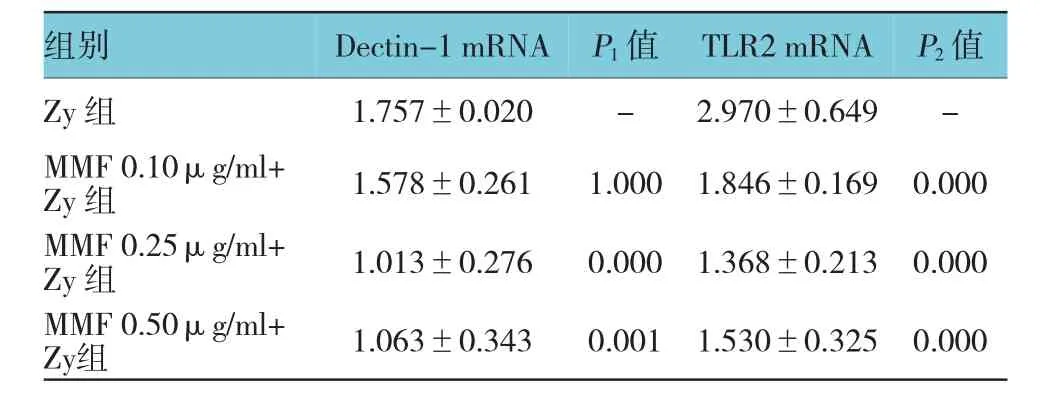
表1 霉酚酸酯对Zymosan A诱导Dectin-1、TLR2 mRNA表达的影响(n=6±s)
注:P1:与Zy组的Dectin-1 mRNA比较;P2:与Zy组的TLR2 mRNA比较
组别Dectin-1 mRNAP1值TLR2 mRNAP2值Zy组1.757±0.020-2.970±0.649-MMF 0.10μg/ml+ Zy组1.578±0.2611.0001.846±0.1690.000 MMF 0.25μg/ml+ Zy组1.013±0.2760.0001.368±0.2130.000 MMF 0.50μg/ml+ Zy组1.063±0.3430.0011.530±0.3250.000
表2 环孢素A对Zymosan A诱导Dectin-1、TLR2 mRNA表达的影响(n=6±s)
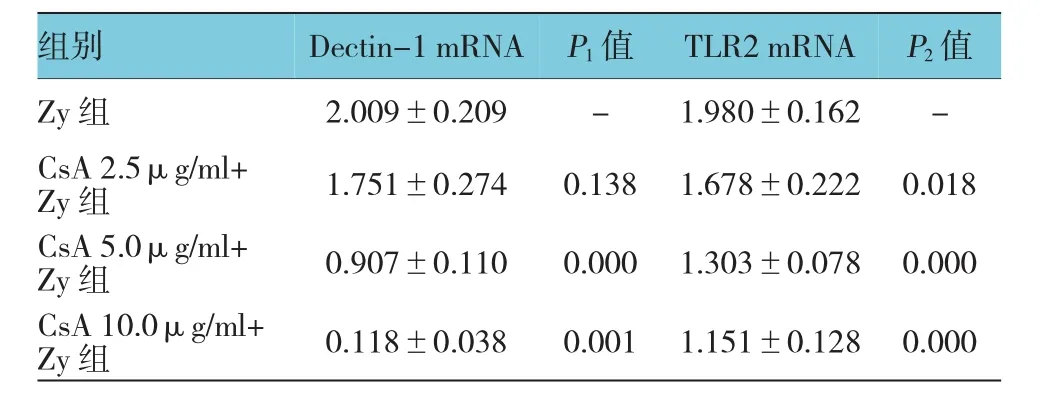
表2 环孢素A对Zymosan A诱导Dectin-1、TLR2 mRNA表达的影响(n=6±s)
注:P1:与Zy组的Dectin-1 mRNA比较;P2:与Zy组的TLR2 mRNA比较
组别Dectin-1 mRNAP1值TLR2 mRNAP2值Zy组2.009±0.209-1.980±0.162-CsA 2.5μg/ml+ Zy组1.751±0.2740.1381.678±0.2220.018 CsA 5.0μg/ml+ Zy组0.907±0.1100.0001.303±0.0780.000 CsA 10.0μg/ml+ Zy组0.118±0.0380.0011.151±0.1280.000
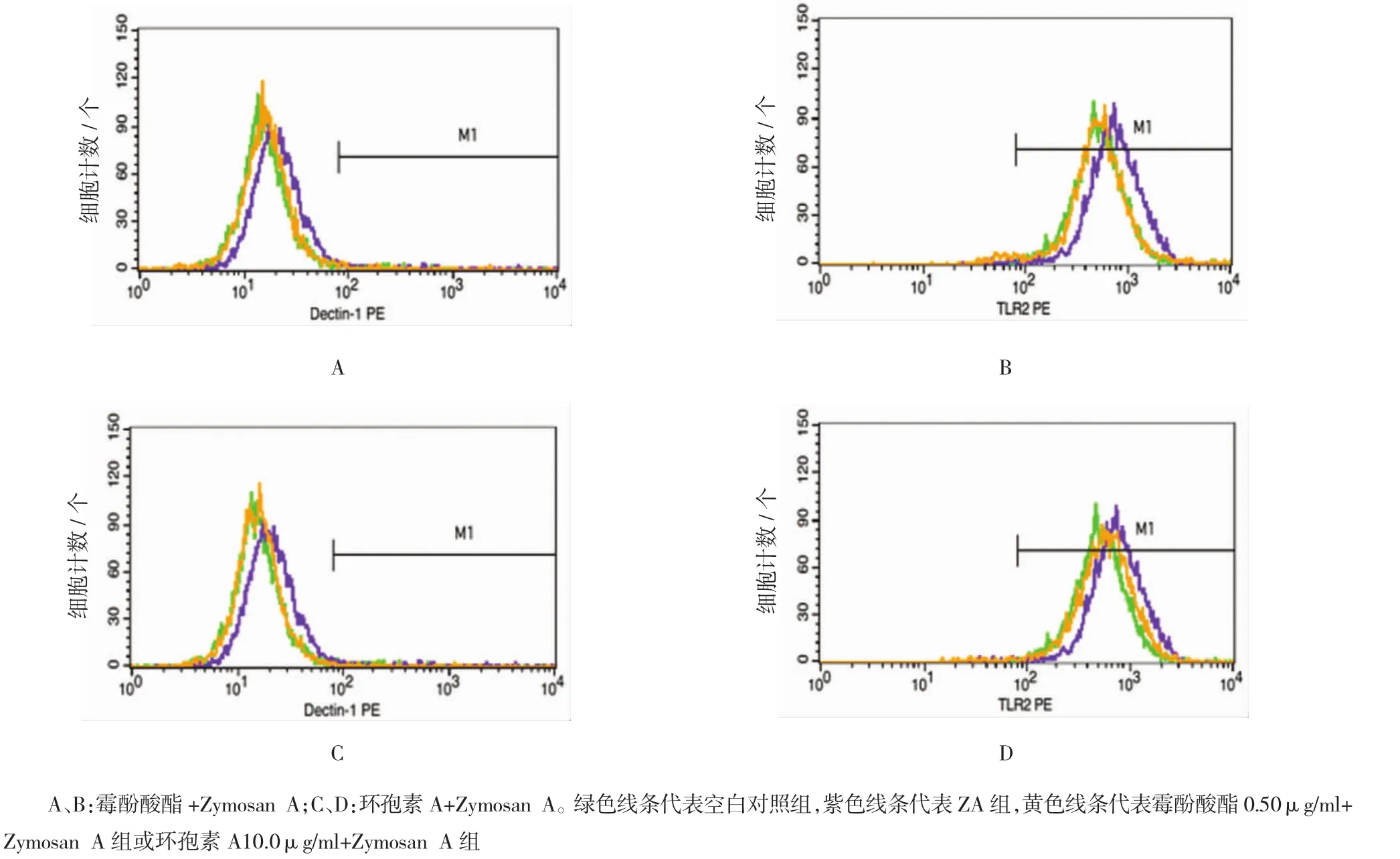
图2 霉酚酸酯、环孢素A对Zymosan A诱导RAW264.7细胞Dectin-1和TLR2蛋白的影响
2.3霉酚酸酯、环孢素A对Zymosan A诱导RAW264.7巨噬细胞分泌TNF-α的影响
空白对照组可检测到低水平TNF-α[(720.450± 61.642)pg/ml],Zymosan A共培养的RAW264.7巨噬细胞分泌TNF-α水平为(1 908.752±32.070)pg/ml,经t检验,差异有统计学意义(t=34.203,P=0.003),Zymosan A能够促进TNF-α的表达。霉酚酸酯0.10μg/ml+Zy组、霉酚酸酯0.25μg/ml+Zy组、霉酚酸酯0.50μg/ml+Zy组、环孢素A2.5μg/ml+Zy组、环孢素A 5.0μg/ml+Zy组、环孢素A 10.0μg/ml+Zy组与、Zy组的TNF-α分泌水平比较,经方差分析,差异有统计学意义(F=675.899,P=0.000)。不同浓度的环孢素A和霉酚酸酯均能抑制Zymosan A诱导的TNF-α的释放水平,其中大剂量的环孢素A(10.0μg/ml)抑制作用最为明显。见图3和表5。
表3 Zymosan(100μg/ml)对巨噬细胞表达Dectin-1、TLR2蛋白MFI的影响(n=3±s)
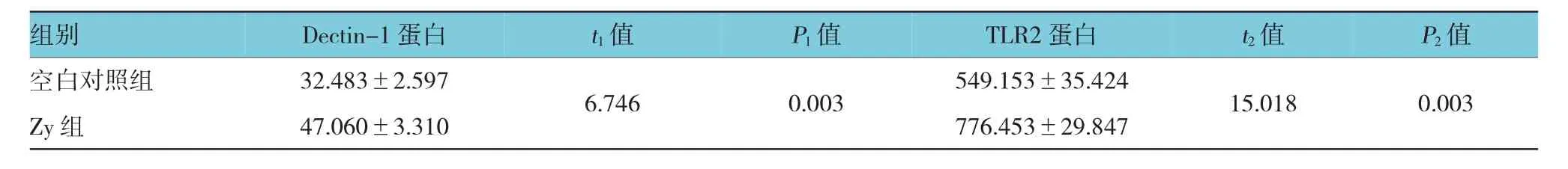
表3 Zymosan(100μg/ml)对巨噬细胞表达Dectin-1、TLR2蛋白MFI的影响(n=3±s)
注:t1、P1:与空白对照组的Dectin-1蛋白比较;t2、P2:与空白对照组的TLR2蛋白比较
组别Dectin-1蛋白t1值P1值TLR2蛋白t2值P2值空白对照组32.483±2.5976.7460.003549.153±35.42415.0180.003 Zy组47.060±3.310776.453±29.847
表4 霉酚酸酯、环孢素A(μg/ml)对Zymosan A诱导Dectin-1、TLR2蛋白MFI的影响(n=3±s)
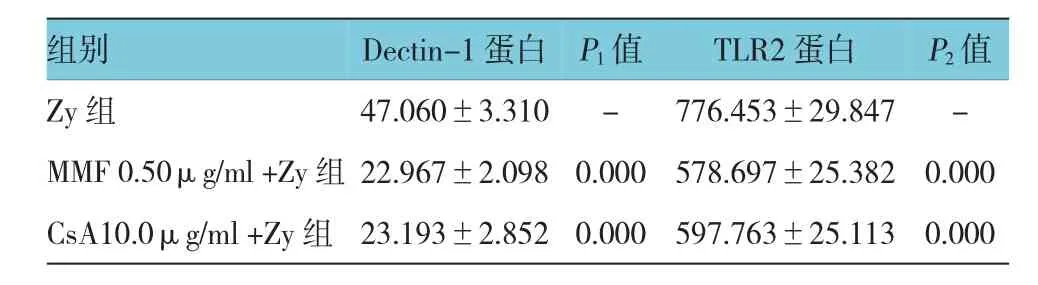
表4 霉酚酸酯、环孢素A(μg/ml)对Zymosan A诱导Dectin-1、TLR2蛋白MFI的影响(n=3±s)
注:P1:与Zy组的Dectin-1蛋白比较;P2:与Zy组的TLR2蛋白比较
组别Dectin-1蛋白P1值TLR2蛋白P2值Zy组47.060±3.310-776.453±29.847-MMF 0.50μg/ml+Zy组22.967±2.0980.000578.697±25.3820.000 CsA10.0μg/ml+Zy组23.193±2.8520.000597.763±25.1130.000
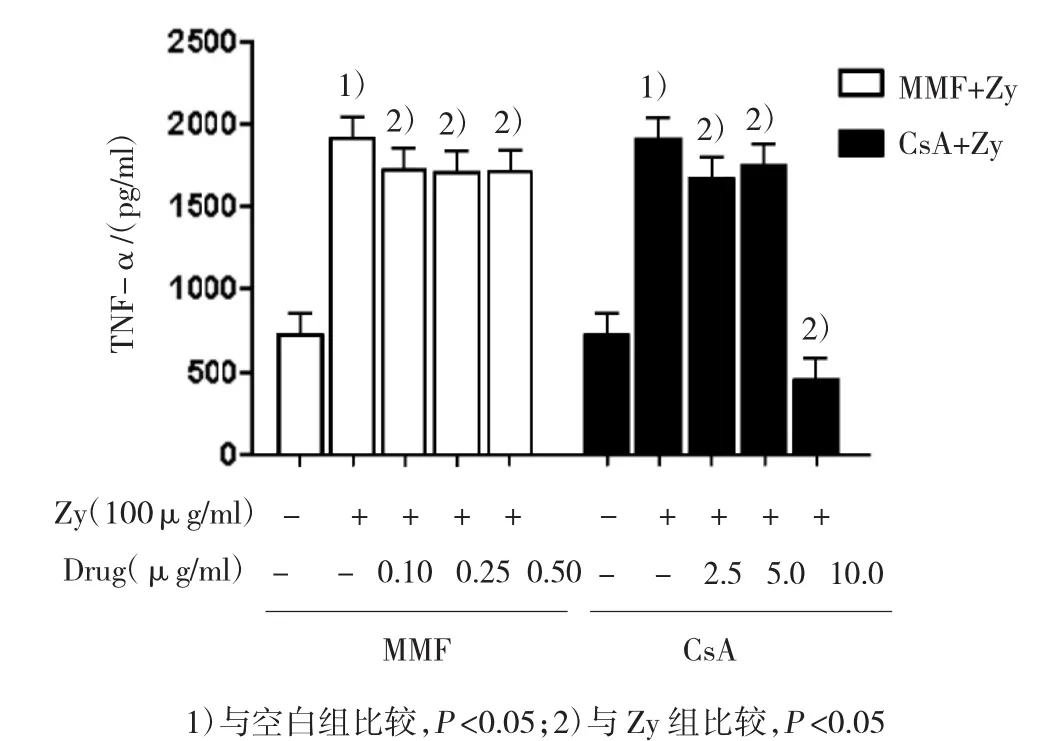
图3 霉酚酸酯对Zymosan A诱导RAW264.7巨噬细胞TNF-α分泌的影响(n=4±s)
表5 霉酚酸酯、环孢素A对Zymosan A诱导TNF-α(pg/ml)分泌的影响(n=4,pg/ml±s)
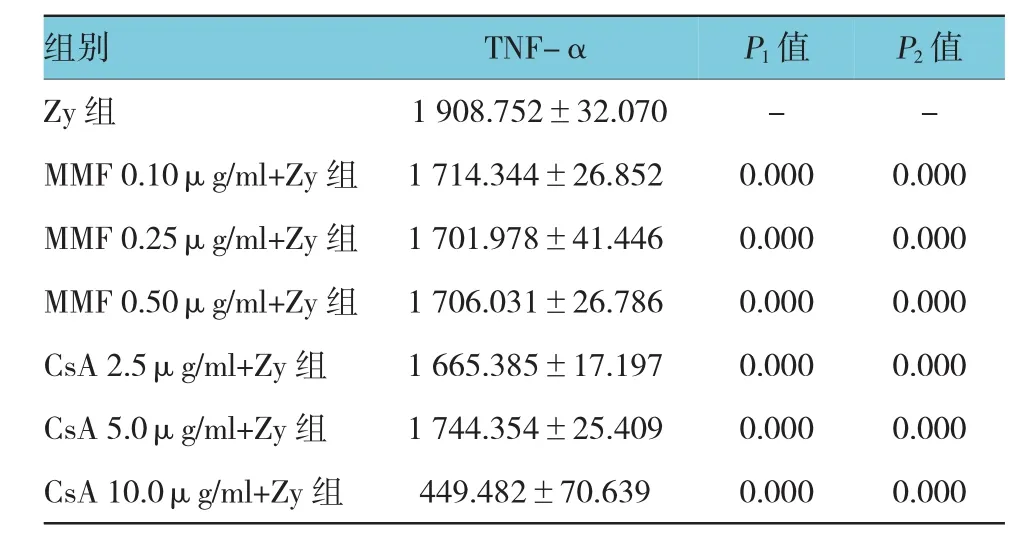
表5 霉酚酸酯、环孢素A对Zymosan A诱导TNF-α(pg/ml)分泌的影响(n=4,pg/ml±s)
注:P1:与Zy组比较;P2:与CsA 10.0μg/ml+Zy组比较
组别TNF-αP1值P2值Zy组MMF 0.10μg/ml+Zy组1 908.752±32.070 1 714.344±26.852 --0.0000.000 MMF 0.25μg/ml+Zy组MMF 0.50μg/ml+Zy组1 701.978±41.446 1 706.031±26.786 0.000 0.000 0.000 0.000 CsA 2.5μg/ml+Zy组1 665.385±17.1970.0000.000 CsA 5.0μg/ml+Zy组1 744.354±25.4090.0000.000 CsA 10.0μg/ml+Zy组449.482±70.6390.0000.000
3 讨论
免疫抑制剂的应用为器官移植后的抗宿主排斥反应、自身免疫性疾病、非自身免疫性疾病,如肿瘤和过敏性疾病等的预防及治疗提供了有效的方法和手段[4]。然而,因免疫功能过度受损引发的感染性疾病,尤其是侵袭性真菌感染,一直是免疫抑制人群面临的重要问题。尽管新的抗真菌药物已被研发出来,但是因为早期诊断困难,病情进展速度快,且发病率和病死率呈逐年攀升趋势,因此侵袭性真菌病仍严重威胁着免疫低下患者的生存。
外来病原体入侵机体时,启动先天性免疫反应和适应性免疫反应形成稳固复杂的免疫网络清除致病真菌。巨噬细胞等固有免疫细胞是先天性免疫系统中的“前哨兵”。通过细胞表面或内部的PRRs识别暴露于病原微生物表面的PAMPs,启动快速有机的炎症信号转导通路,分泌大量炎症细胞因子和趋化因子,驱动并局限中性粒细胞等炎症细胞到达感染部位,触发细胞的吞噬作用、呼吸爆发等功能,进而启动适应性免疫反应,促进机体对真菌病原体的清除[5-6]。大量研究发现,与真菌感染密切相关的PPRs,主要涉及C型凝集素受体家族(C-type lectin family,CLRs)和Toll样受体家族[7],其中尤以Dectin-1和TLR2的研究最为广泛,是近年来真菌相关免疫识别机制的研究热点。
Zymosan A来源于酿酒酵母细胞壁,富含β-葡聚糖和甘露聚糖,常被用来模拟体外真菌感染的免疫学研究。Dectin-1和TLR2协同参与Zymosan A的免疫识别过程,通过激活下游的Syk和MyD88信号通路,最终导致核转录因子活性增强并释放大量的细胞因子TNF-α,协同放大炎症反应[8]。本实验结果表明,在Zymosan A刺激小鼠巨噬细胞的早期,可显著上调受体Dectin-1、TLR2 mRNA和蛋白的表达水平,促进细胞因子TNF-α的释放,最终诱导炎症反应的发生。
环孢素A和霉酚酸酯目前是肾移植患者术后最常用的两种免疫抑制剂,在减少移植物抗宿主反应促进移植术后移植物存活的同时,也往往能够引起患者感染症状加重,甚至发生难控性真菌感染,引起病死率显著升高。目前,有关环孢素A和霉酚酸酯对病原体识别过程的影响,具体机制尚不清楚。特异性T淋巴细胞功能调节药环孢素A,能够选择性抑制T淋巴细胞相关因子如IL-2、TNF-α的分泌,同时削弱宿主的体液/细胞免疫。此外,环孢素A发挥免疫抑制功能的具体机制可能也涉及到模式识别水平。GREENBLATT等[9]认为,环孢素A通过抑制Dectin-1通路下调细胞因子IL-10的表达,来调控对中性粒细胞的抗真菌免疫功能,而与TLR2/Myd88通路无关,并由此得出Dectin-1是环孢素A作用机制的上游元件。洪英礼等[10]通过实验观察到,与空白对照组大鼠比较,皮下注射环孢素A的大鼠TLR2和TLR4 mRNA和蛋白水平明显升高。而本研究结果则显示,中浓度和高浓度的环孢素A能够抑制Zymosan A激活Dectin-1 mRNA和蛋白水平的表达,低、中、高3种浓度的环孢素A均能下调Zymosan A诱导的TLR2的转录和翻译,且具有一定的剂量依赖性。本实验结果还表明,环孢素A能够抑制Zymosan A诱导的TNF-α的释放,大剂量的环孢素作用尤为明显。由此笔者推测环孢素A能同时抑制Dectin-1/Syk和TLR2/Myd88信号通路,抑制炎症细胞因子TNF-α的分泌。霉酚酸酯是一种具有抗代谢功能及强效免疫抑制功能的霉酚酸半合成物,其有效活性成分为霉酚酸(mycophenolic acid,MPA)。前期研究发现,霉酚酸酯主要通过抑制T/B淋巴细胞增殖,并减少B淋巴细胞分泌相关抗体发挥强效、选择性的免疫抑制功能[11],而关于霉酚酸酯是否影响机体模式识别功能的文献报道十分罕见。本研究结果表明,与同环孢素作用相似,霉酚酸酯也能够下调正常状态细胞Dectin-1、TLR2的转录和翻译,对Zymosan A诱导的Dectin-1、TLR2 mRNA和蛋白的表达也表现出一定的抑制作用,降低TNF-α的释放水平,从而抑制机体免疫防御机制被激活。
笔者推测霉酚酸酯和环孢素A通过下调激活状态下的模式识别受体Dectin-1和TLR2的转录和翻译,抑制巨噬细胞炎症细胞因子TNF-α的释放,导致机体处于免疫耐受状态,降低机体对真菌病原体的敏感性,无法有效地清除入侵的真菌病原体,这可能是免疫抑制剂霉酚酸酯和环孢素A诱导感染加重,甚至难控性侵袭性真菌感染的发病机制之一。除环孢素A和霉酚酸酯外,其他种类免疫抑制剂诱发真菌感染的发病机制是否与调节Dectin-1和TLR2信号通路的激活相关,尚需要体内外基础实验和临床实验的进一步验证。通过探讨免疫抑制剂在受体识别过程中的重要靶点,揭示免疫抑制剂加重真菌感染的具体发病机制,为将来研究预防和控制免疫抑制患者并发真菌感染的靶向药物,改善临床预后提供一定的理论和实践意义。
[1]LIBER MAN A C,JIMENA K,DAMIÁN R,et al.Molecular mechanismsofactionofsomeimmunosuppressivedrugs[J]. Medicina,2008,68(6):455-464.
[2]PINKE K H,LIMA H G,CUNHA F Q,et al.Mast cells phagocyte Candida albicans and produce nitric oxide by mechanisms involving TLR2 and Dectin-1[J].Immunobiology,2015,221(2): 220-227.
[3]YANG Z,MARSHALL J S.Zymosan treatment of mouse mast cells enhances dectin-1 expression and induces dectin-1-dependent reactive oxygen species(ROS)generation[J].Immunobiology, 2009,214(4):321-330.
[4]VINCENT J L,RELLO J,MARSHALL J,et al.EPICⅡGroup of Investigators.International study of the prevalence and outcomes of infection in intensive care units[J].Jama the Journal of the American Medical Association,2009,302(21):2323-2329.
[5]LEMOINE S,JARON B,TABKA S,et al.Dectin-1 activation unlocksIL-12AexpressionandrevealstheTH1potencyof neonatal dendritic cells[J].Journal of Allergy Clinical Immunology, 2015,136(5):1355-1368.
[6]ROSENTUL D C,PLANTINGA T S,MARIJE O,et al.Genetic variation in the dectin-1/CARD9 recognition pathway and susceptibility to candidemia[J].Journal of Infectious Diseases,2011, 204(7):1138-1145.
[7]GERSUK G M,UNDERHILL D M,LIQUN Z,et al.Dectin-1 and TLRs permit macrophages to distinguish between different Aspergillus fumigatus cellular states[J].Journal of Immunology, 2006,176(6):3717-3724.
[8]DILLON S,AGRAWAL S,BANERJEE K,et al.Yeast zymosan, a stimulusforTLR2anddectin-1,inducesregulatoryantigen-presenting cells and immunological tolerance[J].Journal of Clinical Investigation,2006,116(4):916-928.
[9]GREENBLATT M B,ANTONIOS A,BELLA H,et al.Calcineurin regulates innate antifungal immunity in neutrophils[J]. Journal of Experimental Medicine,2010,207(5):923-931.
[10]洪英礼,金英顺,崔镇花,等.TLR活化参与环孢素A诱发的慢性肾小管间质损伤[J].中国病理生理杂志,2011,27(3):555-559.
[11]潘春树,何雪菲,钱华.常用免疫抑制剂的作用机制及应用[J].安徽医药,2008,12(10):892-894.
(童颖丹 编辑)
Effect of immunosuppressants on Zymosan A-induced expressions of Dectin-1,TLR2 and TNF-alpha in macrophages
Ya-nan Mao1,Wen Wang2,Dong Wang2,Bo Zhang1
(1.Anhui Medical University,Hefei,Anhui 230032,China;2.Department of Respiratory Medicine,General Hospital of Chinese Air Force,Beijing 100142,China)
Objective To study the effects of Mycophenolate mofetil and Cyclosporin A on Zymosan A-induced expressions of Dectin-1,Toll-like receptor 2(TLR2)and tumor necrosis factor alpha(TNF-α)in RAW264.7 macrophages.Methods Duringin vitroculture,RAW264.7 macrophages were pre-treated with different dosages of Mycophenolate mofetil and Cyclosporine A for 24 h,and then stimulated with 100 μg/ml of Zymosan A alone.RT-PCR was used to detect the expressions of Dectin-1 and TLR2 mRNAs in RAW264.7 macrophages and flow cytometry was used to detect the average fluorescence intensity of Dectin-1 and TLR2proteins.TNF-α level was measured by enzyme-linkedimmunosorbentassay.ResultsThe expressions of Dectin-1 and TLR2 mRNAs and proteins,as well as the concentration of TNF-α increased significantly in the Zymosan A+macrophage group(P<0.05).Mycophenolate mofetil and Cyclosporin A inhibited the expressions of Zymosan A-induced Dectin-1 and TLR2 mRNAs and proteins in various degrees and reduced the secretion of cytokine TNF-α(P<0.05).Conclusions Mycophenolate mofetil and Cyclosporin A reduce the transcription and translation of Dectin-1 and TLR2 and the secretion of the inflammatory cytokine TNF-α induced by Zymosan A,aggravating infection by inhibiting the body's ability to recognize and remove the fungal pathogens.It is probably one of the key mechanisms that Mycophenolate mofetil andCyclosporin A cause refractory fungal infection.
Mycophenolate mofetil;Cyclosporin a;Zymosan a;pattern-recognition receptors;cytokine
R96
A
10.3969/j.issn.1005-8982.2016.21.003
1005-8982(2016)21-0013-06
2016-04-06
张波,E-mail:zhangbohuxi@sina.com
