茶薪菇子实体分化发育中总蛋白二维电泳谱的变化与分析
2016-12-03张筱梅朱维红苗晓燕王楠楠吴艳清
张筱梅,朱维红,苗晓燕*,王楠楠,吴艳清
(保定学院,河北保定071000)
茶薪菇子实体分化发育中总蛋白二维电泳谱的变化与分析
张筱梅,朱维红,苗晓燕*,王楠楠,吴艳清
(保定学院,河北保定071000)
采用TCA-丙酮法和尿素-硫脲法提取了茶薪菇不同分化时期的蛋白质,并利用双向电泳对蛋白质二维图谱的变化进行了分析。结果表明,TCA-丙酮法提取的蛋白较适宜茶薪菇双向电泳;在菌丝体期、原基期、幼菇期、成熟期子实体蛋白质的双向电泳图谱中共检测到1261个特异蛋白斑点,其中幼菇期出现的特异蛋白斑点数在整个分化发育过程中最多,达570个,成熟菌盖出现的蛋白斑点数为515个,而菌丝体期出现的仅为146个,表明子实体幼菇期细胞分化发育处于高峰期,差异蛋白表达十分活跃。分析认为茶薪菇子实体的分化发育与菌丝体的特异蛋白斑点变化规律有一定的相似性,这些特异蛋白斑点有些在随后的子实体发育中消失。推测这些特异蛋白可能与相应子实体的形体特征发育有关。
茶薪菇;子实体;分化;二维电泳图谱
茶薪菇(Agrocybe aegeritaHuang)已成为我国食用菌重要的新品种之一[1],目前其有效成分研究多集中在多糖、凝集素方面[2-5],蛋白质研究主要限于总蛋白、同工酶方面[6-7],有关双向电泳蛋白组谱分析报道较少,双向电泳技术具有高通量、高灵敏度、高分辨率、重复性好等优点[8],越来越多地被应用在蛋白质组学研究方面。由于茶薪菇含有大量多糖、色素等次生代谢产物,同时常规提取方法对双向电泳干扰较大,限制了蛋白质的纯度及蛋白双向电泳技术的进行,致使食用菌蛋白质提取的方法及双向电泳技术研究相对较少,如虎奶菇自溶蛋白质提取使用Tris-饱和酚法和三氯乙酸(trichloroacetic acid,TCA)/丙酮沉淀法[9]、灵芝菌丝体蛋白质提取使用高浓度的尿素-硫脲法[10]、灵芝子实体原基双向电泳技术的建立[11]等。本研究的目的在于探讨双向电泳蛋白质提取纯化的方法,初步探究茶薪菇子实体分化发育过程中蛋白组的变化情况,为研究茶薪菇生长发育规律,茶薪菇高产育种提供实验依据。同时探讨茶薪菇不同材料的双向电泳实验条件,为后续双向电泳条件进一步优化及蛋白质组学研究进行铺垫。
1 材料与方法
1.1材料与试剂
1.1.1菌种
茶薪菇(Agrocybe aegerita)SM菌株:由本院细胞实验室提供。
1.1.2实验试剂
(1)提取液
磷酸缓冲液(Na2HPO4、NaH2PO4)、TCA-丙酮(10%TCA和0.07%β-巯基乙醇)、冰浴丙酮、提取液I(8 mol/L尿素、2.5 mol/L硫脲、1.5 mol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、10 mmol/L Tris、20 mmol/L苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、2 mg/L脱氧核糖核酸酶(deoxyribonuclease,DNase)、5mg/L核糖核酸酶(ribonuclease,RNase)、提取液II(2%3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(3-[(3-cholanidopropyl)dimethy lammonio]-1-propanesulfonate,CHAPS)、4%1,4-二硫代苏糖醇(1,4-dithiothreitol,DTT)、0.5%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)。
(2)胶体配方
本实验均采用BIO-RAD电泳仪专用配套试剂。浓缩胶:Milli Q水、30%丙烯酰胺溶液、1.5 mol/L Tris(pH6.8)、10%SDS、10%过硫酸铵、四甲基乙二胺(N,N,N',N'-Tetraethylmethylenediamine,TEMED)。分离胶:Milli Q水、30%丙烯酰胺溶液、1.5 mol/L Tris(pH8.8)、10%SDS、10%过硫酸铵、TEMED。
(3)缓冲液
十二烷基硫酸纳-聚丙烯酰胺凝胶电泳(SDS-polyacrylamidegelelectrophoresis,SDS-PAGE)上样缓冲液、胶条平衡缓冲液母液、胶条平衡缓冲液I和II、水化上样缓冲液、电极缓冲液、低熔点琼脂糖封胶液等。
(4)染色剂
考马斯亮蓝R-250染色液、聚丙烯酰胺凝胶脱色液、银染固定液、银染敏化液、银染液、银染显色液、银染终止液。
1.2仪器与设备
TES-240超低温冰箱:美国Thremo科技公司;JY92-2D超声波细胞粉碎仪:宁波新芝生物科技股份有限公司;3K18 SIGMA高速冷冻离心机:德国Sigma公司;FD8-4B冷冻干燥机:美国SIM国际有限公司;WD-9405型水平摇床:北京市六一仪器厂;SZ-1型快速混匀器:江苏金坛市金城国胜实验仪器厂;Molcular Devices Filter MaxF5酶标仪:美国美谷分子仪器公司;BIO-RAD双向电泳仪:美国伯乐公司。
1.3方法
1.3.1菌丝体与子实体培养
保藏菌株斜面活化后,25℃平板培养8~10 d,刮取菌丝,将菌丝置于滤纸上,吸干表面水分待用。活化菌种转接栽培袋,25℃培养80 d出菇,得到鲜原基和子实体,选取生长均匀大小适中子实体、原基,清除培养基备用。
1.3.2子实体总蛋白提取
(1)超声破碎协同TCA-丙酮法[12]
取茶薪菇菌丝体、原基、子实体各2 g于研钵剪碎并研磨至粉末状,加10倍体积磷酸缓冲液,冰浴超声(400 W)处理5 s,间隔5 s,全程20 min,保护温度40℃。处理后液体快速移至离心管,于4℃、11 000 r/min离心10 min,取上清加20 mL TCA-丙酮摇匀,-20℃过夜保存。次日4℃、11 000 r/min离心30 min,弃上清;加20 mL 4℃储藏条件下的100%丙酮,11 000 r/min离心30 min弃上清;再加20 mL 4℃储藏条件下的体积分数80%丙酮,11 000 r/min离心30 min,沉淀冷冻干燥1 h后称质量,-20℃保存。所得沉淀待裂解后用于测定蛋白质浓度和SDS-PAGE凝胶电泳。
(2)液氮研磨协同高浓度尿素-硫脲法
分别取茶薪菇菌丝体、原基、子实体2 g于陶瓷研钵中,剪碎加入适量液氮研至粉末状,移至50 mL离心管,分别加入15 mL提取液I,于4℃水浴60 min,分别加入提取液II 5 mL,涡旋30 s×6次,间隔1 min置于冰上,4℃、10 000 r/min离心10 min,上清液冷冻干燥2 d,干粉待裂解后用于蛋白含量测定及SDS-PAGE凝胶电泳。
1.3.3蛋白质含量测定
蛋白质含量按Bradfrod法[13]进行测定:分别取蛋白质溶液和超纯水共100 μL及1 000 μL G250染色液,振荡混匀各样品取200 μL,利用酶标仪进行测定,程序为SoftMax Pro6.1。以不同质量浓度(X)的牛血清蛋白(bull serum albumin,BSA)为横坐标,波长595 nm处的吸光度值(Y)为纵坐标绘制标准曲线,结果表明,标准曲线方程为Y= 0.0162X+0.6553,R2=0.9951。各样品中蛋白质含量(μg/μL)根据样品吸光度值、样品质量、稀释倍数算出。
1.3.4蛋白质电泳
(1)SDS-PAGE电泳
分别取蛋白质样液30 μL进行等体积上样,浓缩胶电压80 V,分离胶电压120 V,电泳后凝胶用考马斯亮蓝染色处理后扫描观察。
(2)双向电泳[14-16]
先进行第一向等电聚焦(isoelectricfocusing,IEF)电泳,采用7 cm pH3-10聚焦电泳(immobilized pH gradient,IPG)胶条,上样(据样品浓度确定蛋白上样体积)。IPG胶条胶面朝下于水化盘样品液上,每胶条覆盖2.5 mL矿物质油,等电聚焦程序见表1。

表1 等电聚焦程序Table 1 Program of isoelectric focusing
第一向等电聚焦后,胶条15 min两次平衡,进行第二向SDS-PAGE电泳。采用12%凝胶,胶条胶面朝外推入琼脂糖封胶液,待琼脂糖封胶液凝固后将凝胶移至电泳槽,加电极缓冲液,进行SDS-PAGE电泳,浓缩胶电压80 V,分离胶电压120 V。电泳后取出凝胶,染色观察。
2 结果与分析
2.1不同时期子实体蛋白质含量比较
茶薪菇子实体分化不同时期蛋白质含量见表2。由表2可知,茶薪菇随子实体开始分化到成熟过程中,蛋白质含量不断增加,且子实体发育不同时期蛋白质含量差别较大,以幼嫩子实体及成熟菌盖中含量较为丰富,其中TCA-丙酮法的幼嫩子实体蛋白含量高达4.786 μg/μL,为菌丝体2倍,成熟菌盖蛋白质含量达3.033 μg/μL,为菌丝体的1.3倍,原基蛋白含量为2.984 μg/μL,为菌丝体的1.25倍。研究表明两种方法提取的子实体各时期蛋白含量均表现出相同的分化发育规律:即菌盖幼菇最高,原基次之,菌丝体最低。但TCA-丙酮法提取的蛋白质含量偏高,而高浓度尿素-硫脲法提取的蛋白质含量偏低。
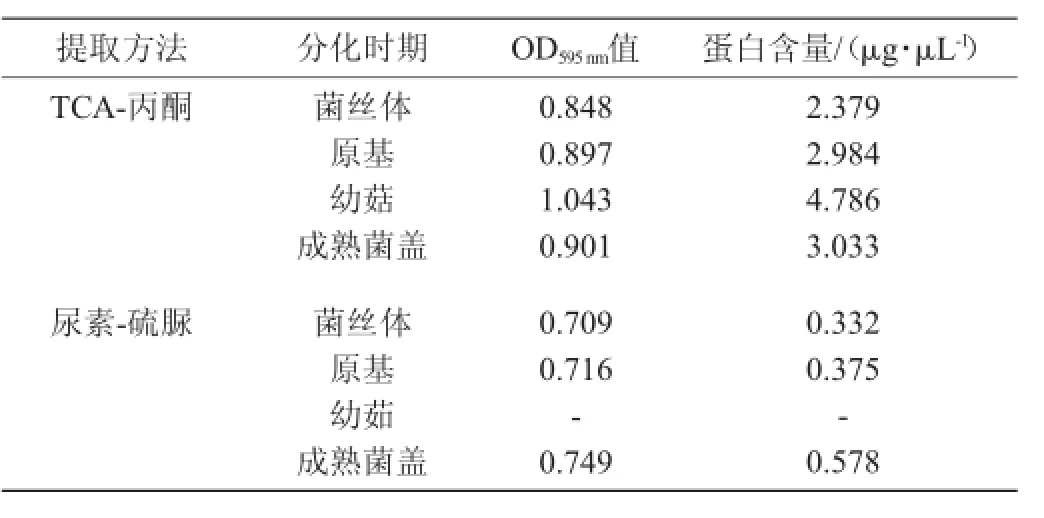
表2 茶薪菇子实体不同分化时期蛋白质含量比较Table 2 Comparison of protein content in different differentiation stages ofAgrocybe aegeritafruiting body
2.2不同提取方法的蛋白质SDS-PAGE电泳图谱分析
两种方法提取蛋白质SDS-PAGE电泳图谱见图1。研究表明,两种方法提取的茶薪菇各时期的蛋白质,分子质量大小主要集中在25~100 ku。TCA-丙酮法提取的蛋白质含量高、丰度较大,条带较多,分布均匀;高浓度尿素-硫脲法提取的蛋白质含量低,丰度小,条带较少,其中泳道5几乎没有条带。TCA-丙酮法提取的蛋白质电泳中,泳道2条带较多染色深,道中间一些蛋白由于浓度过大,未能有效分离,说明幼嫩子实体中蛋白种类较多含量高,上样量较大,后续电泳时应稀释上样量;泳道1为成熟子实体菌盖提取的蛋白质,相比较泳道2浅一些,说明比幼菇中蛋白含量少一些,但高于原基和菌丝体;泳道3、4染色较浅且条带少,表明原基、菌丝体中蛋白含量较子实体低,蛋白种类较少。高浓度尿素-硫脲法提取的蛋白质染色较浅,泳道5几乎看不到条带,说明提取的蛋白含量极少,不适宜进行后续双向电泳,以免影响上样量效果。分析认为茶薪菇细胞多糖色素含量较高,提取液粘度较高,尿素-硫脲法对色素、多酚等干扰物去除能力不足,影响了蛋白质溶解提取;而TCA-丙酮法去除多糖及核酸效果较好,综合比较,TCA-丙酮法提取的蛋白较适合进行后续双向电泳实验。
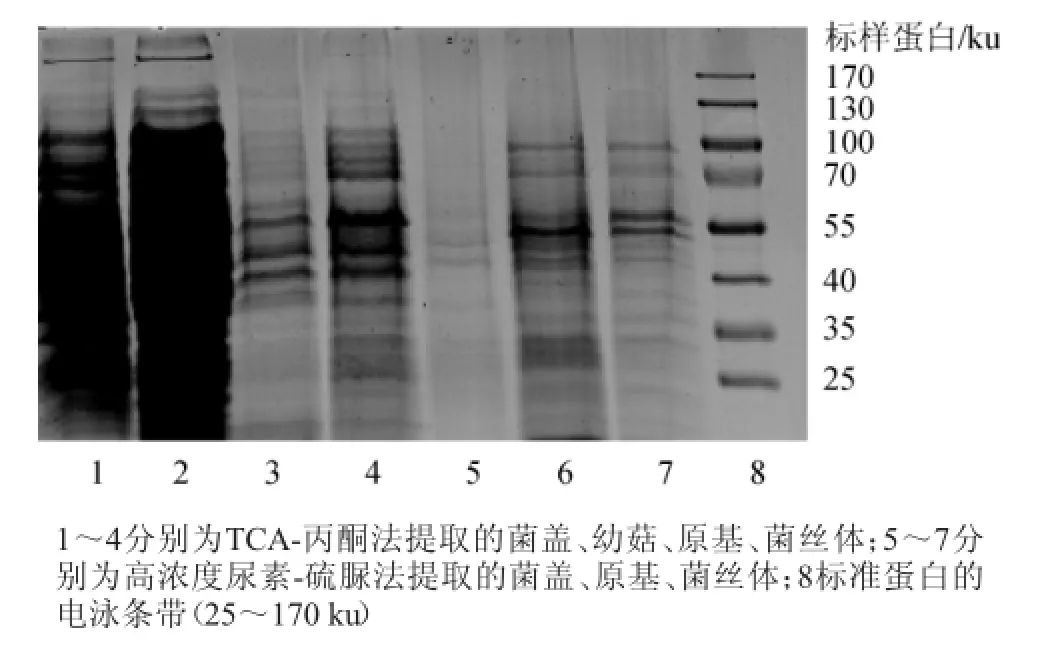
图1 两种方法提取蛋白质SDS-PAGE电泳结果比较Fig.1 Comparison of SDS-PAGE results of two kinds of extraction methods
2.3茶薪菇子实体不同分化期总蛋白的双向电泳图谱分析
实验采用TCA-丙酮法提取的蛋白质样品进行双向电泳试验,样本包括茶薪菇分化过程中的菌丝体、原基、幼菇、成熟菌盖四个时期,双向电泳图谱见图2所示。
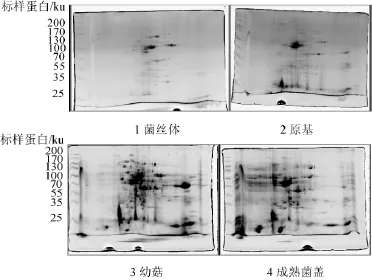
图2 茶薪菇子实体不同分化发育期蛋白质双向电泳图谱Fig.2 Comparison of 2-dimensional gel electrophoresis of Agrocybe aegeritafruiting body protein in different differentiation stages
由蛋白质双向电泳图谱可以看出,各图谱的蛋白点有重合有分散,菌丝体和原基蛋白点少、着色较浅,幼菇和菌盖蛋白点多、着色较深,表明子实体分化发育不同时期蛋白质种类及含量有所不同。其中菌丝体蛋白点着色浅、数量较少,主要集中分布在图谱中部,pI值偏中性,分子质量35~100ku;原基蛋白点着色较浅、数量有所增加、且颜色加深,与菌丝体相似泳点仍集中于中部,分子质量35~100ku,特别是图谱下端35~40 ku及上端130~170 ku增加了一些新的蛋白泳点,表明子实体原基分化形成过程中有些分子量较小的蛋白进行了阶段性的表达;幼菇的蛋白泳点最多,主要集中分布在35~130 ku,泳点着色深,特别是图谱中部左端35~100 ku处蛋白泳点明显增多,表明其pI值偏酸性的蛋白种类及含量明显增多;成熟子实体菌盖与幼嫩子实体蛋白泳点依然是图中部左端蛋白泳点明显增多,但蛋白点分布不够集中,成熟菌盖较幼菇蛋白泳点相对略少,着色稍浅。综合来看,各样本电泳有一些相似的共同蛋白泳点,表明在茶薪菇子实体不同发育阶段与菌丝体有共同的蛋白存在,同时茶薪菇菌丝体与子实体不同发育阶段的总蛋白含量及种类数量存在较为显著差异。
2.4茶薪菇子实体与菌丝体蛋白图谱差异比较
采用BIO-RAD PDQuest 8.0软件分析表明,在茶薪菇子实体发育不同阶段蛋白质的双向电泳图谱中共检测到1 115个特异蛋白斑点,其中原基蛋白点数30个,幼菇期出现的特异蛋白斑点数在整个分化发育过程中最多达570个,成熟菌盖出现的蛋白斑点数较多为515个,与菌丝体出现的146个蛋白点相比,幼菇和成熟菌盖中表达的蛋白明显增多,说明茶新菇子实体幼菇阶段细胞分化发育处于高峰期,基因表达十分活跃。且由图3可知,茶薪菇子实体分化发育过程中与菌丝体的特异蛋白斑点变化规律有一定的相似性,这些特异蛋白斑点有些在随后的子实体发育中消失,有些则进行了上调表达,推测这些特异蛋白可能与相应子实体的形体特征发育有关,有待进一步的研究。

图3 茶薪菇菌丝体与子实体蛋白二维图谱差异比较Fig.3 Comparison of 2-dimensional diagram ofAgrocybe aegerita mycelia and fruiting body protein
2.5讨论
2.5.1样本破碎方法对蛋白电泳效果的影响
茶薪菇细胞壁坚韧不易破碎,胞内蛋白质获取较困难,因此细胞壁破碎处理方法非常重要。目前研究中多采用超声波法、液氮研磨法、酶解法、玻璃珠法及几种结合的方法。酶解法常需要多种酶混合作用,成本较高;玻璃珠法效果有限。液氮研磨配合超声波处理,以20 min、400 W功率破碎效果较好,采用超声波处理时需特别注意使用时间、功率及温度等,否则可能造成蛋白降解,影响电泳效果。
2.5.2样本提取方法对蛋白浓度与纯度的影响
本文初步探究了较适宜茶薪菇蛋白质提取的方法。TCA-丙酮法提取的蛋白质丰度较高,双向电泳获得的点数也较多,但该法仍存在拖尾现象,表明样本存在不纯问题,主要是由于茶薪菇细胞多糖含量比较多,直接影响到提取蛋白的纯度,进而影响到蛋白电泳点的分离度与分辨率,故此在今后研究中需要重点去除菌丝多糖,可通过乙醇、乙醚来除多糖等杂质、减小上样量的方法来进一步优化。本研究采用高浓度尿素-硫脲法也进行了双向电泳实验,但蛋白泳点数极少,原基样本进行第一向等点聚焦时电压很低,可能与样本蛋白浓度过低有关。总之两种方法相比,TCA-丙酮法提取的蛋白较适合茶薪菇的双向电泳。
3 结论
TCA-丙酮法去除多糖及核酸效果较好,提取的蛋白种类和数量较多,较适合茶薪菇蛋白双向电泳。研究表明,茶薪菇子实体分化发育过程中蛋白图谱斑点数量变化规律为:较少—速增—减少,其中菌丝体期出现的特异蛋白斑点数最少,仅146个;幼菇期蛋白斑点数速增3.9倍,达570个;子实体成熟后菌盖蛋白数又降至515个。表明菌丝体阶段蛋白种类少,以细胞基本蛋白为主,子实体幼菇期细胞分化发育达到高峰,差异蛋白表达极其活跃,子实体发育成熟后细胞分化明显减少,蛋白质种类亦逐渐减少。另外实验发现,菌丝体与子实体成熟菌盖之间存在一些位置相同的蛋白斑点,分析认为这些可能是细胞中的一些基本蛋白成分,二者之间的关系有待于进一步研究。
[1]刘万飞,路等学,赵宇慧,等.茶薪菇国内外研究进展及展望[J].中国食用菌,2012,31(3):1-5.
[2]张筱梅,朱维红,贾春凤.二株茶薪菇菌丝多糖深层发酵的培养特征比较与条件控制[J].北方园艺,2014(23):127-129.
[3]郝龙.茶树菇胞外多糖及胞内硒多糖的提取优化和抗氧化研究[D].济南:山东农业大学,2014.
[4]方一泓,余萍,李薇,等.茶薪菇子实体多糖的分离纯化好免疫活性研究[J].食用菌学报,2006,13(4):63-68.
[5]刘艳茹,余萍,郑怡,等.柱状田头菇凝集素的分离纯化及其部分性质研究[J].食用菌学报,2004,11(3):17-23.
[6]毛慧玲,樊棠怀.茶薪菇不同发育期酯酶同工酶的研究[J].南昌大学学报·理科版,2002,26(4):375-376.
[7]党建章,徐旭士,程为民.茶薪菇不同生长期同工酶的研究[J].中国食用菌,2001,20(1):41-43.
[8]陶永新,朱坚,廖剑华.差异蛋白质组学在食用真菌中的研究进展[J].中国农学通报,2011,27(14):55-59.
[9]黄碧芳,朱鸿萍,李彩斌,等.虎奶菇菌丝体自溶蛋白质制备方法比较[J].中国食用菌,2010,29(1):52-54.
[10]唐奕诗,马楚莹,周玉萍,等.一种高效的灵芝菌丝体总蛋白的提取方法[J].生物技术世界,2014(10):4-6.
[11]刘晓云,苏明声,杨俊璋,等.灵芝子实体原基双向电泳和总蛋白质提取方法的建立[J].菌物学报,2009,28(6):802-805.
[12]李顺峰,王安建,侯传伟,等.超声波法优化提取双孢蘑菇废弃菇柄蛋白质[J].食品科技,2014,39(17):258-261.
[13]BRADFORD M M.Rapid and sensitive method for quantitation of microgram quantities of protein utilizing principle of protein-dye binding [J].Anal Biochem,1976,72:248-254.
[14]齐婷婷,段江燕.适用于小麦叶片总蛋白分析的双向电泳技术[J].山西师范大学学报,2012,26(4):50-55.
[15]陈蕊红,张改生,刘卫.小麦花药蛋白质组双向电泳技术体系的优化[J].核农学报,2008,22(4):404-409.
[16]金德善,卢存福,兰小中,等.雪莲愈伤组织蛋白质提取及双向电泳分析[J].西北植物学报,2012,32(9):1903-1909.
Changes and analysis of two-dimensional electrophoresis profiles ofAgrocybe aegerita fruiting body total protein during differentiation
ZHANG Xiaomei,ZHU Weihong,MIAO Xiaoyan*,WANG Nannan,WU Yanqing (Baoding University,Baoding 071000,China)
The protein ofAgrocybe aegeritain different differentiation stages was extracted by TCA-acetone method and urea-thiourea method,and the two-dimensional electrophoresis(2-DE)of the protein were analyzed.The results showed that the TCA-acetone method was suitable for protein electrophoresis.2-DE protein electrophoresis results revealed 1261 specific protein spots in total from samples of the mycelium stage,primordium stage,young fruiting period stage,and mature fruiting body stage.Among them,the electrophoresis of young fruiting period stage showed the most specific spots(570),mature fruiting body ranked second with specific spots of 515,while the mycelium stage showed the lowest specific spots of just 146,indicating that protein expression reached the peak at young fruiting period stage and differential protein profile expressed very active.Results showed that there were certain similarity between the changing rules of specific protein spots of mycelia and the development of fruiting body differentiation stages.However,some protein spots disappeared in the subsequent development of the fruiting body.It was speculated that the specific proteins might be related to the physical characteristics development of the corresponding fruiting bodies.
Agrocybe aegerita;fruiting body;differentiation;two-dimensional electrophoresis
S646.9
0254-5071(2016)10-0140-04
10.11882/j.issn.0254-5071.2016.10.031
2016-05-27
河北省自然科学基金项目(C2013104055);保定学院食药用菌驯化育种与开发科研团队资助。
张筱梅(1957-),女,教授,本科,研究方向为微生物学。
苗晓燕(1980-),女,副教授,硕士,研究方向为生物科学。
