谷氨酸棒状杆菌果糖代谢阻断工程菌的构建
2016-12-02许湄雪王北辰刘金雷韩武洋李天明冯惠勇
许湄雪,王北辰,刘金雷,范 荣,陆 浩,韩武洋,李天明,*,冯惠勇
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.威斯康星大学,威斯康星 麦迪逊 53706,美国)
谷氨酸棒状杆菌果糖代谢阻断工程菌的构建
许湄雪1,王北辰2,刘金雷1,范 荣1,陆 浩1,韩武洋1,李天明1,*,冯惠勇1
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.威斯康星大学,威斯康星 麦迪逊 53706,美国)
谷氨酸棒状杆菌不仅可以利用葡萄糖和果糖作为碳源进行糖类代谢,也可以利用这些碳源作为底物生产葡萄糖酸、甘露醇及山梨醇等产品。为了提高底物利用率和目的产物的积累量,利用代谢工程阻断糖类代谢的磷酸烯醇式丙酮酸-糖磷酸转移酶系统(phosphoenolpyruvate carbohydrate phosphotransferase system,PTS)和失活相应磷酸激酶。是实现此目标的有效手段。本实验利用同源重组和反向筛选等技术手段,分别获得ptsF单基因缺失工程菌CGΔptsF和ptsF、ptsH、ptsI三基因缺失工程菌CGΔptsFΔptsHΔptsI。工程菌的生长情况研究表明:在以葡萄糖为唯一碳源的培养基上,工程菌CGΔptsF和工程菌CGΔptsFΔptsHΔptsI与野生型生长情况基本一致,说明葡萄糖代谢不受3 个基因影响;在以蔗糖为唯一碳源的培养基上,工程菌CGΔptsF和工程菌CGΔptsFΔptsHΔptsI的生长速率分别是野生型的48.4%和29.7%,菌体浓度分别是野生型的61.6%和34.1%;在以果糖为唯一碳源的培养基上,工程菌CGΔptsF菌体浓度是野生型43.2%,工程菌CGΔptsFΔptsHΔptsI生长为0,证明其完全阻断了果糖代谢,同时说明果糖的PTS系统受ptsF、ptsH和ptsI基因编码的PTS相关蛋白的联合控制。果糖代谢阻断工程菌的获得,为进一步构建以果糖原型为底物的甘露醇或山梨醇生产工程菌株提供了遗传资源,也为谷氨酸棒状杆菌的糖类代谢研究提供了理论依据。
谷氨酸棒状杆菌;基因敲除;磷酸烯醇式丙酮酸-糖磷酸转移酶系统
谷氨酸棒状杆菌(Corynebacterium glutamicum)是食品级微生物之一,在氨基酸产品、蛋白质产品、其他化学产品的生产中扮演者非常重要的角色,广泛应用于生物转化、食品添加剂、动物饲料、化妆品、医药卫生等领域[1-2],特别是被广泛用于谷氨酸、赖氨酸的生产[3]。随着谷氨酸棒状杆菌ATCC 13032全基因组的测序,揭示了这种微生物以前未知的代谢调控网络和功能,使我们可以通过代谢工程手段定向改造谷氨酸棒状杆菌,作为细胞工厂生产更多的生物制造产品的目标得以实现[4-7]。
谷氨酸棒状杆菌在工业生产中,利用农副产品提供葡萄糖、蔗糖和果糖作为碳源[8],为生长提供能量。同时作为细胞工厂,谷氨酸棒状杆菌也可以利用这些糖类物质的原型作为底物生产有价值的产品,例如:由葡萄糖生产葡萄糖酸、由果糖生产甘露醇、由果糖生产山梨醇等[9-10]。但是,这些糖类往往通过磷酸烯醇式丙酮酸-糖磷酸转移酶系统(phosphoenolpyruvate carbohydrate phosphotransferase system,PTS)被微生物所摄取,并通过磷酸化后进入糖酵解途径被代谢,或者通过ATP-binding cassette transporter(ABC)转运系统将其原型转运进入细胞,再在磷酸化激酶的作用下磷酸化后被代谢[11-14]。所以,阻断两种形式的磷酸化途径,阻止糖类以碳源的形式被代谢,将有利于底物利用率的提高和目标产物的积累[15-18]。
本实验以谷氨酸棒状杆菌ATCC 13032为出发菌,通过两次同源重组和蔗糖致死基因sacB反向筛选技术进行基因的无痕敲除:第1次重组时,打靶质粒上的同源臂与染色体组发生重组,利用抗性筛选,打靶质粒被整合到染色体上;第2次重组时,打靶质粒上未发生重组的同源臂与基因外侧同源臂发生重组,利用sacB基因反向筛选出同源臂间的目的基因被无痕敲除的菌株[19],采用此方法分别敲除了果糖被代谢的PTS系统,构建了ptsF、ptsH、ptsI基因缺失工程菌,阻断了其对果糖的代谢,为进一步构建以果糖原型为底物的甘露醇或山梨醇生产工程菌株提供了遗传资源,也为谷氨酸棒状杆菌的糖类代谢的研究提供了理论依据。
1 材料与方法
1.1 试剂与培养基
Hi-Fi DNA聚合酶 北京全式金生物技术有限公司;限制性内切酶EcoR I、BamH I、Xba I、Not I NEB(北京)有限公司;T4 DNA 连接酶 宝生物工程(大连)有限公司;琼脂糖凝胶DNA回收试剂盒、DNA纯化回收试剂盒、质粒小提中量试剂盒 天根生化科技(北京)有限公司;Ezup柱式细菌基因组DNA抽提试剂盒 生工生物工程(上海)股份有限公司。聚合酶链反应(polymerase chain reaction,PCR)引物由生工生物工程(上海)股份有限公司合成。
LB培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、NaCl 10 g/L,pH 6.4~6.7,121 ℃灭菌20 min。LB固体培养基,加入20 g/L的琼脂。必要时加入终质量浓度为30 mg/L的卡那霉素。
CD培养基(g/L):磷酸二氢钾1、硫酸铵3、硝酸铵1、硫酸镁0.5、氯化钙0.2、硫酸铁0.01 、硫酸锰0.01、硫酸铜0.002、硫酸锌0.001、生物素0.002,pH 6.4~6.7,0.2 μm过滤除菌。
孵育培养基:CD培养基中加入乙酸钠50 g/L、乳酸钠50 g/L,pH 6.4~6.7,0.2 μm过滤除菌。
本研究所涉及的菌株及质粒如表1所示,相关引物序列如表2所示。

表1 实验所用菌株及质粒Table 1 Strains and plasmids used in this study

表2 实验所用引物Table 2 Primers used in this study
1.2 仪器与设备
PCR仪 德国Eppendorf公司;全自动凝胶成像系统、GenePulser XcellTM电转仪 美国Bio-Rad公司;高速冷冻离心机、DYY-6C电泳仪 北京市六一厂;HWS型培养箱 宁波江南仪器厂;恒温金属浴 杭州博日科技有限公司。
1.3 方法
1.3.1 打靶质粒的构建
本实验用于敲除ptsF、ptsH和ptsI基因的打靶质粒利用如下方法构建:以敲除ptsF基因为例,首先以谷氨酸棒状杆菌ATCC 13032菌株基因组为模板,通过PCR扩增出ptsF基因上游下游同源臂片段,通过融合PCR得到目的片段 ptsF,片段经纯化后,与pK18mobsacB质粒同时进行EcoR I、BamH I双酶切,酶切产物回收后,经T4连接酶16 ℃过夜连接,转化至E. coli Trans5a,筛选阳性转化子,提取质粒进行PCR验证,测序,最终得到打靶质粒pK18mobsacB/ΔptsF。构建示意图如图1所示。利用类似构建方法又得到同时敲除ptsH、ptsI基因的打靶质粒pK18mobsacB/Δpts5。

图1 pK18mobsacB/Δpts F构建示意图Fig. 1 Construction of pK18mobsacB/ΔptsF
1.3.2 工程菌的构建
谷氨酸棒杆菌感受态细胞制备参考van der Rest[20]和Hu[21]等的研究方法,取约5 μg打靶质粒与40 μL感受态细胞轻轻混合,转入电击杯,进行电击(电击条件为2.5 kV/cm电压、250 Ω电阻、25 μF电容、2 mm电击杯)。电击完成后,30 ℃、180 r/min孵育培养4 h,涂布于含有卡那霉素抗性的固体培养基上,30 ℃,培养约40 h,固体培养基平板上长出均匀单菌落,挑取单菌落进行筛选。
1.3.3 工程菌的筛选
将平板培养基上长出的单菌落扩培至含卡那霉素抗性的固体平板培养基上,振荡裂解后进行菌落PCR验证,确认打靶质粒经同源重组成功整合到染色体上。选取验证正确的转化子,在无抗性压力条件下振荡培养6 h,稀释涂布于含有10%蔗糖的固体平板培养基上,利用蔗糖致死基因sacB反向筛选出发生第二次同源重组的转化子,挑取蔗糖平板培养基上单菌落,分别影印在卡那霉素抗性平板培养基及10%蔗糖平板培养基上,30 ℃培养约40 h。选取在卡那霉素抗性平板培养基上不生长而对应蔗糖平板培养基上生长的单菌落,扩培,通过设计相对应的验证引物来进行菌落PCR验证,从而获得阳性工程菌。
1.3.4 工程菌生长情况的研究
将工程菌和谷氨酸棒状杆菌ATCC 13032菌株进行摇瓶发酵。工程菌和谷氨酸棒状杆菌ATCC 13032菌株分别挑取1 环至西林瓶,无菌生理盐水重悬,调节至光密度(OD)值基本一致,接种于CD加唯一碳源的培养基中,30 ℃,180 r/min,不同时间取样,观测其生长情况,在600 nm波长处测定光密度值,以体现菌体浓度。
2 结果与分析
2.1 ptsF基因缺失菌株的构建及验证
2.1.1 ptsF打靶质粒的构建
以谷氨酸棒状杆菌ATCC 13032基因组为模板,通过PCR技术扩增ptsF基因上下同源臂,又利用融合PCR获得目的片段,与pK18mobsacB连接,得到重组质粒pK18mobsacB/ΔptsF。分别利用扩增上下同源臂时设计的引物PTSFUPF/PTSFUPR和PTSFDOF/PTSFDOR对重组质粒pK18mobsacB/ΔptsF进行PCR验证,结果如图2所示,两对引物分别扩增出大小1 050 bp和1 100 bp片段,与谷氨酸棒状杆菌ATCC 13032基因组扩增的大小一致,且空白阴性对照(水为模版)无条带,说明重组质粒pK18mobsacB/ΔptsF构建成功。

图2 pK18mobsacB/ΔptsF质粒PCR验证Fig. 2 Identification of plasmid pK18mobsacB/Δ图2pK18mobsacB/Δpts
2.1.2 CGΔptsF工程菌的筛选
将重组质粒pK18mobsacB/ΔptsF电击转化至谷氨酸棒状杆菌ATCC 13032感受态细胞,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程示意图如图3所示。
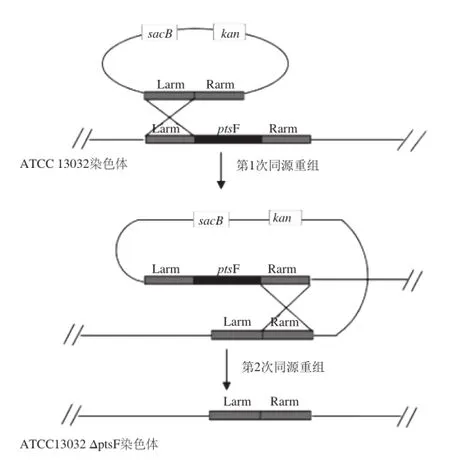
图3 利用sacB系统进行基因敲除过程示例Fig. 3 Gene deletion procedure based on sacB system
按照谷氨酸棒状杆菌ATCC 13032被敲除的ptsF基因序列设计敲除验证引物QPTSFYZF/QPTSFYZR,分别以CGΔptsF菌株、谷氨酸棒状杆菌ATCC 13032菌株的基因组DNA为模板,进行PCR验证,结果如图4所示,谷氨酸棒状杆菌ATCC 13032菌株扩增出大小为520 bp的ptsF基因片段,CGΔptsF菌株没有扩增出相应片段,并且空白阴性(水为模版)对照无条带,说明CGΔptsF工程菌基因组中的ptsF基因已被敲除。
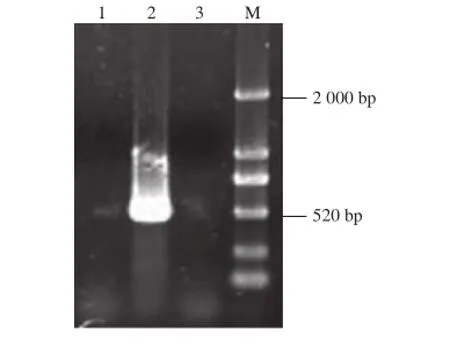
图4 CGΔpts F基因组PCR验证Fig. 4 Identification ofCGΔpts F ptsF deletion by PCR
2.1.3 CGΔptsF工程菌生长状况
CGΔptsF及谷氨酸棒状杆菌ATCC 13032在以果糖为唯一碳源的条件下摇瓶发酵,测定生长曲线,结果如图5所示。由这两条生长曲线可以看出,敲除ptsF基因的突变株与野生型在延滞期生长速率开始降低,生长缓慢,最终生物量比野生型明显下降,表明敲除ptsF基因使菌株对果糖利用率降低,但仍能利用果糖继续生长。
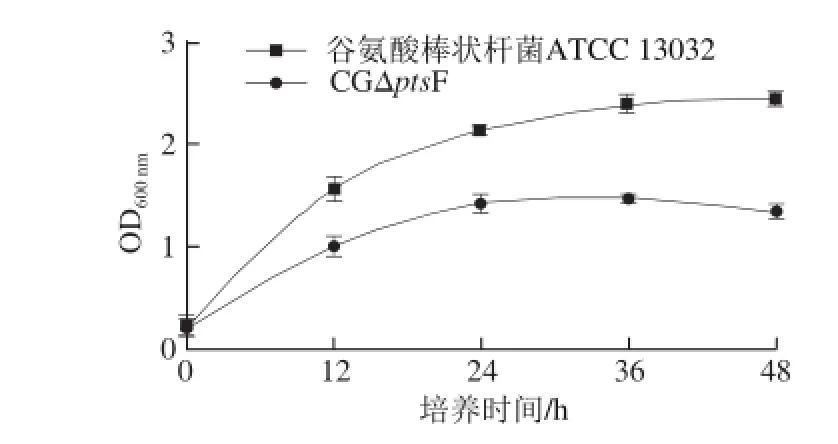
图5 谷氨酸棒状杆菌ATCC 13032与CGΔpts F在果糖为唯一碳源条件下的生长情况Fig. 5 Growth curves of C. glutamicum ATCC 13032 and CGΔptsF in fructose minimal medium
2.2 ptsH、ptsI基因缺失菌株的构建及验证
2.2.1 ptsH、ptsI打靶质粒的构建
以谷氨酸棒状杆菌ATCC 13032基因组为模板,通过PCR技术扩增ptsH、ptsI基因上下同源臂,又利用融合PCR获得目的片段pts5,与pK18mobsacB连接,得到重组质粒pK18mobsacB/Δpts5。分别利用扩增上下同源臂时设计的引物PTS5UPF/PTS5UPR和PTS5DOF/PTS5DOR对重组质粒pK18mobsacB/Δpts5进行PCR验证,结果如图6所示,两对引物分别扩增出大小1 000 bp和1 020 bp的片段,与谷氨酸棒状杆菌ATCC 13032基因组扩增的大小一致,且空白阴性对照(水为模版)无条带,说明重组质粒pK18mobsacB/Δpts5构建成功。
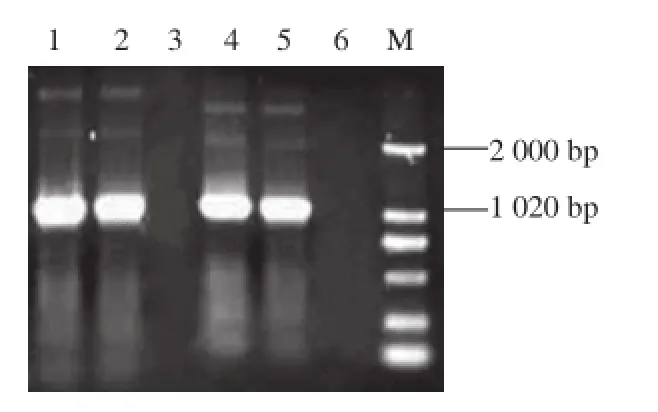
图6 pK18mobsacB/Δpts5质粒PCR验证Fig. 6 Identification of plasmid pK18mobsacB/Δpts5 by PCR
2.2.2 CGΔptsFΔptsHΔptsI工程菌的筛选
将重组质粒pK18mobsacB/Δpts5电击转化至CGΔptsF感受态细胞中,利用两次同源重组方法和sacB基因反向筛选技术来实现基因的无痕敲除,基因重组过程与图3示例相似。
谷氨酸棒状杆菌ATCC 13032基因组序列中被敲除的ptsH基因、ptsI基因为相邻基因,按照其基因序列设计敲除验证引物QPTS5YZF/QPTS5YZR,分别以CGΔptsFΔptsHΔptsI菌株与谷氨酸棒状杆菌ATCC 13032菌株的基因组DNA为模板,进行PCR验证,结果如图7所示,谷氨酸棒状杆菌ATCC 13032菌株扩增出大小为1 080 bp的ptsH、ptsI基因片段,CGΔptsFΔptsHΔptsI菌株没有扩增出相应大小的片段,并且空白阴性对照(水为模版)无条带,说明CGΔptsFΔptsHΔptsI工程菌基因组中的ptsH、 ptsI基因已被敲除。

图7 CGΔptsFΔptsHΔptsI基因组PCR验证Fig. 7 Identification of ptsF ptsH and ptsI deletion by PCR
2.2.3 CGΔptsFΔptsHΔptsI工程菌生长状况
CGΔptsF、CGΔptsFΔptsHΔptsI及谷氨酸棒状杆菌ATCC 13032在以果糖为唯一碳源的条件下摇瓶发酵,测定生长曲线,结果由图8可知,进一步敲除ptsH和ptsI基因的突变株生长量几乎为零,表明敲除ptsH和ptsI基因后,菌株不能利用果糖用生长。
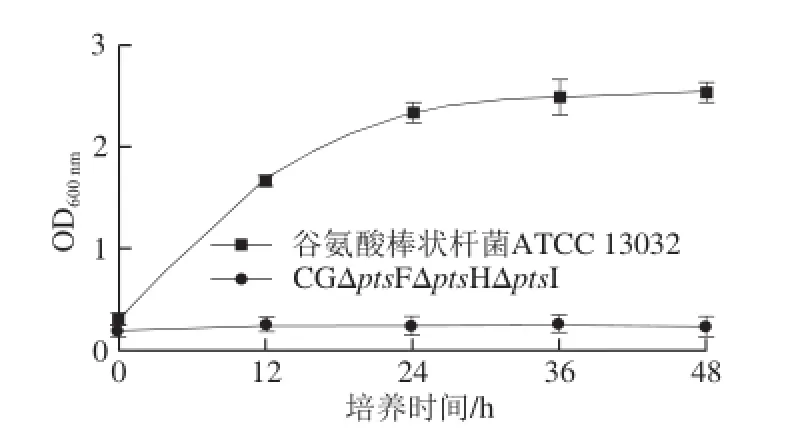
图8 谷氨酸棒状杆菌ATCC 13032与CGΔptsFΔptsHΔpts I在果糖为唯一碳源条件下的生长情况Fig. 8 Growth curves of C. glutamicum ATCC 13032 and CGΔptsFΔptsHΔptsI in fructose minimal medium
2.3 谷氨酸棒状杆菌ATCC 13032、CGΔptsF、CGΔptsFΔptsHΔptsI分别在不同碳源培养基中的生长情况
CD培养基中分别加入1%果糖、1%蔗糖、1%葡萄糖为唯一碳源,配制成3 种CD培养基,将谷氨酸棒状杆菌ATCC 13032、CGΔptsF和CGΔptsFΔptsHΔptsI菌株分别等OD值接种,摇瓶发酵,测定生长曲线,结果如图9所示。
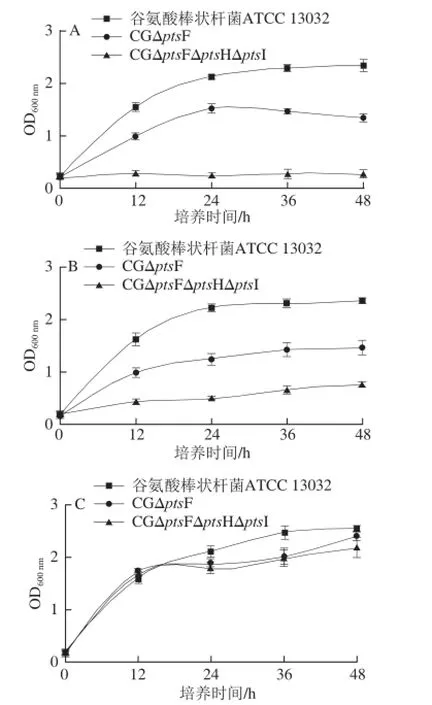
图9 野生菌与工程菌的生长情况Fig. 9 Growth curves of the wild strain and the engineered strains
由图9可知,在果糖培养基中谷氨酸棒状杆菌ATCC 13032生长良好,CGΔptsF生长减缓,菌体浓度降低,为谷氨酸棒状杆菌ATCC 13032的43.2%,CGΔptsFΔptsHΔptsI不能生长,生长量为0。在蔗糖培养基中,谷氨酸棒状杆菌ATCC 13032生长良好,CGΔptsF生长减缓,生长速率为谷氨酸棒状杆菌ATCC 13032的48.4%,CGΔptsFΔptsHΔptsI生长更加微弱,为谷氨酸棒状杆菌ATCC 13032的29.7%。在葡萄糖培养基中,3 株菌均生长良好,无明显差异。
3 讨 论
自从Mori和Shiio首次发现了谷氨酸棒状杆菌中的PTS系统之后[10],一些研究表明,蔗糖、果糖和葡萄糖通过PTS系统被谷氨酸棒状杆菌利用,该系统参与细胞生长过程中对果糖等碳源的吸收、运输和磷酸化过程[11]。据报道,PTS系统由特异性蛋白E1(由ptsH编码)、搬运蛋白HPr(由ptsI编码)和酶Ⅱ(EIIs)组成[9]。PEP代谢中的磷酰基团由E1传递至HPr、EIIs,最终到达葡萄糖,完成葡萄糖的磷酸化转运。EIIs是由多种不同功能可特异性识别和转运的蛋白组成,参与细胞中的磷酸化转运工作[14-15]。PTS系统分为4 种,分别特异作用于葡萄糖、果糖、蔗糖和另外一种未知底物。其中葡萄糖-PTS系统由EIIGlc葡萄糖特异性EIIABC组件(由ptsG编码)和2 个通用组件E1、HPr构成。果糖-PTS系统由EIIFru果糖特异性EIIABC组件(由ptsF编码)构成。蔗糖-PTS系统则由EIIsuc蔗糖特异性EIIABC组件(由ptsS编码)构成[17-18]。
本研究利用基因工程构建工程菌,改变其代谢途径已经成为非常普遍而又有效的方法。本实验以谷氨酸棒状杆菌ATCC 13032为出发菌,利用融合PCR等分子操作构建用于打靶的重组质粒,利用2 次同源重组的原理对目的基因ptsF进行敲除,通过基因组PCR验证基因缺失菌株CGΔptsF。该基因缺失菌株在以果糖为唯一的培养基上的生长速率低于野生型,菌株对果糖的利用率降低,ptsF基因的敲除对菌株生长造成了一定影响,但仍保留了运输果糖的能力,说明果糖的转运除了由ptsF编码的EIIFru果糖特异性EIIABC组件[17]以外,还存在着其他转运磷酸化系统。
在CGΔptsF基础之上,实验又进一步敲除了ptsH和ptsI基因簇,它们分别编码特异性蛋白E1和搬运蛋白HPr[9],获得CGΔptsFΔptsHΔptsI工程菌株,该工程菌在果糖为唯一碳源的培养基上,生长速率为0,完全阻断了果糖的PTS运输系统。而Moon等[15]在谷氨酸棒状杆菌ATCC 13032敲除ptsF基因基础上,进一步敲除ptsG基因后,在果糖为唯一碳源的培养基上不再生长。本研究报道了谷氨酸棒状杆菌ATCC 13032的果糖运输由果糖-PTS系统EIIFru果糖特异性EIIABC组件和PTS系统特异性蛋白E1及搬运蛋白HPr共同构成。另外,发现ptsF、ptsH和ptsI基因的敲除,也影响了蔗糖代谢,可能的原因是蔗糖在EIIsuc蔗糖特异性EIIABC组件(由ptsS编码)作用下成为6-P-蔗糖,水解产生果糖和6-P-葡萄糖,6-P-葡萄糖被代谢利用,果糖被分泌到胞外,而ptsF、ptsH和ptsI基因缺失工程菌已阻断了果糖的代谢,只有6-P-葡萄糖支撑了菌体生长,由此也影响了蔗糖的代谢。Moon等[12]发现ptsF基因缺失菌株在蔗糖为唯一碳源的培养基上培养时,检测到培养基中有果糖积累,当培养基中蔗糖耗尽时,果糖量不再增加,转为碳源继续维持菌体生长,果糖量逐渐降低。这个结论也从另一角度证实了本研究的结论。
[1] BLOMBACH B, SEIBOLD G. Carbohydrate metabolism in Corynebacterium glutamicum and applications for the metabolic engineering of L-lysine production strains[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1313-1322. DOI:10.1007/s00253-010-2537-z.
[2] HOU X, CHEN X, ZHANG Y, et al. L-Valine production with minimization of by-products’ synthesis in Corynebacterium glutamicum and Brevibacterium flavum[J]. Amino Acids, 2012, 43(6): 2301-2311. DOI:10.1007/s00726-012-1308-9.
[3] LEUCHTENBERGER W, HUTHMACHER K, DRAUZ K. Biotechnological production of amino acids and derivatives: current status and prospects[J]. Applied Microbiology and Biotechnology, 2005, 69(1): 1-8. DOI:10.1007/s00253-005-0155-y.
[4] NESVERA J, PATEK M. Tools for genetic manipulations in Corynebacterium glutamicum and their applications[J]. Applied Microbiology and Biotechnology, 2011, 90(5): 1641-1654. DOI:10.1007/s00253-011-3272-9.
[5] 汤俊, 郝宁, 许晟, 等. 谷氨酸棒杆菌argG基因缺失菌株的构建[J].南京工业大学学报, 2013, 35(6): 1671-7627. DOI:10.3969/ j.issn.1671-7627.2013.06.018.
[6] KALINOWSKI J, BATHE B, BARTELS D, et al. The complete Corynebacterium glutamicum ATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J]. Journal of Biotechnology, 2003, 104(1/2/3): 5-25. DOI:10.1016/S0168-1656(03)00154-8.
[7] IKEDA M, MIZUNO Y, AWANE S, et al. Identification and application of a different glucose uptake system that functions as an alternative to the phosphotransferase system in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2011, 90(4): 1443-1451. DOI:10.1007/s00253-011-3210-x.
[8] LÜ Y, LIAO J, WU Z, et al. Genome sequence of Corynebacterium glutamicum ATCC 14067, which provides insight into amino acid biosynthesis in coryneform bacteria[J]. Journal of Bacteriology, 2012, 194(3): 742-743. DOI:10.1128/JB.06514-11.
[9] IKEDA M. Sugar transport systems in Corynebacterium glutamicum: features and applications to strain development[J]. Applied Microbiology and Biotechnology, 2012, 96(5): 1191-2000. DOI:10.1007/s00253-012-4488-z.
[10] MORI M, SHIIO I. Phosphoenolpyruvate: sugar phosphotransferase systems and sugar metabolism in Brevibacterium flavum[J]. Agricultural and Biological Chemistry, 1987, 51(10): 2671-2678. DOI:10.1271/bbb1961.51.2671.
[11] PARCHE S, BURKOVSKI A, SPRENGER G, et al. Corynebacterium glutamicum: a dissection of the PTS[J]. Journal of Molecular Microbiology and Biotechnology, 2001, 3(3): 423-428.
[12] MOON M, PARK S, CHOI S, et al. The phosphotransferase system of Corynebacterium glutamicum: features of sugar transport and carbon regulation[J]. Journal of Molecular Microbiology and Biotechnology, 2007, 12(1/2): 43-50. DOI:10.1159/000096458.
[13] 胡瑾瑜. 谷氨酸棒状杆菌基因敲除和表达系统的构建及其应用[D].无锡: 江南大学, 2014: 4-7.
[14] ESCALANTE A, CERVANTES A, GOSSET G, et al. Current knowledge of the Escherichia coli phosphoenolpyruvate-carbohydrate phosphotransferase system: peculiarities of regulation and impact on growth and product formation[J]. Applied Microbiology and Biotechnology, 2012, 94(6): 1483-1494. DOI:10.1007/s00253-012-4101-5.
[15] MOON M, KIM H, OH T, et al. Analyses of enzyme II gene mutants for sugar transport and heterologous expression of fructokinase gene in Corynebacterium glutamicum ATCC 13032[J]. Microbiology Letters, 2005, 244(2): 259-266. DOI:10.1016/j.femsle.2005.01.053.
[16] 谭延振. 谷氨酸棒状杆菌基因敲除系统的构建[D]. 无锡: 江南大学, 2012: 4-7.
[17] TANAKA Y, TERAMOTO H, INUI M, et al. Regulation of expression of general components of the phosphoenolpyruvate: carbohydrate phosphotransferase system (PTS) by the global regulator SugR in Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology, 2008, 78(2): 309-318. DOI:10.1007/s00253-007-1313-1.
[18] GABOR E, GOHLER A, KOSFELD A, et al. The phosphoenol pyruvate-dependent glucose-phosphotransferase system from Escherichia coli K-12 as the center of anetwork regulating carbohydrate flux in the cell[J]. Journal of Cell Biology, 2011, 90(9): 711-720.
[19] TAN Y, XU D, LI Y, et al. Construction of a novel sacB-based system for marker-free gene deletion in Corynebacterium glutamicum[J]. Plasmid, 2012, 67(1): 44-52. DOI:10.1016/j.plasmid.2011.11.001.
[20] van der REST M, LANGE C, MOLENAAR D. A heat shock following electroporation induces highly efficient transformation of Corynebacterium glutamicum with xenogeneic plasmid DNA[J]. Applied Microbiology and Biotechnology, 1999, 52(4): 541-545. DOI:10.1007/s002530051557.
[21] HU J, TAN Y, LI Y, et al. Construction and application of an efficient multiple-gene-deletion system in Corynebacterium glutamicum[J]. Plasmid, 2013, 70(3): 303-313. DOI:10.1016/j.plasmid.2013.07.001.
Construction of Engineered Strain of Corynebacterium glutamicum Capable of Blocking Fructose Metabolism
XU Meixue1, WANG Beichen2, LIU Jinlei1, FAN Rong1, LU Hao1, HAN Wuyang1, LI Tianming1,*, FENG Huiyong1
(1. College of Biological Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. University of Wisconsin, Madison 53706, USA)
Corynebacterium glutamicum is a food-grade microorganism widely used to produce amino acids, proteins and other chemical products in the fields of biological transformation, food additives, animal feed, cosmetics, medicine and health care. It can not only use glucose and fructose as the carbon sources, but also can use them as the substrates to produce gluconic acid, mannitol, sorbitol and other products. Blocking sugar metabolism in which the phosphoenolpyruvate carbohydrate phosphotransferase system (PTS) and phosphokinase are involved through metabolic engineering is an effective avenue to improve substrate utilization and the accumulation of desired products. In this research, the mutant strains CGΔptsF lacking the ptsF gene and CGΔptsFΔptsHΔptsI lacking the ptsF, ptsH and ptsI genes were constructed by homologous recombination and reverse screening. It was shown that both CGΔptsF and CGΔptsFΔptsHΔptsI were grown in medium with glucose as the only carbon source, while glucose metabolism was not affected by the lack of these three genes. Compared to the wild-type strain, the growth rates of CGΔptsF and CGΔptsFΔptsHΔptsI were 48.4% and 29.7% and cell concentrations of CGΔptsF and CGΔptsFΔptsHΔptsI were 61.6% and 34.1%, respectively, when the mutant strains were grown in medium using sucrose as the sole carbon source. However, when they were grown using fructose as the sole carbon source, the growth rates of CGΔptsF and CGΔptsFΔptsHΔptsI were 43.2% and 0 compared to the wild-type strain. It turned out that the fructose PTS system was controlled by combination of the ptsF, ptsH and ptsI genes encoding proteins associated with PTS. These engineered bacteria capable of blocking fructose metabolism can provide a genetic resource to construct mannitol or sorbitol-producing strains with fructose as the substrate and also lay the theoretical basis for the study of carbohydrate metabolism in Corynebacterium glutamicum.
Corynebacterium glutamicum; gene knockout; phosphoenolpyruvate carbohydrate phosphotransferase system (PTS)
10.7506/spkx1002-6630-201621027
Q789
A
1002-6630(2016)21-0157-07
许湄雪, 王北辰, 刘金雷, 等. 谷氨酸棒状杆菌果糖代谢阻断工程菌的构建[J]. 食品科学, 2016, 37(21): 157-163.
DOI:10.7506/spkx1002-6630-201621027. http://www.spkx.net.cn
XU Meixue, WANG Beichen, LIU Jinlei, et al. Construction of engineered strain of Corynebacterium glutamicum capable of blocking fructose metabolism[J]. Food Science, 2016, 37(21): 157-163. (in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201621027. http://www.spkx.net.cn
2015-11-26
国家高技术研究发展计划(863计划)项目(2014AA022102)
许湄雪(1989—),女,硕士研究生,研究方向为合成生物学与代谢工程。E-mail:646653447@qq.com
*通信作者:李天明(1986—),男,助理研究员,硕士,研究方向为合成生物学与代谢工程。E-mail:iamltm2000@hotmail.com
