二甲基二碳酸盐发酵前处理对茶枝柑果酒发酵特性的影响
2016-12-02邓莎莎吴继军刘忠义余元善徐玉娟
邓莎莎,吴继军,,刘忠义,余元善,徐玉娟
(1.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610;2.湘潭大学化工学院,湖南 湘潭 411105)
二甲基二碳酸盐发酵前处理对茶枝柑果酒发酵特性的影响
邓莎莎1,2,吴继军1,2,*,刘忠义2,余元善1,徐玉娟1
(1.广东省农业科学院蚕业与农产品加工研究所,农业部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610;2.湘潭大学化工学院,湖南 湘潭 411105)
为探究二甲基二碳酸盐(dimethyl dicarbonate,DMDC)非热杀菌技术对茶枝柑果酒发酵特性及果酒品质的影响,将新鲜茶枝柑果汁分别进行DMDC杀菌、巴氏杀菌和不杀菌处理,比较3 种不同的发酵前处理方法对发酵期间可溶性固形物含量、糖组分、乙醇含量、高级醇含量、pH值、总酸含量、有机酸含量、抗坏血酸含量、抗氧化活性等动态指标的影响以及发酵前后微生物菌群的差异。结果表明:相对于未杀菌直接发酵的茶枝柑发酵液,添加DMDC和巴氏杀菌均能有效杀灭污染的杂菌,提高糖的有效利用率和乙醇得率,抑制高级醇产生,其中空白对照组(不杀菌处理)、DMDC组、巴氏杀菌组的乙醇体积分数分别为13.10%、13.30%、13.73%。同时,与巴氏杀菌组相比,DMDC处理后的发酵液抗坏血酸质量浓度较高(211.40~221.70 mg/L),抗氧化活性保留较好(20.83~23.26 μmol TE/mL);但存在乳酸菌等耐受菌残留、乳酸升高的问题。综合而言,DMDC杀菌可以作为茶枝柑果酒发酵前处理的非热杀菌技术进行深入研究。
二甲基二碳酸盐;巴氏杀菌;茶枝柑果酒;发酵特性;非热杀菌
主产于广东新会的茶枝柑,已有700多年栽培历史,因其果皮有药用和食疗价值而闻名海内外。在传统茶枝柑产业中,种植茶枝柑的目的就是剥取果皮制作中药材——广陈皮。由于茶枝柑果肉味酸籽多,质量分数超过80%的果肉(含果籽)除少量鲜食外,大多抛弃到田间路边,不仅浪费了资源,而且污染了环境[1]。事实上,茶枝柑果肉有重要的开发利用价值。研究表明,茶枝柑果肉中富含糖类、有机酸、天然维生素、抗氧化活性物质等,具有很高的食用和药用价值[2]。因此利用茶枝柑果肉酿酒,不仅能够实现资源的综合利用,还能使茶枝柑中的有效药理成分和果酒自身的营养保健功能相结合,具有十分重要的现实意义和巨大的市场推广前景。
在茶枝柑果酒酿制前,剥皮、打浆、榨汁等处理步骤会使发酵液不可避免地受到一些杂菌的污染,这些杂菌的存在不仅会影响发酵的正常进行,而且会形成潜在的食品安全隐患。目前,大中型果酒生产企业发酵前杀菌处理以热杀菌为主,一些小型企业为降低生产成本多采用不杀菌直接发酵的方式[3]。热杀菌具有很好的杀菌效果,它能使腐败菌和致病菌快速失活而得到抑制,但由于果汁对热敏感,热杀菌处理后会导致特色果酒营养价值劣变、整体品质降低。而不杀菌直接发酵的方式使得发酵体系中污染菌增多,不仅难以保证发酵产品品质的一致性,而且存在食品安全问题。因此,大力开发应用一些方便、高效、安全的冷杀菌技术是发展茶枝柑果酒产业的重要课题。
二甲基二碳酸盐(dimethyl dicarbonate,DMDC)属于焦碳酸酯类,因其具有很强的反应活性,能与多种基团(如巯基、羟基、氨基和羧基)发生化学反应[4]。研究表明,其在常温甚至低温下对很多污染菌有较强的杀灭能力,且在水中很快分解为微量的甲醇和二氧化碳,不会影响人体健康和产品品质[5-7],故DMDC杀菌是一种很有潜力的非热杀菌技术。目前,许多国家已经批准DMDC作为微生物抑制剂应用在酒饮料、碳酸饮料、果汁饮料,甚至是100%全果汁中[4]。关于DMDC发酵前处理的研究多集中于荔枝[8-9]、桑果[10]、苹果[11]、葡萄[12]等低酸性水果果汁,而对茶枝柑等高酸性水果果汁发酵特性的研究还鲜见报道。
因此,本实验通过分析比较DMDC杀菌、巴氏杀菌、不杀菌处理后,发酵期间茶枝柑发酵液主要品质指标的变化,探讨DMDC用于茶枝柑果酒加工的可行性,以期为DMDC杀菌技术在茶枝柑果酒加工中的应用提供数据参考和理论依据。
1 材料与方法
1.1 材料与试剂
新鲜新会茶枝柑于当天在广东省江门市新会陈皮村合作社采摘;DMDC 美国Sigma公司;葡萄酒活性干酵母 安琪酵母股份有限公司;平板计数琼脂(plate count agar,PCA)、MRS琼脂、胰胨大豆琼脂斜面(tryptic soy agar,TSA)、孟加拉红琼脂 广东环凯微生物科技有限公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;SPX-250B-Z生化培养箱 上海佳胜实验设备有限公司;Infinite M200PRO型酶标仪 瑞士Tecan公司;PB-10型PH计 德国Sartorius公司;酸碱滴定仪 上海仪电科技股份有限公司;DMA35型密度计 奥地利Anton Paar有限公司;阿贝折光仪 英国Stanley公司;LC1200型高效液相色谱(high performance liquid chromatography,HPLC)仪(配有可变波长紫外检测器、蒸发光检测器和LabSolutions工作站) 日本岛津公司;6890N/5975B型气相色谱-质谱联用仪(配有G1701DA GC-MSD化学工作站) 美国安捷伦科技有限公司;Biofuge Stratos Sorvall型台式高速冷冻离心机美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 茶枝柑果汁的制备
将茶枝柑鲜果进行拣选、清洗、去皮、压榨汁,然后过100目滤布(除去瓤衣和果核),得到茶枝柑果汁,其出汁率为41.26%,pH值为3.54,总酸质量浓度为9.37 g/L,可溶性固形物含量为9.08°Brix。在茶枝柑果汁中添加蔗糖,使其可溶性固形物含量达到(23.00±0.26)。
1.3.2 茶枝柑果汁的发酵前处理
茶枝柑果汁的发酵分为3 种不同前处理方式。空白对照组:茶枝柑果汁直接接入活化的酿酒酵母,混合均匀;DMDC组:茶枝柑果汁经DMDC(终质量浓度为250 mg/L)杀菌处理3 h后,接入活化的酿酒酵母,混合均匀;巴氏杀菌组:茶枝柑果汁煮沸1 min,迅速冷却至室温,接入活化的酿酒酵母,混合均匀。其中,酵母菌接种量为当量干酵母粉0.2 g/L。
安琪葡萄酒专用酵母活化方法参考产品说明:干酵母粉用质量分数为10%灭菌蔗糖水在30 ℃活化30 min,其中酵母均活化质量浓度为20 g/L。
3组实验发酵液分别置于20 ℃发酵罐中进行发酵,每个实验组重复3次,每隔24 h取样测定其理化指标及发酵前后微生物菌体浓度。
1.3.3 发酵期间茶枝柑发酵液理化指标的测定
1.3.3.1 可溶性固形物含量和糖组分质量浓度测定
可溶性固形物含量:采用手持便携式折光仪在室温测定,具体操作参考GB 12143.1—1989《软饮料中可溶性固形物的测定方法 折光计法》。
糖组分测定:将茶枝柑发酵液与无水乙醇以体积比1∶1混合离心,上清液过0.22 μm滤膜用于后续的HPLC分析。色谱条件为:Shodex Asahipak NH2P-504E色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃;蒸发光检测器进行检测,ELSD漂移管温度40 ℃;流动相75%乙腈,流速1 mL/min,进样量10 μL,用外标法定量[9]。
1.3.3.2 pH值、总酸含量和有机酸含量测定
pH值测定:采用酸度计直接测定;总酸含量测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》,总酸度以酒石酸计。
有机酸含量测定:采用HPLC测定,将茶枝柑发酵液与蒸馏水以体积比1∶1混合离心,上清液过0.22 μm滤膜用于后续的HPLC分析,采用基于峰面积的外标法定量。色谱条件为:Agilent Zorbax Carbohydrate色谱柱(4.6 mm×150 mm,5 μm),柱温30 ℃;流动相0.1 mol/L磷酸二氢铵(pH 2.7),流速0.8 mL/min,进样量20 μL,紫外检测波长210 nm[9]。
1.3.3.3 酒精度和高级醇测定
参考GB/T 15038—2006方法,取50 mL茶枝柑发酵液置于500 mL圆底烧瓶中,添加50 mL蒸馏水,蒸馏出50 mL样品。
酒精度测定:采用密度计直接测定;高级醇测定:蒸馏样液经二氯甲烷按体积比1∶1萃取3次,合并有机相,旋蒸浓缩至1倍体积,用气相色谱-质谱和外标法分析测定其质量浓度。
气相色谱-质谱的色谱条件为:采用DB-5MS弹性毛细管柱(30 m×0.25 mm,0.25 μm),程序升温方式为初始温度45 ℃,保持5 min,以10 ℃/min的速率升至130 ℃并保持2 min;氦气流速为20 mL/min,分流比为10∶1;进样口温度为160 ℃,进样量为1 μL;气相色谱-质谱条件为电子轰击电离离子源(70 eV),离子源温度230 ℃,接口温度280 ℃,质量扫描范围m/z 10~450。
1.3.3.4 抗坏血酸质量浓度和抗氧化活性测定
抗坏血酸质量浓度测定:同有机酸测定,紫外检测波长为245 nm。
抗氧化活性测定:采用氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法测定,参考Prior[13]、续洁琨[14]等的方法,将80 μL 1.25 μmol/L现配的荧光素钠溶液(溶剂为75 mmol/L磷酸盐缓冲液,pH 7.4)和20 μL茶枝柑发酵液添加入酶标板中,37 ℃避光反应5 min。再加入100 μL 140 mmol/L现配的偶氮二异丁脒盐酸盐溶液(溶剂为75 mmol/L磷酸盐缓冲液,pH 7.4)。酶标仪测定条件:激发光波长485 nm,发射光波长520 nm,多点测定循环:循环35 次,每次150 s。以蒸馏水为空白对照。测定结果以μmol TE(Trolox equivalent)/mL表示。
1.3.4 发酵前后茶枝柑发酵液微生物量的测定
参考GB 4789.2—2010《食品微生物学检验 菌落总数测定》、GB 4789.15—2010《食品微生物学检验 霉菌和酵母计数》、GB 4789.35—2010《食品微生物学检验乳酸菌检验》,采用稀释倒平板法测定发酵结束后的菌落总数、酵母菌数以及乳酸菌数。菌落总数采用PCA琼脂,在37 ℃生化培养箱中培养2~3 d后计数;酵母菌采用孟加拉红琼脂,乳酸菌采用MRS琼脂,均在30 ℃生化培养箱中培养2~3 d后计数;结果以每毫升茶枝柑发酵液中菌落数的常用对数值表示。
1.4 统计分析
所有的不同处理均重复3次,数据结果采用统计软件SPSS 17.0进行方差分析,并用Microcal Origin 7.5软件制图。显著性水平取0.05,数值以±s表示。
2 结果与分析
2.1 发酵前后茶枝柑发酵液中微生物情况

表1 发酵前后茶枝柑发酵液中的微生物菌体浓度Table 1 Microbial biomass of Citrus reticulata cv. Chachiensis fruit juice before and after fermentation lg(CFU/mL)
由表1可知,在去皮、压榨汁等的过程中,茶枝柑果汁污染了大量微生物,主要为酵母菌、乳酸菌。发酵结束后不同发酵组的菌落总数有显著差异(P<0.05),其中DMDC组含菌量最高,巴氏杀菌组含菌量次之,空白对照组含菌量最低。进一步组内、组间对比分析发现,DMDC组和巴氏杀菌组的酵母菌含量没有显著差异(P>0.05),均高于空白对照组。组间乳酸菌含量存在显著差异,顺序依次为DMDC组>空白对照组>巴氏杀菌组。不难发现,巴氏杀菌组中酵母菌是优势菌,DMDC组中乳酸菌和酵母菌是优势菌,对照组中酵母菌、乳酸菌及其他杂菌的菌体浓度均介于7.00~8.00 (lg(CFU/mL)),其杂菌菌体浓度在3 个实验组中最高。这应该是由于3个实验组发酵前的处理方式不同所致。一些研究发现,DMDC对酵母菌的杀菌能力最强,而乳酸菌是DMDC的耐受菌[4,12],使得DMDC组残留的乳酸菌在发酵中进一步生长繁殖;巴氏杀菌能有效杀灭杂菌,使得接种的酵母菌有适宜的生长环境,繁殖成为优势菌;而空白对照组因为没有采取任何抑菌措施,使得发酵液污染的杂菌抑制了酵母菌的生长。
2.2 发酵期间茶枝柑发酵液中可溶性固形物含量和糖组分的变化

图1 茶枝柑果酒发酵期间可溶性固形物(a)、葡萄糖(b)、蔗糖(c)、果糖(d)含量的变化Fig. 1 Changes in total soluble solid (a), glucose (b), sucrose (c) and fructose (d) during fermentation of Citrus reticulata cv. Chachiensis fruit wine
由图1可知,随着发酵时间的延长,茶枝柑发酵液中的可溶性固形物、蔗糖、果糖、葡萄糖含量逐渐降低。在发酵前期,可溶性固形物及各糖组分下降较快,发酵后期下降趋于平缓。发酵期间3个实验组的可溶性固形物含量均呈下降趋势,测定DMDC组杀菌处理前后可溶性固形物含量没有变化,巴氏杀菌组热处理后可溶性固形物含量由23.26°Brix升至24.76°Brix,这主要是因为热处理使得水分挥发,固形物浓缩,淀粉、果胶以及蔗糖水解(巴氏杀菌后测定发酵液中蔗糖质量浓度由216.24 g/L下降至175.72 g/L,葡萄糖质量浓度由25.90 g/L上升至51.63 g/L、果糖质量浓度由26.88 g/L上升至48.38 g/L)等原因综合所致。
空白对照组的葡萄糖、蔗糖、果糖分别在发酵第3、6、8天不再显著下降(P>0.05);DMDC组的葡萄糖、蔗糖、果糖分别在发酵第4、6、8天不再显著下降(P>0.05);巴氏杀菌组的葡萄糖、蔗糖、果糖分别在发酵第4、7、9天不再显著下降(P>0.05)。这应该是由于3个实验组中含有的微生物菌落浓度不同所致,对照组因发酵前没有进行过任何灭菌处理,起始菌大量存在使得各糖组分更早的消耗完。巴氏杀菌组能有效杀菌污染菌,接种的酿酒酵母经过一段时间的生长繁殖达到一定数量,才开始高效进行糖消耗和转化。
2.3 发酵期间茶枝柑发酵液中pH值、总酸和有机酸含量的变化
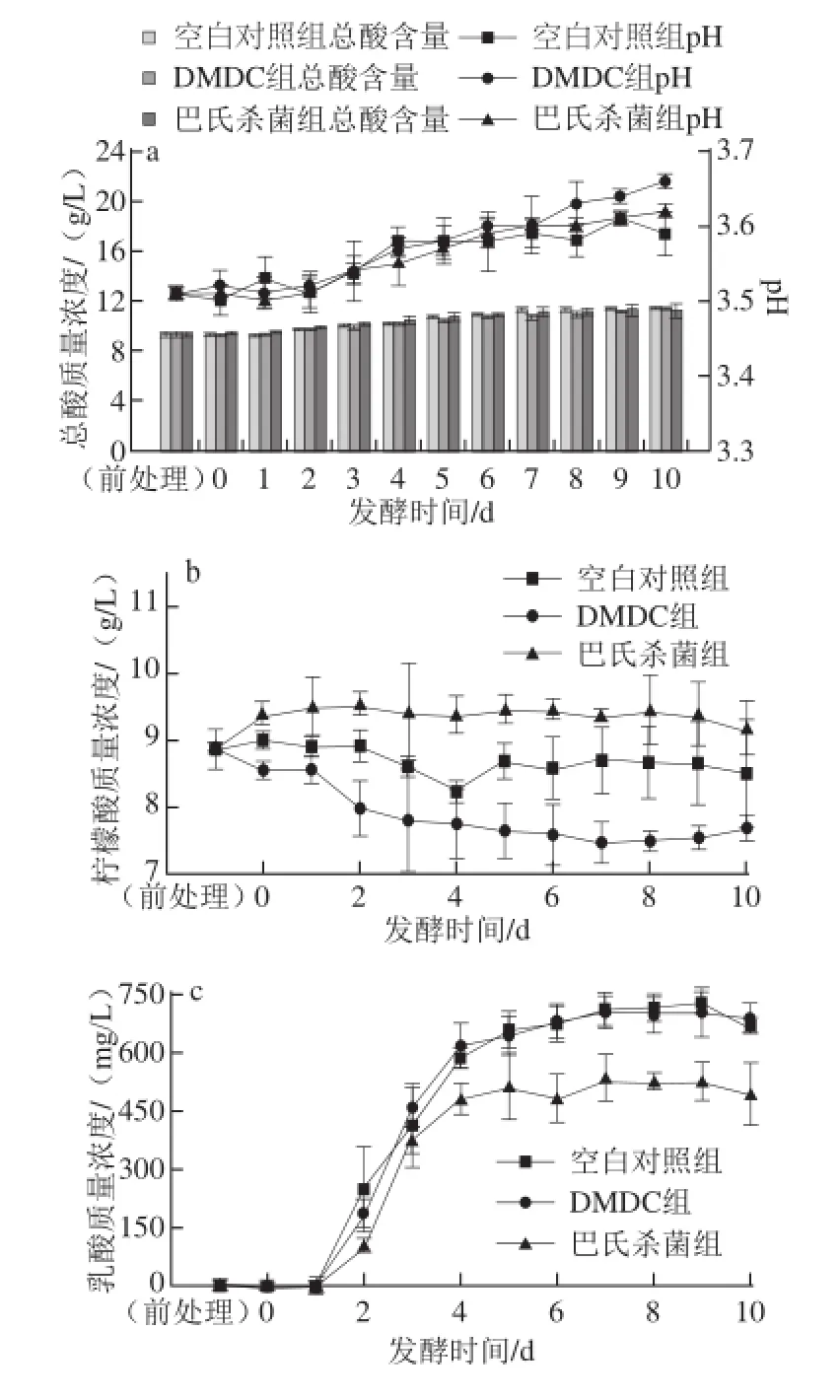
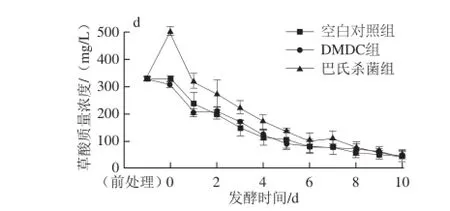
图2 茶枝柑果酒发酵期间pH值、总酸(a)、柠檬酸(b)、乳酸(c)、草酸(d)含量的变化Fig. 2 Changes in pH, total acid (a), citric acid (b), lactic acid (c) and oxalic acid (d) during fermentation of Citrus reticulata cv. Chachiensis fruit wine
由图2a可知,随着发酵时间的延长,发酵液中总酸质量浓度逐渐增加,pH值也逐渐升高,这可能是由于发酵过程中一些酸性较强的有机酸减少,而另一些酸性较弱的有机酸生成较多,最终导致总酸质量浓度增加,pH值相应升高。其中,DMDC组和空白对照组总酸质量浓度持续升高。与空白对照组相比,发酵后期DMDC组和巴氏杀菌组pH值升高较显著,且DMDC组高于巴氏杀菌组。
发酵液中柠檬酸、乳酸、草酸含量的变化情况见图2b~d。这3种有机酸的酸性强弱依次为柠檬酸>乳酸>草酸。HPLC分析表明,柠檬酸在茶枝柑果汁的有机酸中质量浓度最高(8.89 g/L),是茶枝柑的主体酸味成分,这与白卫东等[15]对新会柑果汁成分分析的研究结论相同。其中,空白对照组和DMDC组柠檬酸质量浓度都呈现出不同程度的下降,发酵结束分别维持在8.25~8.51、7.49~7.70 g/L之间。巴氏杀菌组柠檬酸质量浓度没有显著变化,这可能与热处理水分挥发,使得柠檬酸发酵起始质量浓度增加有关。3个实验组的乳酸质量浓度都呈现出不同程度升高,发酵4 d以后质量浓度不再显著增加,分别维持在658.70~726.90、621.80~704.90、477.30~531.70 mg/L之间,这应该是由于发酵液中原始乳酸菌菌体浓度不同造成的。3个实验组草酸质量浓度均呈下降趋势,至发酵第10天分别由原始的328.40、309.04、502.33 mg/L下降至同一水平(41.86~46.72 mg/L)。
2.4 发酵期间茶枝柑发酵液中酒精度和高级醇质量浓度的变化
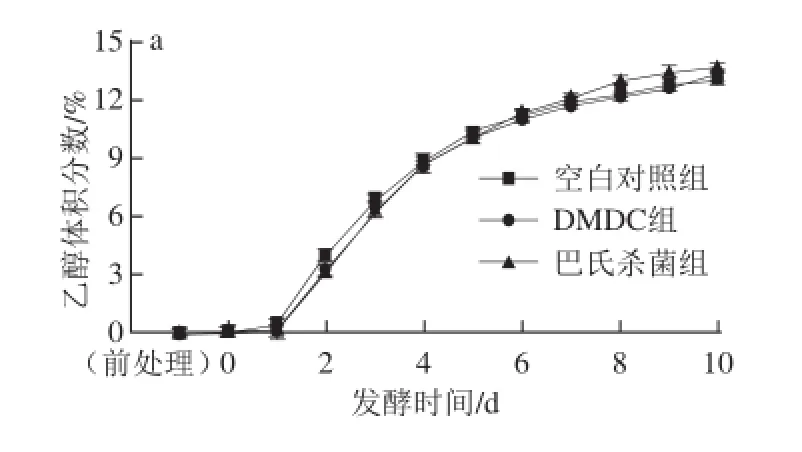
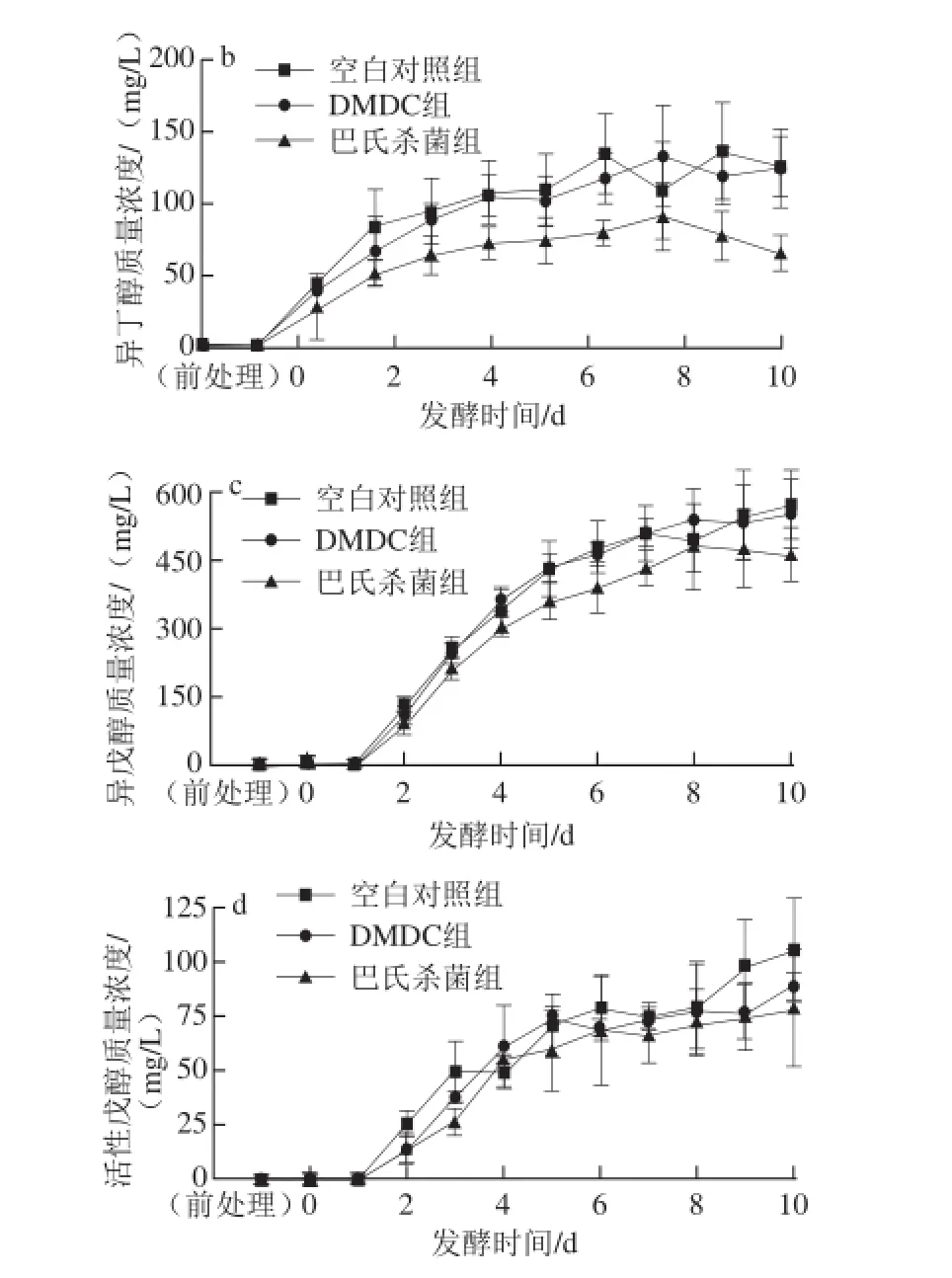
图3 茶枝柑果酒发酵期间酒精度(a)、异丁醇(b)、异戊醇(c)、活性戊醇(d)含量的变化Fig. 3 Changes in alcohol (a), isobutanol (b), isoamylol (c) and active-amyl alcohol (d) during fermentation of Citrus reticulata cv. Chachiensis fruit wine
由图3可知,发酵期间3 个实验组的乙醇体积分数均呈上升趋势。发酵结束时空白对照组、DMDC组、巴氏杀菌组的乙醇体积分数分别为13.10%、13.30%、13.73%,并且有显著性差异(P<0.05)。适量的高级醇能使酒体丰富,口味协调,给人以醇厚的感觉,但如果含量过高,由于高级醇的分子质量比较大,进入人体后,很难迅速被代谢,就会产生“上头”感觉。如果发酵液中缺乏酵母生长需要的营养物质,酵母生长就会受到抑制,产生过多的高级醇[16-17]。杨小兰[17]、朱静[18]等均就如何降低啤酒、果酒中的高级醇做了研究。由图3可知,3 个实验组的异丁醇质量浓度分别在发酵第4、5、3天不再显著上升(P>0.05),分别维持在95.59~137.04、103.14~133.36 、51.49~91.68 mg/L之间;3 个实验组的异戊醇质量浓度分别在发酵第6、7、6天不再显著上升(P>0.05),分别维持在476.48~569.53、509.67~557.83、386.64~482.36 mg/L之间;3 个实验组的活性戊醇质量浓度分别在发酵第6、7、8天不再显著上升(P>0.05),分别维持在74.50~105.63、72.77~88.82、54.55~77.43 mg/L之间。这表明,对于抑制高级醇的产生而言,巴氏杀菌组发酵液所含的营养物质和环境更适于酵母菌生长,DMDC组次之,对照组最差。
2.5 发酵期间茶枝柑发酵液中抗坏血酸质量浓度和抗氧化活性的变化

图4 茶枝柑果酒发酵期间抗坏血酸质量浓度和抗氧化活性的变化Fig. 4 Changes in ascorbic acid and antioxidant activity during fermentation of Citrus reticulata cv. Chachiensis fruit wine
由图4可知,随着发酵时间的延长抗坏血酸质量浓度呈缓慢上升趋势,3个实验组抗坏血酸质量浓度分别维持在217.30~238.00、211.40~221.70、202.40~221.40 mg/L之间。显而易见,发酵过程中DMDC组抗坏血酸平均质量浓度介于巴氏杀菌组与空白对照组之间,这是由于茶枝柑发酵液经热处理后,抗坏血酸热分解严重,使得发酵期间抗坏血酸质量浓度显著低于另外两实验组。Roig等[19]报道在橙汁等抗坏血酸含量高的果汁中抗坏血酸降解是引起褐变的主要因素。而空白对照组之所以有高的抗坏血酸质量浓度,可能是因为大量原始微生物新陈代谢消耗了茶枝柑发酵液中溶解的氧,从而抑制了抗坏血酸的有氧降解[20]。有报道称有氧降解速率是无氧降解速率的100~1 000 倍[21],也可能是因发酵起始菌中含有很多杂菌,其通过微生物发酵产生一定量的抗坏血酸,具体原因有待进一步研究证实。
ORAC是对样品的相对总抗氧化能力进行评价的一种最简单、准确的分析方法。由图4抗坏血酸质量浓度和抗氧化活性的变化趋势可知,抗坏血酸质量浓度和抗氧化活性存在一定的正相关性。但茶枝柑发酵液的抗氧化能力受多种生物活性成分影响,如黄酮、多酚、果胶等[22]。所以仅仅用抗坏血酸质量浓度变化不足以表征发酵液的抗氧化活性。对比3个实验组的抗氧化活性可知,随着发酵时间的延长,发酵液的抗氧化活性均呈下降趋势。发酵后期(5~10 d),3个实验组的抗氧化活性呈现出稳定差异性,DMDC组抗氧化活性最高,巴氏杀菌组次之,空白对照组最低,这应该是微生物代谢、氧气氧化、热处理损失等综合作用的结果。
3 讨论
目前利用茶枝柑果汁酿酒的前处理杀菌方式多为热处理,但因果汁中含有大量的热敏性营养及功能成分,例如,抗坏血酸质量浓度为217.21 mg/L,抗氧化活性为21.86 μmol TE/mL,以及多酚、果胶等。采用常规的热处理加工方式易使产品营养及功能成分损失严重,所以利用非热加工技术将是茶枝柑果汁加工的一个发展趋势。结合茶枝柑果汁低pH值(pH 3.54)的特殊性,以及DMDC最适杀菌pH值范围(pH 3.0~4.0)[4,7],探讨DMDC发酵前处理对茶枝柑果酒发酵特性的影响有非常必要的研究意义。
研究发现,未经杀菌的茶枝柑发酵液,因为发酵起始杂菌的大量存在,使得可溶性固形物和各种糖组分较快被消耗和转化。同时,伴随着发酵液中有机酸总量显著增加,pH值改变。由于酵母转化生成乙醇的底物有所减少以及环境条件的改变,使得空白对照组的乙醇生成量较少,而杂菌降解产生的氨基酸较多,导致高级醇含量较高。巴氏杀菌能有效杀灭茶枝柑发酵液污染的杂菌,使得发酵液中的糖分能充分被酵母利用,更多的转化生成乙醇,提高酒精度。同时也能避免高含量的高级醇和有机酸生成。但是,高温热处理使得发酵液中的抗坏血酸和抗氧化活性显著降低。
DMDC冷杀菌技术能在一定程度上杀灭污染的杂菌,相对于空白对照组,能使发酵液中的糖分更有效地转化为乙醇,高级醇产生量也相对较少。相对于热杀菌而言,使得发酵产品中的活性成分保留较好。但由于有一些DMDC耐受菌(乳酸菌)的存在,使得发酵过程中产生了一定量的有机酸(乳酸等)。所以,有必要进一步研究DMDC与其他非热杀菌技术协同杀菌的工艺。此外,关于DMDC发酵前处理对茶枝柑果酒发酵感官特性的研究也有待深入开展。综合而言,DMDC冷杀菌技术可以作为茶枝柑果酒发酵前处理的技术进行深入研究。
[1] 黄庆华. 新会陈皮原料茶枝柑的综合利用开发[C]//第三届中国·新会陈皮产业发展论坛. 江门: 新会柑(陈皮)行业协会, 2011.
[2] ZOU Zhuo, XI Wanpeng, HU Yan, et al. Antioxidant activity of citrus fruits[J]. Food Chemistry, 2016, 196: 885-896. DOI:10.1016/ j.foodchem.2015.09.072.
[3] 吕庆峰. 近现代中国葡萄酒产业发展研究[D]. 杨凌: 西北农林科技大学, 2013: 84-85.
[4] DAVIDSON P M, SOFOS J N, BRANEN A L. Antimicrobials in food[M]. 3rd ed. New York: Taylor & Francis Group, 2005: 305-326.
[5] RENOUF V, STREHAIANO P, LONVAUD-FUNEL A. Effectiveness of dimethlydicarbonate to prevent Brettanomyces bruxellensis growth in wine[J]. Food Control, 2008, 19(2): 208-216. DOI:10.1016/ j.foodcont.2007.03.012.
[6] 尹卓容. DMDC在葡萄酒及饮料中的应用[J]. 食品科学, 1992, 13(8): 26-28.
[7] 晏日安, 李莎. 新型防腐剂二碳酸二甲酯抗菌性能的研究[J]. 食品与机械, 2012, 28(5): 66-70. DOI:10.3969/ j.issn.1003-5788.2012.05.017.
[8] 王威利, 吴继军, 余元善, 等. 焦炭酸二甲酯对荔枝汁中大肠杆菌杀菌效果及动力学模型研究[J]. 中国食品学报, 2013, 13(10): 97-101.
[9] YU Yuanshan, XIAO Gengsheng, XU Yujuan, et al. Effects of dimethyl dicarbonate (DMDC) on the fermentation of litchi juice by Lactobacillus casei as an alternative of heat treatment[J]. Journal of Food Science, 2014, 79(5): 947-954. DOI:10.1111/1750-3841.12428.
[10] 程银棋, 余元善, 吴继军, 等. DMDC处理对桑果汁品质的影响[J]. 热带作物学报, 2014, 35(7): 1439-1443. DOI:10.3969/ j.issn.1000-2561.2014.07.032.
[11] BASARAN-AKGUL N, CHUREY J J, BASARAN P, et al. Inactivation of different strains of Escherichia coli O157:H7 in various apple ciders treated with dimethyl dicarbonate (DMDC) and sulfur dioxide (SO2) as an alternative method[J]. Food Microbiology, 2009, 26(1): 8-15. DOI:10.1016/j.fm.2008.07.011.
[12] COSTA A, BARATA A, MALFEITO-FERREIRA M, et al. Evaluation of the inhibitory effect of dimethyl dicarbonate (DMDC) against wine microorganisms[J]. Food Microbiology, 2008, 25(2): 422-427. DOI:10.1016/j.fm.2007.10.003.
[13] PRIOR R L. Oxygen radical absorbance capacity (ORAC): new horizons in relating dietary antioxidants/bioactives and health benefits[J]. Journal of Funcrional Foods, 2015, 18: 797-810. DOI:10.1016/j.jff.2014.12.018.
[14] 续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J].中国药理学通报, 2006, 22(8): 1015-1021.
[15] 白卫东, 钱敏, 蔡培钿, 等. 新会柑果汁成分的分析[J]. 农产品加工, 2008(11): 23-26.
[16] WILHELM C J, HASHIMOTO J G, ROBERTS M L. Females uniquely vulnerable to alcohol-induced neurotoxicity show altered glucocorticoid signaling[J]. Brain Resaerch, 2015, 1601: 102-116. DOI:10.1016/j.brainres.2015.01.002.
[17] 杨小兰, 罗正明, 胡仕屏, 等. 降低高浓啤酒发酵中高级醇含量的研究[J]. 食品科学, 2011, 32(9): 188-192.
[18] 朱静, 师俊玲. 苹果渣对高级醇的降解作用[J]. 食品科学, 2011, 32(增刊1): 97-101.
[19] ROIG M G, BELLO J F, RIVERA Z S, et al. Studies on the occurrence of non-enzymatic browning during storage of citrus juice[J]. Food Research International, 1999, 32: 609-619. DOI:10.1016/S0963-9969(99)00128-3.
[20] LEONG Y S, OEY I. Effect of endogenous ascorbic acid oxidase activity and stability on vitamin C in carrots (Daucus carota subsp. sativus) during thermal treatment[J]. Food Chemistry, 2012, 134: 2075-2085. DOI:10.1016/j.foodchem.2012.04.002.
[21] KABASAKALIS V, SIOPIDOU D, MOSHATOU E. Ascorbic acid content of commercial fruit juices and its rate of loss upon storage[J]. Food Chemistry, 2000, 70(3): 325-328. DOI:10.1016/S0308-8146(00)00093-5.
[22] PÉREZ-GREGORIO M R, REGUEIRO J, ALONSO-GONZÁLEZ E, et al. Influence of alcoholic fermentation process on antioxidant activity and phenolic levels from mulberries (Morus nigra L.)[J]. LWTFood Science and Technology, 2011, 44(8): 1793-1801. DOI:10.1016/ j.lwt.2011.03.007.
Effect of Dimethyl Dicarbonate Pretreatment on Fermentation Characteristics of Citrus reticulata cv. Chachiensis Fruit Wine
DENG Shasha1,2, WU Jijun1,2,*, LIU Zhongyi2, YU Yuanshan1, XU Yujuan1
(1. Key Laboratory of Functional Foods, Ministry of Agriculture, Guangdong Key Laboratory of Agricultural Products Processing, Sericultural & Agri-Food Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510610, China; 2. College of Chemical Engineering, Xiangtan University, Xiangtan 411105, China)
The paper aimed to explore the effect of dimethyl dicarbonate (DMDC) pretreatment as a non-thermal sterilization technology on the fermentation characteristics and quality of Citrus reticulata cv. Chachiensis fruit wine. The effects of DMDC sterilization and pasteurization on the changes in quality indicators such as total soluble solid, ethanol, higher alcohol, total acid, organic acid and ascorbic acid contents, sugar composition, pH and antioxidant activity during the fermentation process and the differences in the microbial community before and after fermentation were compared with those of the non-sterilized control. Results showed that both DMDC addition and pasteurization could improve the effective utilization of sugar and the yield of ethanol and restrain the synthesis of fusel by killing unwanted bacteria when compared with the control. The ethanol contents of the control, DMDC treatment, and pasteurization treatment were 13.10%, 13.30%, and 13.73%, respectively. Importantly, when compared with pasteurization, DMDC treatment gave higher ascorbic acid concentration (211.40-221.70 mg/L) and antioxidant activity (20.83-23.26 μmol TE/mL) in fermented Citrus reticulata cv. Chachiensis fruit juice. However, DMDC treatment showed higher residues of resistant bacteria such as Lactobacillus and an increment of lactic acid. To sum up, DMDC sterilization is worthy of further investigation for application as a non-thermal sterilization technology in sample pretreatment for the fermentation of Citrus reticulata cv. Chachiensis fruit wine.
dimethyl dicarbonate; pasteurization; Citrus reticulata cv. Chachiensis fruit wine; fermentation characteristics; non-thermal sterilization
10.7506/spkx1002-6630-201621002
S571.9
A
1002-6630(2016)21-0007-07
引文格式:
邓莎莎, 吴继军, 刘忠义, 等. 二甲基二碳酸盐发酵前处理对茶枝柑果酒发酵特性的影响[J]. 食品科学, 2016, 37(21): 7-13. DOI:10.7506/spkx1002-6630-201621002. http://www.spkx.net.cn
DENG Shasha, WU Jijun, LIU Zhongyi, et al. Effect of dimethyl dicarbonate pretreatment on fermentation characteristics of Citrus reticulata cv. Chachiensis fruit wine[J]. Food Science, 2016, 37(21): 7-13. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201621002. http://www.spkx.net.cn
2016-01-07
国家自然科学基金青年科学基金项目(31401531);广东省自然科学基金项目(2015A030312001);广东省科技计划项目(2015B020204001)
邓莎莎(1988—),女,硕士研究生,研究方向为食品营养与食品加工。E-mail:565271175@qq.com
*通信作者:吴继军(1976—),男,研究员,硕士,研究方向为果蔬深加工。E-mail:wujijun@126.com
