超声皂化法提取β-隐黄素
2016-12-02黄巧娟盛冉孙志高郝静梅
黄巧娟,盛冉,孙志高,郝静梅
(西南大学 柑桔研究所,重庆 400712)
超声皂化法提取β-隐黄素
黄巧娟,盛冉,孙志高*,郝静梅
(西南大学 柑桔研究所,重庆 400712)
以砂糖橘皮粉为原料,采用超声皂化法提取精制β-隐黄素。对比考察了水浴皂化与超声皂化对β-隐黄素得率的影响;考察超声皂化温度、皂化时间、KOH浓度、KOH-乙醇添加量、正己烷添加量等因素对超声皂化反应的影响,对超声皂化反应进行单因素及正交试验, 确定超声皂化的最适工艺条件。结果表明:超声皂化与水浴皂化相比能缩短皂化时间,提高β-隐黄素得率;超声皂化最佳工艺条件为,超声时间1 h、超声温度30 ℃、KOH浓度为1.5 mol/L,正己烷添加量为4 mL,β-隐黄素得率为0.238 4‰。
水浴皂化;超声皂化;β-隐黄素得率;工艺优化
β-隐黄素又称β-隐黄质,3-羟基-β-胡萝卜素,是人体血液中存在的六大类胡萝卜素之一,主要存在于水果、蔬菜中,其分子式为C40H56O,分子质量为552.88,分子结构如图1所示[1]。近年来大量流行病学的调查与研究表明,β-隐黄素具有抗氧化、抗癌、缓解骨质疏松、预防心血管疾病等多种生理功能[1-2]。β-隐黄素作为功能性成分,越来越受到研究者的重视。近期的研究表明,β-隐黄素可能成为比β-胡萝卜素更好的VA前体物质[3]。

图1 β-隐黄素的分子结构Fig.1 The molecular structure of β-cryptoxanthin
β-隐黄素酯的形式存在于水果及蔬菜中,如β-隐黄素月桂酸酯、肉豆蔻酸酯、棕榈酸酯、油酸酯等[4-5]。通过皂化反应将β-隐黄素酯转化为游离的β-隐黄素,是分离纯化β-隐黄素,提高最终产品中β-隐黄素含量的重要手段。皂化通常有冷皂化及热皂化两种,热皂化速度快,但对活性物质损失较大;冷皂化耗时较长,皂化时间越长对生物活性物质影响越大[6]。超声波提取具有提取时间短、提取率高等优点,其作为一种辅助手段已运用于叶黄素酯、番茄红素酯等物质的皂化[7-8]。本试验以砂糖橘皮粉为原料,通过乙醇提取获得总酯萃取物,运用皂化法制备β-隐黄素单体,通过皂化破坏总酯萃取物中的脂肪、叶绿素等物质,使β-隐黄素单体从β-隐黄素酯中游离出来,从而达到提取精制β-隐黄素的目的。本文对比分析了水浴皂化及超声皂化对β-隐黄素得率的影响,并对超声皂化工艺条件进行研究,以获得最优的皂化工艺条件,减少皂化过程中β-隐黄素的降解损失。
1 材料与方法
1.1 材料与试剂
干燥的砂糖橘皮粉、正己烷(AR)、KOH(AR)、无水乙醇(AR)、丙酮(AR)、β-隐黄素标准品(Sigma公司)、乙腈(HPLC)、乙酸乙酯(HPLC)、NaCl(AR)。
1.2 仪器与设备
BT224S电子分析天平,赛多利斯科学仪器有限公司;H-1850R高速冷冻离心机,长沙湘仪离心机有限公司),KQ5200E型超声波仪器,昆山市超声波仪器有限公司;UltiMate3000高效液相色谱仪,戴安中国有限公司;双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;恒温水浴锅,上海双舜实业发展有限公司;TTL-DCI型氮吹仪,北京同泰联科技发展有限公司;6202型高速粉碎机,北京燕山正德机械设备有限公司;旋转蒸发仪,瑞士BUCHI公司;真空泵,南京真空泵厂。
1.3 实验方法
1.3.1 β-隐黄素标品的制备
参考蒋国玲的方法[9],并稍作修改。将1 mg β-隐黄素标准品用丙酮溶解并定容至10 mL,分别取100、200、300、400、500、600、900 μL于10 mL容量瓶中,用丙酮定容至10 mL,摇匀。以丙酮做参比,在451 nm处测定吸光度A。对吸光值做线性回归方程,得到吸光度(A)-浓度(C)的标准曲线。
1.3.2 高效液相色谱条件[10]
PDA检测器、C18柱、流动相:A为乙酸乙酯,B为体积分数90%的乙腈,A∶B体积比为 40∶60、检测波长:451 nm、柱温:30℃、流速:1 mL/min、进样量:20 μL。
1.3.3 β-隐黄素得率的计算[11]
(1)
式中:C为β-隐黄素的浓度;V为β-隐黄素样品总体积;m为砂糖橘皮粉样品干重。
1.3.4 超声皂化法与水浴皂化法的对比
称取400g经40 ℃干燥的砂糖橘皮粉,用1 200mL无水乙醇在40 ℃条件下水浴浸提4h,重复提取两次。将提取液真空浓缩至不再有溶剂旋出,得总酯萃取物50mL。取5mL总酯萃取物于50mL烧杯中,分别加入5mL正己烷、KOH-乙醇溶液(2mol/L),密封。分别于0.08、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、5.0、5.5h取1mL样品于分液漏斗中,加入2mL正己烷萃取2次,收集上相。用4mL0.5%的NaCl水溶液水洗3次,收集有机层,在451nm波长下进行含量测定。
1.3.5 单因素试验
通过单因素试验对β-隐黄素皂化反应中影响β-隐黄素得率的各因素进行分析,确定最佳工艺参数。
1.3.5.1 皂化时间
取6份1mL的总酯萃取物,分别置于25mL的具塞试管中,并分别加入正己烷1mL及2mol/L的KOH-乙醇溶液1mL后震荡摇匀。设置超声波温度为40 ℃,研究皂化时间分别为0.5、1.0、1.5、2.0、2.5、3.0h时对β-隐黄素得率的影响。
1.3.5.2 皂化温度
取5份1mL的总酯萃取物,分别置于25mL的具塞试管中,并分别加入正己烷1mL及2mol/L的KOH-乙醇溶液1mL后震荡摇匀。皂化时间为1.0h,研究皂化温度分别为30、40、50、60、70 ℃时β-隐黄素的得率。
1.3.5.3KOH浓度的影响
取8份1mL的总酯萃取物,分别置于25mL的具塞试管中,并分别加入正己烷1mL及不同浓度的KOH-乙醇溶液1mL于试管中后,震荡摇匀。固定超声温度为40 ℃、皂化时间为1.0h,研究KOH浓度分别为0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、5.0mol/L时对β-隐黄素得率的影响。
1.3.5.4KOH-乙醇溶液添加量的影响
取8份1mL的总酯萃取物,分别置于25mL的具塞试管中,并分别加入正己烷1mL于试管中,固定超声温度为40 ℃、皂化时间为1.0h,KOH浓度为1.5mol/L,研究KOH-乙醇溶液的添加量分别为0.5、1、2、4、6、8、10mL时对β-隐黄素得率的影响。
1.3.5.5 正己烷添加量的影响
取7份1mL的总酯萃取物,分别置于25mL的具塞试管中,并分别加入1.5mol/L的KOH-乙醇溶液6mL。固定超声温度为40 ℃,超声时间为1.0h,研究正己烷添加量分别为0、1、2、3、4、5、6mL时对β-隐黄素得率的影响。
1.3.6 正交试验优化超声皂化β-隐黄素工艺参数
通过单因素试验,选择超声时间、超声温度、KOH浓度、正己烷添加量4个因素作为优化的单因素,以β-隐黄素得率为评价指标,进行4因素3水平正交试验设计,优化β-隐黄素的皂化工艺。用SPSS17.0软件对实验数据进行回归分析,确定最佳工艺参数。

表1 正交试验因素与水平
2 结果与分析
2.1 标准曲线的制作
实验得到的β-隐黄素标准曲线(图2)回归方程为A=0.104 17C-0.006 03,其中R2=0.998 5由此可知β-隐黄素在1~9 μg/mL内有良好的线性关系,可做为β-隐黄素含量测定的标准曲线。

图2 β-隐黄素标准曲线Fig.2 Standard curve of β-cryptoxanthin
2.2 皂化前后样品的HPLC图
图3为β-隐黄素标准品的高效液相色谱图,出峰时间为13.6 min左右。图4为β-隐黄素样品在皂化前后的HPLC图,从图4中可以看出,皂化前的样品,13.6 min峰面积较小,主要物质出峰时间为14 min之后。这可能是因为未皂化的β-隐黄素主要以β-隐黄素酯的形式存在,而β-隐黄素酯的出峰时间为14 min之后,这一结果与Dietmar等的研究一致[12]。图5为皂化后的β-隐黄素酯,从图中可以看出,β-隐黄素出峰时间为13.61 min,且在15 min之后几乎没有出现峰,说明皂化反应能有效的将β-隐黄素从其酯形式中释放出来。

图3 β-隐黄素标准品高效液相色谱图Fig.3 HPLC chromatogram of β- cryptoxanthin standard
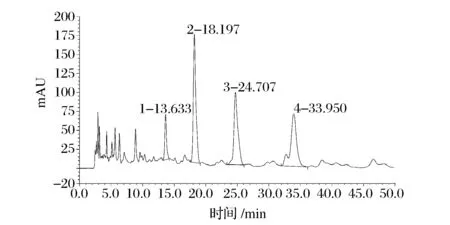
图4 样品皂化前的HPLC图Fig.4 HPLC diagram of the sample before saponification

图5 样品皂化后的HPLC图Fig.5 HPLC diagram of the sample after saponification
2.3 超声皂化法与水浴皂化法的对比
由图6可知,超声皂化反应相比水浴皂化反应,所需时间更短,且皂化效果更好。超声皂化反应随着皂化时间的延长,β-隐黄素得率增加迅速,在皂化时间为1.0 h时,皂化反应达到最大值,此时得率0.014 9%。水浴皂化整体得率相比超声皂化较低,在皂化3.5 h后β-隐黄素得率达到最大值,为0.013 1%。因此,从试验结果可以看出,超声皂化相比水浴皂化能节约更多的时间,且皂化效果更好。在皂化一段时间后,2种皂化方式都使β-隐黄素得率有细微降低,这可能与β-隐黄素不稳定,易降解有关。
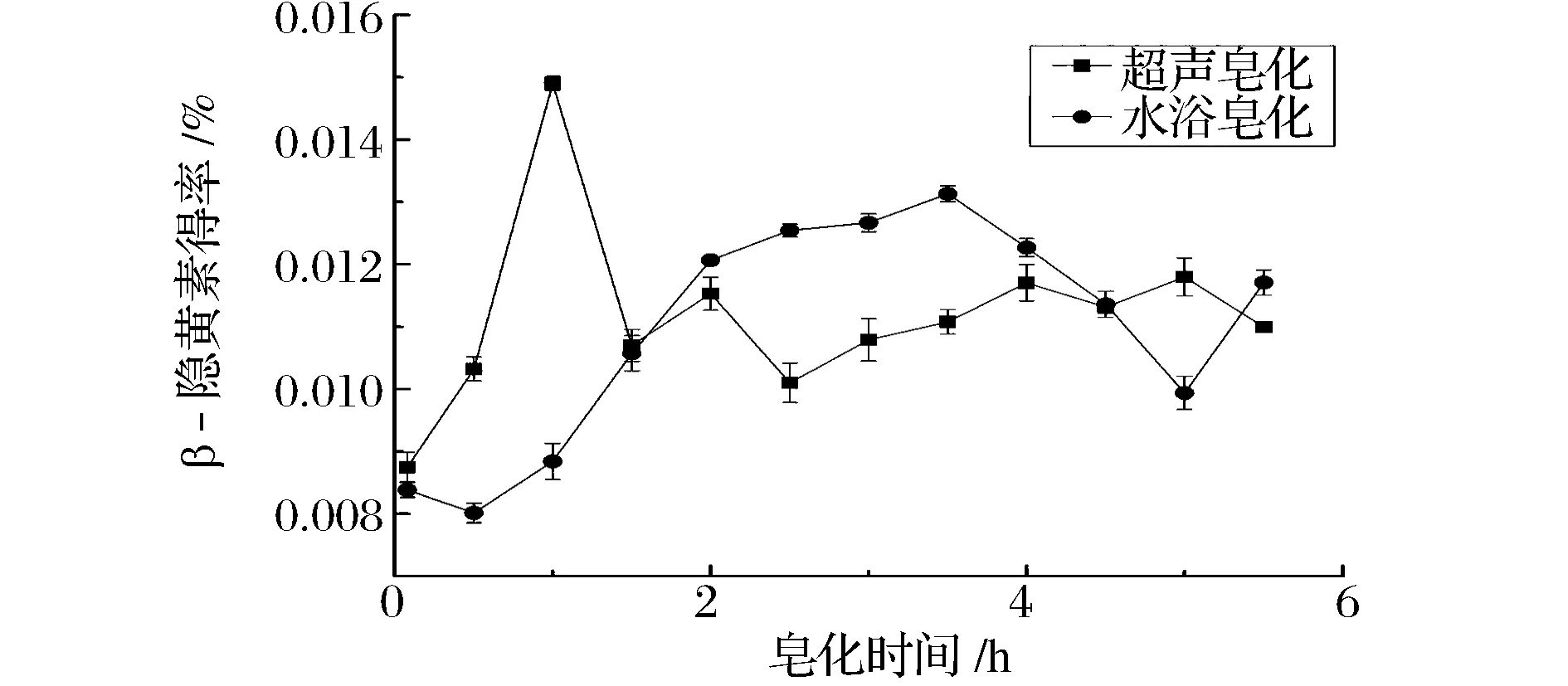
图6 不同皂化方式对β-隐黄素得率的影响Fig.6 Effect of different methods on the yield of β-cryptoxanthin
2.4 单因素试验结果
2.4.1 超声时间单因素
由图7可知,当超声时间为0.5 h后,β-隐黄素得率迅速上升,当超声时间为1.0 h时,β-隐黄素得率达到最大,在超声时间继续延长时,β-隐黄素得率有所下降。故选择超声时间为1 h较为适宜。

图7 超声时间对β-隐黄素得率的影响Fig.7 Effect of ultrasonic time on the yield of β-cryptoxanthin
2.4.2 KOH浓度的选择
由图8可以看出,KOH浓度对β-隐黄素得率有一定的影响。当KOH浓度低于2 mol/L时,对β-隐黄素得率影响较大。随着KOH浓度的升高,β-隐黄素得率提高,当KOH浓度达到1.5 mol/L时,β-隐黄素得率最大,达到0.017 6%,故选择KOH浓度为1.5 mol/L较为适宜。

图8 KOH浓度对β-隐黄素得率的影响Fig.8 Effect of the concentration of KOH on the yield of β-cryptoxanthin
2.4.3 超声温度的选择
如图9所示,随着超声温度的升高,β-隐黄素得率有缓慢升高的过程,当温度升高到40 ℃后,β-隐黄素得率达到最大值。但当温度继续升高时,β-隐黄素的得率下降显著,这主要与高温会破坏β-隐黄素的结构有关。故选择最适超声温度为40 ℃。
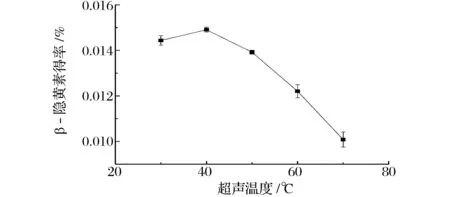
图9 超声温度对β-隐黄素得率的影响Fig.9 Effect of ultrasonic temperature on the yield of β-cryptoxanthin
2.4.4 KOH-乙醇溶液添加量的影响
由图10可知,当KOH-乙醇溶液的体积6 mL时,β-隐黄素得率最高。当KOH-乙醇体积继续升高时,β-隐黄素得率有所下降,这可能与皂化时加入的正己烷有关。不同比例的正己烷-乙醇-水形成不同的分配体系,影响β-隐黄素在萃取上相及下相的分布[8,13]。因此,加入不同体积的KOH-乙醇溶液β-隐黄素得率略有差异。
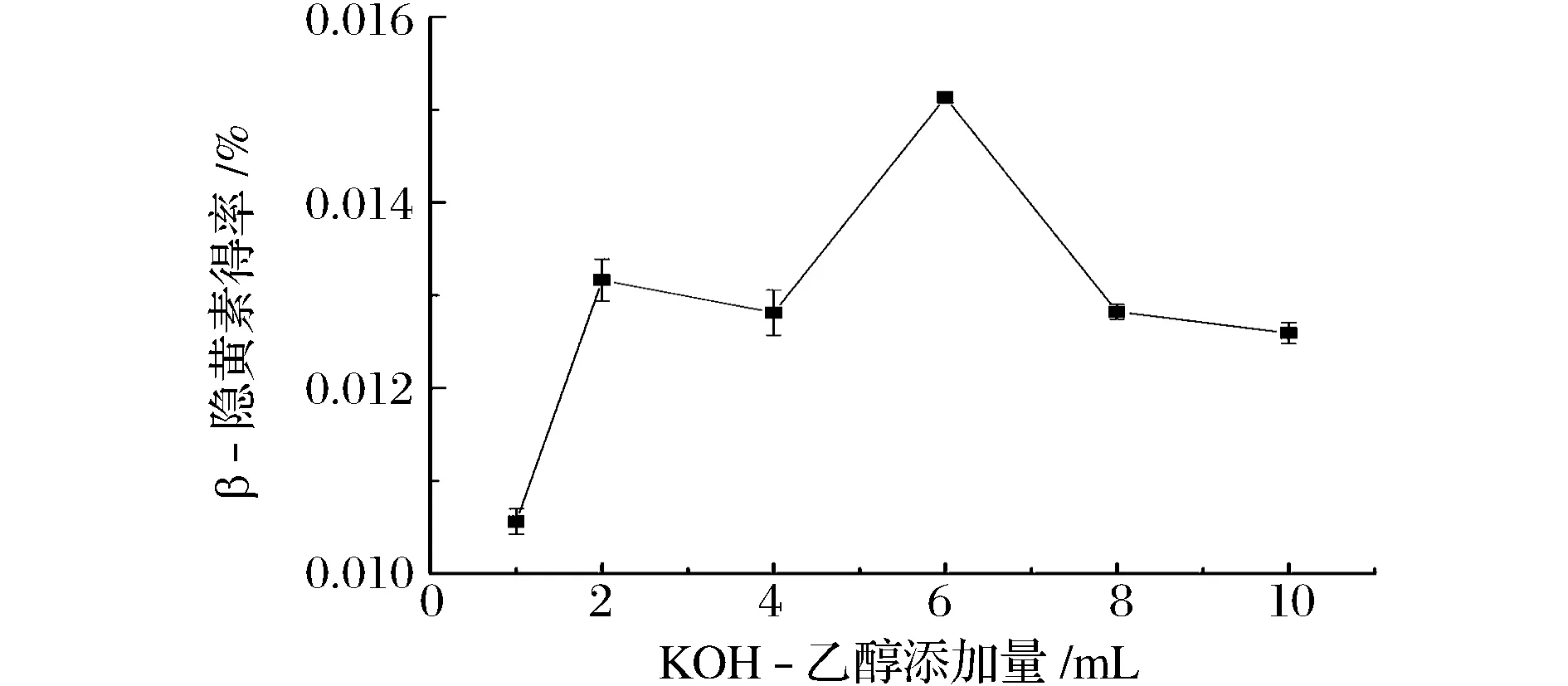
图10 KOH-乙醇添加量对β-隐黄素得率的影响Fig.10 Effect of KOH- ethanol addition on the yield of β-cryptoxanthin
2.4.5 正己烷添加量的影响
从图11可以看出,正己烷的添加量对β-隐黄素的得率有较大影响。皂化时随着正己烷添加量的增加其β-隐黄素得率也逐渐增高。当正己烷添加量为3 mL时,β-隐黄素得率达到最大值,为0.018 12%;但若继续增加正己烷的量则β-隐黄素的得率反而有所下降。造成此现象的原因主要有两个,正己烷-乙醇-水形成液液萃取体系,改变了β-隐黄素在乙醇相及正己烷相的分布;正己烷的添加使得体系中KOH的浓度发生改变,从而造成皂化效果不一致。本实验选用正己烷适宜添加量为3 mL。
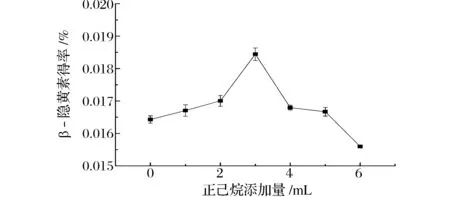
图11 正己烷添加量对β-隐黄素得率的影响Fig.11 Effect of the amount of n-hexane on the yield of β-cryptoxanthin
2.5 正交试验优化超声皂化工艺的结果
由超声皂化工艺优化正交试验极差分析结果(表2)可知,对β-隐黄素得率的影响大小依次为:KOH浓度>超声时间>正己烷添加量>超声温度,优化的最佳超声皂化参数为A2B1C2D3,即在超声时间为1 h、超声温度为30 ℃、KOH浓度为1.5 mol/L、正己烷添加量为4 mL时β-隐黄素得率最高,为0.023 84%。由表3方差分析可知,对β-隐黄素得率的影响大小为超声时间、KOH浓度、正己烷添加量对β-隐黄素得率影响极显著,达到极显著水平,而超声温度对β-隐黄素得率有显著影响。
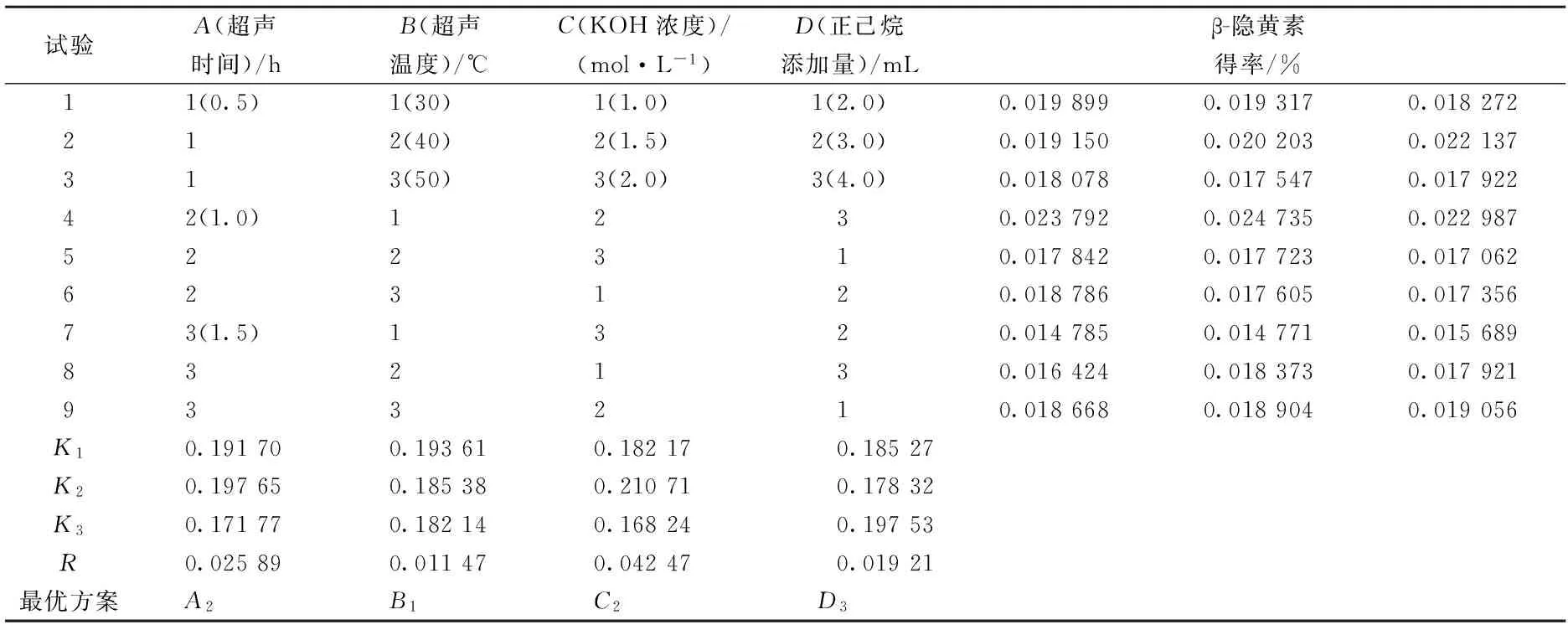
表2 正交试验结果
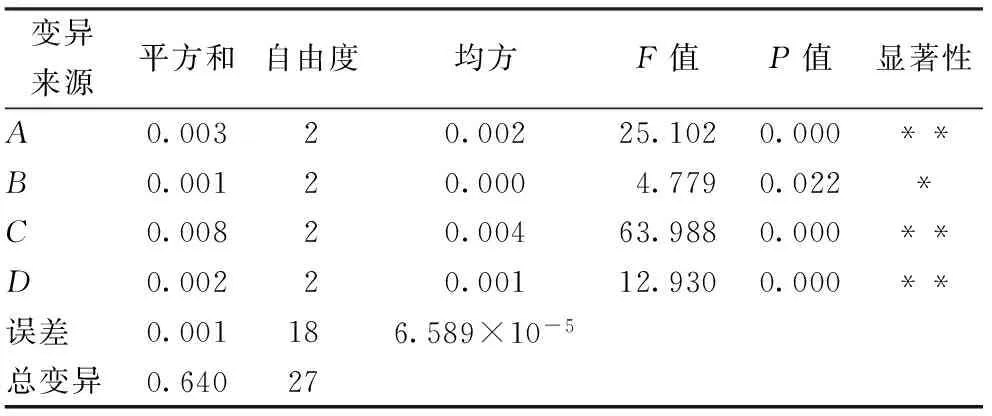
表3 正交实验方差分析表
注:*为显著,P<0.05;**为极显著,P<0.01。
3 结论及讨论
本试验对比分析了超声皂化与水浴皂化在不同时间的皂化效果,以β-隐黄素得率为评价指标。结果发现超声皂化比水浴皂化能获得更高的β-隐黄素得率,且能节约皂化时间,因此超声皂化比普通水浴皂化具有更好的皂化效果,这与赵伟研究的叶黄素超声皂化与水浴皂化结果相似[7]。研究了不同因素对β-隐黄素得率的影响,并选取超声时间、超声温度、KOH浓度、正己烷添加量等因素进行工艺优化,得出对β-隐黄素得率的影响大小为:KOH浓度>超声时间>正己烷添加量>超声温度,优化的工艺条件为:超声时间1 h、超声温度30 ℃、KOH浓度为1.5 mol/L,正己烷添加量为4 mL,β-隐黄素得率为0.023 84%,这一结果与王洪洋[14]、蒋国玲[11]等的报道基本吻合,但由于选取材料不同,材料中β-隐黄素含量有所差异,使得最终β-隐黄素得率有细微差异。经过皂化后β-隐黄素的含量得到很大提高,但需得到β-隐黄素纯品,还需进一步进行纯化,如进行过柱层析、结晶精制、制备液相分离等[15-17]。
超声波作为一种辅助提取手段,常用于辅助有机溶剂浸提生物活性物质,而将其用于皂化反应的尝试较少。本试验结果显示,将超声波用于皂化反应,能加速皂化反应的进行,提高目标物质得率,对生物活性物质的提取纯化具有重要意义。大多生物活性物质具有不稳定、易分解等特点,若能将超声波辅助法运用于生物活性物质的提取与纯化过程,将大大缩短其提取纯化时间,更有利于保护生物活性物质的原有性质。
[1] YANO M,IKOMA Y,SUGIURA M.Recent progress in β-cryptoxanthin research[J]. Bulletin of the National Institute of Fruit Tree Science, 2005(4):13-28.
[2] 李涛,张慧,张志忠,等.β-隐黄质的特性及其应用[J].中国食品添加剂,2011(4):156-158.
[3] BURRI B J.Beta-cryptoxanthin as a source of vitamin A.[J].Journal of the Science of Food & Agriculture, 2015,95(9):1 786-1 794.
[4] MAIANI G, CASTN M J, CATASTA G, et al. Carotenoids: Actual knowledge on food sources, intakes, stability and bioavailability and their protective role in humans[J]. Molecular Nutrition & Food Research, 2009, 53(Supplement 2):S194-S218.
[5] KAN K,OOKURA T, MORIMOTO S, et al. Investigation of β-cryptoxanthin fatty acid ester compositions in citrus fruits cultivated in Japan[J]. Food & Nutrition Sciences, 2013, 4(9):98-104.
[6] 李高峰.万寿菊花中叶黄素的提取技术及分析方法研究[D].太原:中国日用化学工业研究院, 2009: 58-65.
[7] 赵伟.叶黄素的超声皂化制备工艺及高速逆流色谱纯化的研究[D].长春:吉林大学,2014:8-14.
[8] 张程,陈芳,赵广华,等.超声波辅助皂化法精制番茄红素油树脂的研究[J].中国农业科技导报,2009,11(3):121-125.
[9] 蒋国玲.温州蜜柑皮β-隐黄素的提取、纯化及稳定性研究[D].重庆:西南大学,2012:12-14.
[10] 惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:117-138.
[11] 蒋国玲,孙志高,贺金梅,等.溶剂和超声波辅助提取温州蜜柑皮β-隐黄素的条件优化[J].食品工业科技,2012,33(13):294-297.
[12] BREITHAUPT D E,BAMEDI A ,Carotenoid esters in vegetables and fruits:a screening with emphasis on beta-cryptoxanthin esters[J]. Journal of Agricultural & Food Chemistry,2001, 49(4):2 686-2 686.
[13] 李高阳,丁霄霖.正己烷-乙醇-水三元体系的相平衡研究[J].食品科学,2008,29(8):91-94.
[14] 王洪洋,谢春阳.超声波辅助提取南瓜瓤中隐黄素的响应面工艺优化[J].食品工业科技,2013,34(17):274-277.
[15] 井凤,王丽,徐双双,等.辣椒中β-隐黄质的分离制备[J].食品科学,2013,34(6):10-13.
[16] 杜桂彩,郭群群,滕大为,等.高纯度叶黄素的制备及稳定性研究[J].精细化工,2004(21):447-449.
[17] 王锋.番茄红素的提取与纯化工艺研究[D].济南:山东师范大学,2007:50-64.
Study on ultrasonic saponification to extract β-cryptoxanthin
HUANG Qiao-juan,SHENG Ran,SUN Zhi-gao*,HAO Jing-mei
(Citrus Research Institute, Southwest University, Chongqing 400712, China)
Ultrasonic saponification was used to extract β-cryptoxanthin from powder of orange peel. Water bath and ultrasonic saponification was compared based on the yield of β-cryptoxanthin. The effects of saponification temperature, saponification time, KOH concentration, KOH-ethanol and n-hexane content on the amount of ultrasound saponification reaction were studied. The optimal conditions for the saponification of β-cryptoxanthin esters were determined by single factor experiment and orthogonal experiment. The results are as follows: compared with water bath saponification, ultrasonic saponification can shorten saponification time, improve β-cryptoxanthin yield. The optimal conditions for ultrasonic saponification are: ultrasonic time1h, ultrasonic temperature 30 ℃, KOH concentration 1.5 mol/L,n-hexane addition 1∶4. Under these optimal conditions, the β-cryptoxanthin yield reached 0.02384%.
water bath saponification; ultrasonic saponification; β-cryptoxanthin yield; process optimization
10.13995/j.cnki.11-1802/ts.201610034
硕士研究生(孙志高副研究员为通讯作者,E-mail:cpro@cric.cn)。
重庆市科技支撑示范工程项目(cstc2014fazktjcsf80034)
2015-10-14,改回日期:2016-03-22
