陆地棉萌发至幼苗期抗冷性的鉴定
2016-12-01王俊娟王德龙阴祖军樊伟丽陆许可郭丽雪叶武威喻树迅
王俊娟,王德龙,阴祖军,王 帅,樊伟丽,陆许可,穆 敏,郭丽雪,叶武威,喻树迅
(中国农业科学院棉花研究所/棉花生物学国家重点实验室/农业部棉花遗传改良重点开放实验室,河南安阳 455000)
陆地棉萌发至幼苗期抗冷性的鉴定
王俊娟,王德龙,阴祖军,王 帅,樊伟丽,陆许可,穆 敏,郭丽雪,叶武威,喻树迅
(中国农业科学院棉花研究所/棉花生物学国家重点实验室/农业部棉花遗传改良重点开放实验室,河南安阳 455000)
【目的】低温胁迫是影响棉花正常生长的重要因子之一,通过对棉花种质进行合理的抗冷性鉴定,可以为棉花的抗冷机制研究提供重要的先决条件,进而为棉花抗冷品种的选育提供一定的理论参考。【方法】利用4个抗冷性不同的陆地棉品种(系),设置0、4、10和15℃不同温度处理7 d,然后在正常条件(28℃,光照/黑暗,14 h/10 h)恢复生长7 d,筛选适合棉花萌发期进行抗冷性鉴定的低温条件;然后对4个品种(系)进行0℃低温处理1、2、3、4、5、6和7 d,恢复正常生长7 d,筛选萌发期抗冷性鉴定0℃低温处理的天数。对于芽期的抗冷性鉴定,选用抗冷性差异显著的2个陆地棉材料进行4℃低温处理0、1、2、3、4、5、6和7 d,筛选适用于芽期抗冷鉴定的低温处理的天数。将47个陆地棉材料(子叶期)进行4℃处理24 h,恢复正常生长7 d后调查冷害指数,鉴定棉花子叶期的抗冷性。采用南京建成生物工程研究所研制的试剂盒测定芽期和子叶期低温胁迫后的生化指标。【结果】通过对棉花不同时期,包括萌发期、芽期和子叶期进行不同低温胁迫条件的筛选,最终初步建立了适合棉花不同时期的抗冷性鉴定标准。0℃处理4 d,恢复正常生长7 d的相对子叶平展率可以作为萌发期的抗冷鉴定指标;4℃处理5 d,恢复正常生长的7 d的子叶平展率可以作为芽期的抗冷鉴定指标;4℃处理24 h,恢复正常生长的7 d的抗冷指数可以作为子叶期的抗冷鉴定指标。抗冷材料豫2067芽的SOD酶活和POD酶活均在低温处理前期呈上调趋势,之后下降至趋于平稳,而冷敏感材料衡棉3号芽的两种酶在低温处理前期迅速下降,然后上调后趋于平稳;2个材料芽的CAT酶活性在低温处理早期均先上升后下降,在冷处理后期抗冷材料豫2067的CAT酶活一直高于冷敏感材料衡棉3号;2个材料的可溶性蛋白含量在冷处理早期比较接近,在冷处理后期抗冷材料豫2067的可溶性蛋白含量一直高于冷敏感材料衡棉3号。4℃低温处理子叶期棉苗24 h后,抗冷材料豫2067子叶的SOD酶活力、POD酶活力、CAT酶活力均下降,而冷敏感材料衡棉3号的3种酶活力均上升,抗冷材料子叶中可溶性蛋白上升,冷敏感材料中的可溶性蛋白下降。【结论】棉花不同的生育时期应有相应的抗冷性鉴定标准,不同材料和不同生育时期的耐冷性鉴定标准具有差异性。推测棉花芽期抗冷性与酶活力有关。子叶期抗冷性与3种抗氧化酶活性差异不显著,可能与叶片中可溶性蛋白含量有关。
棉花;生育时期;抗冷性;鉴定方法;生化特性
0 引言
【研究意义】低温冷害是限制农业生产的主要农业气象灾害之一。低温冷害可使作物生育延迟,造成产量减少、品质降低[1]。重要作物如水稻、玉米、大豆、棉花和番茄等,对冷胁迫均比较敏感,而且冷适应能力差[2]。低温冷害是威胁棉花的重要灾害之一,尤其对在早春季节播种期和苗期的棉花危害更为严重[3]。棉花是喜温热作物,低温使棉花生育期延迟、落花落蕾,品质和产量严重下降。随着人口的日益增加和气候条件的不断恶化,粮棉争地的矛盾越来越激烈,在保障国家粮食安全的前提下,培育棉花抗冷性品种,将棉花种植向新疆内蒙等寒凉地带转移是缓解粮棉争地矛盾的有效途径。对不同生育时期的耐低温能力进行鉴定,制定出一套关于棉花抗冷性的综合评价体系,筛选优异的棉花抗冷种质资源,有利于推进棉花抗冷育种进程。【前人研究进展】除了处于休眠期的干种子外,起源于热带、亚热带的冷敏感植物生长发育的所有阶段均易受到冷胁迫的伤害[4]。目前,在水稻、玉米、大豆以及蔬菜等植物中进行了大量的耐低温研究,并且制定出相应的抗冷性鉴定方法。不同作物间、同一作物的不同生育时期抗冷性评价指标具有多样性。BERTIN等[5]利用6个材料筛选水稻萌发期和苗期的抗冷鉴定指标,指出10℃低温是最有效的抗冷鉴定温度。在玉米的耐寒性鉴定中,将低温与常温下各性状测定值的比值作为耐寒性强弱的评价指标[6]。李育军等[7]指出,在6℃人工气候箱内,大豆低温萌发指数和田间出苗指数呈正相关,室内萌发耐低温的大豆品种,在田间出苗也表现较强的耐低温性能。苗永美等[8]研究表明,黄瓜17℃相对发芽势、相对发芽率、相对胚根长和相对活力指数与萌芽期耐冷性关系显著,冷害指数与恢复后成活率与苗期抗冷性相关,并将黄瓜材料耐冷性分为3个等级。小豆芽期、苗期耐冷性鉴定方法研究结果表明,三叶期低温5—8℃胁迫7 d后能够生长正常的幼苗所占百分比可以作为小豆苗期耐冷性鉴定指标,而且小豆发芽期与三叶期耐冷性存在差异[9]。辣椒在4℃处理条件下的幼苗(4叶1心期)冷害指数和15℃条件下的发芽指数可以作为评价辣椒品种的耐低温能力[10]。在棉花的耐低温鉴定中,武辉等[11]通过测定低温胁迫(5℃、12 h)及恢复处理(25℃、24 h)下棉花幼苗叶片初始荧光(Fo1)、最大光化学效率(Fv/Fm1)、气孔导度(Gs)、可溶性糖含量(SS)、丙二醛含量(MDA)和相对电导率(REC)等6个鉴定指标,进行棉花品种耐寒性强弱的快速鉴定和预测。【本研究切入点】陆地棉是世界上重要的经济作物和油料作物,起源于适应亚热带极端温度变化的野生多年生植物[12],然而,现代栽培种是在适宜的温度条件下针对产量和纤维品质目标经过人工选择下培育出来的,其抗逆性的遗传多样性无意中变得越来越窄[13],研究表明,最适合棉花生长的温度是28℃左右[14],低温对棉花生长的影响远大于其他作物[15]。因此,筛选出具有抗冷性的棉花种质资源材料是目前棉花育种中的主要任务之一。棉花耐低温研究起步比较晚,目前仍停留在低温对棉花的影响和危害方面[16-18]以及如何进行抗寒锻炼来提高棉花的抗冷性[19-20];对棉花抗冷性鉴定的研究主要关注某一个时期的抗冷性[21],棉花苗期的抗冷性鉴定指标主要限制在生理生化、光合特性等方面[11,22]。对棉花不同生育时期进行抗冷性鉴定缺少系统性、综合性研究,生产上更是缺少抗冷性的棉花品种。【拟解决的关键问题】针对棉花生育期长、抗逆性状复杂,以及资源鉴定数量多和规模大、且材料来源于不同生态区、变异类型丰富的特点,本研究通过对棉花不同生育时期进行低温胁迫,寻求适合萌发期、芽期、子叶期的抗冷鉴定指标,建立相应的抗冷评价体系,目的是筛选优良的抗冷种质资源,为棉花抗冷育种和抗冷机制的研究提供理论参考。
1 材料与方法
1.1 试验材料
陆地棉萌发期是指棉籽吸胀后开始萌发至芽长达种子长度的1/2处这段时间。其抗冷鉴定所用材料选取4个陆地棉花品种:豫2067、sGK958、GK50、衡棉3号,验证萌发期抗冷鉴定方法选用13份陆地棉材料:豫2067、GZ1、中棉所44、冀616、冀228、sGK958、GK50、邯242、衡棉3号、中棉所50、新研96-48、鲁棉研16和中404A。
陆地棉芽期是指棉花种子萌发后至出苗这段时间,其抗冷性鉴定指标筛选所用材料:抗冷性较强的鲁棉研16和冷敏感材料中404A抗。验证芽期抗冷鉴定方法选用11份陆地棉材料:冀616、鲁棉研16、中404A、中棉所44、衡棉3号、sGK958、豫2067、邯242、GZ1、冀228和GK50。
陆地棉子叶期是指种子萌发出土后从子叶平展到第一片真叶长出这段时间,其抗冷性鉴定指标的筛选所用材料为47份陆地棉花品种(系)(表1),分别来源于美国和中国的华北、华中、山东等地,来源广泛,遗传变异丰富。
试验所用材料种子均来源于中国农业科学院棉花研究所,所选材料的田间农艺性状等综合性状优异,抗病、抗虫,产量能保证后续室内试验的顺利进行。试验于2015年在中国农业科学棉花研究所完成。
1.2 陆地棉萌发期的抗冷鉴定
1.2.1 不同处理温度的设置 棉花种子于28℃吸胀12 h后在0℃、4℃、10℃和15℃不同温度条件下处理7 d,0℃和4℃低温条件的获得是冰箱处理,10℃和15℃的温度条件由培养箱获得,每个处理设3个重复,每个重复100粒种子,对照(CK)处理为种子吸胀12 h后直接种于恒温灭菌沙土中(28℃、光照14 h/黑暗10 h),每个重复100粒种子。低温胁迫的种子在28℃、光照14 h/黑暗10 h恒温恢复生长7 d后调查其出苗情况,并直接调查对照生长7 d的出苗情况,计算子叶平展率(%)=子叶平展数/总种子数×100。
1.2.2 0℃低温处理天数的确定 将棉花种子置于含双层滤纸的培养皿中,28℃吸胀12 h后,将种子直接放入冰箱中分别进行0℃处理0、1、2、3、4、5、6和7 d,每个处理设3个重复,每个重复100粒种子,然后种植在恒温灭菌沙土(28℃、光照14 h/黑暗10 h)恢复发芽7 d,调查其出苗情况,计算其子叶平展率(%)。
1.2.3 棉花种质资源萌发期抗冷性评价 将13份陆地棉材料种子于28℃吸胀12 h后直接放入冰箱进行低温处理(0℃)4 d,未经低温处理的设为对照(CK),每个处理设3个重复,每个重复100粒种子,然后种植在恒温灭菌沙土(28℃、光照14 h/黑暗10 h)恢复培养发芽7 d,调查其出苗情况,计算其相对子叶平展率(%)=低温处理后子叶平展率/CK的子叶平展率×100。
1.3 陆地棉芽期的抗冷性鉴定
1.3.1 棉花芽期抗冷性鉴定方法的确定 挑选鲁棉研16和中404A饱满一致的种子,用双层湿滤纸于28℃左右恒温保湿催芽,待芽长到1 cm左右时,挑选一致、发育良好的芽置入双层滤纸的培养皿中,保湿进行4℃低温处理,处理时间分别为0(CK)、1、2、3、4、5、6和7 d。每个处理设3个重复,每个重复50粒。将低温处理过的芽分别种植在高温灭菌含水量为23%的沙子里,并置于培养箱(28℃、光照14 h/黑暗10 h)中恢复生长,7 d后计算其子叶平展率(%)=子叶平展数/总芽数×100。
1.3.2 棉花种质资源芽期抗冷性评价 选用11份棉花材料在28℃恒温下进行催芽,待芽长到1 cm左右时每个材料选取生长一致的种子150粒,分3个重复置入双层滤纸的培养皿中进行4℃低温处理,低温处理0 d(CK)和5 d后,将对照和低温处理过的种子种植在沙土中(高温灭菌且含水量为23%左右)进行恢复生长(28℃、光照14 h/黑暗10 h),7 d后调查其子叶平展率,并计算相对子叶平展率。
1.4 陆地棉子叶期的抗冷性鉴定
1.4.1 子叶期棉花苗的培育 将高温灭菌的沙子(含水量为23%)均匀平铺于长19.5 cm×宽14 cm ×深5 cm的有机发芽盒中,沙子的厚度约为2 cm,将50粒棉花种子均匀平铺于上面,并加盖同样湿度和厚度的沙子,加盖保湿,置于28℃、光照14 h /黑暗10 h培养箱中进行萌发。7 d后将子叶未平展、弱苗及畸形苗拔除,留下均匀的、健壮的苗25—30棵继续生长2 d后用于后续试验研究。每个品种设3个重复。
1.4.2 子叶期低温处理方法及调查方法 将1.4.1中的苗浇水后加盖保湿。置于4℃、光照14 h/黑暗10 h培养箱中处理24 h,然后转入28℃、光照14 h/黑暗10 h的培养箱中恢复生长7 d,并调查子叶受伤害面积,根据茎的受伤害程度,分为烂茎、断茎和茎完好,再针对茎完好的单株调查子叶脱落情况,调查未脱落子叶的受伤害面积,记录烂斑面积占该片叶面积比例为X,记录总烂斑面积占总叶面积比例为Y(当只有一片子叶未脱落时,Y= X;当子叶完好时视为X=0),划分直观、详细、可操作性强。根据冷害级别调查出每一个品种(系)的冷害指数,冷害指数和抗冷指数计算方法如下:
冷害指数/%=∑(级别×该级个数)/(8×总个数)×100;
抗冷指数/%=100-冷害指数。
1.4.3 陆地棉芽期和子叶期的生化指标测定方法
选取抗冷性差异显著的2个陆地棉材料,按1.3.1的方法进行催芽和4℃低温处理,分别选取处理不同时间的芽全长,取鲜重0.1 g左右,液氮速冻后-80℃冰箱保存备用,3个重复。按1.4.1和1.4.2的方法进行子叶期棉苗的培育及低温处理,分别对低温处理前(CK)和4℃低温处理24 h后的子叶进行取样,取鲜重0.10 g左右,液氮速冻后-80℃保存备用,3个生物学重复。
采用考马斯亮蓝G-250染色法[23]测定可溶性蛋白。采用南京建成生物工程研究所研制的试剂盒测定超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化物酶(peroxidase,POD)活性、过氧化氢酶(catalase,CAT)活性,具体操作步骤按使用说明书进行。
1.5 数据处理
用Stata 11.0软件进行数据分析。
2 结果
2.1 陆地棉萌发期抗冷性鉴定
2.1.1 萌发期抗冷性鉴定温度的确定 由图1可知,15℃及以下低温处理7 d, 28℃恢复生长7 d后的子叶平展率平均值均低于对照(28℃)处理,且随着温度的降低子叶平展率呈下降趋势,表明15℃及以下低温处理对棉花种子萌发出苗均造成伤害,温度越低,伤害越严重。0℃低温处理7 d后,4个材料间的子叶平展率差异达到极显著,且0℃条件容易获得,所以0℃低温处理可以作为棉花萌发期抗冷性鉴定的合理温度条件。
2.1.2 0℃低温处理天数的确定 由图1可以看出,0℃低温处理7 d后,4个棉花品种虽然差异极显著,但最高的出苗率也只有约28.00%,最低的还不到10.00%,平均子叶平展率为15.62%,说明0℃低温处理7 d的时间太长,在该处理条件下,一些耐低温能力中等的材料不容易被鉴定出来,所以应找到0℃低温处理合适的天数。
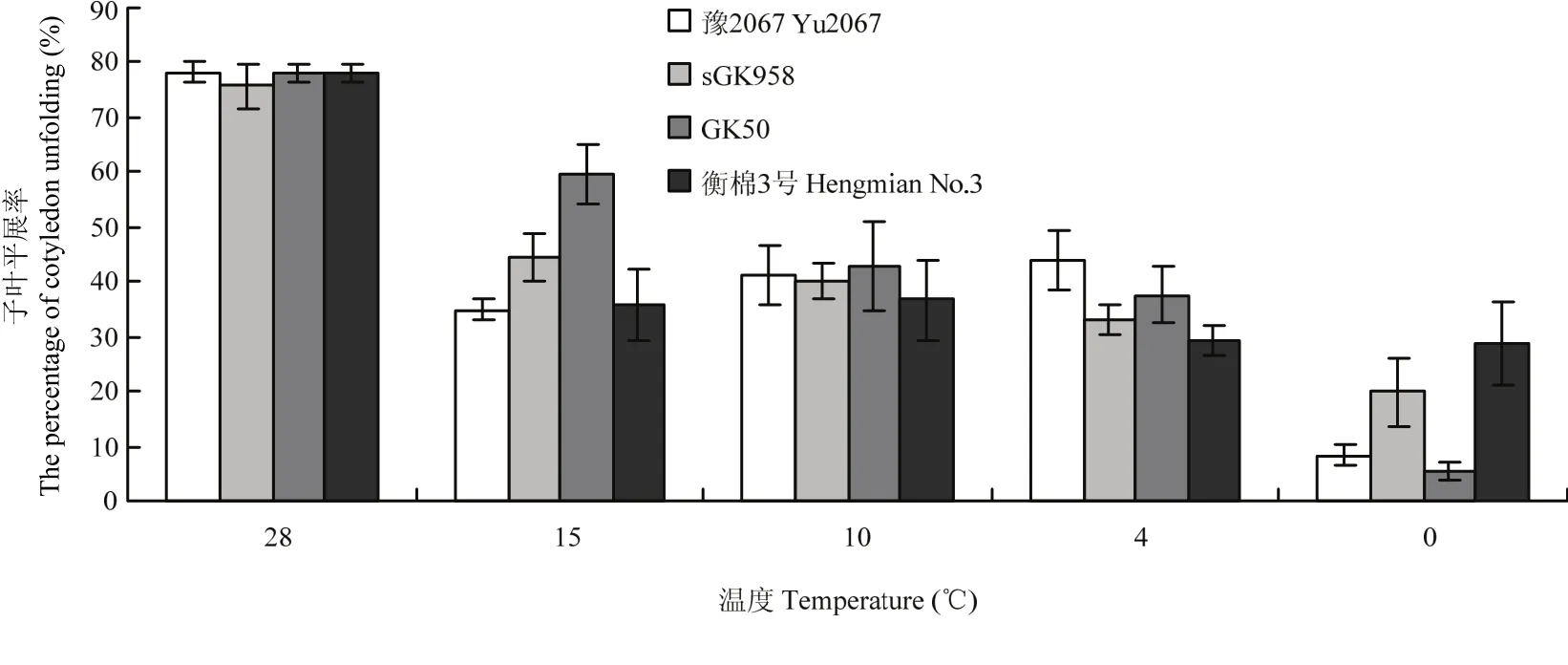
图1 萌发期不同温度处理后子叶平展率Fig. 1 The percentage of cotyledon unfolding after different temperature treatments at germination stage
由图2可以看出,随着0℃低温处理天数的增加,4个棉花品种在恢复正常生长7 d后的子叶平展率呈下降趋势,说明低温处理的时间越长,对棉花萌发的影响越大。处理4 d时,4个材料的子叶平展率差异达到极显著,所以0℃处理4 d可以作为陆地棉萌发期抗冷性鉴定的指标。
2.1.3 棉花种质资源萌发期抗冷性评价 为进一步验证筛选出的适合萌发期抗冷性鉴定的温度条件,同时也为了筛选萌发期抗冷性强的种质资源,挑选综合性状良好的13个陆地棉品种进行萌发期抗冷性鉴定(图3)。
13个棉花新材料在萌发期抗冷性差异达到极显著。说明棉花萌发期经0℃低温处理4 d后恢复生长7 d后的子叶平展率作为棉花萌发期抗冷性鉴定指标是可行的。根据研究结果可以把萌发期期抗冷性标准定为:子叶相对平展率为0—29.90%为冷敏感;30.00%—49.90%时为不抗冷;50.00%—74.90%为耐冷;75.00%—89.90%为抗冷;90.00%—100.00%为高抗冷。由图3可以看出,13个陆地棉材中,萌发期期达到抗冷水平的棉花品种(系)有1个(冀616),占7.69%;萌发期耐冷的棉花品种(系)有7个,分别为鲁棉研16、中404A、中棉所44、中棉所50、衡棉3号、sGK958、新研96-48,占53.85%,说明超过50%的棉花材料在萌发期的抗冷水平均达到中等水平。
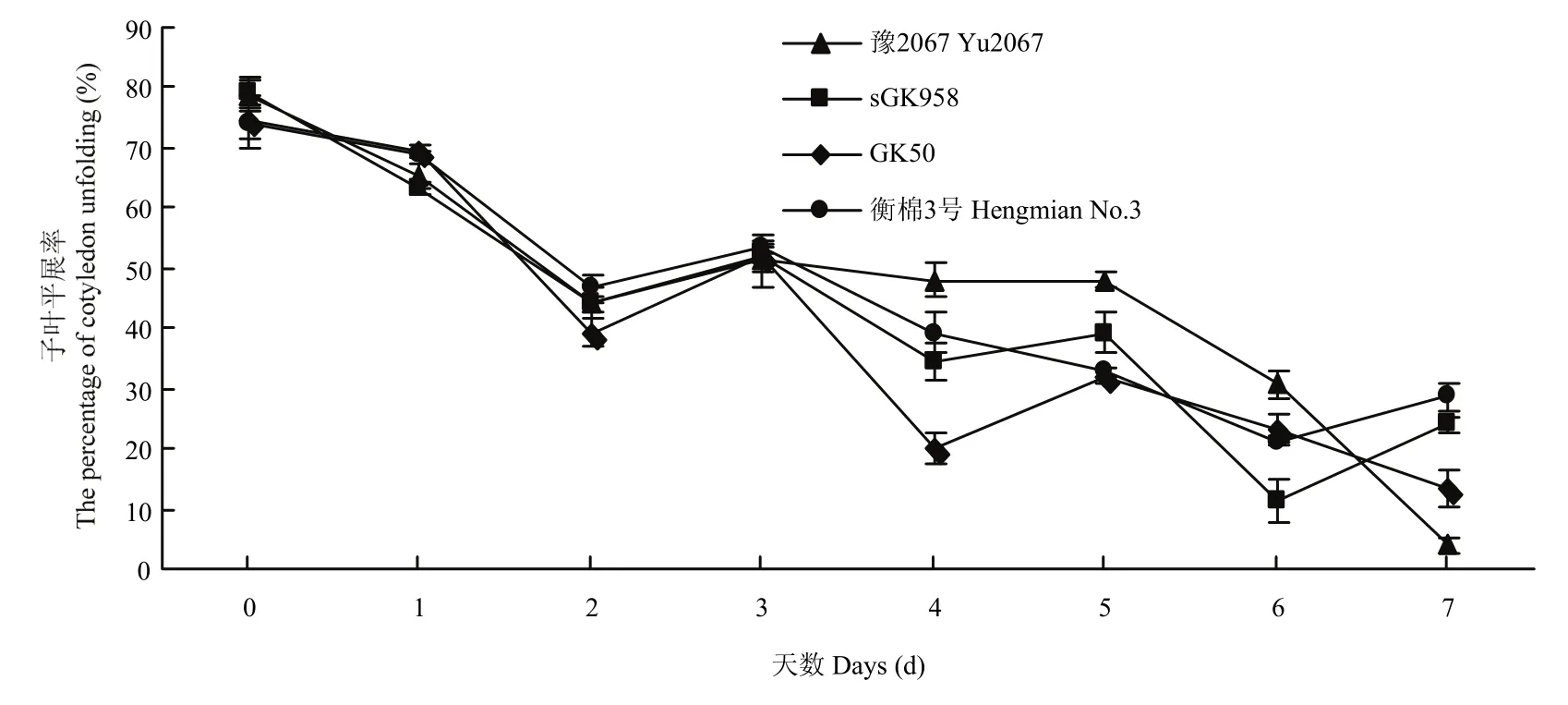
图2 萌发期0℃温度处理不同天数后子叶平展率Fig. 2 The percentage of cotyledon unfolding after 0℃temperature treatment at germination period
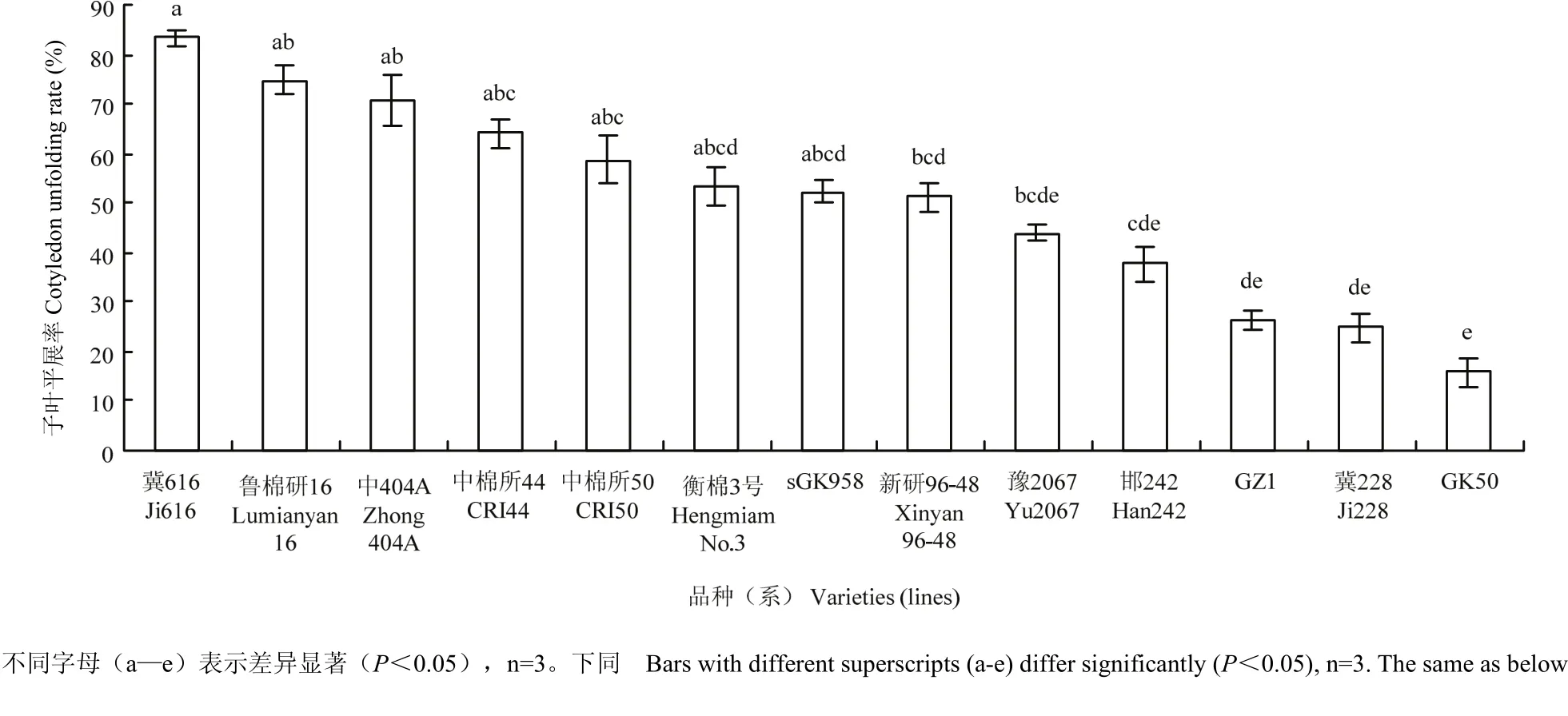
图3 棉花种质资源萌发期抗冷性评价Fig. 3 The evaluation of chilling resistance on cotton germplasm resources at germination stage
2.2 陆地棉芽期抗冷性鉴定
2.2.1 陆地棉芽期抗冷性鉴定方法的确定 人工模拟早春低温天气对陆地棉芽期进行4℃低温冷处理,低温胁迫1—4 d时,抗冷品种鲁棉研16和冷敏感品种中404A的子叶平展率与对照相比没有明显变化,2个材料间差异不显著。低温处理5 d后,子叶平展率开始下降,随着处理时间的延长,下降幅度变大,但抗冷品种下降速率比冷敏感品种下降慢。低温处理5 d时,2个品种子叶平展率差别最大,达到差异极显著水平;冷处理7 d时,抗冷品种鲁棉研16的子叶平展率比对照下降了90.60%,而冷敏感品种中404A则下降了98.70%,2个品种(系)受到的伤害程度相近,均已经遭到严重伤害。因此,棉花芽期4℃低温冷处理5 d后恢复正常生长7 d的子叶平展率可以作为鉴定条件来鉴定抗冷品种和冷敏感品种。
棉花芽期经过4℃低温处理5 d后,对棉花的生长发育具有明显的影响。与对照相比,棉芽在低温处理以后恢复7 d正常生长后叶色变浅,失绿,有些子叶出现有黄斑,且子叶平展缓慢或不平展,也有子叶出苗即腐烂现象;茎变粗,变脆,易断,芽尖即胚根部分受伤,重新生出侧根,所以根系发育缓慢,容易产生倒根,不能成苗,侧根发生能力强的材料,相对应的子叶平展比较高,所以耐低温能力比较强。
2.2.2 陆地棉种质资源芽期抗冷性评价 利用Stata11.0对11个棉花材料(4℃冷处理5 d后恢复7 d正常生长)的相对子叶平展率进行分析和观察(图4),结果表明,11个棉花材料芽期的抗冷性差异达到了显著。因此,棉花芽经4℃低温处理5 d后恢复生长7 d的子叶平展率作为棉花芽期抗冷性的鉴定指标是可行的。将棉花芽期抗冷性的鉴定标准设定为:相对子叶平展率0—29.90%为冷敏感;30.00%—49.90%为不抗冷;50.00%—74.90%为耐冷;75.00%—89.90%为抗冷;90.00%—100.00%为高抗冷。11份陆地棉材中,芽期耐冷的棉花材料有4份,分别为豫2067、GK50、鲁棉研16和中棉所44,占总材料的36.36%;不抗冷的材料有5份,占45.45%;冷敏感材料有2份,占18.18%。芽期没有筛选到高抗冷和抗冷的材料。
2.3 陆地棉子叶期抗冷性鉴定
2.3.1 陆地棉子叶期低温处理后叶片冷害级别划分由图5可以看出,4℃低温处理24 h后,不同材料间的冷害差异显著。由子叶受伤害的面积可将子叶期冷害划分为8个级别(表2)。根据抗冷指数,将陆地棉子叶期的抗冷性划分为5个等级:抗冷指数为0—29.90%时为冷敏感;30.00%—49.90%为不抗冷;50.00%—74.90%为耐冷;75.00%—89.90%为抗冷;90.00%—100.00%为高抗冷。
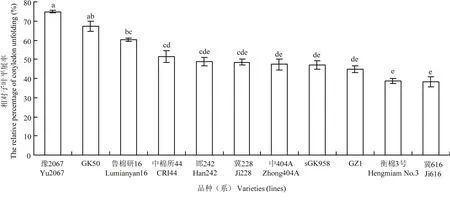
图4 棉花种质资源芽期抗冷性评价Fig. 4 The evaluation of chilling resistance on cotton germplasm resources at budding stage

图5 陆地棉子叶期低温处理后叶片冷害级别图示Fig. 5 The diagram of chilling injury level after low temperature treatment at cotyledon stage

表1 棉花种质资源子叶期抗冷性评价Table 1 The evaluation of chilling resistance on cotton germplasm resources at cotyledon stage

表2 陆地棉子叶期叶片冷害级别Table 2 The level of chilling injury at cotyledon stage
2.3.2 棉花种质资源子叶期抗冷性评价 由表1可以看出,47份陆地棉材料的子叶期抗冷性差异显著,抗冷指数由14.29%—86.35%不等,平均抗冷指数为51.60%。47份陆地棉种质资源材料中,子叶期抗冷的材料有7份,分别为邯郸109、豫2067、创棉22、冀杂3268F6、中棉所44、中404A抗-13和光籽2,占总鉴定材料的12.77%;耐冷的有15份,占31.91%,不抗冷或冷敏感的有25份,占53.19%,没有高抗冷的材料。因此,用4℃低温处理24 h鉴定陆地棉子叶期抗冷性是可行的。在北方高纬度长期种植筛选驯化过程中,陆地棉中有部分材料已经拥有了一定的抗冷性(12.77%),但是对于子叶期的棉花来说,有高于50%的材料还是不抗冷或冷敏感(53.19%),培育出高抗冷材料还需要长期的努力。
2.4 不同生育时期陆地棉抗冷差异
不同棉花材料在不同生育时期的抗冷性表现存在差异性(表3)。鲁棉研16、中棉所44在3个时期抗冷相对一致,均表现出耐冷或抗冷,其萌发期相对子叶平展率74.81%和64.22%,芽期子叶平展率60.24%和51.52%,而子叶期的抗冷指数为67.86%和85.27%;邯242、GZ1、冀228在萌发期、芽期和子叶期均表现出不抗冷,说明鲁棉研16、中棉所44、邯242、GZ1、冀228在不同生育时期的抗冷性是一致的;中404A和衡棉3号在萌发期均表现耐冷,在芽期和子叶期却不抗冷或冷敏感;豫2067在萌发期不抗冷,而在芽期和子叶期分别为耐冷和抗冷。sGK958是在萌发期和子叶期均耐冷,芽期不抗冷;GK50则相反,在萌发期和子叶期分别表现为冷敏感和不抗冷,在芽期却表现为耐冷,说明同一材料在不同时期的抗冷性存在差异。
2.5 低温胁迫对陆地棉芽期抗氧化酶活性的影响
由图6-A可知,随着4℃低温处理时间的延长,与对照相比,抗冷材料豫2067芽的SOD酶活性呈略微上升趋势,至4 d时达到最高,然后下降,至处理5 d时下降到最低后趋于平稳状态;而冷敏感材料衡棉3号的芽在低温处理1 d时开始下降,2 d时下降到最低,随后3 d时又迅速上升后趋于平稳。
随着4℃低温处理时间的延长,与对照相比,抗冷材料豫2067芽的POD酶活性迅速上升,在冷处理1和3 d时达到最大值,在冷处理4 d时又迅速下降到最低,然后平稳缓慢上升;而冷敏感材料衡棉3号的芽在低温处理1 d时开始下降,3 d时下降到最低,随后4 d时上升,6 d时达到最高值,低温冷处理7 d时又开始下降。总之,抗冷材料先于冷敏感材料达到最高值,后于冷敏感材料达到最低值(图6-B)。
随着4℃低温处理时间的延长,与对照相比,抗冷材料豫2067和冷敏感材料芽的CAT酶活性均先上升后下降,其中,豫2067在冷处理2 d时上升到最大,3 d时又迅速下降到最低,衡棉3号在冷处理1 d时上升到最大,然后迅速下降,冷处理4 d时下降到最小,然后2个材料的CAT酶活又开始上升,抗冷材料豫2067在冷处理后期芽的CAT酶活一直高于冷敏感材料衡棉3号,至7 d时两者酶活又趋于接近状态(图6-C)。
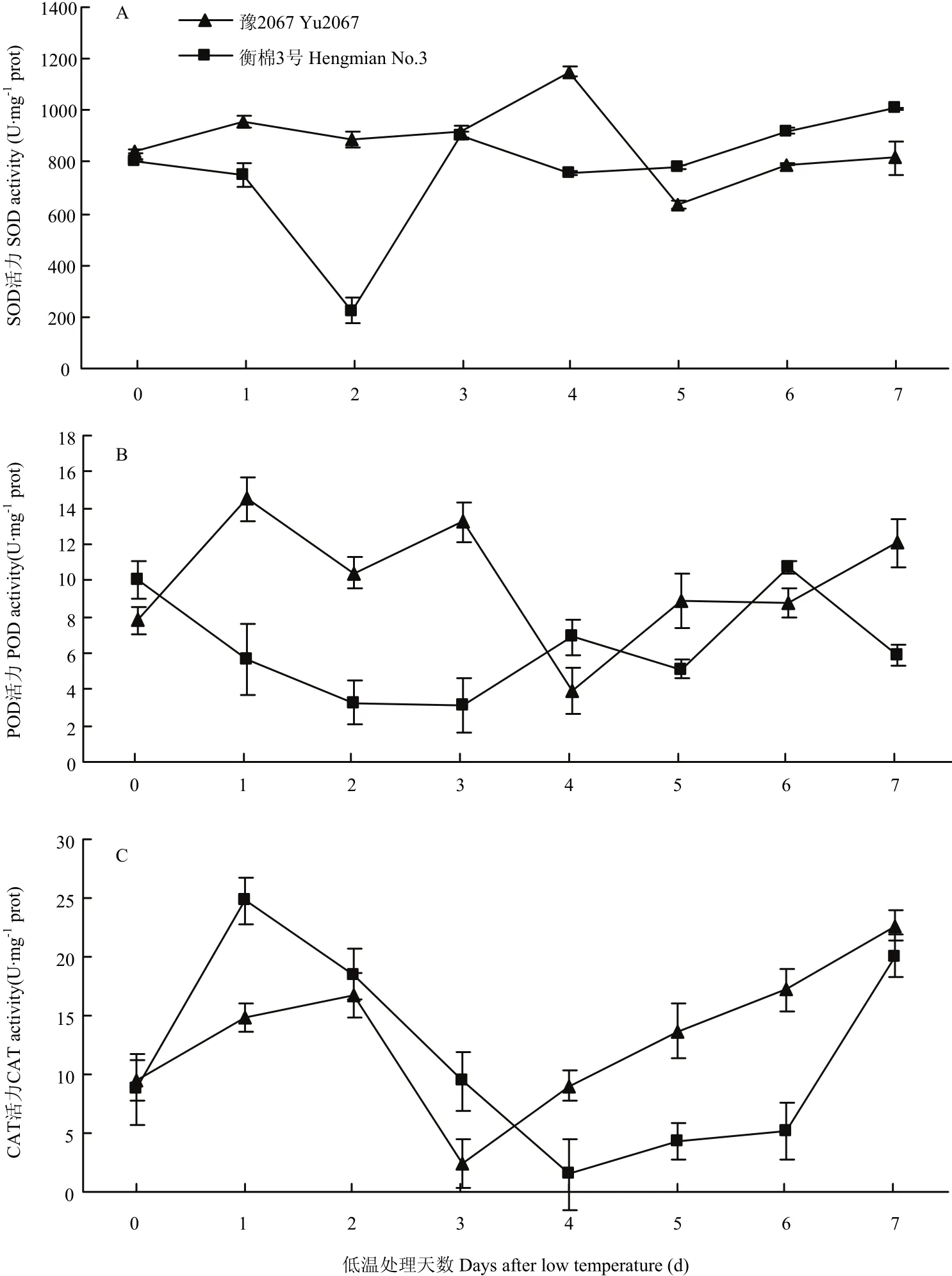
图6 低温胁迫对陆地棉芽期抗氧化酶活性的影响Fig. 6 Effects of low temperature stress on the activity of antioxidant enzymes at the budding stage of upland cotton
2.6 低温胁迫对陆地棉芽可溶性蛋白含量的影响
在低温处理的早期,陆地棉芽的可溶性蛋白比对照略微下降(图7),冷处理3 d时下降到最小,其中,冷敏感材料衡棉3号比抗冷材料豫2067下降速度快,2个材料芽的可溶性蛋白在冷处理后期又呈上升趋势,其中,抗冷材料豫2067比冷敏感材料衡棉3号上升速度快,且于冷处理5 d时达到最大,而衡棉3号在冷处理4 d时可溶性蛋白达到最大,冷处理7 d时2个材料又趋于一致。在冷处理后期,抗冷材料的可溶性蛋白含量均高于冷敏感材料。
首先要合理配置审计模拟实训课程的课时,要对现有开设的几门审计理论课程重复的内容进行归并和调整,从而相应的增加审计模拟实训的课时,理想的审计实训课时应该占据审计总教学课时的半壁江山,这是因为审计是一门理论性和实践性都很强的学科,重视理论联系实践,实行理实一体化的教学模式,不但能激发学生学习热情,并且能够使学生在实践中加深对理论的理解,同时有利于培养学生的职业能力和职业素养;另一方面审计模拟实训教学面广量大,系统性和综合性强,只有充足的课时才能保质保量地完成审计实训的任务,实现审计模拟实训目标。
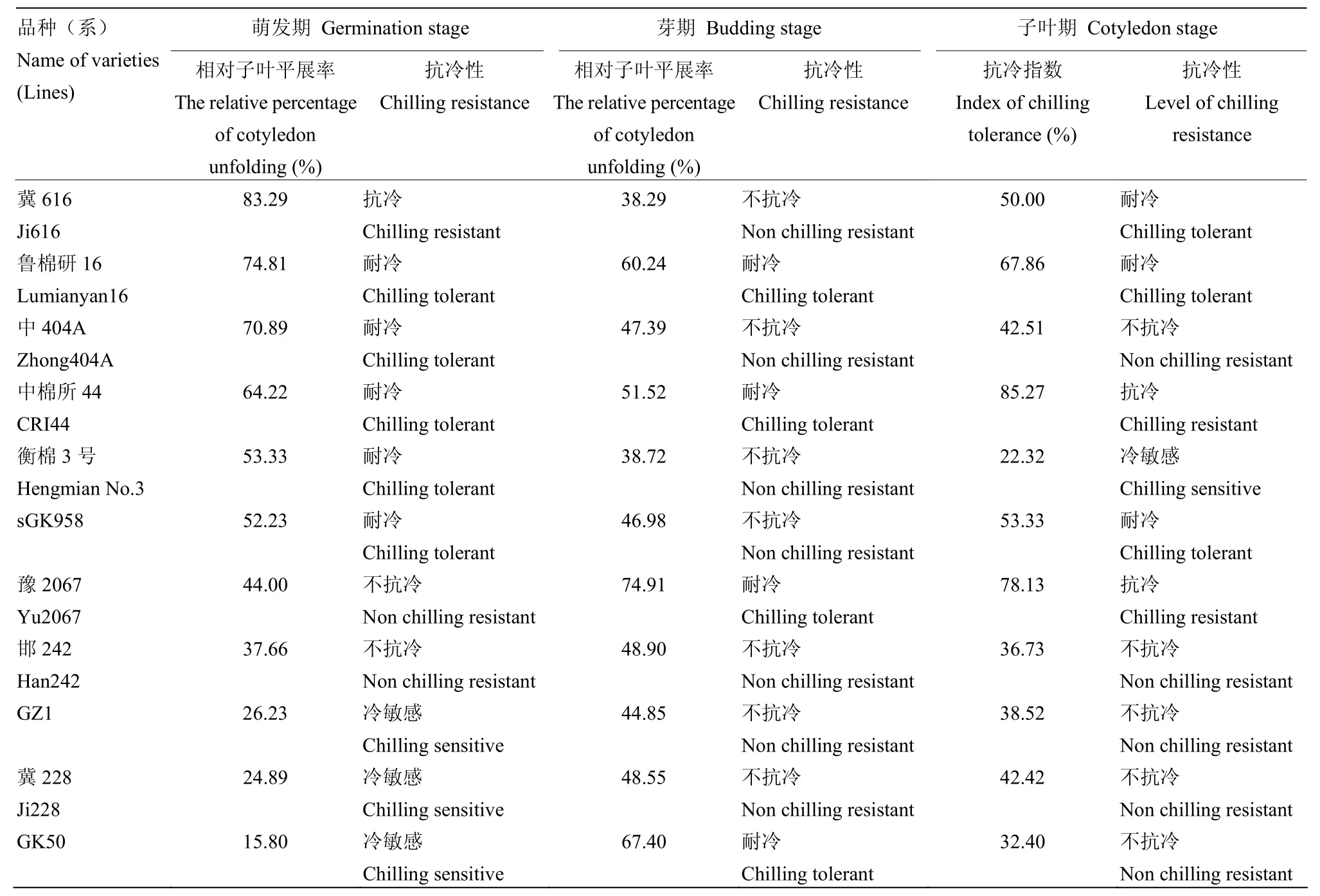
表3 棉花萌发期与子叶期抗冷性比较Table 3 The comparison of cotton chilling resistance among germination stage, budding stage and cotyledon stage
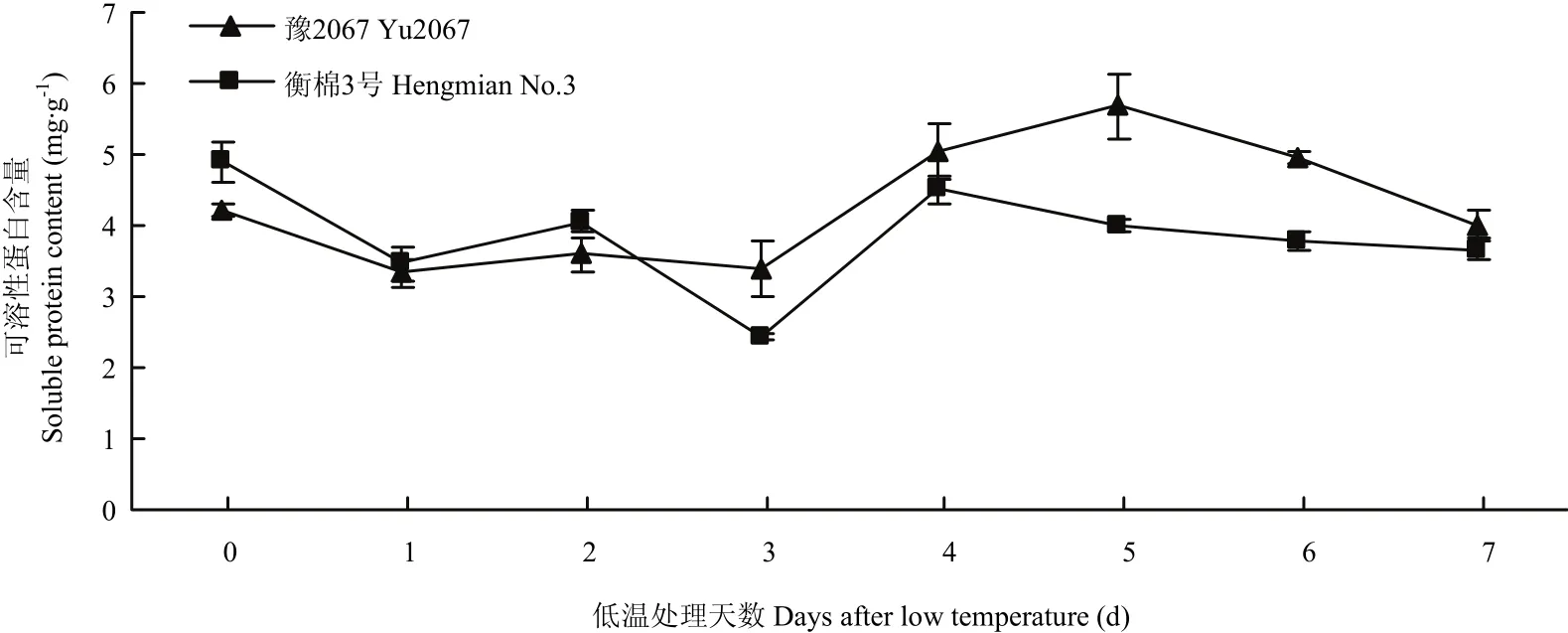
图7 低温胁迫对陆地棉芽可溶性蛋白含量的影响Fig. 7 Effects of low temperature stress on the soluble protein content at the budding stage of upland cotton
2.7 低温胁迫对陆地棉子叶抗氧化酶活性和可溶性蛋白的影响
由表4可以看出,陆地棉子叶期的子叶经过4℃低温处理24 h后,与对照相比,抗冷材料豫2067的 SOD酶活、POD酶活、CAT酶活均下降,而冷敏感材料衡棉3号的3种酶活均上升;而抗冷材料豫2067子叶的可溶性蛋白含量升高,冷敏感材料衡棉3号子叶的可溶性蛋白含量下降11.56%。
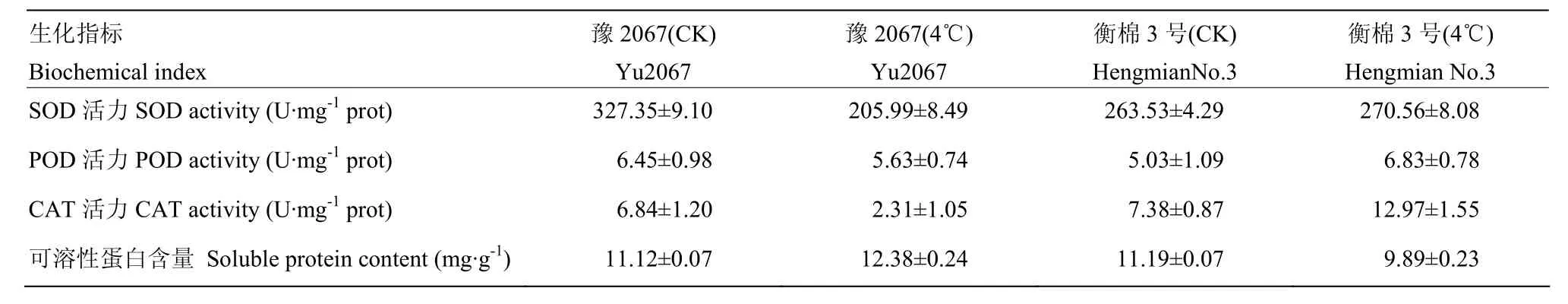
表4 低温胁迫对陆地棉子叶抗氧化酶活性和可溶性蛋白的影响Table 4 Effects of low temperature stress on the activity of antioxidant enzymes and the soluble protein content of the cotyledon of upland cotton
3 讨论
低温冷害是棉花不同生育时期经常发生的自然灾害,每一次低温冷害都会造成不同程度的棉花减产及品质降低。选用抗冷品种是减轻低温冷害最经济有效的措施。对棉花种质资源进行有效的抗冷鉴定、筛选与利用是抗冷育种的基础。本试验针对棉花不同生育时期对低温反应的差异,提出了不同的抗冷鉴定方法和评价指标,有利于对棉花进行系统的抗冷鉴定。
3.1 棉花不同生育时期抗冷性鉴定和抗冷指标的筛选
植物的抗冷性是植物对低温环境的适应能力,包括植物对低温逆境的耐受能力,和逆境解除后恢复生长的能力。本研究表明,棉花种子的萌发能力随着温度的降低而下降,0℃处理4 d,28℃条件下恢复正常生长7 d的相对子叶平展率可以作为萌发期的抗冷鉴定指标。与菠菜[24]、辣椒[10]、玉米[25]萌发期抗冷鉴定采用发芽指数作为评价指标不同,在棉花的萌发期和芽期的抗冷鉴定中,不采用萌发指数或出苗率作为评价指标,是因为在试验的过程中发现,有的棉苗虽然萌发出土,却迟迟不能子叶平展,剥开种皮后看到,其子叶大多已枯烂,不能成苗,可能是由于子叶在低温处理过程中受到了严重伤害,虽能出苗,但子叶不能平展,不能继续进行光合作用,不能长大成苗,所以本研究以恢复正常温度后的子叶平展率作为萌发期和芽期抗冷性评价指标。
前人在农作物的苗期抗冷鉴定研究中,大多将低温处理后的死苗率作为作物耐冷性鉴定指标,如水稻[26]。而在棉花苗期抗冷鉴定中发现,棉花在子叶期受到4℃低温处理24 h后,虽然有的棉花材料能看到明显的伤害,但是很多材料看不到明显伤害,且材料间差异不明显,只有等到恢复生长后才能看到材料间受伤害的差异,所以用低温处理后恢复正常生长7 d后的抗冷指数作为鉴定指标来区分抗冷性有差异的材料是可行的。不同材料间棉苗受到低温伤害程度不同,极少一部分会出现死苗会现象,其他大部分只是受伤害程度不同,所以用死苗率来评价棉花苗期的抗冷性不容易区分不同材料的抗冷性。本试验采用苗期子叶受低温伤害面积计算出冷害指数,再换算成抗冷指数,分级详细,直观明白,容易判断,易于操作,容易区分不同抗冷级别的材料。
3.2 棉花不同生育期抗冷性存在差异性
不同棉花材料在不同的生育时期抗冷性有的一致,有的不一致,说明棉花种质材料抗冷性具有多样性,具有丰富的遗传基础。
3.3 低温胁迫后棉花不同生育时期的生化反应
低温胁迫对植物的伤害与细胞内氧化系统的伤害有关[29-31],另一方面,高等植物通过形成包括SOD、POD、CAT等抗氧化酶等清除活性氧系统来抵抗低温的胁迫[32]。在受低温胁迫的前期,陆地棉芽期抗冷材料的SOD酶活和POD酶活高于冷敏感材料的酶活;在低温胁迫的后期,陆地棉芽期抗冷材料的CAT酶活和可溶性蛋白含量高于冷敏感材料。说明抗冷性强的棉花芽期在受低温持续胁迫的过程中,不同的抗氧化酶在清除棉花体内活性氧的过程中相互协调、交替起作用;在受低温胁迫的后期,抗冷性强的棉花材料通过积累比较多的可溶性蛋白来抵御低温胁迫。
4℃低温处理24 h后的抗冷材料豫2067子叶中SOD酶活力、POD酶活力、CAT酶活力低于对照,可溶性蛋白含量却高于对照,冷敏感材料的3种抗氧化酶活和可溶性蛋白含量却相反,因此,推测棉花子叶期抗冷能力与叶片的抗氧化酶活性关系不大,可能与叶片的可溶性蛋白含量有关系。这与GUO等[33]在水稻品种的抗冷能力与抗氧化酶活性的研究结果不同,据GUO等报道,水稻的抗冷性与水稻面对低温胁迫抗氧化能力密切相关。本研究结果与在黄瓜中的研究结果相似,据苗永美等[8]报道,黄瓜耐冷性与超氧化物歧化酶(SOD)、过氧化物酶(POD)过氧化氢酶(CAT)等没有相关性。据报道,可溶性蛋白含量的高低可用来评价植物的抗冷能力[34],与本研究中抗冷性棉花材料苗期受低温胁迫后可溶性蛋白的含量升高且高于冷敏感材料的结果相一致。说明棉花的抗冷性是一个复杂的性状,将从分子水平进一步探讨棉花的抗冷机制。
4 结论
棉花不同的生育时期应有相应的抗冷性鉴定标准。0℃处理4 d,28℃条件下恢复正常生长7 d的相对子叶平展率可以作为萌发期的抗冷鉴定指标;4℃处理5 d,28℃条件下恢复正常生长7 d的相对子叶平展率可以作为芽期的抗冷鉴定指标;4℃处理24 h,28℃条件下恢复正常生长7 d的抗冷指数可以作为子叶期的抗冷鉴定指标。抗冷性强的棉花芽期在受低温持续胁迫的过程中,不同的抗氧化酶在清除棉花体内活性氧的过程中相互协调、交替起作用,可溶性蛋白含量的高低与棉花苗期抗冷能力有一定相关性。
[1] 潘铁夫, 方展森, 赵洪凯, 卢庆善. 农作物低温冷害及其防御. 北京: 中国农业出版社, 1983. PAN T F, FANG Z S, ZHAO H K, LU Q S. Crop Chilling Damage and Its Defense. Beijing: China Agriculture Press, 1983. (in Chinese)
[2] CHINNUSAMY V, ZHU J H, ZHU J K. Cold stress regulation of gene expression in plants. Trends in Plant Science, 2007, 12(10): 444-451.
[3] 孙忠富. 霜冻灾害与发育技术. 北京: 中国农业出版社, 2001. SUN Z F. Frost Disaster and Its Development and Technologies. Beijing: China Agriculture Press, 2001. (in Chinese)
[4] SALTVEIT M E, MORRIS L L. Overview on chilling injury of horticultural crops// Wang C Y. Chilling Injury of Horticultural Crops. Florida: CRC Press, 1990: 3-15.
[5] BERTIN P, KINET J M , BOUHARMONT J. Evaluation of chilling sensitivity in different rice varieties. Relationship between screening procedures applied during germination and vegetative growth. Euphytica, 1996, 89: 201-210.
[6] HODGES D M, HAMILTON R L, CHAREST C A. Chilling resistant test for inbred maize lines. Canadian Journal of Plant Seience, 1994, 74: 687-691.
[7] 李育军, 常汝镇, 赵玉田, 孙剑英. 大豆室内耐冷筛选及其在田间的应用研究. 大豆科学, 1992, 11(l): 49-57. LI Y J, CHANG R Z, ZHAO Y T, SUN J Y. The screening of cold tolerance of soybean in ndoor and its application in the field. Soybean Science, 1992, 11(l): 49-57. (in Chinese)
[8] 苗永美, 宁宇, 曹玉杰, 沈佳, 庞欣, 崔利, 程春燕, 陈劲枫. 黄瓜萌芽期和苗期耐冷性评价. 应用生态学报, 2013, 24(7): 1914-1922. MIAO Y M, NING Y, CAO Y J, SHEN J, PANG X, CUI L, CHENG C Y, CHEN J F. Evaluation of cucumber s chilling tolerance at germination and seedling stages. Chinese Journal of Applied Ecology, 2013, 24(7): 1914-1922. (in Chinese)
[9] 濮绍京, 金文林, 史亚俊, 赵波, 万平. 人工环境鉴定小豆芽苗期耐冷性研究. 植物遗传资源学报, 2008, 9(1): 41-45. PU S J, JIN W L, SHI Y J, ZHAO B, WAN P. Identification for cold tolerance of adzuki bean at germination and seedling stage in artificial environment. Journal of Plant Genetic Resources, 2008, 9(1): 41-45. (in Chinese)
[10] 任旭琴, 曹碚生, 缪旻珉, 杨晓兰. 辣椒不同生育期耐低温性鉴定及相关分析. 安徽农业大学学报, 2010, 37(1): 141-144. REN X Q, CAO P S, MIAO M M, YANG X L. Identification and analysis on chilling tolerance of pepper (Capsicum annuum L.) varieties at different development stages. Journal of Anhui AgriculturalUniversity, 2010, 37(1): 141-144. (in Chinese)
[11] 武辉, 侯丽丽, 周艳飞, 范志超, 石俊毅, 阿丽艳·肉孜, 张巨松.不同棉花基因型幼苗耐寒性分析及其鉴定指标筛选. 中国农业科学, 2012, 45(9): 1703-1713. WU H, HOU L L, ZHOU Y F, FAN Z C, SHI J Y, A L Y ·ROUZI, ZHANG J S. Analysis of chilling-tolerance and determination of chilling-tolerance evaluation indicators in cotton of different genotypes. Scientia Agricultura Sinica, 2012, 45(9): 1703-1713. (in Chinese)
[12] KOHEL R J. Influence of certain morphological characters on yield. Cotton Growth Review, 1974, 51: 281-292.
[13] ROSENOW D T, QUISENBERRY J E, WENDT C W, CLARK L E. Drought tolerant sorghum and cotton germplasm. Agricultural Water Management, 1983, 7(1/3): 207-222.
[14] LAUTERBACH B, KRIEG D R, JIVIDEN G. Fatty acid composition of lipid fractions in germinating cotton as affected by temperature. Proceedings Beltwide Cotton Conference, 1999, 1: 564-565.
[15] SAWAN Z M, HANNA L I, GAD EL KARIM G A, MCCUISTION W L. Relationships between climatic factors and flower and boll production in Egyptian cotton (Gossypium barbadense). Journal of Arid Environments, 2002, 52(4): 499-516.
[16] ANJUM Z I, KHATOON A. Chilling effect on germination and seedling vigour of some cultivated species of Gossypium. Asian Journal of Plant Sciences, 2003, 2(3): 297-299.
[17] ZHAO J Q, LI S, JIANG T F, LIU Z, ZHANG W W, JIAN G L, QI F G. Chilling stress-the key predisposing factor for causing alternaria alternata infection and leading to cotton (Gossypium hirsutum L.) leaf senescence. PLoS ONE, 2012, 7(4): e36126.
[18] 邹陈, 陈冬花, 吉春容, 杨举芳, 尹育红, 李新建. 障碍型冷害对石河子棉区花铃期棉花生长的影响研究. 中国农学通报, 2012, 28(12): 54-59. ZOU C, CHEN D H, JI C R, YANG J F, YIN Y H, LI X J. Experiments and studies about effect of obstacle cold disaster on cotton during the flowering and boll stages in the cotton region of Shihezi. Chinese Agricultural Science Bulletin, 2012, 28(12): 54-59. (in Chinese)
[19] 范月仙, 王鹏, 李生泉. 临界生长温度锻炼对棉苗抗冷性的影响.棉花学报, 2011, 23(1): 90-93. FAN Y X, WANG P, LI S Q. The effect of critical growth temperature exercise on cotton seedling cold resistance. Cotton Science, 2011, 23(1): 90-93. (in Chinese)
[20] 杨美森, 王雅芳, 干秀霞, 罗宏海, 张亚黎, 张旺锋. 外源一氧化氮对冷害胁迫下棉花幼苗生长、抗氧化系统和光合特性的影响. 中国农业科学, 2012, 45(15): 3058-3067. YANG M S, WANG Y F, GAN X X, LUO H H, ZHANG Y L, ZHANG W F. Effects of exogenous nitric oxide on growth, antioxidant system and photosynthetic characteristics in seedling of cotton cultivar under chilling injury stress. Scientia Agricultura Sinica, 2012, 45(15): 3058-3067. (in Chinese)
[21] 王俊娟, 叶武威, 赵云雷, 樊保香, 宋丽艳, 张丽娜. 棉花芽期抗冷性鉴定方法及抗冷性机理的研究. 棉花学报, 2008, 20(6): 477-479. WANG J J, YE W W, ZHAO Y L, FAN B X, SONG L Y, ZHANG L N. Studies on identification way and mechanism of chilling resistance at bud bursting period in cotton. Cotton Science, 2008, 20(6): 477-479. (in Chinese)
[22] 李志博, 华显伟, 魏亦农, 曹连莆. 叶绿素荧光动力学O-J-I-P参数在棉花幼苗耐冷性评价上的应用, 棉花学报, 2010, 22(2): 132-137. LI Z B, HUA X W, WEI Y N, CAO L P. Cold tolerance evaluation of cotton seedling using some parameters of chlorophyll a fluorescence kenitics O-J-I-P. Cotton Science, 2010, 22(2): 132-137. (in Chinese)
[23] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 148-219. LI H S. Plant Physiology and Biochemistry Experimental Principles and Techniques. Beijing: Higher Education Press, 2000: 148-219. (in Chinese )
[24] 张南. 菠菜种质资源遗传多样性及耐寒性鉴定 [D]. 哈尔滨: 东北农业大学, 2007. ZHANG N. Study on the genetic diversity and the low temperature tolerance of spinach germplasm [D]. Harbin: Northeast Agricultural University, 2007. (in Chinese)
[25] 扈光辉. 玉米种质耐冷性鉴定及农艺性状遗传分析 [D]. 北京: 中国农业科学院, 2006. HU G H. Cold tolerance identification and genetic analysis of agronomic trait in maize germplasm [D]. Beijing: Chinese Academy of Agricultural Sciences, 2006. (in Chinese)
[26] 张艳梅, 王敬国, 刘化龙, 邹德堂. 东北粳稻不同生育期耐冷性分析. 东北农业大学学报, 2012, 43(4): 43-48. ZHANG Y M, WANG J G, LIU H L, ZOU D T. Analysis of japonica rice cold tolerance at different growing periods in Northeast area. Journal of Northeast Agricultural University, 2012, 43(4): 43-48. (in Chinese )
[27] 游俊梅, 阮仁超, 陈惠查, 杨玉顺, 金桃叶. 稻种资源耐冷性鉴定与评价指标分析. 贵州农业科学, 2000, 28(3): 34-36. YOU J M, RUAN R C, CHEN H C, YANG Y S, JIN T Y. Analysis and evaluation on cold tolerance for rice germplasm resources.Guizhou Agricultural Sciences, 2000, 28(3): 34-36. (in Chinese )
[28] 金铭路, 杨春刚, 余腾琼, 郭桂珍, 汤翠凤, 张俊国, 阿新祥, 曹桂兰, 徐福荣, 刘宪虎, 戴陆园, 张三元, 韩龙植. 中国水稻微核心种质不同生育时期耐冷性鉴定及其相关分析. 植物遗传资源学报, 2009, 10(4): 540-546. JIN M L, YANG C G, YU T Q, GUO G Z, TANG C F, ZHANG J G, A X X, CAO G L, XU F R, LIU X H, DAI L Y, ZHANG S Y, HAN L Z. Evaluation of cold tolerance at different growing period for mini core collection of rice (Oryza stiva L.) in China. Journal of Plant Genetic Resources, 2009, 10(4): 540-546. (in Chinese)
[29] OMRAN R G. Peroxide levels and the activities of catalase peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings. Plant Physiology, 1980, 65: 407-408.
[30] PRASAD T K, ANDERSON M D, MARTIN B A, STEWART C R. Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide. The Plant Cell, 1994, 6: 65-74.
[31] GECHEV T, WILLEKENS H, VAN MONTAGU M, INZÉ D, VAN CAMP W, TONEVA V, MINKOV I. Different responses of tobacco antioxidant enzymes to light and chilling stress. Journal of Plant Physiology, 2003, 160: 509-515.
[32] BOWLER C, VAN MONTAGU M, INZE D. Superoxide dismutase and stress tolerance. Annual Review of Plant Physiology and Plant Molecular Biology,1992, 43: 83-116.
[33] GUO Z, OU W, LU S, ZHONG Q. Differential responses of antioxidative system to chilling and drought in four rice cultivars differing in sensitivity. Plant Physiology and Biochemistry, 2006, 44: 828-836.
[34] 马迪, 岳桦. 大叶铁线莲对低温胁迫的响应. 北方园艺, 2010(6): 112-114. MA D, YUE H. Response on physiology and biochemistry of clematis heracleifolia under low temperature stress. Northern Horticulture, 2010(6): 112-114. (in Chinese)
(责任编辑 李莉)
Identification of the Chilling Resistance from Germination Stage to Seedling Stage in Upland Cotton
WANG Jun-juan, WANG De-long, YIN Zu-jun, WANG Shuai, FAN Wei-li, LU Xu-ke, MU Min, GUO Li-xue, YE Wu-wei, YU Shu-xun
(Institute of Cotton Research of Chinese Academy of Agricultural Sciences/State Key Laboratory of Cotton Biology/Key Laboratory for Cotton Genetic Improvement, Ministry of Agriculture, Anyang 455000, Henan)
【Objective】 Low-temperature is one of the main factors affecting the normal growth and development of cottonplants. Identification of chilling resistance of cotton is the prior condition for the mechanism of cold resistance, which also can provide certain theoretical
for cold resistance breeding. 【Method】 The temperature conditions for cotton cold resistance identification were screened at germination stage following 7 d recovery at normal conditions (28℃, day/night, 14 h/10 h) after 7 d treatment at different low temperatures of 0℃, 4℃, 10℃, 15℃ with 4 upland cotton varieties (lines) with different cold resistance levels. Screening of days of cold resistance identification for 0℃ low-temperature treatment at germination stage was performed by 7 d recovery after the respective treatments of 1, 2, 3, 4, 5, 6, and 7 d under 0℃ low temperature. Two upland cotton varieties (lines) with different cold resistance levels was treated for 1, 2, 3, 4, 5, 6, and 7 d under 4℃ low temperature and recovered 7 d in order to evaluate cold resistance of cotton at budding stage. Evaluation of cold resistance of cotton at cotyledon stage was carried out at 4℃for 24 h and normal growth was recovered for 7 d with 47 cotton varieties. The biochemical indexes of bud and cotyledon under low temperature were measured at budding and cotyledon stages with the reagent kit developed by Nanjing Jiancheng Bioengineering Institute. 【Result】 The study established the standards of identification of cold-resistance by screening the stress conditions at different growth periods, including germination stage, budding stage and cotyledon stage. The relative cotyledons unfolding rate under normal condition growth for 7 d after 0℃ treatment for 4 d can be served as a cold resistance identification index of germination stage. The relative cotyledons unfolding rate under normal condition growth for 7 d after 4℃ treatment for 5 d can be used as chilling resistance identification index of the budding stage. Chilling resistance index under normal condition growth for 7 d after 4℃ treatment for 24 h can be used for evaluating the chilling resistance of cotton at cotyledon stage. The activities of SOD and POD in the bud of cold-resistant variety Yu2067 were increased at the early stage of low-temperature treatment and then decreased to a steady, while the activities of two enzymes in the bud of chilling-sensitive cotton line Hengmian No.3 decreased at first and then increased to steady. The activity of CAT in the bud of two varieties all showed a uptrend at first and then downtrend, but the activity of CAT in Yu2067 was always higher than that in Hengmian No.3 at later stage of low-temperature treatment. Besides, the soluble protein contents in the bud of two varieties were similar at first, but the content in Yu2067 started to be higher than that in Hengmian No.3 at later stage of low-temperature treatment. After the treatment of 4℃ for 24 h at cotyledon stage, the activities of SOD, POD and CAT were all showed a down-trend in Yu2067 while they all went up in Hengmian3. But the soluble protein content in Yu2067 went up while declined in Hengmian No.3. 【Conclusion】 Specific identification ways are needed at different growth stages correspondingly. The standards of identification of cold-resistance levels at different stages are different. Different materials have different cold resistance at different growth stages. Based on the variation trends of enzyme activity of three enzymes, it was speculated that the cold-resistance of cotton at budding stage had relation with antioxidant enzymes activity, while the cold-resistance of cotton at cotyledon stage had little relation with three antioxidant enzyme activities, but may be closely with the soluble protein content.
Gossypium hirsutum L.; growth stages; cold resistance; identification ways; biochemical characteristics
2016-02-18;接受日期:2016-04-11
国家现代农业产业技术体系(CARS-18-02A)
联系方式:王俊娟,Tel:15093920872;E-mail:wjj2004liyuan@sina.com。通信作者喻树迅,Tel:0372-2562201;E-mail:ysx195311@163.com
