炭化苹果枝对苹果根区土壤细菌和真菌多样性的影响
2016-12-01李燕歌周春然宁留芳杨洪强
曹 辉,李燕歌,周春然,宁留芳,杨洪强
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
炭化苹果枝对苹果根区土壤细菌和真菌多样性的影响
曹 辉,李燕歌,周春然,宁留芳,杨洪强
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安 271018)
【目的】根区土壤微生物是影响根系环境的重要因素,炭化苹果枝是废弃果树枝条低氧高温热解产物,研究施用炭化苹果枝对苹果根区土壤细菌和真菌的群落结构及其多样性的影响,为炭化苹果枝的合理应用以及改善果园土壤生物学性状提供理论依据。【方法】在春季,将长势一致的2年生‘富士’苹果幼树(砧木为平邑甜茶)移栽到含有不同质量比(0—4%)炭化苹果枝的盆栽土壤中,于移栽120 d后采集土样,提取基因组DNA,通过PCR扩增建立文库,利用Miseq平台Illumina第二代高通量测序技术并结合相关生物信息学分析土壤细菌16S rRNA基因V3+V4区域和真菌ITS1区域的丰富度和多样性指数以及群落结构。【结果】从15个苹果根区土壤样本中获得16 656个细菌分类操作单元(OTU)和435个真菌OTU,其中,变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和酸杆菌门(Acidobacteria)是优势细菌,其相对丰度共占70.68%—72.80%;担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和接合菌门(Zygomycota)是优势真菌,其相对丰度共占68.00%—75.14%。群落物种丰富度指数(Chao指数和Ace指数)分析显示,1%炭化苹果枝增加了细菌的群落丰富度,其Chao指数提高了15.42%,Ace指数提高3.89%;0.5%炭化苹果枝增加了真菌的群落丰富度,其Chao指数提高了2.80%,Ace指数提高了3.61%。群落多样性指数(Shannon指数和Simpson指数)分析表明,0.5%—4%炭化苹果枝降低了土壤细菌的多样性,增加了土壤真菌的多样性;其中,细菌群落多样性Shannon指数在炭化苹果枝用量为1%时最低,真菌Shannon指数在炭化苹果枝用量为0.5%时最高。1%、2%和4%的炭化苹果枝均不同程度地降低了根区土壤变形菌门、酸杆菌门和担子菌门的相对丰度,提高了拟杆菌门和接合菌门的相对丰度;真菌担子菌门中的锈革孔菌科(Hymenochaetaceae)的相对丰度最大(数值在31.99%—46.74%),施用1%、2%和4%的炭化苹果枝可使其降低。0.5%—4%的炭化苹果枝能增加不同处理所独有的细菌OTU数目,改变细菌类群组成,其中独有的细菌OTU数目是共有OTU数目的1—3倍,但对真菌类群组成没有明显影响。【结论】施用0.5%—4%(w/w)炭化苹果枝明显改变苹果根区土壤细菌和真菌的丰富度和多样性,增加各用量下所特有的细菌物种,其中1%的炭化苹果枝明显提高根区土壤细菌的丰富度。
炭化苹果枝;根区土壤;Illumina高通量测序;细菌;真菌
0 引言
【研究意义】微生物是构成土壤肥力的重要因素,但由于氮素化肥的大量施用,导致果园土壤氮素含量偏高,有机质(有机碳)含量偏低,致使土壤微生物结构恶化,土壤肥力普遍下降,严重威胁果树生产的可持续发展,因此,迫切需要通过增碳减氮等措施改善微生物群落结构,提高土壤质量。【前人研究进展】有机物料经过高温炭化后施入土壤,不仅促进废弃物的资源化利用,还具有给土壤增碳和促进植物生长的作用。闫丽娟等[1]报道炭化苹果枝施入土壤可促进平邑甜茶叶片的光合作用、根系发育和植株生长。有机物料高温炭化产物是生物炭,生物炭作为一种土壤改良剂在农林和环境等领域具有重要应用价值[2]。大量研究发现,向土壤中添加生物炭,可改善土壤结构[3],干扰土壤硝酸盐代谢[4],提高土壤pH、电导率(EC)、阳离子交换量[5]、养分持留能力、保水能力等[6],并因此能够为土壤微生物栖息提供良好的“微环境”[7]。土壤微生物不仅是土壤的重要组成部分,更是土壤养分循环的主要推动者,其在土壤有机物质分解、养分释放、能量转移等生物地化循环中起着重要作用[8]。生物炭具有众多孔隙和巨大比表面积,还有碳、磷和钼等多种营养元素,这不仅可有效吸附微生物,还能为微生物提供所需营养物质和优越的栖息地[9]。LEHMANN等[10]认为生物炭通过为土壤细菌提供更多碳源及改善土壤细菌生存环境条件而促进了细菌的生长和繁衍。土壤微生物特别是细菌对自然或人为活动引起的环境变化十分敏感,曾有人把细菌群落作为评估土壤环境变化的指示性标志[11]。SOLAIMAN等[12]发现腐生菌因其丰富的菌丝和高活性胞外酶而便于在生物炭中生长,而生物炭对腐生菌也起保护作用,它能促进真菌与根系共生以及真菌菌根的生长;WARNOCK等[13]研究发现生物炭和菌根真菌互生能影响微生物菌群,适量菌根真菌和生物炭添加还能改善植物养分吸收及缓解盐胁迫[14]。物种多样性是分析土壤微生物状况的重要参数,常采用群落丰富度指数(Chao和Ace)和群落多样性指数(Shannon和Simpson)等反映[15]。在土壤微生物多样性研究中,前人主要采用琼脂培养基培养方法、Biolog平板法、磷脂脂肪酸和核酸分析法等来分析微生物,但对不可培养的微生物无能为力,试验中还会受到主观因素、操作繁琐、数据量小等难题的困扰[8]。而高通量测序可通过检测土壤微生物细胞内特定遗传物质(原核微生物16s rDNA/rRNA、真核微生物18s rDNA/rRNA)的碱基序列,经过对这些序列的对比分析,可探究并揭示土壤微生物物种和群落结构的多样性[16]。【本研究切入点】近年来高通量测序技术的不断发展,其无需培养、能够客观还原菌群结构和数据量大等优点为深入分析微生物种类及其多样性提供了可能[17]。此外,尽管生物炭可改善土壤微生物群落结构,但是其效果常因生物炭的制备材料等不同而存在很大差异[18-19];炭化苹果枝是一种不同于以稻壳、秸秆等为材料制备的生物炭,其对土壤细菌和真菌多样性的影响目前还不清楚。【拟解决的关键问题】本研究以冬季修剪下来的苹果枝为原料,通过高温低氧处理后施入土壤,采用高通量测序技术,探讨炭化苹果枝对苹果根区土壤细菌、真菌多样性的影响,揭示根区土壤微生物菌落结构在施用炭化苹果枝后的变化,以期为炭化苹果枝的合理应用以及改善果园土壤生物学性状提供理论依据。
1 材料与方法
试验于2014年3—11月在山东农业大学园艺试验站和山东省高校果树生物学重点实验室进行。
1.1 试验材料
供试植株为长势一致的2年生盆栽红富士苹果幼树,砧木为平邑甜茶;盆栽土壤由壤土、兔粪、沙按照3∶1∶1(v/v/v)比例均匀混合而成,土壤基本理化指标:容重1.45 g·cm-3、pH 7.1、速效磷32.9 mg·kg-1、碱解氮26.6 mg·kg-1、速效钾102.5 mg·kg-1、有机质12.41 g·kg-1。炭化苹果枝是将冬季修剪下来的苹果枝条粉碎后用高温炭化炉在700℃下低氧活化2 h制得;采用JSM-5610LV型扫描电镜,先将炭化苹果枝放入镀膜机内镀膜,之后将其放入载物台并用导电胶将其固定后装入机箱进行照片采集,其超微结构见图1、理化性质见表1。
1.2 试验设计
2014年4月8日将盆栽苹果盆土倒出,分别与质量比(w/w)0(CK)、0.5%、1.0%、2.0%、4.0%炭化苹果枝混匀后装盆、栽树,使树根在盆中均匀分布。每个炭化苹果枝用量为一个处理,每处理重复3次。处理120 d后开始取样,每盆采集3点混合土样,用直径2 cm不锈钢土钻钻取0—20 cm深度土壤,去除根系、杂草、土壤动物和石块等杂质,混匀后分成2份,一份于-20℃冷冻保存用于土壤微生物分析,一份放进4℃冰箱备测。
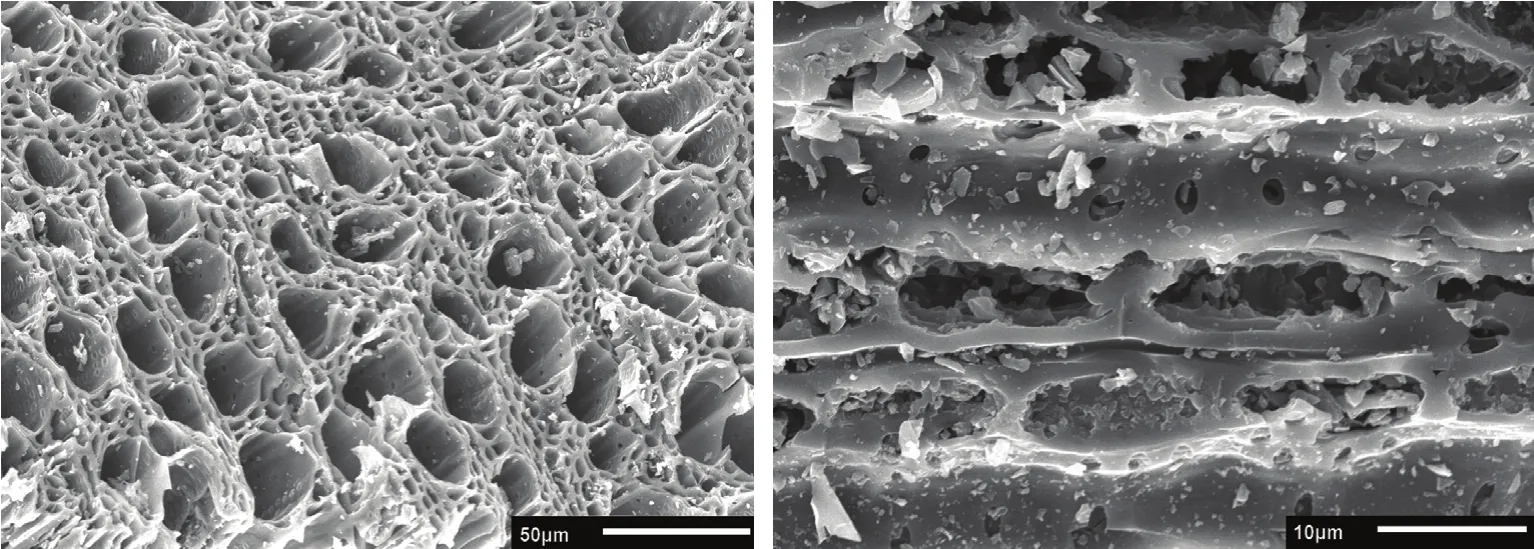
图1 炭化苹果枝横、纵径电镜扫描Fig. 1 SEM figure of carbonized apple branches
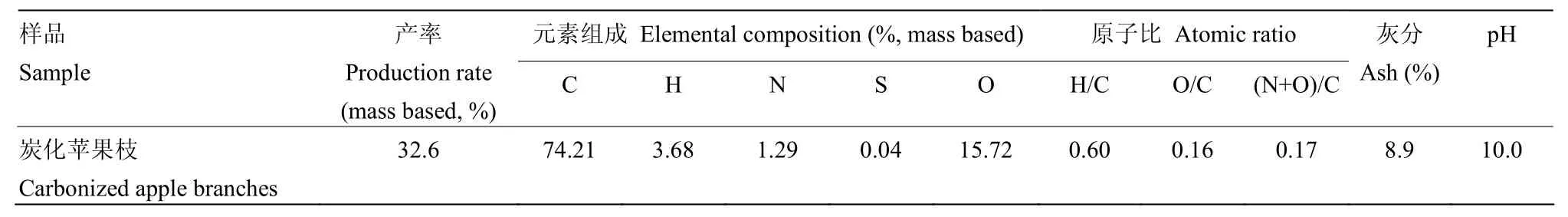
表1 炭化苹果枝的化学特性Table 1 Chemical characteristics of carbonized apple branches used in this study
1.3 试验方法
1.3.1 土壤微生物基因组DNA的提取 采用E.Z.N.A.®Soil DNA Kit(OMEGA,美国)的试剂盒方法,称取0.5 g于-20℃保存的土壤样品,按试剂盒的试验步骤进行土壤微生物总DNA的提取,DNA样品于-20℃冰箱保存待用。
1.3.2 试验流程 提取样品总DNA后,根据设计得到细菌V3+V4(F:5′-ARACTYCTACGGRAGGCW G-3′;R:5′-GACTACNVGGGTATCTAATCC-3′)和真菌ITS1(F:5′-AACCTGCGGAAGGATCATT-3′;R:5′-GARCCAAGAGATCCRTTG-3′)合成的引物,合并引物接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库用Illumina MiSeq PE300进行测序,由北京百迈客生物科技有限公司完成测序。
1.3.3 信息分析流程 对原始测序序列进行质量评估,拼接双端Reads并过滤得到优化序列,用于后续生物信息学的分析。将优化序列进行物种注释并聚类得到OTU(Operational Taxonomic Units,操作分类单元),根据OTU的序列组成得到其物种分类。基于OTU聚类分析结果,对样品的多样性及组间差异性进行分析,并结合物种分类信息,在各个分类水平上进行分类学分析(图2)。
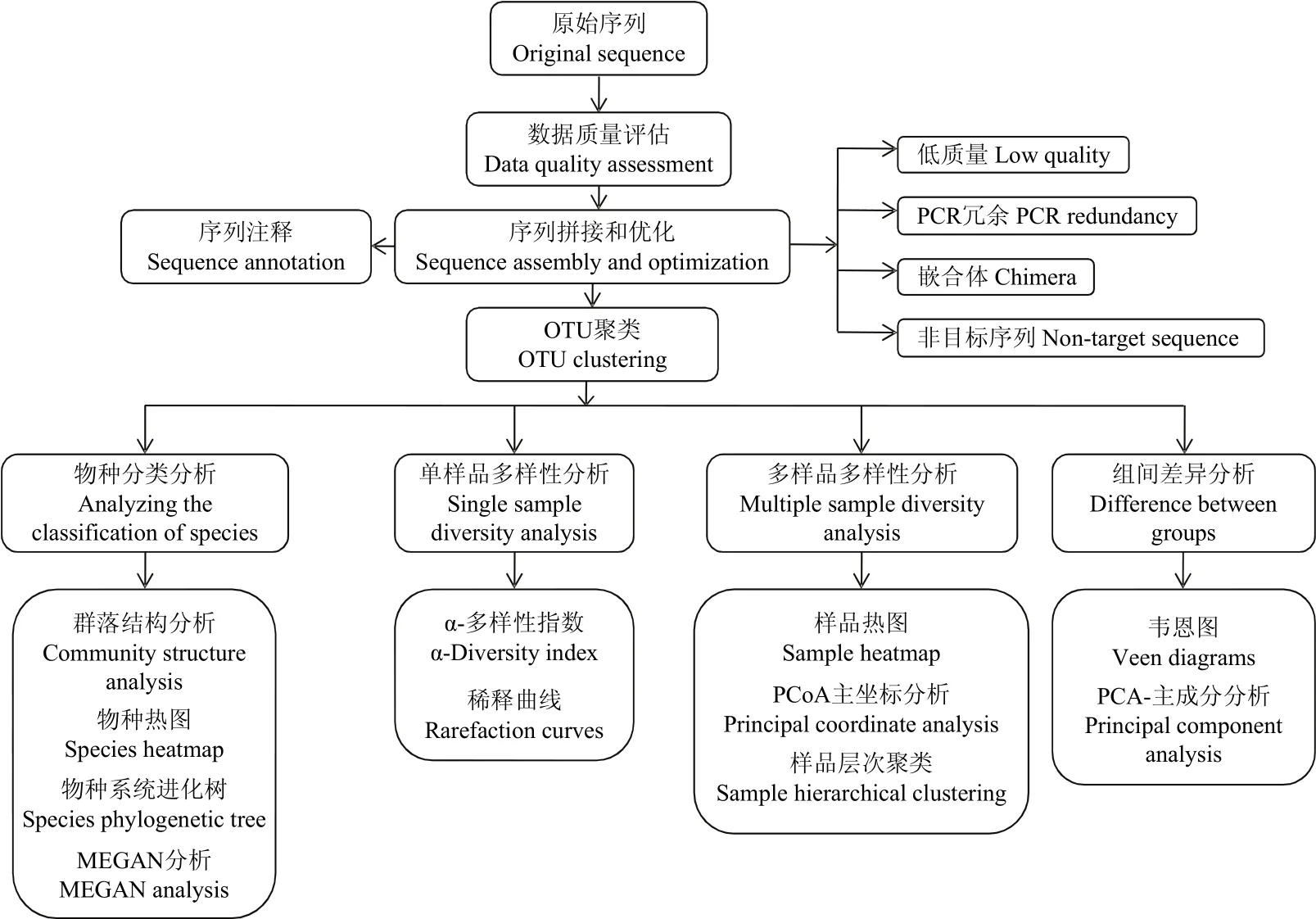
图2 微生物多样性生物信息分析流程图Fig. 2 Bioinformatics analysis of microbial diversity process
1.4 生物信息分析方法
1.4.1 数据过滤及质量评估 测序得到的原始序列(Sequenced reads)里含有带接头的、低质量的reads,为了保证信息分析质量,需要对原始测序序列进行过滤,得到高质量的reads,用于后续信息分析。数据过滤的主要步骤[20]如下:(1)去除带接头的reads;(2)若一条reads上N(未能确定出具体的碱基类型)的比例大于5%,则过滤掉该双端reads;(3)去除低质量reads。
1.4.2 序列优化 利用Mothur软件(version 1.34.4,http://www.mothur.org/),进行序列优化,主要步骤[21]如下:(1)对序列进行筛选,去除模糊碱基数大于0、单碱基高重复区大于8、重叠区错配数大于0及长度大于97.5%的序列(细菌)、重叠区长小于20 bp的序列(真菌);(2)进行去冗余处理。
1.4.3 OTU聚类分析 OTU即操作分类单元,是在系统发生学研究或群体遗传学研究中,为了便于进行分析,人为给某一个分类单元(品系、种、属、分组等)设置的同一标志。一般情况下,如果序列之间的相似性高于97%就可以把它定义为一个OTU,每个OTU对应于一种不同的序列[22]。可根据不同的相似度水平,对所有序列进行OTU划分,通常在97%的相似水平下对OTU进行生物信息统计分析。利用Mothur软件以平均邻近聚类算法(Average Neighbor Clustering Algorithm)在0.03(或97%的相似度)水平下进行OTU的聚类,并统计获得OTU的个数。
1.4.4 丰富度指数和多样性指数计算 选取Chao和Ace指数反映微生物丰富度,用Simpson和Shannon指数反映微生物多样性[23-24]。
Chao指数:是用Chao1算法估计样品中所含的OTU数目的指数,Chao1在生态学中常用来估计物种总数。计算公式:
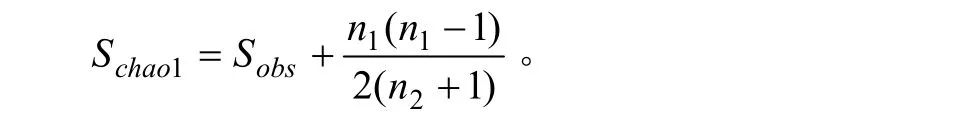
式中,Schao1=估计的OTU数;Sobs=实际观测到的OTU数;n1=只含有一条序列OTU数目;n2=只含有两条序列的OTU数目。
Ace指数:用来估计群落中含有OTU数目的指数,由Chao提出,是生态学中估计物种总数的常用指数之一,与Chao1的算法不同。计算公式:
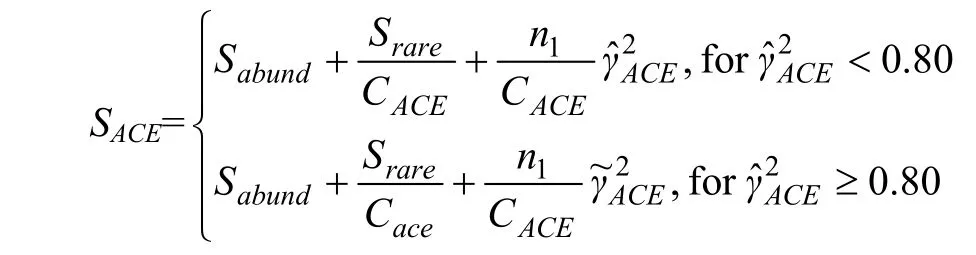
式中,ni=含有i条序列的OTU数;Srare=低于阈值的OTU数;Sabund=超过阈值的OTU数;abund=含有丰富OTU数的阈值。
Simpson指数:用来估计样品中微生物多样性指数之一,在生态学中常用来定量描述一个区域的多样性。Simpson指数越大,说明群落多样性越低。
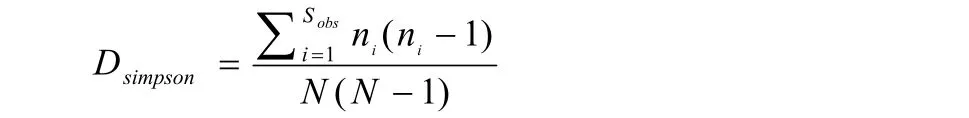
式中,Sobs=实际观测到的OTU数;ni=含有i条序列的OTU数;N=所有的序列数。
Shannon指数:用来估算样品中微生物多样性指数之一,它与Simpson多样性指数常用于反映alpha多样性指数,Shannon值越大,说明群落多样性越高。式中,Sobs=实际观测到的OTU数;ni=含有i条序列的OTU数;N=所有的序列数。
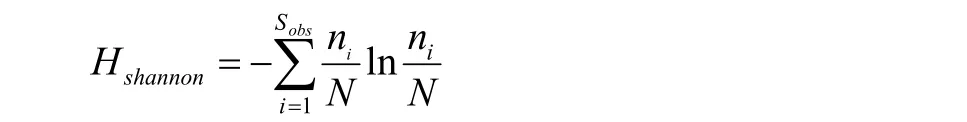
1.5 数据分析
随机选取相似度在97%条件下的OTU生成稀释曲线,并利用软件Mothur计算丰富度指数Chao和ACE,多样性指数Simpson和Shannon。基于RDP和UNITE分类学数据库对OTU进行物种注释,并用Excel和SPSS进行数据处理,利用Excel和R语言工具对样品物种组成及相对丰度统计结果绘制柱状图和Veen图。
2 结果
2.1 土壤样品测序深度评估
Illumina第二代高通量测序结果显示,15个土壤细菌样品测序、过滤后共获得482 Mb数据量,双端reads拼接后共产生892 071条Raw Tags,序列优化后共得到78 237条Clean Tags,聚类一共获得16 656个OTU;15个土壤真菌样品测序、过滤后共获得1Gb数据量,双端reads拼接后共产生2 049 567条Raw Tags,序列优化后共得到1 103 018条Clean Tags,聚类一共获得435个OTU。
参照文献[25]随机抽取测序序列,将抽到的序列数与它们所能代表OTU的数目构建曲线,在97%相似性水平下聚类OTU并制作各样品的稀释曲线图(图3),由图可知,细菌和真菌曲线逐渐趋向平坦,说明测序数量合理。
2.2 炭化苹果枝对根区土壤细菌和真菌群落丰富度和多样性的影响
Ace和Chao指数可反映群落物种丰富度,由表2可知,土壤细菌Ace和Chao指数在施用1%(w/w)炭化苹果枝后增加,增加幅度分别为15.42%和3.89%;在施用0.5%、2%和4%后降低,其中,Ace指数分别降低52.12%、10.87%和44.67%,Chao指数分别降低48.69%、18.54%和41.55%。真菌的Ace和Chao指数在施用0.5%炭化苹果枝后分别增加,增加幅度分别为2.80%和3.61%;在施用1%、2%和4%炭化苹果枝后降低。其中,Ace指数分别降低0.36%、0.75%和0.26%,Chao指数分别降低0.21%、1.80%和1.95%。显示土壤细菌和真菌群落物种丰富度的变化因炭化苹果枝的用量而有较大差异,施用1%(w/w)炭化苹果枝可增加土壤细菌群落丰富度、0.5%的炭化苹果枝则增加土壤真菌群落丰富度,施用2%和4%炭化苹果枝均降低细菌和真菌的群落丰富度。
表2数据显示,施用0.5%、1%、2%和4%炭化苹果枝后,土壤细菌Shannon指数均有所下降,下降幅度分别为2.90%、4.01%、0.14%和3.18%,在1%的用量时细菌Shannon指数最低;土壤真菌Shannon指数在施用0.5%、1%、2%和4%炭化苹果枝后均有所提高,提高幅度分别为14.69%、3.13%、10.31%和7.81%,在0.5%的用量下真菌Shannon指数最高;Simpson指数的变化与之相反。可见,向土壤中添加0.5%—4%的炭化苹果枝降低土壤细菌多样性而提高真菌多样性。
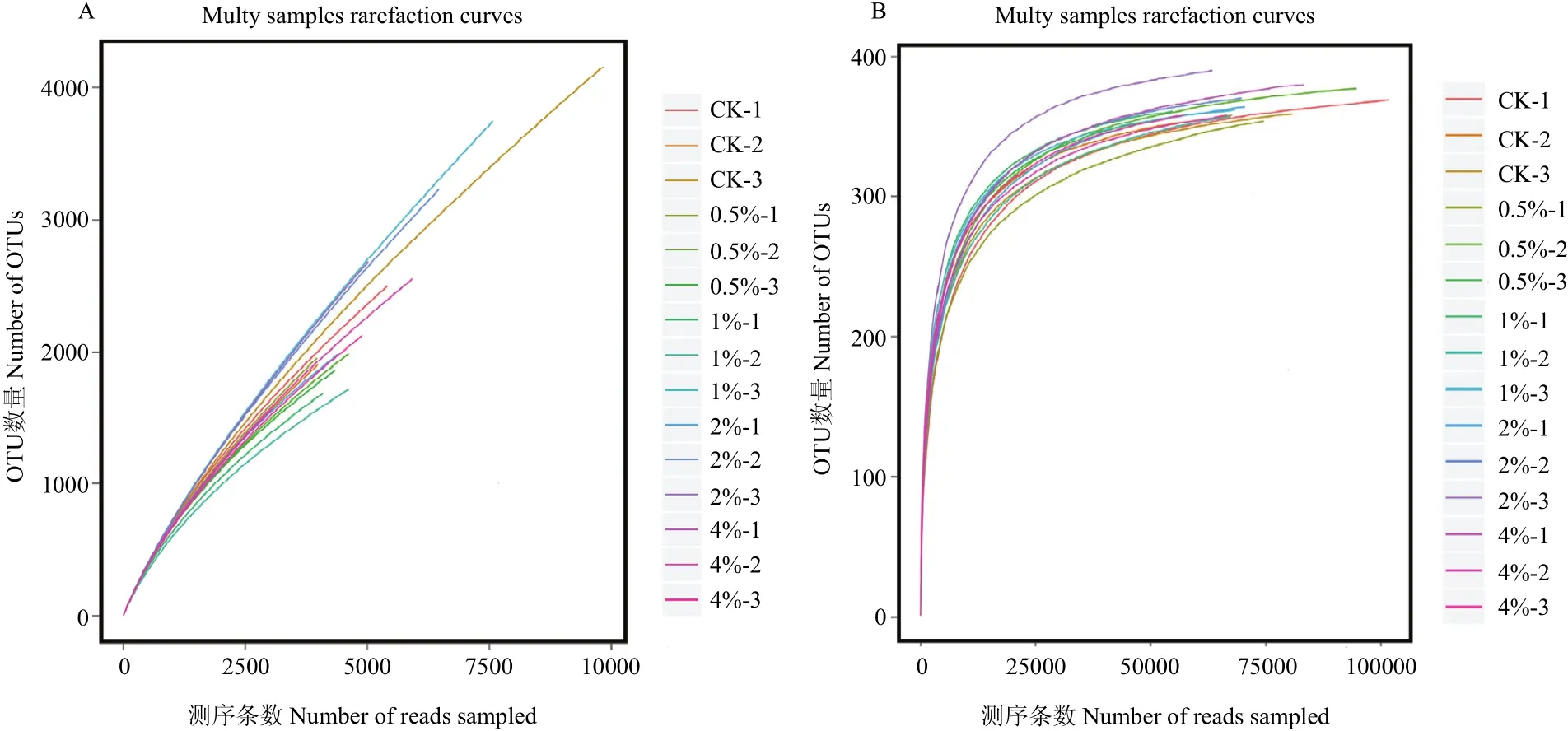
图3 土壤样品细菌(A)、真菌(B)多样品稀释曲线Fig. 3 Bacterial (A) and fungal (B) rarefaction curves of different soil samples
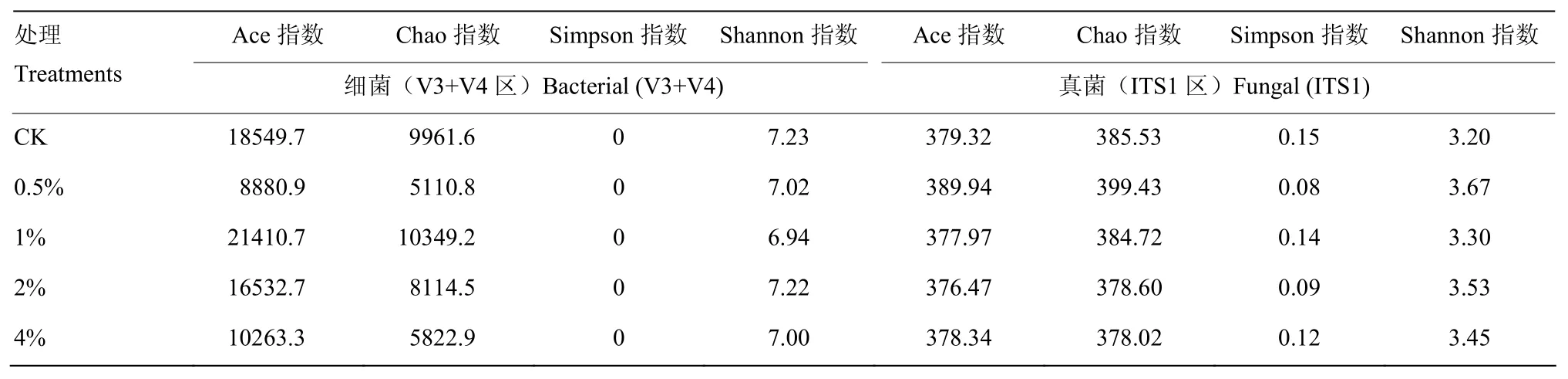
表2 炭化苹果枝处理下根区土壤样本群落丰富度和多样性指数Table 2 OTUs’ abundance and diversity of root-zone soil samples with carbonized apple branches applied
2.3 炭化苹果枝对根区土壤细菌和真菌相对丰度的影响
图4为根区土壤细菌和真菌在不同分类水平上的物种柱状图。由图4-A可知,苹果根区土壤样品中的细菌包含变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)等菌群,各处理间细菌群落组成相似;除了未确定种属的其他菌类,变形菌门、拟杆菌门、酸杆菌门的相对丰度最高,分别为39.59%—44.03%、13.38%—18.50%和11.85%—15.39%,属于优势细菌,它们的相对丰度合计为70.68%—72.80%。
图4-A还显示,施用0.5%、1%、2%和4%炭化苹果枝能不同程度的降低根区土壤变形菌门和酸杆菌门的相对丰度,提高了拟杆菌门的相对丰度,其中,0.5%、1%、2%和4%炭化苹果枝使变形菌门的相对丰度分别比对照降低10.08%、5.56%、2.43%和5.93%,使拟杆菌门的相对丰度分别比对照提高了21.08%、26.01%、28.03%和38.27%,使酸杆菌门的相对丰度分别比对照降低了3.25%、12.61%、23.00%、20.60%。0.5%和1%炭化苹果枝使放线菌门相对丰度分别提高17.96%和1.48%;2%和4%炭化苹果枝则使放线菌门相对丰度分别降低24.55%和19.60%。
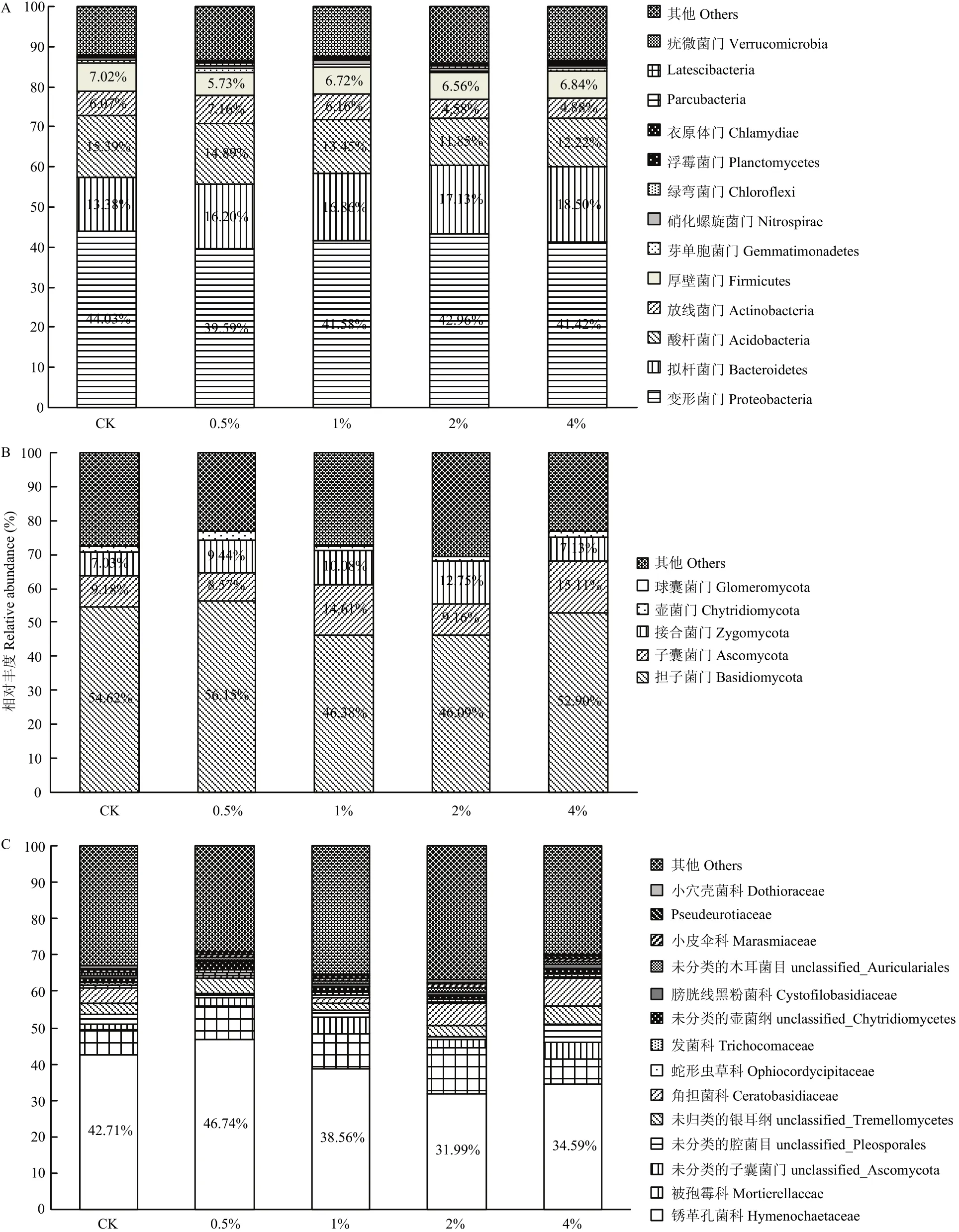
图4 炭化苹果枝处理下土壤样品细菌门水平(A)、真菌门(B)和科(C)水平相对丰度变化Fig. 4 Changes in relative abundance of soil bacterial species at phylum level (A) and fungal species at phylum (B) and family (C) levels with carbonized apple branches applied
图4-B显示,苹果根区土壤样品中的真菌包含担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)等,除了未确定种属的其他菌类,担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、接合菌门(Zygomycota)相对丰度最高,分别为46.09%—56.15%、8.57%—15.11%和7.03%—12.75%,属于优势细菌,它们的相对丰度合计为68.00%—75.14%。
图4-B还显示,施用1%、2%和4%的炭化苹果枝降低了担子菌门的相对丰度(分别比对照降低15.09%、15.62%和3.15%),施用0.5%和2%炭化苹果枝降低了子囊菌门的相对丰度(比对照降低6.64%和0.22%),而施用1%和4%炭化苹果枝使子囊菌门的相对丰度分别提高了59.15%和64.60%。0.5%、1%、2%和4%炭化苹果枝增加了接合菌门的相对丰度,分别增加了34.28%、43.39%、81.37%和1.42%。
图4-C显示,根区土壤真菌在科水平上,除了未确定科类外,担子菌门中的锈革孔菌科(Hymenochaetaceae)的相对丰度在各处理中均最大(数值在31.99%—46.74%)。施入不同用量炭化苹果枝可引发土壤真菌在不同分类水平上相对丰度的差异性变化,其中施用0.5%炭化苹果枝提高了锈革孔菌科相对丰度(比对照提高9.44%),而1%、2%和4%炭化苹果枝使锈革孔菌科相对丰度比对照分别降低了9.72%、25.10%和19.01%。
可见,变形菌门、拟杆菌门和酸杆菌门是根区土壤的优势细菌,担子菌门、子囊菌门和接合菌门是根区土壤的优势真菌,锈革孔菌科是相对丰度最大的土壤担子菌;施入1%、2%和4%的炭化苹果枝均可不同程度地降低根区土壤变形菌门、酸杆菌门和担子菌门以及担子菌门中的锈革孔菌科的相对丰度,提高了拟杆菌门和接合菌门的相对丰度。
2.4 炭化苹果枝处理后根区土壤细菌、真菌类群分析
在97%的相似度下,得到了每个样品的OTU个数,如表3所示,0、0.5%、1%、2%和4%炭化苹果枝处理后分别获得6 374、4 093、5 378、10 598和4 476个细菌OTU,以及422、421、419、423和426个真菌OTU。
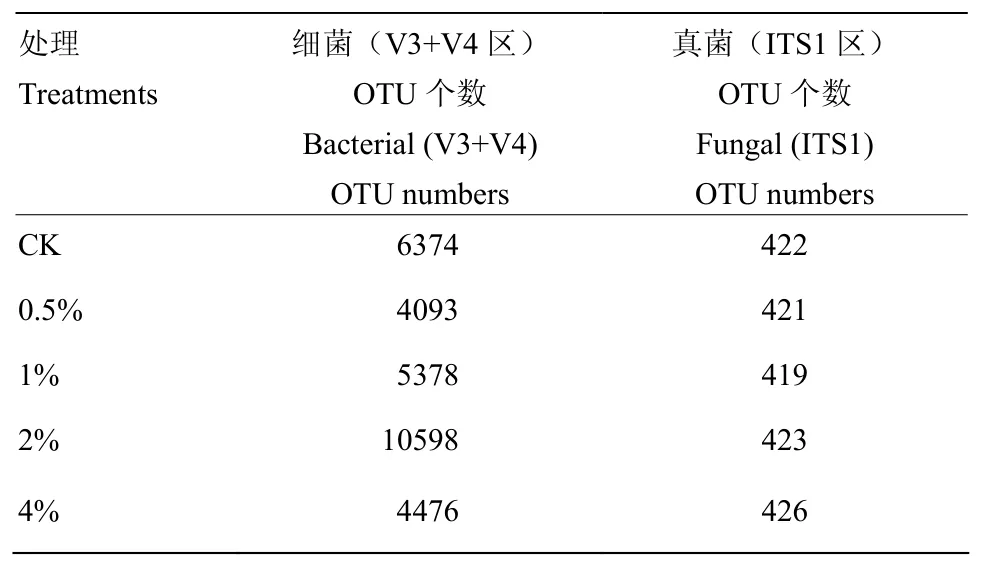
表3 苹果根区土壤样本测序获得的细菌、真菌OTU序列读数Table 3 Reads of observed soil bacterial and fungal OTUs
Venn图能够反映组间或样品之间共有和特有OTU数目,能够直观地表现出组间或样品间OTU的重叠情况[26]。结合OTU所代表的物种,可以找出不同环境中的核心微生物。从图5-A中可以看出,不同处理之间共有的细菌OTU数目为1 192个,代表的物种分别属于α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、酸杆菌纲-Gp6(Acidobacteria_Gp6)、γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、放线菌纲(Actinobacteria)、拟杆菌纲(Bacteroidetes)等。未施用炭化苹果枝(CK)的根区土壤不含有其独有的细菌OTU,而施用不同量的炭化苹果枝后,各用量下所独有的细菌OTU数目是共有OTU数目的1—3倍,说明施用炭化苹果枝能引起土壤细菌特异性变化,在根区土壤能够增加该处理所特有细菌物种,但增加的物种,因用量而不同,其中0.5%的用量增加了柔膜菌纲(Mollicutes)、Spartobacteria等特有物种,1%的用量增加了迷踪菌纲(Elusimicrobia)、装甲菌纲(Armatimonadia)等特有物种,2%的用量增加了疣微菌纲(Verrucomicrobiae)、Chthonomonadetes等特有物种,4%的用量增加了Ignavibacteria等特有物种。
从图5-B中可以看出,各处理之间共有的真菌OTU数目为391个,主要共有物种分别属于伞菌纲(Agaricomycetes)、座囊菌纲(Dothideomycetes)、银耳纲(Tremellomycetes)、子囊菌纲(Ascomycota)、粪壳菌纲(Sordariomycetes)、散囊菌纲(Eurotiomycetes)、壶菌纲(Chytridiomycetes)、球囊菌纲(Glomeromycetes)、圆盘菌纲(Orbiliomycetes)等。不同处理之间没有各自独有的真菌OTU,说明施用不同用量的炭化苹果枝对土壤真菌类群组成没有明显影响。
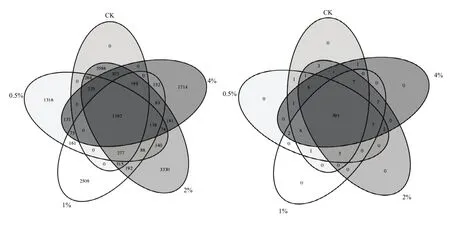
图5 炭化苹果枝处理后根区土壤细菌(A)、真菌(B)Venn图Fig. 5 Venn diagrams of soil bacterial (A) and fungal (B) community with carbonized apple branches applied
可见,土壤施入0.5%—4%的炭化苹果枝能增加苹果根区土壤中独有的细菌OTU数目,改变细菌类群组成,但对真菌类群组成没有明显影响。
3 讨论
生物炭施入土壤通过改变土壤理化性质而直接或间接影响土壤微生物。本研究发现施入1%炭化苹果枝提高了细菌丰富度指数,施入0.5%、2%和4%时则降低了该指数(表2),说明不同用量炭化苹果枝对土壤中细菌丰富度的影响不同,较低(0.5%)和较高(2%和4%)用量都不利于细菌物种数量的增加。生物炭的孔径、挥发物及灰分的组成与含量等都会影响细菌在土壤中的繁衍和生存状态[13],PIETIKÄINEN等[27]认为细菌能够被吸附到生物炭的表面,使它们不易受土壤淋洗的影响,从而增加了土壤中细菌的数量;但由于生物炭的来源和热解条件的不同,它们会因土壤类型和生物炭用量等因素的差异而对微生物种群和数量产生不同的影响[18-19]。不同用量的生物炭施入土壤,土壤的结构和理化性状也会发生不同改变,这种改变并不与用量呈现简单的线性关系[6,28],因此,细菌物种丰富度也不会因生物炭用量的逐渐增加呈简单的线性变化。比如,炭化苹果枝比土壤轻,施入土壤后会使土壤容重下降,这样土壤氧气含量会因炭化苹果枝用量的增加而逐渐提高,土壤细菌既有厌氧类群,也有好氧类群,它们各自的丰富度会因土壤容重的减小而互有升降;炭化苹果枝pH为碱性,随着施用量的增加,土壤微区pH会随之增加,这样对pH要求不同的细菌的丰富度也会互有升降。因此,施入不同量的炭化苹果枝后整个细菌类群丰富度的变化会很复杂,要揭示细菌丰富度与炭化苹果枝用量之间更细致的关系,还有待将土壤细菌分类由门具体到科、属、种甚至小种的层面。真菌物种丰富度随炭化苹果枝用量的变化也存在类似的问题,不过,有报道指出在土壤pH较高时,真菌丰度会降低[29],高用量的炭化苹果枝会提高土壤微区pH,因此当用量提高到1%以上时会降低土壤真菌物种的丰富度。
本研究发现施用1%炭化苹果枝增加了细菌物种丰富度,但降低了细菌物种多样性;施用1%、2%和4%炭化苹果枝降低了真菌物种丰富度,却增加真菌物种多样性,这主要是因为微生物的多样性由物种丰富度和均匀度共同决定,它与物种丰富度的关系会因丰富度和均匀度二者所占比重而不同[30]。施用炭化苹果枝一方面促进某些微生物生长,同时也会抑制某类微生物生长,使微生物群落结构发生变化,导致物种均匀度改变,并进而影响微生物多样性与物种丰富度的关系。炭化苹果枝像其他生物炭一样可吸附微生物,改变微生物生长环境等[31],这必然会引起微生物数量差异或是群落结构的变化,影响群落的物种均匀度和丰富度,并进而导致多样性指数的变化(表2、图4)。
基于RDP分类学数据库和UNITE分类学数据库的分析显示,在苹果根区土壤中,变形菌门、拟杆菌门和酸杆菌门等是主要细菌类群,担子菌门、子囊菌门、接合菌门等是主要真菌类群(图4),这与前人对土壤微生物群落的研究结果一致[32]。0.5%—4%炭化苹果枝能不同程度的降低变形菌门和酸杆菌门的相对丰度,提高拟杆菌门的相对丰度。变形菌门是细菌中最大的一类,所试样品中的变形菌主要有α-变形菌、β-变形菌、γ-变形菌、δ-变形菌等,多样性很高,数量也很大,属于苹果根区土壤中的优势细菌。酸杆菌门大多都是嗜酸菌,其丰富度与土壤pH呈显著的负相关,在土壤pH较低的环境中酸杆菌丰度最高[33],因此,炭化苹果枝可通过提高土壤微区pH而降低酸杆菌门的相对丰度。拟杆菌门的细菌与DNA、蛋白质和脂类等有机物质的转换紧密相关,这些有机物质的吸收和利用是碳循环的重要组成部分[34],炭化苹果枝作为一种碳源,施入土壤有利于提高土壤拟杆菌门的相对丰度。不同用量炭化苹果枝能引起真菌群落差异性变化(图4-B),其中,0.5%—4%炭化苹果枝能不同程度提高接合菌门的相对丰度,这种不一致的变化可能是由于炭化苹果枝本身有效碳的缺乏抑制了某些真菌的定殖,而表面吸附的溶解性有机碳可以选择性地被接合菌门利用[19]。大多数的病原菌来自于真菌,本研究显示1%—4%炭化苹果枝能降低真菌担子菌门锈革孔菌科的相对丰度,而锈革孔菌科包含了很多与林木病有关的真菌[35],其相对丰度的降低会在一定程度上减少植株受病菌侵害的几率。
土壤细菌和真菌相对丰度的变化也可改变土壤微生物类群组成。本研究发现添加0.5%—4%炭化苹果枝能增加苹果根区土壤中独有的细菌OTU数目,增加细菌特有物种,进而改变了细菌类群组成,但对真菌类群组成没有明显影响(图5),这主要在于炭化苹果枝会像其他生物炭一样能影响土壤理化性质和生物学特性,能够为微生物创造特定的微环境[19],不同类群的微生物(比如真菌和细菌)对最适环境的要求不会完全一样,炭化苹果枝对不同菌群生存和繁衍的影响也不可能完全一样。微生物对外界环境非常敏感,土壤环境的微小变动就会引起微生物多样性的变化[11],土壤施入不同量炭化苹果枝会使土壤环境发生不同程度的改变,这必然会引起微生物多样性的差异性变化(表2)。通常认为熟化程度高、肥力好的土壤微生物数量以及细菌所占的比例均较高,干旱和贫瘠土壤中的真菌和放线菌所占比例较高[36],本研究发现,施用0.5%—4%的炭化苹果枝使各用量下所特有的细菌物种增多(图5),2%和4%的炭化苹果枝降低真菌群落丰富度(表2)以及放线菌门的相对丰度(图4-A)等,这些变化应该有利于土壤肥力状况的改善,具体有待进一步研究。
本研究还发现苹果根区土壤细菌和真菌中还有很多未分类或是未确定种属的物种,它们也受到炭化苹果枝的影响,但其功能和特点尚不清楚,还有待通过深度测序或利用其他先进手段对微生物进行更细致地分类研究,并结合土壤的相关指标进行深入探索。
4 结论
高通量测序技术在苹果根区土壤微生物研究中具有极大优势和可行性,施用0.5%—4%(w/w)炭化苹果枝明显改变苹果根区土壤细菌和真菌的丰富度和多样性,增加各用量下所特有细菌物种。炭化苹果枝对土壤微生物的影响因施用剂量而呈现不同的变化趋势,其中,1%的炭化苹果枝明显提高根区土壤细菌的丰富度,2%和4%的炭化苹果枝降低真菌群落丰富度。施用适量炭化苹果枝可改变微生物群落结构,将有利于改善土壤生物学性状。
[1] 闫丽娟, 杨洪强, 苏倩, 门秀巾, 张玮玮. 施用炭化苹果枝粉末对平邑甜茶生长及根系构型的影响. 园艺学报, 2014, 41(7): 1436-1442. YAN L J, YANG H Q, SU Q, MEN X J, Zhang W W. Effects of carbonized powder of apple branch on the growth and root architecture of Malus hupehensis. Acta Horticulturae Sinica, 2014, 41(7): 1436-1442. (in Chinese)
[2] RAJAPAKSHA A U, CHEN S S, TSANG D C, ZHANG M, VITHANAGE M, MANDAL S, GAO B, BOLAN N S, OK Y S. Engineered/designer biochar for contaminant removal/immobilization from soil and water: Potential and implication of biochar modification. Chemosphere, 2016, 148: 276-291.
[3] LEHMANN J, RILLIG M C,THIES J, MASIELLO C A, HOCKADAY W C, CROWLEY D. Biochar effects on soil biota-A review. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836.
[4] 闫丽娟, 杨洪强, 苏倩, 门秀巾, 张玮玮. 炭化秸秆对苹果根系一氧化氮生成及根区土壤硝酸盐代谢的影响. 中国农业科学, 2014, 47(19): 3850-3856. YAN L J, YANG H Q, SU Q, MEN X J, ZHANG W W. Effects of carbonized straw on the nitric oxide formation and nitrate metabolism in apple roots and its root zone soil. Scientia Agricultura Sinica, 2014, 47(19): 3850-3856. (in Chinese)
[5] JANUS A, PELFRÊNE A, HEYMANS S, DEBOFFE C, DOUAY F, WATERLOT C. Elaboration, characteristics and advantages of biochars for the management of contaminated soils with a specific overview on Miscanthus biochars. Journal of Environmental Management, 2015, 162: 275-289.
[6] MOLNÁR M, VASZITA E, FARKAS É, UJACZKI É, FEKETEKERTÉSZ I, TOLNER M, KLEBERCZ O, KIRCHKESZNER C, GRUIZ K, UZINGER N, FEIGL V. Acidic sandy soil improvement with biochar: A microcosm study. Science of the Total Environment, 2016, 563/564: 855-865.
[7] LIANG B Q, LEHMANN J, SOHI S P, THIES J E, O’NEILL B, TRUJILLO L, GAUNT J, SOLOMON D, GROSSMAN J, NEVES E G, LUIZÃO F J. Black carbon affects the cycling of non-black carbon in soil. Organic Geochemistry, 2010, 41(2): 206-213.
[8] 周桔, 雷霆. 土壤微生物多样性影响因素及研究方法的现状与展望. 生物多样性, 2007, 15(3): 306-311. ZHOU J, LEI T. Review and prospects on methodology and affecting factors of soil microbial diversity. Biodiversity Science, 2007, 15(3): 306-311. (in Chinese)
[9] FARRELL M, KUHN T K, MACDONALD L M, MADDERN T M, MURPHY D V, HALL P A, SINGH B P, BAUMANN K, KRULL E S, BALDOCK J A. Microbial utilisation of biochar-derived carbon. Science of Total Environment, 2013, 465: 288-297.
[10] LEHMANN J, RILLIG M C, THIES J, MASIELLO C A, HOCKADAY W C, CROWLEY D. Biochar effects on soil biota-A review. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836.
[11] SHARMA S K, RAMESH A, SHARMA M P, JOSHI O P, GOVAERTS B, STEENWERTH K L, KARLEN D L. Microbial community structure and diversity as indicators for evaluating soil quality//Lichtfouse E. ed. Biodiversity, Biofuels, Agroforestry and Conservation Agriculture. Springer Netherlands, 2010, 5: 317-358.
[12] SOLAIMAN Z M, BLACKWELL P, ABBOTT L K, STORER P. Direct and residual effect of biochar application on mycorrhizal root colonization, growth and nutrition of wheat. Australian Journal of Soil Research, 2010, 48(7): 546-554.
[13] WARNOCK D D, LEHMANN J, KUYPER T W, RILLIG M C. Mycorrhizal responses to biochar in soil-concepts and mechanisms. Plant Soil, 2007, 300: 9-20.
[14] HAMMER E C, FORSTREUTER M, RILLIG M C, KOHLEr J. Biochar increases arbuscular mycorrhizal plant growth enhancement and ameliorates salinity stress. Applied Soil Ecology, 2015, 96: 114-121.
[15] 唐玉姝, 魏朝富, 颜廷梅, 杨林章, 慈恩. 土壤质量生物学指标研究进展. 土壤, 2007(2): 157-163. TANG Y S, WEI C F, YAN T M, YANG L Z, CI E. Biological indicator of soil quality: A review. Soils, 2007(2): 157-163. (in Chinese)
[16] CUMMINGS P J, AHMED R, DUROCHER J A, JESSEN A, VARDI T, OBOM K M. Pyrosequencing for microbial Identification and characterization. Journal of Visualized Experiments, 2013, 78: e50405.
[17] 段曌, 肖炜, 王永霞, 赖泳红, 崔晓龙. 454测序技术在微生物生态学研究中的应用. 微生物学杂志, 2011, 31(5): 76-81. DUAN Z, XIAO W, WANG Y X, LAI Y H, CUI X L. Application of 454 sequencing technique in microbial ecology. Journal of Microbiology, 2011, 31(5): 76-81. (in Chinese)
[18] KUPPUSAMY S, THAVAMANI P, MEGHARAJ M, VENKATESWARLU K, NAIDU R. Agronomic and remedial benefits and risks of applying biochar to soil: Current knowledge and future research directions. Environment International, 2016, 87: 1-12.
[19] 丁艳丽, 刘杰, 王莹莹. 生物炭对农田土壤微生物生态的影响研究进展. 应用生态学报, 2013, 24(11): 3311-3317. DING Y L, LIU J, WANG Y Y. Effects of biochar on microbial ecology in agriculture soil: A review. Chinese Journal of Applied Ecology, 2013, 24(11): 3311-3317. (in Chinese)
[20] EDGAR R C, HAAS B J, CLEMENTE J C, QUINCE C, KNIGHT R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194-2200.
[21] KOZICH J J, WESTCOTT S L, BAXTER N T, HIGHLANDER S K, SCHLOSS P D. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform. Applied Environmental Microbiology, 2013, 79(17): 5112-5120.
[22] BLAXTER M, MANN J, CHAPMAN T, THOMAS F, WHITTON C, FLOYD R, ABEBE E. Defining operational taxonomic units using DNA barcode data. Philosophical transactions of the Royal Society of London Series B Biological sciences, 2005, 360(1462): 1935-1943.
[23] PITTA D W, PARMAR N, PATEL A K, INDUGU N, KUMAR S, PRAJAPATHI K B, PATEL A B, REDDY B, JOSHI C. Bacterial diversity dynamics associated with different diets and different primer pairs in the rumen of Kankrej cattle. PLoS ONE, 2014, 9(11):e111710.
[24] SUN R B, ZHANG X X, GUO X S, WANG D Z, CHU H Y. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw. Soil Biology and Biochemistry, 2015, 88: 9-18.
[25] AMATO K R, YEOMAN C J, KENT A, RIGHINI N, CARBONERO F, ESTRADA A, GASKINS H R, STUMPF R M, YILDIRIM S, TORRALBA M, GILLIS M, WILSON B A, NELSON K E, WHITE B A, LEIGH S R. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes. The ISME Journal, 2013, 7: 1344-1353.
[26] CHEN H, BOUTROS P C. Venn Diagram: a package for the generation of highly-customizable Venn and Euler diagrams in R. BMC Bioinformatics, 2011, 12(1): 35.
[27] PIETIKÄINEN J, KIIKKILÄ O, FRITZE H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus. Oikos, 2000, 89(2): 231-242.
[28] CHEN X W, WONG J T, NG C W, WONG M H. Feasibility of biochar application on a landfill final cover: A review on balancing ecology and shallow slope stability. Environmental Science and Pollution Research, 2016, 23(8): 7111-7125.
[29] ROUSK J, BÄÄTH E, BROOKES P C, LAUBER C L, LOZUPONE C, CAPORASO J G, KNIGHT R, FIERER N. Soil bacterial and fungal communities across a pH gradient in an arable soil. The ISME Journal, 2010, 4(10): 1340-1351.
[30] 刘根林. 转基因大豆对根际根际土壤微生物群落的影响及其多样性指数的度量[D]. 南京: 南京大学, 2012. LIU G L. Effects of transgenic soybeans on the rhizospheric soil microbial communities and their diversity indices measurement [D]. Nanjing: Nanjing University, 2012. (in Chinese)
[31] 张又弛, 李会丹. 生物炭对土壤中微生物群落结构及其生物地球化学功能的影响. 生态环境学报, 2015, 24(5): 898-905. ZHANG Y C, LI H D. Influence of biochar on the community structure and biogeochemical functions of microorganisms in soils. Ecology and Environmental Sciences, 2015, 24(5): 898-905. (in Chinese)
[32] ROESCH L F, FULTHORPE R R, RIVA A, CASELLA G, HADWIN A K, KENT A D, DAROUB S H, CAMARGO F A, FARMERIE W G, TRIPLETT E W. Pyrosequencing enumerates and con-trasts soil microbial diversity. The ISME Journal, 2007, 1(4): 283-290.
[33] JONES R T, ROBESON M S, LAUBER C L, HAMADY M, KNIGHT R, FIERER N. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses. International Society for Microbial Ecology Journal, 2009, 3(4): 442-453.
[34] MICHAND L, LO GINDICE A, TROUSSELLIER M, SMEDILE F, BRUNI V, BLANCHETON J P. Phylogenetic characterization of the heterotrophic bacterial communities inhabiting a marine recirculating aquaculture system. Journal of Applied Microbiology, 2009, 107(6): 1935-1946.
[35] 戴玉成. 中国木本植物病原木材腐朽菌研究. 菌物学报, 2012, 31(4): 493-509. DAI Y C. Pathogenic wood-decaying fungi on woody plants in China. Mycosystema, 2012, 31(4): 493-509. (in Chinese)
[36] 周丽霞, 丁明懋. 土壤微生物学特性对土壤健康的指示作用. 生物多样性, 2007, 15(2): 162-171. ZHOU L X, DING M M. Soil microbial characteristics as bioindicators of soil health. Biodiversity Science, 2007, 15(2): 162-171. (in Chinese)
(责任编辑 赵伶俐)
Effect of Carbonized Apple Branches on Bacterial and Fungal Diversities in Apple Root-Zone Soil
CAO Hui, LI Yan-ge, ZHOU Chun-ran, NING Liu-fang, YANG Hong-qiang
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong)
【Objective】The microorganisms in soil of root-zone are important factors affecting root environment, carbonized apple branches are the low oxygen pyrolysis products of the abandoned fruit trees. The purpose of this study was to understand the structure of soil bacteria and fungi in apple root-zone and the response of their diversities to carbonized apple branches, and to provide a theoreticalbasis for the reasonable application of carbonized apple branches and the improvement of soil biological characters in orchard.【Method】 In the spring, the 2-year-old ‘Fuji’ apple trees (rootstock for Malus hupehensis Rehd) in similar growth were transplanted to the potting soil, the soil was mixed with different mass ratios (0-4%) of carbonized apple branches beforehand. Soil samples were collected after 120 days of transplanting, genomic DNA was extracted, and PCR amplification was made to establish libraries. In this study, the 16S rRNA genes V3+V4 regions of soil bacteria and fungal ITS1 regions were sequenced by Illumina high-throughput sequencing technology on Miseq platform, and related biological analysis was conducted to explore the changes of soil bacterial and fungal abundances, diversities and structures.【Result】A total of 16 656 bacterial operational taxonomic units (OTUs) and 435 fungal OTUs were obtained from 15 apple root-zone soil samples, among them, Proteobacteria, Bacteroidetes and Acidobacteria were the dominant bacteria which the total relative abundance was 70.68%-72.80%, and Basidiomycota, Ascomycota and Zygomycota were dominant fungi which the total relative abundance was 68.00%-75.14%. The richness indices of Chao and Ace showed that 1% (w/w) carbonized apple branches increased the abundance of bacteria by 15.42% and 3.89% compared with the control, respectively. 0.5% (w/w) carbonized apple branches increased the richness of fungi by 2.80% and 3.61%, respectively. Simpson and Shannon diversity index analysis showed that 0.5%-4% (w/w) carbonized apple branches reduced the diversity of soil bacteria, increased the diversity of soil fungi; bacteria Shannon diversity index was the lowest at 1% carbonized apple branches and fungi Shannon diversity index was the highest at 0.5% carbonized apple branches. Application of 1%, 2% and 4% carbonized apple branches to the soil, the relative abundance of Proteobacteria, Acidobacteria and Basidiomycota all decreased and the relative abundance of Bacteroidetes and Zygomycota all increased in apple root-zone soil at different degrees. The relative abundance of Hymenochaetaceae (31.99%-46.74%) was the highest in Basidiomycota. 1%, 2% and 4% carbonized apple branches all made it decrease. Carbonized apple branches at 0.5%-4% dosage could increase the number of bacteria unique OTUs significantly and affect the bacteria groups, wherein the number of bacterial unique OTU was one to three times of the common OTU numbers, but they had no significant effect on the fungal groups.【Conclusion】The 0.5%-4% (w/w) carbonized apple branch applied to the soil of apple root-zone, the abundance and diversity of soil bacteria and fungi had obviously changed, and the specific bacterial species under each dosage increased too. The soil bacterial richness increased significantly in root-zone applied 1% carbonized apple branches.
carbonized apple branches; root-zone soil; Illumina high-throughput sequencing; soil bacteria; soil fungi
2016-01-31;接受日期:2016-04-19
国家“十二五”科技支撑计划(2014BAD16B02)、国家自然科学基金(31372016)
联系方式:曹辉,E-mail:caohui716@163.com。通信作者杨洪强,E-mail:hqyang@sdau.edu.cn, labft@sdau.edu.cn
