微流控液液萃取-液液波导集成化分析系统
2016-12-01李盼盼马滢雪杨春光徐章润
姜 健, 李盼盼, 马滢雪, 杨春光, 徐章润
(1. 辽东学院化学工程学院, 丹东 118003; 2. 东北大学分析科学研究中心, 沈阳 110819)
微流控液液萃取-液液波导集成化分析系统
姜 健1,2, 李盼盼2, 马滢雪2, 杨春光2, 徐章润2
(1. 辽东学院化学工程学院, 丹东 118003; 2. 东北大学分析科学研究中心, 沈阳 110819)
利用溴化1-丁基-3-甲基咪唑离子液体/碳酸钠溶液双水相体系, 实现了多相层流液液萃取. 以具有较高折射率的离子液体为液芯, 较低折射率的盐溶液为包层, 实现了液液波导吸光度检测. 据此建立了一种液液萃取与液液波导检测集成化的微流控分析系统. 该系统对甲酚红试样的萃取率在93%以上, 对甲酚红试样检测的线性范围为0.01~0.40 mg/mL, 相对标准偏差为3.4%(n=11), 检出限为3.8 μg/mL(3σ). 该系统将萃取分离与液液波导长光程吸光度检测集成在一起, 为拓展吸光度检测在微流控系统中的应用提供了新思路.
微流控芯片; 离子液体双水相萃取; 液液波导; 吸光度检测; 集成化
吸光度检测是最常用的检测技术之一, 也是最早用于微全分析系统的检测技术. 由于微流控芯片通道检测区的体积小、 吸收光程短, 故导致检测灵敏度低, 严重制约了吸光度检测技术在微流控分析中的应用. 采用轴向检测[1~3]、 多重反射[4,5]及液芯波导(Liquid core waveguide, LCW)[6~12]等方法可在一定程度上提高检测灵敏度. 液芯波导检测能够有效增加吸收光程[6,7], 在微流控分析系统中有良好的应用前景. 杜文斌等[7]将Teflon AF 2400毛细管与微流控芯片耦合, 建立了一种基于液芯波导技术的长光程吸收光度检测系统, 并用邻菲啰啉-铁(Ⅱ)显色体系验证了该系统的分析性能. Sun等[8]建立了液芯波导吸光度检测-停留萃取系统, 以Teflon AF毛细管作为萃取通道和吸收池, 对十二烷基硫酸钠进行了萃取和检测. Whitesides等[9]在聚二甲基硅氧烷(PDMS)材质的芯片上, 以去离子水(n=1.335)作为包层液体, CaCl2的水溶液(n=1.445)作为液芯流体, 在液液界面上形成了液液光波导. 但由于CaCl2在两水相界面的扩散, 使液液界面逐渐变得不清晰, 折射率的差值变小, 严重影响了液液波导的性能. Lee等[10]以CaCl2水溶液(n=1.489)和去离子水(n=1.335)分别作为液芯和包层液体, 利用迪恩涡作用使竖直方向的聚焦流体将液芯流体上下包夹, 再经过水平流体聚焦, 形成了三维的液液波导系统; 并基于三维流体聚焦的方法建立了三维液液波导的荧光检测方法. 与以固体为包层的液芯波导相比, 液液波导具有界面光滑、 光损失小、 对通道的平整度要求不高和灵活可调等优点. 但是, 其包层一般采用水或水溶液, 液芯多采用能与水互溶的有机溶剂(如乙二醇[11])或盐的水溶液[9,10], 液芯和包层的界面会因扩散而逐渐模糊, 折射率差逐渐消失, 导致无法产生液液光波导. 寻找界面清晰且具有不同折射率的两相液体, 对于液液波导光学检测方法的开发与应用具有重要意义.
离子液体(IL)双水相萃取体系在萃取生物样品方面(如抗生素[12]、 植物组分[13]和蛋白质[14~16]等)表现出优异的性能. 基于微流控芯片的离子液体双水相萃取具有更快的分相速度和更高的萃取效率[17]. 尽管微流控芯片双水相萃取仅需数十秒至几分钟时间, 但是后续的分析检测通常在芯片外进行, 往往需要数十分钟. 若将萃取分离与检测集成在同一芯片上, 不仅能简化操作过程, 减少试样和试剂消耗, 而且能避免试样污染, 易于实现自动化和便携化.
和绝大多数有机溶剂一样, 离子液体的折射率通常大于水溶液的折射率, 不能用作液液波导的外包层溶液. 但若通过液液萃取, 将水相中的待测物转移到萃取溶剂中, 则以离子液体溶剂为液芯, 水溶液为外包层, 即可实现液液波导检测. 基于此, 本文建立了一种集成化的微流控液液萃取-液液波导吸光度检测系统, 制作了集成螺旋形萃取通道和直线型吸光度检测通道的微流控芯片. 利用离子液体折射率高和萃取性能优异的特点, 选取亲水性离子液体溴化1-丁基-3-甲基咪唑为萃取剂和液芯, Na2CO3溶液为包层溶液, 在多相层流通道中实现了双水相萃取; 萃取后的多相层流进入检测通道, 利用液液界面上产生的全反射现象, 构建了液液波导吸光度检测系统. 以甲酚红溶液为试样考察了该系统的萃取和检测性能.
1 实验部分
1.1 试 剂
若无特殊说明, 所用试剂均为分析纯; 实验用水为18 MΩ·cm纯水; 溴化1-丁基-3-甲基咪唑(含量≥98%, 上海成捷化学有限公司)溶液的配制: 称取11.29 g [C4mim]Br, 加入1.00 mL水, 超声溶解, 混匀备用; Na2CO3(分析纯, 天津大茂化学试剂厂)溶液的配制: 称取15.6 g Na2CO3, 溶于少量水中, 稀释至100 mL.
1.2 芯片的制备和结构
微流控芯片基底材料为聚二甲基硅氧烷(美国Dow Corning公司), 芯片上的通道结构由SU-8 2050光刻胶(美国MicroChem公司)制作的阳模复制而成. 为了减小芯片体积, 将萃取通道设计为螺旋形; 为了形成液芯波导, 采用包层/液芯/包层三相层流方式. 如图1(A)所示, 螺旋形通道由不同直径的半圆相连组成, 最小的半圆直径为2 mm, 最大的半圆直径为12 mm, 萃取通道的总长度为180 mm; 检测通道位于萃取通道的下游, 长度为13 mm. 试剂引入通道宽度均为200 μm, 图1(B)和(C)交叉口间的通道宽度为600 μm, 其余通道宽度为800 μm. 通道深度均为100 μm.

Fig.1 Channel layout of the microfluidic chip(A), multiphase flows at different positions of the extractionchannel(B—E) and photograph of the microfluidic chip(F)(A) 1. Inlet of the liquid core; 2 and 3. inlets of the inner cladding liquid; 4 and 5. inlets of the outer cladding liquid.
1.3 实验装置
吸光度检测光源为LS-1-LL钨灯光源(波长范围为360~2000 nm, 美国海洋光学公司); 吸光度信号由USB4000-UV-VIS-ES光纤光谱仪(东芝TCD1304AP线性CCD阵列检测器, 在600 nm的灵敏度为60光子/计数值, 光学分辨率约为1.5 nm, 信噪比为300∶1, 美国海洋光学公司)检测; 用P200-2-UV-VIS和P600-2-UV-VIS石英光纤(直径分别为200和600 μm, 美国海洋光学公司)连接光源、 芯片检测通道和光谱仪. 将芯片置于三维精密移动台上, 检测通道两端的光纤均连接准直透镜, 并分别由光纤耦合器固定. 入射光纤发出的光与检测通道在一个水平面内, 入射光纤光出口距离检测通道入口端7 mm, 以一定角度照射在检测通道内; 接收光纤对准检测通道的出口, 距离出口端2 mm. 光纤的角度可通过移动台和光纤耦合器的粗、 细调旋钮调整. 液体由PHD2000型精密注射泵(美国Harvard公司)驱动. 整个实验装置置于暗箱内.
2 结果与讨论
2.1 设计原理
液芯/液层光波导具有波导界面光学平滑、 光损失小及灵活可调等优点. 然而, 由于常见非水溶剂的折射率大于待测物水溶液的折射率, 难以形成以待测物水溶液为液芯的液液光波导系统, 因此基于液芯/液层光波导的光学检测方法未得到广泛应用. 离子液体是一种性能优良的溶剂, 而离子液体双水相具有萃取条件温和、 含水量高及分相速度快等特点. 为了建立用于吸光度检测的液芯/液层光波导系统, 将离子液体双水相体系用于建立微流控多相层流系统, 在微通道内形成盐溶液/离子液体溶液/盐溶液的三相层流. 选用折射率较大的亲水性离子液体作为层流的液芯, 溶有试样的无机盐溶液在液芯的两侧, 在层流过程中, 试样从两侧的水相中被萃取到中间的离子液体相中. 芯片中螺旋形通道为萃取通道, 萃取完成后, 多相层流进入相同宽度和深度的直线型通道, 该通道为检测通道, 采用吸光度检测法, 以检测通道的液芯为样品吸收池. 当入射光从检测通道的一端以一定角度照射时, 由于内芯的折射率大于外层溶液的折射率, 入射光在离子液体和盐溶液的液液界面上发生全内反射, 沿液芯轴向传导, 从而实现液芯中试样的吸光度检测.
在该系统中, 利用离子液体优异的萃取能力, 将试样从两侧的水相溶液中萃取到离子液体液芯中, 不仅可以对试样起到一定的富集作用, 更重要的是能够构建液液光波导检测系统, 不再受待测物水相溶液折射率小的限制. 此外, 在水相层流中, 通常因分子扩散而导致层流界面逐渐模糊, 甚至消失. 而该多相层流体系具有异常稳定的层流界面, 几乎不受流速和通道长度的影响, 这得益于所选择的离子液体双水相体系. 用于液芯波导时, 由于两相界面为稳定的液面, 具有光学平滑性, 能减少因折射和散射而导致的光损失.
2.2 溴化1-丁基-3-甲基咪唑/碳酸钠双水相层流萃取
将亲水性离子液体和盐溶液的双水相体系用于多相层流萃取. 选用亲水性离子液体[C4mim]Br和Na2CO3溶液双水相体系, 考察了室温(25 ℃)下不同浓度的Na2CO3溶液对双水相形成的影响. 结果表明, 当Na2CO3溶液的浓度在0.069~0.241 g/mL之间, 0.9186 g/g [C4mim]Br溶液与Na2CO3溶液的体积比在1∶5~3∶5之间时, 均可较好地形成双水相. 考虑到盐浓度过低时, 分相后盐相体积变小, 反而导致盐易结晶析出, 后续实验中Na2CO3的浓度选择为0.156 g/mL. 以0.35 mg/mL甲酚红的碳酸钠溶液为模型萃取物, 考察了微流控芯片多相层流双水相萃取的性能. [C4mim]Br溶液从入口1引入, 甲酚红的碳酸钠溶液从入口2和3引入, 即在主通道中就形成离子液体在中间、 盐溶液在两侧的三相层流. 在显微镜下可观察到[C4mim]Br与碳酸钠溶液在39 cm长的通道中始终能保持稳定的层流. 但在主通道中出现离子液体液滴贴壁现象, 其原因是在通道中心流动的[C4mim]Br由于分相作用与盐分相后, 有一少部分贴到通道壁上且随液流贴壁流动. 为了解决此问题, 又从入口4和5分别引入不含甲酚红的碳酸钠溶液, 在主通道中形成五相层流, 不含甲酚红的碳酸钠溶液沿通道侧壁流动, 含有甲酚红的碳酸钠溶液不与通道侧壁直接接触, 从而避免了离子液体液滴贴壁现象, 如图1(B)~(F)所示. 最外层碳酸钠水溶液层流的引入使含甲酚红的碳酸钠溶液两相液流变窄, 使其更易于扩散到离子液体[C4mim]Br中, 从而提高萃取速度. 该双水相体系分相速度快, 可在5 cm长的通道内基本完成对目标物质的萃取, 时间仅需13 s. 可见, [C4mim]Br和Na2CO3溶液的双水相体系在微通道中能够保持稳定的层流状态, 不仅可以快速完成待测物萃取, 而且稳定的层流对实现液液光波导至关重要.
2.3 液芯/液层波导吸光度检测
对于理想的吸收池, 入射光应全部透过待测溶液后进入检测器. 微流控芯片吸光度检测过程中, 微通道中液层的厚度一般仅为100 μm左右, 当光路垂直于通道轴向时, 因吸收光程短, 检测灵敏度低; 当光路沿通道轴向时, 由于未经过待测溶液的入射光不可避免地进入检测器, 导致背景信号偏高, 同样难以提高灵敏度. 本文利用液芯/液层波导体系, 使入射光与检测通道轴向呈一定角度, 既能避免背景光的干扰, 又能在液芯内形成全内反射, 增加有效光程, 从而达到提高检测灵敏度的目的. 实验中考察了入射光角度和液芯宽度对检测灵敏度的影响.
2.3.1 入射光角度的影响 入射光的传导光纤、 接收光信号的光纤与芯片通道的相对位置如图2所示. 在芯片检测通道的一端放置入射光光纤, 入射光经准直透镜后照射到液芯中, 另一端放置接收光纤. 为获得更高的检测灵敏度, 避免入射光线直接照射接收光纤, 需要优化入射光的入射角度.
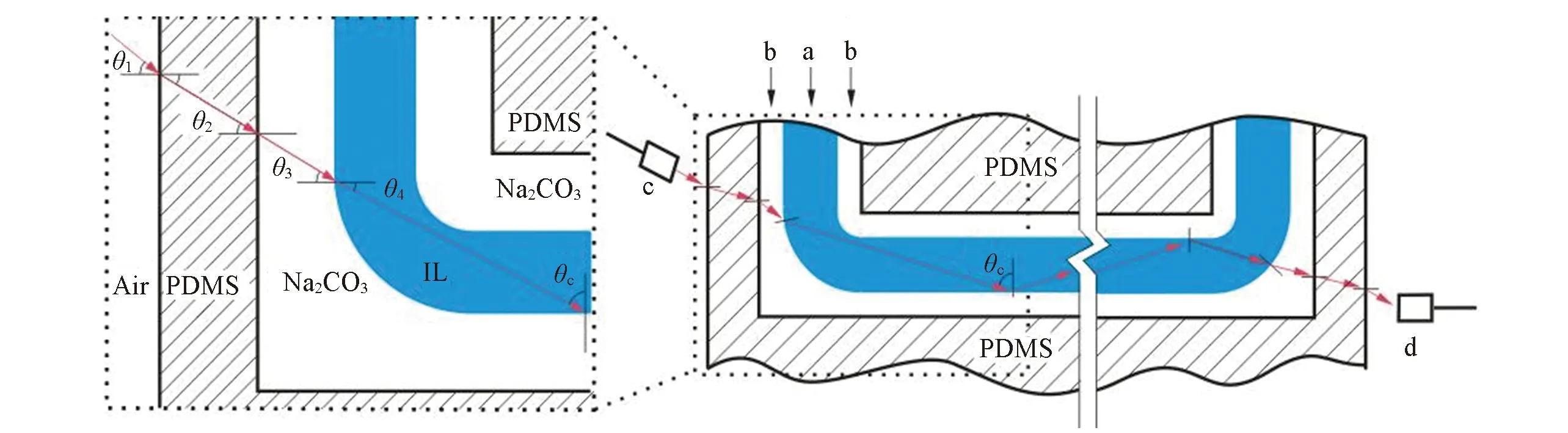
Fig.2 Schematic diagram of liquid-liquid waveguide in the detection channel a. Liquid core; b. liquid cladding; c. optical fiber for transmitting incident light; d. optical fiber for receiving optical signal.θc: critical angle of the total internal reflection.
在所使用的离子液体双水相体系中, 离子液体与盐溶液分相后, 位于液芯位置的离子液体[C4mim]Br溶液的折射率较大(n=1.527), 位于包层位置的Na2CO3溶液的折射率较小(n=1.362). 离子液体与碳酸钠溶液接触后发生分相, 分相后碳酸钠相和[C4mim]Br相的折射率n3和n4分别变为1.382和1.404, 此时发生全反射的临界角θc= arcsinn3/n4= 79.8°. 即当入射角大于临界角θc的光从液芯照射到两相界面时, 发生全内反射现象(如图2所示). 光纤发出的光照射到液芯前, 依次经过空气、 PDMS层和Na2CO3溶液. 设光纤发出的光在空气和PDMS界面的入射角为θ1, 则有n1sinθ1=n2sinθ2=n3sinθ3=n4sinθ4, 其中n1,n2,n3和n4分别为空气、 PDMS、 Na2CO3溶液和IL溶液的折射率(n1=1.000,n4=1.404); 当θc=79.8°时,θ4=10.2°, 此时光纤入射角θ1=14.4°, 即当光纤入射角≤14.4°时液芯内发生全内反射.
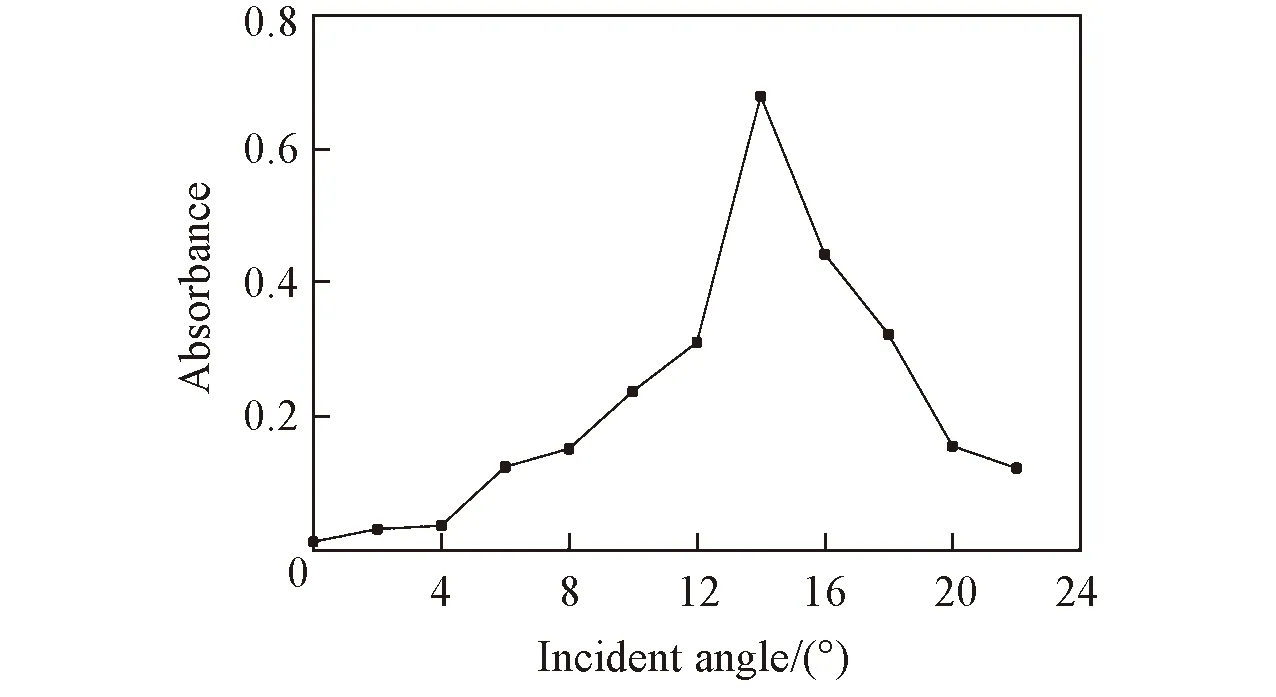
Fig.3 Effect of incident angle of the optical fiberon absorbance
理论上, 当入射光进入PDMS芯片的入射角在0~14.4°之间时才能形成全内反射, 而若想避免接收光纤被未经待测溶液的入射光照射, 光纤入射角应尽可能大. 图3示出了改变光纤入射光的角度时对吸光度的影响. 由图3可见, 当入射角在2°~22°之间时, 随入射角增大, 吸光度先增加后减小, 在14°时出现最大值. 当光纤入射光照射角度不同时, 产生的全内反射光程不同, 全内反射的次数也不同. 在0~14.4°之间, 随入射角增大, 单次反射光程减小, 反射次数增加, 但全内反射总光程增加, 因此吸光度值增加. 当光纤入射角大于14.4°时, 即相界面处入射角小于临界角79.8°, 理论上全内反射完全消失. 但本文中, 从入射光纤出射的光经过准直透镜之后, 光线并非完全平行, 其光斑有一定程度的收缩, 当光纤入射角大于14.4°时, 仍有部分光线的入射角大于临界角, 导致全内反射随光纤入射角的增大而逐渐消失, 吸光度值逐渐下降. 光纤入射角为14°时, 既降低了背景光的干扰, 又有效地增加了吸收光程, 此时吸光度值最大, 该结果与理论相符.
2.3.2 液芯宽度的影响 从芯片的入口1引入[C4mim]Br溶液, 从入口2和3引入0.35 mg/mL甲酚红的Na2CO3溶液, 从入口4和5注入0.156 g/mL Na2CO3溶液. [C4mim]Br溶液的流速设定为4 μL/min, 改变内、 外包层的液体流速, 观察层流的稳定性, 并测定[C4mim]Br液芯的宽度. 结果表明, 当[C4mim]Br相流速不变, 内、 外包层碳酸钠溶液流速增大时, 液芯宽度减小. 当[C4mim]Br与碳酸钠溶液的总流速比在0.15~0.31之间时, 形成的层流较稳定. 流速比接近0.15时, 包层液体总流速较大, 液芯宽度较小, 不利于检测光路的对准; 流速比大于0.31时, 包层液体的流速较小, 液芯易飘动, 不利于液芯波导检测. 实验选择[C4mim]Br与碳酸钠溶液的流速比为0.29, 此时[C4mim]Br溶液、 甲酚红的Na2CO3溶液和Na2CO3溶液的流速分别为4, 10和4 μL/min, [C4mim]Br液芯宽度为(401±8) μm, 该液芯宽度有利于光路对准, 且层流稳定.
2.4 系统的分析性能

Fig.4 Standard curve of cresol red in IL solution
将不同浓度的甲酚红的[C4mim]Br溶液从入口1注入, 0.156 g/mL Na2CO3溶液分别从入口2~5注入, 入口1, 2/3, 4/5的流速分别为4, 10和4 μL/min; 光纤入射角为14°, 在最大吸收波长586 nm处测定吸光度, 作标准曲线, 结果见图4. 系统对甲酚红检测的线性范围为0.01~0.40 mg/mL, 线性回归方程为A=1.41c+0.02[其中A为吸光度;c为甲酚红在[C4mim]Br中的浓度(mg/mL)],R2=0.9945. 连续测定0.10 mg/mL 的甲酚红-[C4mim]Br标准溶液的吸光度, 相对标准偏差为3.4%(n=11), 检出限为3.8 μg/mL(3σ). 测定一次样品, 包括萃取和检测过程仅需23 μL试样和9 μL试剂, 在1 min内即可完成.
以[C4mim]Br为液芯, 不同浓度的甲酚红的Na2CO3溶液(c1)作为内包层, Na2CO3溶液作为外包层, 设定各相的流速分别为4, 10和4 μL/min, 在波长586 nm处测定液芯中甲酚红的吸光度, 按照标准曲线计算液芯中甲酚红的浓度(c2). 从入口至出口两相的接触时间较短, 离子液体相比变化可以忽略, 在上述流速下液芯[C4mim]Br与内包层Na2CO3溶液的体积比为0.4. 假设碳酸钠中的甲酚红全部被萃取到离子液体中, 则液芯[C4mim]Br中甲酚红的浓度c2′=2.5c1, 则萃取率的计算公式为E(%)=(c2/c2′)×100%, 结果列于表1, 可见甲酚红的萃取率均在93%以上.

Table 1 Extraction of cresol red in the Na2CO3 solution
3 结 论
将离子液体双水相萃取与液液波导检测集成在一个芯片上, 简化了操作步骤, 减少了试样用量, 提高了分析速度, 便于实现微型化和便携化. 该集成化分析检测系统不仅具有较高的萃取效率, 而且利用液芯/液层波导的方法有效地增加了吸收光程, 避免了背景光的干扰, 提高了检测灵敏度. 由于多相层流的相界面异常稳定, 液液波导吸光度检测系统有望通过进一步增加光程来提高检测灵敏度. 此外, 离子液体具有良好的生物相容性, 可采用离子液体双水相萃取分离生命物质, 而生命物质大多有紫外吸收, 因此有望在微流控芯片上利用离子液体双水相实现对该类物质的分离与检测的集成化.
[1] Collins G. E., Lu Q., Pereira N., Wu P.,Talanta, 2007, 72(1), 301—304
[2] Liang Z. H., Chiem N., Ocvirk G., Tang T., Fluri K., Harrison D. J.,Anal.Chem., 1996, 68(6), 1040—1046
[3] Petersen N. J., Mogensen K. B., Kutter J. P.,Electrophoresis, 2002, 23(20), 3528—3536
[4] Mishra S. K., Dasgupta P. K.,Anal.Chim.Acta, 2007, 605(2), 166—174
[5] Salimi-Moosavi H., Jiang Y. T., Lester L., McKinnon G., Harrison D. J.,Electrophoresis, 2000, 21(7), 1291—1299
[6] Okada T.,Electrophoresis, 2007, 28(19), 3414—3419
[7] Du W. B., Fang Q., Fang Z. L.,Chem.J.ChineseUniversities, 2004, 25(4), 610—613(杜文斌, 方群, 方肇伦. 高等学校化学学报, 2004, 25(4), 610—613)
[8] Sun M., Du W. B., Fang Q.,Talanta, 2006, 70(2), 392—396
[9] Wolfe D. B., Conroy R. S., Garstecki P., Mayers B. T., Fischbach M. A., Paul K. E., Prentiss M., Whitesides G. M.,Pro.Natl.Acad.Sci.USA, 2004, 101(34), 12434—12438
[10] Lee K. S., Kim S. B., Lee K. H., Sung H. J., Kim S. S.,Appl.Phys.Lett., 2010, 97(2), 021109
[11] Lim J. M., Urbanski J. P., Choi J. H., Thorsen T., Yang S. M.,Anal.Chem., 2011, 83(2), 585—590
[12] Zhao D. H., Zeng Y. B., Li L., Zou J. J., Zheng X. J., Shen B., Xi Q. H.,ChineseJ.Anal.Chem., 2009, 37(3), 445—448(赵弟海, 曾延波, 李蕾, 邹建军, 郑先军, 沈兵, 奚奇辉. 分析化学, 2009, 37(3), 445—448)
[13] Claudio A. F. M., Freire M. G., Freire C. S. R., Silvestre A. J. D., Coutinho J. A. P.,Sep.Purif.Technol., 2010, 75(1), 39—47
[14] Chen X.W., Mao Q. X., Wang J. H.,Prog.Chem., 2013, 25(5), 661—668(陈旭伟, 毛全兴, 王建华. 化学进展, 2013, 25(5), 661—668)
[15] Zeng Q., Wang Y. Z., Li N. Huang X., Ding X. Q., Lin X., Huang S. Y., Liu X. J.,Talanta, 2013, 116, 409—416
[16] Lin X., Wang Y. Z., Zeng Q., Ding X. Q., Chen J.,Analyst, 2013, 138(21), 6445—6453
[17] Novak U., Pohar A., Plazl I., Znidarsic-Plazl P.,Sep.Purif.Technol., 2012, 97, 172—178
(Ed.: N, K)
† Supported by the National Natural Science Foundation of China(Nos.20975019, 21375012, 21305010).
Microfluidic Analysis System Integrated with Liquid-liquid Extraction and Liquid-liquid Waveguide†
JIANG Jian1,2, LI Panpan2, MA Yingxue2, YANG Chunguang2, XU Zhangrun2*
(1.InstituteofChemicalEngineering,EasternLiaoningUniversity,Dandong118003,China;2.ResearchCentreforAnalyticalSciences,NortheasternUniversity,Shenyang110819,China)
A microfluidic analysis system integrated with liquid-liquid extraction and liquid-liquid waveguide detection was explored. Multiphase laminar liquid-liquid extraction was realized using 1-butyl-3-methyl imidazolium bromide ionic liquid/sodium carbonate solution aqueous two-phase system. Liquid-liquid waveguide absorption photometric detection was achieved by the ionic liquid with higher refractive index served as liquid core and the salt aqueous solution with lower refractive index served as liquid cladding. The extraction efficiency for cresol red extraction is more than 93%. The linear range, the relative standard deviation and the detection limit for cresol red detection were 0.01—0.40 mg/mL, 3.4%(n=11) and 3.8 μg/mL(3σ) respectively. Extraction separation and liquid-liquid waveguide-based long optical path absorbance detection were integrated in the system, which provided a new strategy for expanding the application of absorbance detection in microfluidic systems.
Microfluidic chip; Ionic liquid aqueous two-phase extraction; Liquid-liquid waveguide; Absorbance detection; Integration
10.7503/cjcu20150701
2015-09-08.
日期: 2016-03-09.
国家自然科学基金(批准号: 20975019, 21375012, 21305010)资助.
O657.32
A
联系人简介: 徐章润, 男, 博士, 教授, 主要从事微流控分析技术研究. E-mail: xuzr@mail.neu.edu.cn
