高铁酸钾氧化去除水中三氯生的研究
2016-12-01李青松金伟伟马晓雁李国新陈国元高乃云廖文超厦门理工学院水资源环境研究所福建厦门604浙江工业大学建筑工程学院浙江杭州004同济大学污染控制与资源化研究国家重点实验室上海0009
李青松,金伟伟,马晓雁,李国新,陈国元,高乃云,廖文超(.厦门理工学院水资源环境研究所,福建厦门 604;.浙江工业大学建筑工程学院,浙江 杭州 004;.同济大学污染控制与资源化研究国家重点实验室,上海 0009)
高铁酸钾氧化去除水中三氯生的研究
李青松1*,金伟伟1,2,马晓雁2,李国新1,陈国元1,高乃云3,廖文超1(1.厦门理工学院水资源环境研究所,福建厦门 361024;2.浙江工业大学建筑工程学院,浙江 杭州 310014;3.同济大学污染控制与资源化研究国家重点实验室,上海 200092)
采用高铁酸钾对水中三氯生(TCS)的去除进行了研究, 探讨了TCS的降解机理,考察了高铁酸钾投加量、pH值、天然有机物(NOM)和双氧水等因素对TCS去除和中间产物2,4-二氯苯酚(2,4-DCP)生成的影响.结果表明:TCS通过醚键断裂降解生成2,4-DCP,TCS浓度为550µg/L,高铁酸钾浓度为15mg/L时,600s后TCS去除率可达96.48%.增加高铁酸钾投加量可以提高TCS的去除,TCS的去除率随pH值升高呈现出降低的趋势,酸性环境有利于TCS的去除,pH值为4时,TCS的去除达100%,腐殖酸和双氧水对TCS的去除有抑制作用.高铁酸钾可以有效降解TCS并降低溶液的急毒性,降低水质健康风险.
三氯生;高铁酸钾;2,4-二氯苯酚;降解产物
三氯生(2,4,4’ -三氯- 2’-羟基二苯醚,TCS)是PPCPs中一种典型的广谱抗菌消毒剂,广泛被添加在个人护理用品中,其浓度范围为 0.1%~1%[1].2002年全球 TCS产量已达到 1500t,大约96%的TCS通过排水系统进入到废水/污水处理厂[2-3].现有污水处理工艺无法有效去除 TCS[4-5],导致其在水环境中频被检出[6-7].
近期研究表明TCS对水生生物具有毒害作用,并且太阳光作用下可以形成氯仿、二恶英等毒性更大的副产物[8-9].这些副产物的积累会造成更大的环境危害.因此美国和欧盟要求对 TCS的安全性展开评估[10-11].由于TCS的广泛使用和其潜在的环境风险,因此有必要展开水体中 TCS去除研究,为饮用水安全提供技术支持.
芬顿、超声和臭氧等工艺被用来去除TCS[1,12-14].作为一种新型高效的非氯型水处理药剂,高铁酸钾在整个pH值范围均显示出很强的氧化能力,高铁酸钾在水处理过程中兼具氧化、吸附和絮凝等多种功能[15-18],同时自身分解的产物为无毒的三价铁.Yang等[19-20]考察了高铁酸钾氧化降解水中三氯生(TCS)的反应动力学和反应机制,但有关高铁酸钾去除TCS时有关水质影响对TCS去除和中间产物生成的影响尚未见报道.
本文采用高铁酸钾去除水中 TCS,考察了高铁酸钾去除TCS的性能,探讨高铁酸钾投加量、pH值、腐殖酸和双氧水等因素对TCS去除和中间产物2,4-DCP生成影响.以期为高铁酸钾深度处理污水处理厂出水和饮用水提供理论依据.
1 实验部分
1.1 试剂与仪器
TCS(德国Dr.Ehrenstorfer公司,纯度>99.5%);乙腈(HPLC级,德国Merck);腐殖酸(上海巨枫化学科技有限公司),质量分数为90% K2FeO4(天津威一化工科技有限公司)为化学纯,HCl、NaOH、Na2S2O3和H2O2(30%,国药集团化学试剂有限公司)为分析纯; BioFix® Lumi Multi-Shot 冻干细菌及激活溶液,HC-18 固相萃取柱(CNWBOND,中国),实验用水采用Milli-Q超纯水(18.2MΩ).
HJ-6A数显恒温多头磁力搅拌器(金坛市友联仪器研究所),BioFix®®Limi-10生物毒性分析仪(Macherey-Nagel,德国),LC-20A高效液相色谱仪(Shimadzu,日本),自动进样器(SIL-20A),检测器(SPD-M20A);UV2550 (Shimadzu,日本);GCMS-QP2010ultra (Shimadzu,日本),GC/MS自动进样器(AOC-5000,日本岛津),色谱柱5ms:30m×0.32mm×0.25μm,日本岛津). pH 仪(Eutevch,美国).
1.2 实验方法
称取 9.0mgTCS,溶于碱性溶液后配制成9mg/L的标准储备液,然后再回滴至中性,使用时稀释至所需的浓度.
1L烧杯中加入一定浓度的 TCS溶液,然后加入一定量的高铁酸钾,在六联恒温磁力搅拌器上于一定温度下搅拌并开始计时取样,水样滴加过量的Na2S2O3溶液抑制反应,经0.45µm玻璃纤维膜过滤后进行水质分析.
1.3 分析方法
TCS和 2,4-DCP采用 HPLC分析,采用GC/MS对TCS及其降解产物进行鉴定.HPLC条件:色谱柱为 Insertsil C18 (4.6×250mm,5µm),流动相为乙腈/水-70/30(V:V),流速为0.8mL/min,采用PDA检测器(SPD- M20A),检测波长λ=230nm,进样体积10µL,S/N大于3.
GC/MS条件:载气为高纯氦气,90kPa;进样量1μL;无分流进样方式;进样口温度为 280℃;炉温控制:初始温度为75℃,保留1min,以10℃/min升温至150℃,持续5min,然后以15℃/min升温至280℃,持续 3min;MS离子化温度为250℃;接口温度280℃;采用scan扫描,质量范围:50~600m/z.
采用生物毒性仪BioTox-B测试方案进行急毒性分析,培养时间为 30min,急毒性分析结果的表达形式是以抑制百分比和增强百分比来表示样品里的光强度和没有受到抑制的试剂空白值比较结果.

2 结果与讨论
2.1 高铁酸钾降解TCS产物识别及机制
TCS初始浓度为 500μg/L,投加高铁酸钾10mg/L反应10min后加入硫代硫酸钠溶液终止反应,取500mL反应溶液经SPE富集、洗脱、吹干、定容后进行GC/MS分析,结果见图1.
由图1可见,质谱图上在10.905与33.900min有两个相对明显的出峰.其中 33.900min时的出峰经鉴定为TCS, 10.905min时的出峰为TCS的降解产物,该产物特征碎片为m/z 63,98,126,162,经谱图检索为2,4-DCP.

图1 高铁酸钾降解TCS氧化产物的质谱 扫描Fig.1 MS spectra for main oxidized product of TCS bypotassium ferrate
Song等[1]和Hyun-Seok等[21]采用类芬顿和TiO2光催化去除TCS时均鉴定出了2,4-DCP[1,21].实验中没有发现二等其他副产物.研究表明TCS和 2,4-DCP的 EC50分别为 0.28mg/L和4.9mg/L[22-23],因此高铁酸钾可以降低 TCS的毒性.
反应中测定到了2,4-DCP的生成,高铁酸钾降解TCS可能是TCS分子结构中的醚键的受到攻击断裂,进而形成中间产物2,4- DCP.等物质量的TCS可降解为等量的2,4- DCP(图2).

图2 高铁酸钾降解TCS示意Fig.2 Proposed reaction schemes for oxidation of TCS by potassium ferrate
2.2 高铁酸钾对TCS的去除性能
高铁酸钾投加量为5mg/L,TCS初始浓度为400 µg/L时降解过程中 TCS和主要降解产物2,4-DCP及溶液急毒性的变化见图3.
由图3可知,高铁酸钾氧化120s后TCS的去除率为63.76,600s时TCS的去除增加为75.47%.反应过程中有2,4-DCP生成,其浓度由0s时的0μg/L增加至240s时的138 μg/L,整个反应时间2,4-DCP一直存在.毒性测试表明反应液的急毒性由 21%的抑制率降低至 0~3%,按照美国Microtox急毒性等级划分方法[24],此时溶液等级为无毒或微毒.

图3 高铁酸钾降解TCS过程中TCS, 2,4-DCP及溶液毒性的变化Fig.3 Evolution of acute toxicity and concentration change of TCS and 2,4-DCP during TCS degradation by potassium ferrate
TCS降解过程中忽略其他次要反应,由于等物质量的TCS可降解为等量的2,4-DCP,因此溶液中TCS和2,4-DCP的浓度有以下的关系:

式中:C(TCS)0为TCS的初始浓度;C(2,4-DCP)和C(TCS)为反应过程中 2,4-DCP和 TCS的浓度,µg/L;M(2,4-DCP)和M(TCS)分别为2,4-DCP和TCS的分子量,g/mol.
实验中不同取样时间的TCS和2,4- DCP的浓度均能较好的符合式(1).
图3表明了高铁酸钾可以有效降解TCS生成2,4-DCP,并降低溶液的急毒性.
2.3 高铁酸钾降解TCS影响因素
2.3.1 高铁酸钾投加量对 TCS去除及 2,4-DCP生成影响 TCS初始浓度为 550μg/L时,改变高铁酸钾的投加量分别为 3、5、8、10、13和16mg/L,考察高铁酸钾对TCS去除的影响,结果见图4.

图4 高铁酸钾投加量对TCS去除和2,4-DCP生成的影响Fig.4 Time-evolution of TCS (a) and 2,4-DCP (b) at different potassium ferrate dosage
由图 4(a)可知,高铁酸钾不同投加量时均能有效去除TCS.高铁酸钾的投加量分别为3、5、8、10、13和16mg/L时,600s内TCS的去除率分别为 53.26、76.83、84.74、90.37、95.25和96.48%.TCS去除主要集中在前180s,高铁酸钾投加量为13和16mg/L时,反应180s后TCS的去除率均在90%以上.
实验浓度范围内TCS的去除率随高铁酸钾浓度升高呈现增加的趋势.这是因为随着高铁酸盐投加量的增加,溶液中高铁酸根的浓度增加,与TCS分子反应的机率也增加,因此TCS的去除率逐渐增大,此后随着高铁酸钾投加量的增加导致溶液呈碱性.高铁酸钾的氧化电位下降,均导致其氧化性减弱,所以较高高铁酸钾投加量时TCS去除率增加并不明显.
图4(b)反应了中间产物2,4-DCP浓度随时间的变化情况.由图4(b)可知TCS去除的过程中伴随着2,4-DCP的生成且其浓度随TCS的去除而增加.2,4-DCP的生成主要集中在前180s,高铁酸钾的投加量分别为3、5、8、10、13和16mg/L时,600s时 2,4-DCP的生成量分别为 115.97、176.07、268.93、283.04、272.96和 266.21μg/,此时 2,4-DCP/ TCS的生成摩尔比分别为36.01%、57.12%、85.20%、93.30%、84.68%和87.72%.
作者的前期实验表明高铁酸钾可以单独去除2,4-DCP,但实验中生成的2,4-DCP并没有和TCS同步除去.这可能因为相对于醚键断裂反应,TCS分子结构中苯环开环反应不易发生,去除反应以醚键断裂为主[25].反应剩余高铁酸钾的量不足以继续氧化去除TCS降解生成的2,4-DCP.
2.3.2 pH值对 TCS去除及 2,4-DCP生成影响 高铁酸钾的氧化能力、稳定性都取决于溶液的pH值大小,TCS的形态也与pH值有关,因此考察了溶液pH值对TCS降解的影响.
高铁酸钾投加量为 10mg/L时,改变溶液的pH值,考察pH值对TCS去除的影响,结果见图5.由图5可知,pH值对TCS的去除和2,4-DCP的生成有着显著的影响.
实验范围内TCS去除率随pH值升高而降低.pH值为 9时,600s时 TCS去除率仅为11.83%.pH值为8、7、6及5时,TCS去除率分别增加为 32.32%、77.65%、80.91%和 91.38%.当 pH值为 4时,TCS的去除率最高,此时不仅TCS的浓度已低于检测限,而且生成的2,4-DCP也得到了部分去除,浓度由180s时246.72μg/L降低为600s的213.97μg/L.图5表明pH值显著影响TCS的去除,TCS去除率随pH值升高而升高.

图5 pH值TCS去除和2,4-DCP生成的影响Fig.5 Time-evolution of TCS (a) and 2,4-DCP (b) at different pHs
较高的pH值不利于TCS的去除,进而降低2,4-DCP的生成.pH值为8和9时2,4-DCP的生成量为94.27和19.10μg/L,显著低于其他pH值时200μg/L左右的生成量.
首先,pH值影响高铁酸盐的氧化还原电位和溶液的稳定性.酸性条件下高铁酸钾的氧化电位可达 2.20V,但稳定性较差;偏碱性溶液虽然可以增加高铁酸钾的稳定性,保证其与反应物有更长的反应时间,但碱性条件下氧化电位高铁酸钾的氧化还原电位较低,仅为0.72V[26-28].
其次,pH值能改变TCS的存在形态和亲疏水性,影响到其在反应溶液中的分布和去除途径.TCS为疏水性、弱挥发性物质,当溶液是弱碱时,TCS一部分以分子形式存在(TCS的 pKa= 7.9)[29],强碱环境中TCS是以负离子形式存在.碱性条件下高铁酸根主要以 FeO42-为存在形态,在碱性条件下均带负电荷的FeO42-和TCS分子的两种离子之间,存在静电相斥作用,二者之间有效碰撞几率小,这影响了FeO42-对TCS的氧化降解作用,而在酸性条件下,TCS大部分以中性分子的形态存在,与碱性环境相比,FeO42-与TCS之间有效碰撞几率增大,有利于高铁酸盐对TCS的氧化降解.
图5(a)表明实验范围内TCS的去除率随pH值增加而逐渐降低,这与杨滨等[30]考察高铁酸钾氧化降解TCS动力学研究时反应速率常数随pH值的增加逐渐降低的结论类似,但与高铁酸钾降解邻氯苯酚的趋势并不一致[31].
TCS的去除率随pH值增加而逐渐降低是高铁酸根氧化还原电位、稳定性及TCS电离电位等3种影响因素共同作用的结果,实验结果表明高铁酸根氧化还原电位在TCS的降解中起主导作用.
2.3.3 天然有机物对TCS去除及2,4-DCP生成影响 自然水体中常含天然有机物(NOM),实验中以腐殖酸(HA)模拟NOM,调整溶液中腐殖酸含量值,在TCS的浓度为550μg/L,高铁酸钾投加量为10mg/L时,考察有机物对TCS去除的影响,结果见图6.
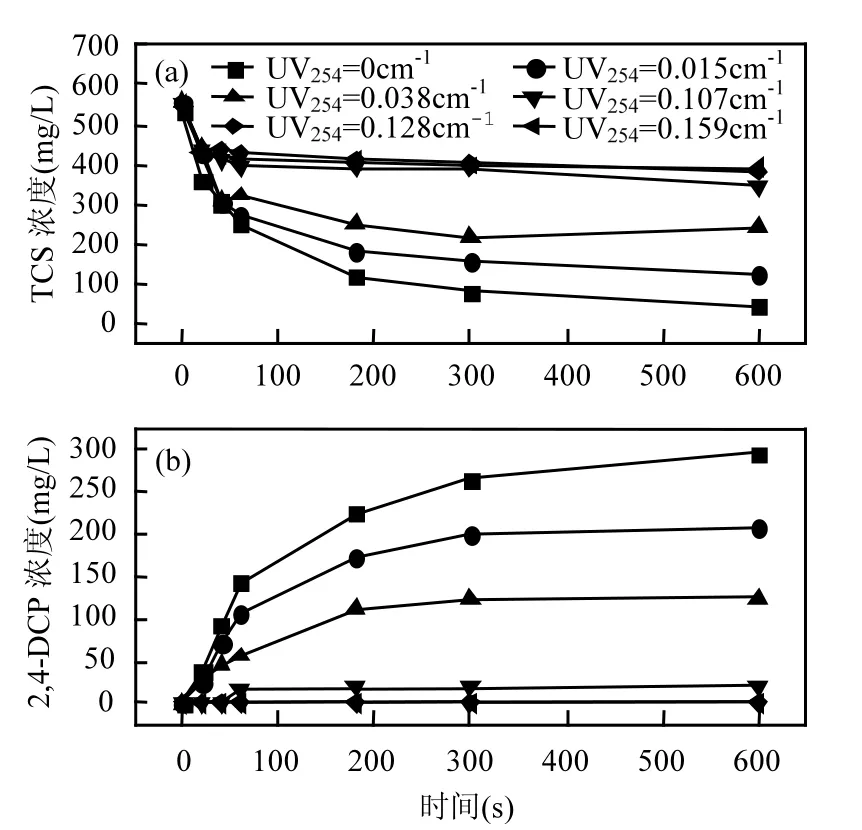
图6 NOM对TCS去除和2,4-DCP生成的影响Fig.6 Time-evolution of TCS (a) and 2,4-DCP (b) at different NOM concentrations
由图6可知,实验范围内TCS去除随NOM含量的升高而降低,2,4-DCP的生成量随 NOM含量的增加而降低.NOM含量为 0时,600s时TCS去除率为92.58%,NOM含量为0.015、0.038、0.107、0.0128及0.159UV254-1时,TCS去除率分别降低为78.20%、57.27%、38.12%、30.65%和28.65%.由TCS降解产生的2,4-DCP也随之呈生成减少的趋势.当 NOM 含量为 0.0128和0.159UV254
-1时,由于TCS去除率太低,实验中没有测出2,4-DCP的生成.
NOM的存在可以降低TCS的去除率,这是因为腐殖酸含有诸如羧基、酚羟基、醇羟基等基团,高铁酸钾可以直接或通过高铁酸钾自分解产生的氧化物质氧化除去腐殖酸[32],因此腐殖酸可以与反应体系中的TCS竞争高铁酸钾,从而对高铁酸钾氧化降解TCS产生不利影响.
2.2.4 双氧水对TCS去除及2,4-DCP生成影响自然水体中存在一定浓度的双氧水(H2O2)、羟基自由基(·OH)、单线态氧(1O2)等ROS,它们对水环境中物质的化学行为有重要影响.因此实验中考察双氧水对TCS去除的影响,结果见图7.

图7 双氧水对TCS去除和2,4-DCP生成的影响Fig.7 Time-evolution of TCS (a) and 2,4-DCP (b) at different hydrogen peroxide concentrations
由图7可知,TCS去除率随双氧水投加量的增加而下降,双氧水投加量为0、1、3、5、7和10mg/L时,TCS的去除率为90.34%、77.82%、62.46%、53.62%、49.79%和 36.43%. 600s时2,4-DCP的生成量也有 262.51μg/L [C(H2O2)= 0mg/L]降低为122.13 μg/L [C(H2O2) =10mg/L].
有研究[33-34]表明H2O2可以和高铁酸钾氧化过程中产生的Fe2+形成Fenton体系,进一步强化高铁酸钾氧化降解有机物的能力.但在实验中未证实这一点,实验范围内双氧水均不同程度地抑制了氧化反应的进行.这可能是因为作为一种强氧化剂,高铁酸钾能和双氧水发生反应生成氧气:

导致溶液中高铁酸钾的消耗,从而降低了TCS的去除率.
3 结论
3.1 高铁酸钾可以有效用于去除水中的 TCS,高铁酸钾投加量为15mg/L,TCS浓度为550μg/L时,TCS去除率可达96.48%.
3.2 TCS通过醚键的断裂降解生成中间产物2,4-DCP.
3.3 高铁酸钾氧化可以降低溶液的急毒性,TCS的去除伴随着2,4-DCP的生成, 2,4-DCP的生成两取决于TCS的降解, TCS的去除和溶液急毒性的降低并不是同步过程.
3.4 TCS的去除率高铁酸钾浓度的增加而增加,TCS去除率随pH值升高而降低,腐殖酸和双氧水对 TCS的降解有抑制作用,二者可以降低TCS的去除率和2,4-DCP的生成.
[1] Song Zhou, Wang Nan, Zhu Lihua, et al. Efficient oxidative degradation of triclosan by using an enhanced Fenton-like process [J]. Chem. Eng. J., 2012,198-199:379-387.
[2] Bester K. Fate of triclosan and triclosan-methyl in sewage treatment plants and surface waters [J]. Arch. Environ. Contam. Toxicol., 2005,49:9—17.
[3] Cale T. Anger, Charles Sueper, Dylan J. Blumentritt, et al. Quantification of triclosan, chlorinated triclosan derivatives, and their dioxin photoproducts in lacustrine sediment cores [J]. Environ. Sci. Technol., 2013,47:1833-1843.
[4] Sabaliunas D, Webb S F, Hauk A, et al. Environmental fate of triclosan in the River Aire Basin, UK [J]. Water Res., 2003,37:3145—3154.
[5] Winkler G, Fischer R, Krebs P, et al. Mass flow balances of triclosan in rural wastewater treatment plants and the impact of biomass parameters on the removal [J]. Eng. Life Sci., 2007,7:42—51.
[6] Hua W, Bennett E R, Letcher R J. Triclosan in waste and surface waters from the upper Detroit river by liquid chromatography—electrospray—tandem quadrupole mass spectrometry [J]. Environ. Int., 2005,31:621—630.
[7] Weigel S, Berger U, Jensen E, et al. Determination of selected pharmaceuticals and caffeine in sewage and seawater from Tromsa/Norway with emphaisi on ibuprofen and its metabolites[J]. Chemosphere, 2004,56:583—592.
[8] Mezcua M, Gómez M J, Ferrer I, et al. Evidence of 2,7/2,8-dibenzodichloro-p-dioxin as a photodegradation product of trilosan in water and wastewater samples [J]. Anal. Chim. Acta.,2004,524:241—247.
[9] Tixier C, Singer H P, Canonica S, et al. Phototrans -formation of triclosan in surface waters: a relevant elimination process for this widely used biocide- laboratory studies, field measurements, and modeling [J]. Environ. Sci. Technol., 2002,36:3482—3489.
[10] USFDA. Triclosan: what consumers should know, U.S. food and drug administration, Washington, DC, 2010. (http://www.fda.gov/ ForConsumers/ConsumerUpdates/ucm205999.htm).
[11] ECHA. Draft community rolling action plan (CoRAP), Rev.1-11[R]. European chemical agency, 2011. (http://echa.europa.eu/ regulations/reach/evaluation/substance-evaluation/community-ro lling-action-plan).
[12] Ren Yan-Ze, Franke Marcus, Anschuetz Franziska, et al. Sonoelectrochemical degradation of triclosan in water [J]. Ultrasonics Sonochemistry, 2014,21:2020—2025.
[13] Chen Xijuan, Richard Jessica, Liu Yaling, et al. Ozonation products of triclosan in advanced wastewater treatment [J]. Water Res., 2012,46:2247-2256.
[14] Yu Jimmy C, Kwong T Y, Luo Q, et al. Photocatalytic oxidation of triclosan [J]. Chemosphere, 2006,65:390—399.
[15] Jiang J Q, Lloyd B. Progress in the development and use of ferrate (VI) salt as an oxidant and coagulant for water and wastewater treatment [J]. Water Res., 2002,36(6):1397—1408.
[16] Huang H, David S, Brian C, et a1. Ferrate(Ⅵ) oxidation of aqueous phenol: kinetics and mechanism [J]. J. Phys. Chem. A,2001,105(14):3536-3541.
[17] 崔建国,刘幼琼,李 娜.高铁酸钾同时降解微污染水中苯酚和Cr(Ⅵ)的研究 [J]. 中国环境科学, 2011,31(9):1461-1465.
[18] Anquandah G A K, Sharma V K, Panditi V R, et al. Ferrate(VI)oxidation of propranolol: kinetics and products [J]. Chemosphere,2013,91(1):105—109.
[19] Yang Bin, Ying Guang-Guo, Zhao Jian-Liang, et al. Removal of selected endocrine disrupting chemicals (EDCs) and pharmaceuticals and personal care products (PPCPs) during ferrate (VI) treatment of secondary wastewater effluents [J]. Water Res., 2012,46(7):2194—2204.
[20] Yang Bin, Ying Guang-Guo, Zhao Jian-Liang, et al. Oxidation of triclosan by ferrate: Reaction kinetics, products identification and toxicity evaluation [J]. J. Hazard. Mater., 2011,186(1):227—235.
[21] Hyun-Seok Son, Gwangpyo Ko, Kyung-Duk Zoh. Kinetics and mechanism of photolysis and TiO2photocatalysis of triclosan [J]. J. Hazard. Mater., 2009,166(2/3):954-960.
[22] Farré, M L, Pérez S, Kantiani L, et al. Fate and toxicity of emerging pollutants, their metabolites and transformation products in the aquatic environment [J]. Trac-trend. Anal. Chem,2008,27(11):991-1007.
[23] DeLorenzo M E, Keller J M, Arthur C D, et al. Toxicity of the antimicrobial compound triclosan and formation of the metabolite methyl-triclosan in estuarine systems [J]. Environ. Toxicol.,2008,23(2):224-232.
[24] Reuveni O, Fanger-Vexler L, Heth D.The effect of rooting environment, kind and source of cuttings on rooting of Eucalyptus camaldulensis Dehn. cuttings [J]. Commonw For Rev.,1990,69(2):181-189.
[25] Gao Yanpeng, Ji Yuemeng, Li Guiying, et al. Mechanism, kinetics and toxicity assessment of OH-initiated transformation of triclosan in aquatic environments [J]. Water Res., 2014,49:360—370.
[26] Virender K Sharma. Potassium ferrate VI: an environmentally friendly oxidant [J]. Adv. Environ. Res., 2006,6:143-156.
[27] Jiang J Q. Research progress in the use of ferrate (V1) for the environmental remediation [J]. J. Hazard. Mat., 2007,146(3):617-623.
[28] 马 艳,高乃云,祝淑敏,等.高铁酸钾去除水中磺胺嘧啶 [J]. 同济大学学报(自然科学版), 2013,41(1):106-110.
[29] Wong-Wah-Chung P, Rafqah S, Voyard G, et al. Photochemical behaviour of triclosan in aqueous solutions: kinetic and analytical studies [J]. J. Photoch. Photobio. A., 2007,191(2/3):201-208.
[30] 杨 滨,应光国,赵建亮.高铁酸钾氧化降解三氯生的动力学模拟及反应机制研究 [J]. 环境科学, 2011,32(9):2543-2548.
[31] 曲久辉,林 谡,田宝珍,等.高铁氧化去除饮用水中邻氯苯酚的研究 [J]. 环境科学学报, 2001,21(6):701-704.
[32] Lim Mihee, Kim Myoung-Jin. Removal of natural organic matter from river water using potassium ferrate (VI) [J]. Water Air Soil Poll., 2009,200:181-189.
[33] 沈希裴,王佳莹,杨玉峰,等.高铁酸钾联合H2O2对酸性红B废水的预处理试验研究 [J]. 浙江工业大学学报, 2010,38(3):304-307.
[34] 平成君,梁建奎,金士威,等.高铁酸钾与双氧水联用处理含苯废水 [J]. 化学与生物工程, 2015,32(9):50-53.
Study on the degradation of triclosan in aqueous by potassium ferrate.
LI Qing-song1*, JIN Wei-wei1,2, MA Xiao-yan2, LI Guo-xin1, CHEN Guo-yuan1, GAO Nai-yun3, LIAO Wen-chao1(1.Water Resources and Environmental Institute, Xiamen University of Technology, Xiamen 361005, China;2.College of Civil Engineering and Architecture,Zhejiang University of Technology, Hangzhou 310014, China;3.National Key Laboratory of Pollution Control and Reuse,Tongji University, Shanghai 200092, China). China Environmental Science, 2016,36(9):2665~2671
The degradation of triclosan (TCS) in aqueous by potassium ferrate was investigated, and the degradation mechanism of TCS was researched. Besides, the effects of different factors, such as potassium ferrate dosage, TCS initial concentration, pH, natural organic matter (NOM) and hydrogen peroxide on TCS degradation and the 2,4-DCP formation during potassium ferrate oxidation was specifically discussed. The results indicated that TCS was degraded into 2,4-DCP via cleavage of the ether bond. The degradation rate of TCS could reach 96.48% within 600s under TCS initial concentration of 550µg/L, and potassium ferrate dosage of 15mg/L. The oxidation of TCS was not a simultaneous detoxification process. The degradation of TCS was showed positive correlation with the increase of potassium ferrate dosage, but decreased with the increase of pH. Acid environment was conducive to the TCS removal, and the removal of TCS reached 100% when pH value was 10.7. However, TCS removal was inhibited by the presence of NOM and hydrogen peroxide. Potassium ferrate can effectively degrade TCS, lower acute toxicity of reaction solution, and therefore,reduce health risk of water quality.
triclosan;potassium ferrate;2,4-DCP;degradation product
X703.1
A
1000-6923(2016)09-2665-07
2016-01-06
国家自然基金项目(51378446,51309197,51408518);福建省高等学校新世纪优秀人才支持计划资助(JA14227);福建省自然科学基金 (2016J01695);厦 门市 科技局 项 目(3502Z20131157,3502Z20150051)
* 责任作者, 副研究员, leetsingsong@sina.com
李青松(1979-),男,山东东明人,副研究员,博士,主要从事水处理理论与技术研究.发表论文50余篇.
