猪群混合感染伪狂犬病毒及乙型脑炎病毒的鉴定与分离
2016-12-01谢佳芮李华春王静林王生奎
刘 宁,宋 聪,高 林,谢佳芮,李华春,王静林,姚 俊,王生奎
(1.云南农业大学动物科学技术学院,昆明650201;2.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明650224)
·简报·
猪群混合感染伪狂犬病毒及乙型脑炎病毒的鉴定与分离
刘 宁1,宋 聪1,高 林2,谢佳芮2,李华春2,王静林2,姚 俊2,王生奎1
(1.云南农业大学动物科学技术学院,昆明650201;2.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明650224)
云南省文山市某规模化猪场2015年7~8月频繁发生以种公猪一侧睾丸肿大,母猪流产、产死胎、木乃伊胎及弱仔为主要临床症状的繁殖障碍疫情。为了查明病因,对送检流产胎猪进行病理解剖,采集胎猪及胎盘病料进行猪瘟病毒、猪繁殖与呼吸综合征病毒欧洲型及美洲型毒株、猪细小病毒、伪狂犬病毒、乙型脑炎病毒、猪流产衣原体、布氏杆菌及弓形虫PCR和realtime PCR检测,同时应用猪肾原代细胞及BHK-21传代细胞进行病毒分离鉴定以及细菌分离鉴定。检测结果显示,从流产胎猪内脏器官、大脑及胎盘组织扩增出乙型脑炎病毒prM基因及伪狂犬病毒gE基因目的条带。序列分析结果显示,扩增的乙型脑炎病毒prM基因序列与NCBI GenBank中的参考毒株(Accession no.AB594829.1)序列同源性达99%;伪狂犬病毒gE基因核苷酸序列与NCBI GenBank 中的参考毒株(Accession no.KT936475.1)序列同源性达100%。应用BHK-21传代细胞盲传分离获得1株可致细胞病变(cytopathic effect,CPE)的病毒株,鉴定为乙型脑炎病毒,并命名为JEV-2015-WS-YN。由此推测,引起此次猪群繁殖障碍极有可能为日本乙型脑炎病毒和伪狂犬病毒共同感染造成。
日本乙型脑炎病毒;伪狂犬病毒;混合感染
伪狂犬病毒(Pseudorabies virus,PRV)属于疱疹病毒科、疱疹病毒亚科,又称猪疱疹病毒Ⅰ型,可引起牛、羊、猫、马等家畜和多种野生动物产生以发热、奇痒(猪除外)及脑脊髓炎为特征的急性致死性传染病[1],又名奥叶兹基病(Aujeszkys disease,AD)。猪是PRV主要的贮存宿主和传染源,也可感染多种家畜和野生动物,PRV属于典型且极难防疫的自然疫源性疾病病原之一。匈牙利学者Aujeszky在1902年对伪狂犬病首先进行了报道,随后,Schniedhoffer证明了本病是由病毒引起的。1935年,Shope发现了猪在伪狂犬病的传播过程中起到了至关重要的作用。我国研究人员1947年首次从猫身上分离到PRV[2]。现在PRV感染已经遍及全国大多数省市,给畜牧业的发展造成了重大影响。猪感染PRV后出现的症状因日龄不同而异,妊娠母猪感染后可引起流产,产木乃伊胎和死胎;哺乳仔猪感染出现神经症状,麻痹、衰竭死亡,死亡率几乎高达100%;成年猪一般为隐性感染,不表现临床症状,但病毒可在猪体内保存很长时间,导致成年猪长期处于带毒和排毒状态,成为最为危险的传染源[3]。伪狂犬病在猪群中具有传播快、死亡率高、流行范围广、传播途径多、病原体顽固等特点,是长期以来影响养猪业发展的主要疫病之一,对我国养猪业造成了巨大的损失,严重影响养猪业的发展[4]。
猪乙型脑炎病毒又称日本脑炎病毒(Japanese encephalitis virus,JEV),属黄病毒科、黄病毒属,主要以三带喙库蚊为传播媒介。JEV感染是一种急性传染病,严重危害人畜健康[5]。本病具有明显的季节性和地理分布区域,常以蚊虫较多的夏秋季多发,属于典型的自然疫源性疾病,主要分布在南亚、东南亚、东亚以及澳大利亚等地[6,7]。猪是JEV最重要的传染源和储存宿主,目前JEV多为隐性感染或呈散发性。JEV在环境中不稳定,易被消毒剂灭活[8]。据不完全统计,在我国大约有90%的病例发生在7~9月[9]。育肥猪感染后表现为持续高热,新生仔猪主要呈现脑炎。妊娠母猪感染后主要的临床表现为流产和产死胎,产下的胎儿大小不一,即使同窝差别也比较明显,如果体内的胎儿木乃伊化而不能排除体外,长期滞留子宫内可诱发母猪子宫内膜炎,引起母猪繁殖障碍。公猪感染的主要临床症状是睾丸炎,常表现为一侧睾丸肿胀,一侧睾丸正常,若发现比较及时进行治疗,可得到治愈并且继续留为种用,从而减少经济损失,若经过一定时间治疗发现不能产生具有活性的精子,应淘汰另引种公猪[10]。JEV感染对猪场造成的经济损失主要表现在母猪繁殖障碍,因此在日常的管理和免疫过程中不容忽视。
云南省文山市某规模化猪场存栏经产母猪365头,后备母猪56头,种公猪9头。猪群经过猪瘟、仔猪副伤寒、口蹄疫O、A型二联灭活疫苗、猪细小病毒疫苗免疫,但未免疫猪繁殖与呼吸综合征、伪狂犬、乙型脑炎、圆环病毒病及喘气病疫苗。该场猪群于2014年7~8月频繁发生以种公猪一侧睾丸肿大、母猪流产、产死胎、木乃伊胎及弱仔为主要临床表现的繁殖障碍疫情,期间共发生流产、死产、木乃伊胎及产弱仔窝数为39窝,有5头种公猪发生一侧睾丸肿大。为了查明病因,对送检的流产胎猪进行病理解剖,可见肾脏有针尖大小出血点及出血斑,脑膜充血、出血及水肿(见图1),其余脏器未见异常。遂采集流产胎猪内脏及胎盘病料进行猪瘟病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、伪狂犬病毒、日本乙型脑炎病毒、猪流产衣原体、布氏杆菌及岗地弓形虫PCR和real-time PCR检测,同时应用猪肾原代细胞及BHK-21传代细胞对送检样品进行病毒及细菌的分离鉴定。最终从送检的3头流产胎儿的大脑及内脏组织检测出伪狂犬野毒gE基因及乙型脑炎病毒prM基因,测序后序列与NCBI GenBank中参考毒株序列同源性分别达99%及96%以上,并应用BHK-21细胞系分离获得1株JEV流行毒株。
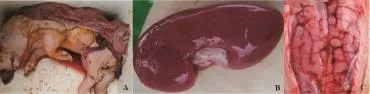
图1 流产猪胎儿及病理变化Fig.1 Aborted fetuses and pathological change
1 材料与方法
1.1 样品 送检1份胎盘组织及2头流产胎儿(剖检后采集大脑、肺脏、脾脏、肺门淋巴结、肠系膜淋巴结、肝脏、肾脏进行检测),每头流产胎儿的上述内脏组织混合匀浆后作为1份待检样品,大脑组织单独匀浆后作为1份样品,胎盘组织单独匀浆后作为1份待检样品,总共制备5份待检样品。
1.2 细胞 猪肾原代细胞由云南省热带亚热带动物病毒病重点实验室制备、冻存;BHK-21传代细胞系由云南省热带亚热带动物病毒病重点实验室冻存。
1.3 主要试剂、培养基及仪器 营养琼脂培养基、显色指示剂、革兰氏染液购自杭州滨和微生物试剂有限公司;Gico新生犊牛血清、反转录试剂盒AgPath-IDTMone-step RT-PCR Kit(AM1005)购自美国生命技术有限公司(Life Technologies);病毒DNA提取试剂盒(Viral DNA Kit)、病毒RNA提取试剂盒(Viral RNA Kit)购自美国OMEGA生物技术有限公司;荧光定量qPCR及qRT-PCR试剂盒、2×Plus Taq酶、DNA Marker 2000均购自天根生物技术(北京)有限公司;一步法RT-PCR试剂盒(One Step RT-PCR Kit)购自大连宝生物(TaKaRa)生物技术有限公司。普通光学显微镜为OLYMPUS CX31显微镜;CO2培养箱为THERMO SCIENTIFIC公司产品;生物安全柜为ESCO CLASS II TYPE A2;PCR 仪 Gene Amp PCR System 9700、梯度PCR仪均购自ABI(Applied Biosystems Inc)公司。
1.4 实验动物 昆明成年小白鼠41只,购自昆明医科大学实验动物中心。
1.5 引物、探针 猪瘟病毒、伪狂犬病毒、乙型脑炎病毒及猪细小病毒检测引物及探针由云南省热带亚热带动物病毒病重点实验室设计。检测猪繁殖与呼吸综合征病毒欧洲型毒株及美洲型毒株、经典毒株及通用型引物和探针,以及猪流产(鹦鹉热)衣原体,布氏杆菌,刚地弓形虫的检测引物及探针参考文献[11-16]合成。以上引物及探针分别由上海Invitrogen生物科技有限公司、上海GENEray生物科技有限公司及昆明硕擎生物科技有限公司合成,详细信息见表1。
1.6 病毒核酸的抽提 取流产胎儿大脑、肺脏、脾脏、肺门淋巴结、肠系膜淋巴结、肝脏、肾脏及胎盘组织匀浆,反复冻融3次后,4500×g离心10 min,取上清液按美国OMEGA生化试剂公司的病毒基因组DNA、RNA提取试剂盒说明书操作,提取的病毒核酸-80℃保存备用。
1.7 猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性及经典毒株、猪瘟病毒、猪细小病毒、猪流产衣原体、布氏杆菌及弓形虫PCR及real-time PCR检测运用云南省热带亚热带动物病毒病重点实验室建立的猪瘟病毒real-time PCR和猪细小病毒PCR检测方法,以及参考相关发表文献中的猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性毒株、经典毒株,猪流产衣原体,布氏杆菌及刚地弓形虫PCR及实时荧光定量PCR检测方法对送检样品进行检测[11-16]。猪瘟病毒real-time PCR反应体系25 μL:2×One step RT-PCR buffer 12.5 μL,上下游引物CSFV-F、R(10 μmol/mL)及探针CSFV-P(10μmol/mL)各1 μL,50×Detection Enhancer 0.5 μL,25×Enzyme Mix 1 μL,模板DNA 4 μL,用无核酸酶的PCR级无离子水补足至25 μL,混匀,短暂离心后进行扩增。反应条件:45℃ 10 min,95℃10 min,95℃3 s、60℃ 30 s运行45个循环。猪细小病毒PCR反应体系25 μL:2×Taq Plus PCR Master mix 12.5 μL,上下游引物PPV-VP2-F、R(10 μmol/mL)各1 μL,模板DNA4 μL,用无核酸酶的PCR级无离子水补足至25 μL,混匀,短暂离心后进行扩增。反应条件为94℃5 min,95℃ 30 s、57℃ 30 s、72℃40 s运行35个循环,72℃ 7 min,PCR产物经1.5%琼脂糖凝胶电泳检测。
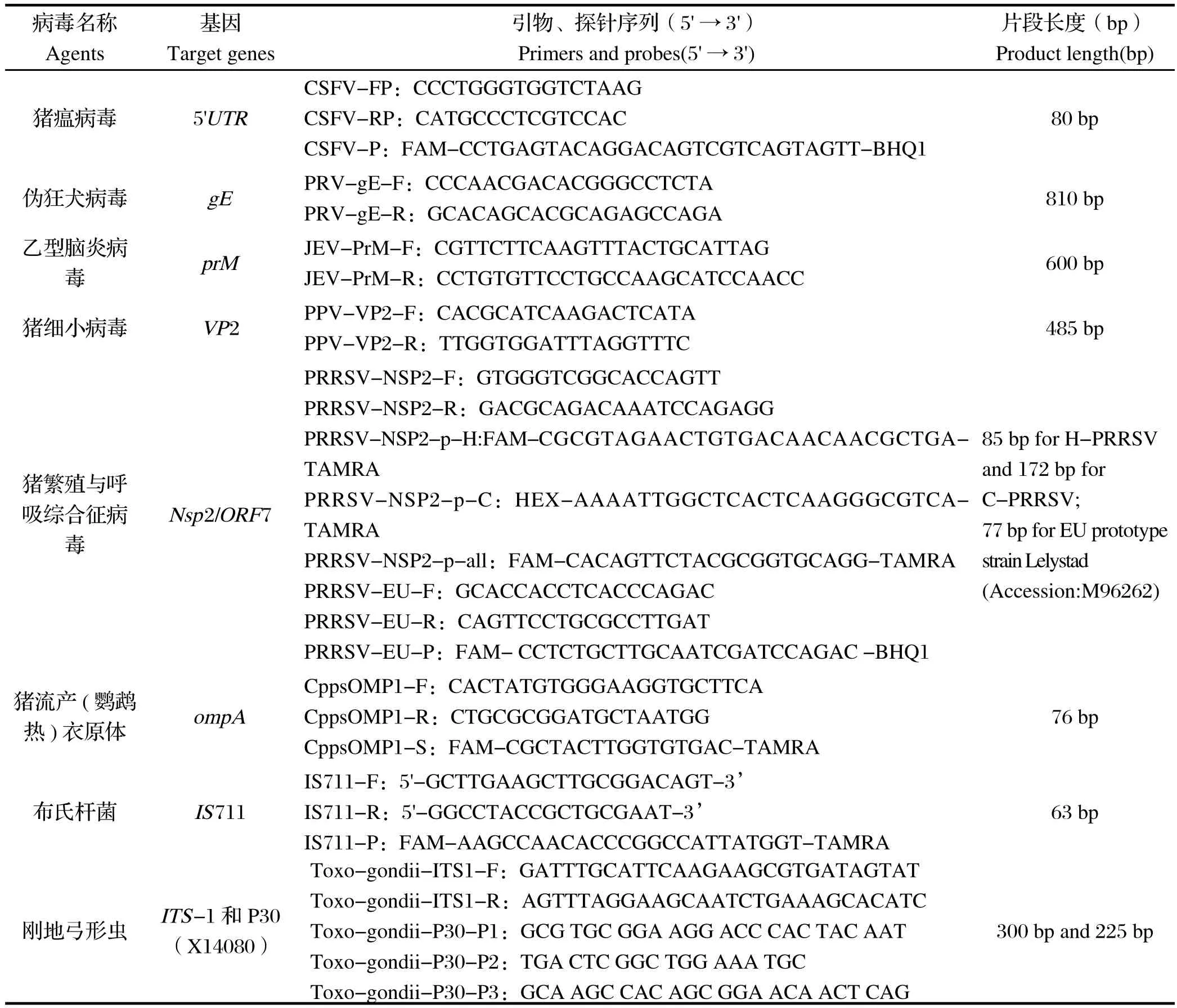
表1 引物、探针Table1 Primers and probes
1.8 伪狂犬病毒、日本乙型脑炎病毒PCR检测、测序及序列分析 伪狂犬病毒 PCR扩增反应体系按照25 μL进行:2×Taq Plus PCR Master mix 12.5 μL,上下游引物PRV-gE-F、R(10 μmol/mL)各1 μL,模板DNA 3 μL,用无核酸酶的PCR级无离子水补足至25 μL,混匀,短暂离心后进行PCR扩增。反应条件为95℃ 5 min,95℃ 40 s、58℃ 40 s、72℃ 90 s运行35个循环,72℃ 5 min,PCR产物经1.5%琼脂糖凝胶电泳检测。
日本乙型脑炎病毒P C R扩增反应体系按照25 μL进行:PrimeScript 1 step Enzyme Mix 12.5 μL,上下游引物JEV-PrM-F、R(10 μm/ mL)各1 μL,模板DNA 3 μL,用无核酸酶的PCR级无离子水补足至25 μL,混匀,短暂离心后进行PCR扩增。反应条件为50℃ 30 min,95℃ 5 min,95℃ 30s、55℃ 30s、72℃ 1 min运行35个循环,72℃5 min。PCR产物经琼脂糖凝胶电泳分析,对目的条带切胶回收、纯化,送昆明硕擎生物科技有限公司进行测序,采用Blast在线比对分析。
1.9 细菌分离、鉴定 将送检流产胎儿内脏器官及大脑组织样品划线接种于血清琼脂平板后,置于普通培养箱及厌氧发生器,37℃培养24~48 h后,观察有无菌落生长,有菌落生长则取少许菌落染色镜检并观察形态。将细菌纯化后,接种细菌生化编码鉴定管进行鉴定。
1.10 病毒分离、鉴定 取5份内脏及大脑组织匀浆样品反复冻融3次后,4500×g离心10 min,取上清经0.2 μm针头式滤头过滤除菌,分别接种于25 cm2猪肾原代细胞及BHK-21传代细胞单层培养瓶各5瓶,同时每种细胞各设立1瓶正常细胞对照。37℃孵育90 min后,移除吸附液,换为含2%胎牛血清(FBS)的1×MEM,37℃培养7~9 d,每天观察细胞病变效应(cytopathic effect,CPE),盲传3~5代,若培养细胞出现规律性CPE时则反复冻融3次后,抽提病毒DNA和RNA进行PCR检测及测序、序列分析。
1.11 昆明小白鼠细菌致病性实验 将分离纯化后的细菌混悬于无菌生理盐水中,经菌数测定后稀释为1.5×108个细菌/mL,每只小白鼠腹腔接种0.1 mL,共接种20只作为实验组,同时设立5只阴性对照,腹腔接种同等剂量无菌生理盐水。接种后观察、记录发病及死亡情况,解剖死亡小白鼠观察病理变化,并无菌采集心血及肝脏回收分离病原菌。
1.12 昆明小白鼠病毒致病性实验 将分离鉴定的病毒分离株细胞培养物反复冻融3次后,4500×g离心10 min,取上清脑内接种40 μL/只,共接种6只作为实验组,同时设立2只阴性对照,脑内接种同等剂量无菌生理盐水。接种后观察、记录发病及死亡情况。
2 结果和讨论
2.1 猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性毒株、经典毒株,猪瘟病毒,猪细小病毒,猪流产衣原体,布氏杆菌,岗地弓形虫PCR及real-time PCR检测结果 5份待检样品经猪繁殖与呼吸综合征病毒欧洲型及美洲型高致病性毒株、经典毒株,猪瘟病毒,猪流产衣原体,布氏杆菌及岗地弓形虫real-time PCR及猪细小病毒PCR检测,结果全为阴性,见图2。
2.2 伪狂犬病毒PCR扩增及序列分析结果 5份待检样品经伪狂犬病毒PCR扩增后,2份脑及1份组织匀浆样品PCR扩增出PRV gE基因目的条带,大小约800 bp(见图3)。序列分析显示其核苷酸序列与NCBI GenBank中伪狂犬病毒参考毒株(登录号:KT936475.1)序列同源性达100%。
2.3 乙型脑炎病毒RT-PCR扩增及序列分析结果 5份待检样品经乙型脑炎病毒RT-PCR扩增后,2份脑组织匀浆样品扩增出JEV prM基因目的条带,大小约600 bp(图4)。序列分析显示其核苷酸序列与NCBI GenBank中的乙型脑炎病毒参考毒株序列(登录号:AB594829.1)同源性达99%。
2.4 细菌分离、鉴定结果 置于37℃有氧及厌氧条件下培养的血清琼脂平板均无菌落生长,细菌分离培养结果见图5。
2.5 病毒分离、鉴定结果 1份内脏组织匀浆样品接种BHK21细胞后,第1代培养至5~8 d,即观察到细胞单层单个细胞脱落较对照细胞多,但无细胞集聚、皱缩及细胞融合现象(见图6)。传代至3~5代后CPE较为明显和规律,收集第5代培养物反复冻融3次后,4500×g离心5 min,抽提病毒DNA和RNA分别进行伪狂犬病毒及日本乙型脑炎病毒检测,PCR仅扩增出600 bp大小的JEV prM基因目的条带,经测序及序列分析后确定为日本乙型脑炎病毒,将分离获得的流行毒株命名为JEV WS-MT-2015-07株。其余4份匀浆样品接种猪肾原代及BHK-21传代细胞后盲传7代,均未观察到任何细胞病变,细胞培养物经过伪狂犬病毒及乙型脑炎病毒PCR检测也呈阴性,最后作无害化处理。
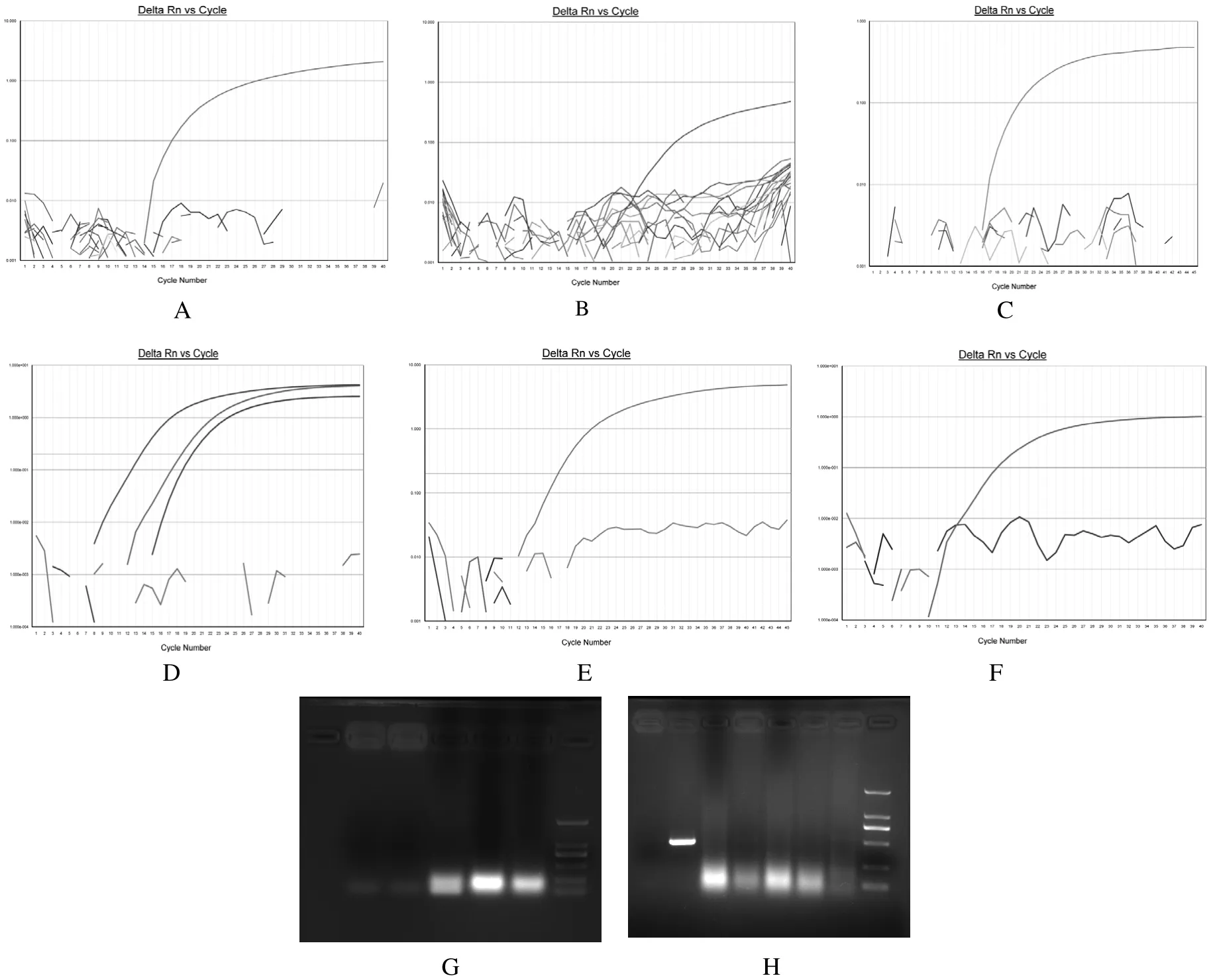
图2 PCR及real-time PCR检测结果Fig.2 The results of PCR and real-time PCR
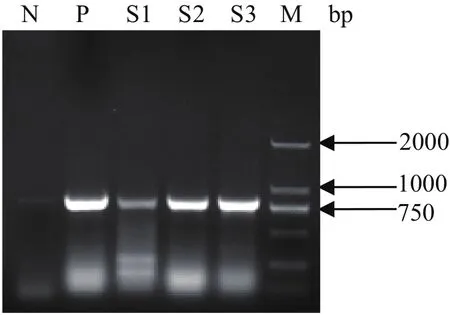
图3 伪狂犬病毒PCR扩增结果Fig.3 PCR results of PRV
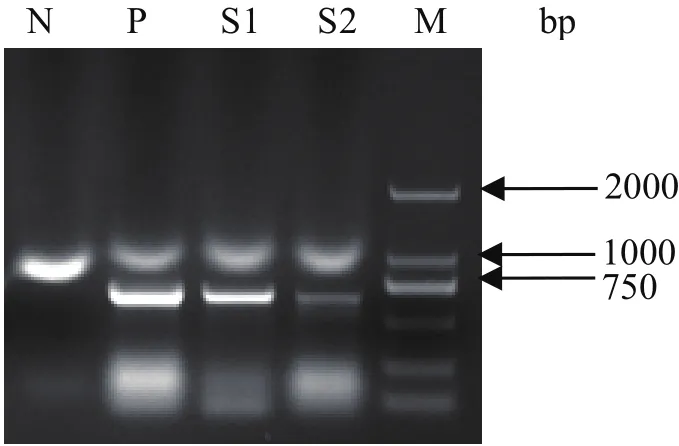
图4 日本乙型脑炎病毒扩增结果Fig.4 PCR result of JEV
本研究对送检的流产猪胎儿大脑、内脏及胎盘组织匀浆样品进行病原学检测,检测出有乙型脑炎及伪狂犬病毒核酸同时存在。运用猪肾原代细胞及BHK-21传代细胞系进行病毒分离、鉴定,结果从1份胎儿内脏分离到1株乙型脑炎病毒,但通过几次尝试分离伪狂犬野毒均告失败,提示送检样品中虽然有PRV核酸的存在,但可能没有或者仅有极少量具有感染力的活病毒粒子存在。比较有意思的是,分离到乙型脑炎病毒的内脏组织匀浆样品却没有被RT-PCR方法扩增出有乙脑病毒核酸的存在,相反prM 基因RT-PCR扩增结果呈阳性的大脑组织匀浆样品反而没有分离到病毒,造成这种现象的原因可能是大脑组织残留有大量乙型脑炎病毒核酸,但没有足够数量的具有感染力的活病毒粒子,内脏组织虽然没有检测出病毒核酸的存在,但却保留有一定数量的具有感染力的活病毒粒子,因而能感染最敏感的细胞株BHK-21细胞而被成功分离获得,从另外一个角度也提示了PCR检测灵敏度可能有时并没有病毒分离的灵敏度高。

图5 细菌分离培养结果Fig.5 The results of bacterial isolation and culture

图6 乙型脑炎病毒分离株在BHK-21细胞上引起的细胞病变Fig.6 CPE caused by JEV isolate in BHK-21
2.6 昆明小白鼠病毒致病性实验结果 JEV分离毒株脑内接种成年昆明小白鼠,40 μL/只,共接种6只,均于攻毒后5~7 d内死亡,2只阴性对照无异常表现(图7)。

图7 昆明小白鼠脑内攻毒实验结果Fig.7 The results of challenge infection with JEV isolate in Kunming mice
[1] 殷震,刘景华.动物病毒学[M].2版.北京: 科学出版社, 1997: 998.
[2] 吴发兴, 郑辉, 元传德, 等.猪伪狂犬病病毒PCR检测方法的建立与应用[J].动物医学进展, 2009, 30(5): 5-9.
[3] 李春华, 王英, 蒋凤英, 等.猪伪狂犬病研究进展[J].动物医学进展, 2008, 29(3): 68-72.
[4] 孔德江, 何晓玲, 易栋, 等.规模化猪场猪伪狂犬病的筛查与防控[J].中国兽医学报, 2009, 10(5): 75-77.
[5] Solomon T, Ni H, Beasley D W, et a1.Origin and evolution of Japanese encephalitis virus insoutheast Asia[J].J Vitrol, 2003, 77(5): 3091-3098.
[6] Weaver S C,Barrett A D T.Transmission cycles,host range,evolution and emergence of arboviral disease[J].Nat Rev Microbiol, 2004, 2(10): 789-801.
[7] Gbler D J.Resurgent arboviral diseases as a global public health problem[M].Xl Vth.International congress for tropical medicine and malaria.1996, 40.
[8] 王守义.流行性乙型脑炎的诊断与治疗[J].华夏医药, 2008, 3(6): 406-408.
[9] 蔡宝祥.动物传染病诊断学[M].南京: 江苏科技出版社, 1992: 93-94.
[10] 邓永, 徐高原.猪乙型脑炎研究进展[J].养殖与饲料, 2007(6): 43-46.
[11] Xiao S, Chen Y,Wang L, et al.Simultaneous detection and differentiation of highly virulent and classical Chinese-type isolation of PRRSV by real-time RTPCR[J].J Immunol Res, 2014: 809656.
[12] Kleiboeker S B, Schommer S K, Lee S M, et al.Simultaneous detection of North American and European porcine reproductive and respiratory syndrome virus using realtime quantitative reverse transcriptase-PCR[J].J Vet Diagn Invest, 2005, 17(2): 165-170.
[13] Pantchev A, Sting R, Tyczka J, et al.New real-time PCR tests for species-specific detection of Chlamydophila psittaci and Chlamydophila abortus from tissue samples[J].Vet J, 2009, 181(2): 145-150.
[14] Hinić V, Brodard I, Thomann A, et al.Novel identification and differentiation of Brucella melitensis, B.abortus, B.suis, B.ovis, B.canis, and B.neotomae suitable for both conventional and real-time PCR systems[J].J Microbiol Methods, 2008, 75(2): 375-378.
[15] 孔得翔, 王素华, 曲道峰, 等.弓形虫半巢式PCR检测方法的建立[J].中国兽医学报, 2009, 29(1): 52-54.
[16] 邵国青, 杨莉莉, 王继春, 等.弓形虫ITS-1序列PCR诊断方法的建立[J].中国人兽共患病学报, 2008, 24(5): 446-450.
DUAL INFECTION OF SWINE PSEUDORABIES VIRUS AND JAPANESE ENCEPHALITIS VIRUS IN PIGS
LIU Ning1, SONG Cong1, GAO Lin2, XIE Jia-rui2, LI Hua-chun2, WANG Jing-lin2, YAO Jun2, WANG Sheng-kui1
(1.College of Animal Science and Technology, Yunnan Agricultural University, Kunming 650201,China; 2.Yunnan Tropical and Subtropical Animal Virus Diseases Laboratory, Yunnan Animal Science and Veterinary Institute, Kunming 650224, China )
A reproductive disease with clinical manifestations of boar testicle swelling, sow abortion, stillbirth, mummy and weak offspring occurred on a large-scale pig farm from July to August of 2015 in city of Wenshan, Yunnan province.In order to identify the etiological agent(s), CSFV, PRRSV (American/EU type/), PPV, PRV, JEV, Chlamydia psittaci, Toxoplasma gondii, Brucella suis were examined using PCR, real-time PCR and bacterial isolation.As a result, 600 bp fragments of PrM gene of JEV and 810 bp fragments of gE gene of PRV were amplified in RT-PCR or PCR.Sequence analysis showed that the homology of nucleotide sequences of the amplicons was 99% with the reference strains of JEV (Accession:AB594829.1) and 100% with PRV (Accession:KT936475.1) from GenBank.In addition, primary pig kidney cells and BHK21 cells were used for virus isolation.One virus isolate of JEV was obtained from aborted fetal tissue and designated as JEV-2015-WS-YN.Although PRV detection in PCR was positive, isolation of PRV failed after5 blind passages in primary pig kidney cells and BHK21 cells.According to the animal pathogenicity, epidemiology and etiology analysis, this reproductive failure was most likely caused by dual infection of JEV and PRV.After immunization with Japanese encephalitis attenuated live vaccine (SA14-14-2 strain) and pseudorabies gene deletion vaccine (Bartha K61 strain), the reproductive problem was prevented and controlled successfully in pig herds.
Swine psdeudorabies virus; Japanese encephalitis virus; dual infection
S852.659.1
B
1674-6422(2016)02-0068-08
2015-12-01
云南省科技厅重大科技专项(2012ZA017)
刘宁,男,硕士研究生,临床兽医学专业
姚俊,E-mail:810535839@qq.com;王生奎,E-mail:544628182@qq.com
