超声引导细针穿刺在脾脏弥散性病变诊断中的应用
2016-11-30曹授俊北京农业职业学院北京房山102442
李 朋 姜 晨 胡 平 曹授俊 (北京农业职业学院 北京 房山 102442)
超声引导细针穿刺在脾脏弥散性病变诊断中的应用
李 朋 姜 晨 胡 平 曹授俊 (北京农业职业学院 北京 房山 102442)
本文通过对笔者收集的10例非脾扭转的犬猫脾脏弥散性低回声小结节病变并进行超声引导细针穿刺检查的病例进行分析,所有病例超声引导穿刺均获得良好的细胞学样本,穿刺后均未见出血并发症发生,提示超声引导脾脏穿刺安全可行。收集样本中淋巴瘤病例占60%,髓外造血占30%,肥大细胞瘤占10%,提示相同脾脏弥散性低回声小结节声像有多重鉴别诊断需要区分。
犬猫 脾脏 超声 细针穿刺
本文就超声引导细针穿刺在脾脏弥散性病变诊断中的应用效果的情况进行了总结。
1 材料与方法
1.1 材料来源 2014年5月~2016年4月在北京农业职业学院教学合作动物医院,超声检查脾脏不同程度增大,脾脏内部出现弥散性低回声小结节病变的病例(图1),并通过超声引导细针穿刺检查确诊定性的10个病例(见附表)。
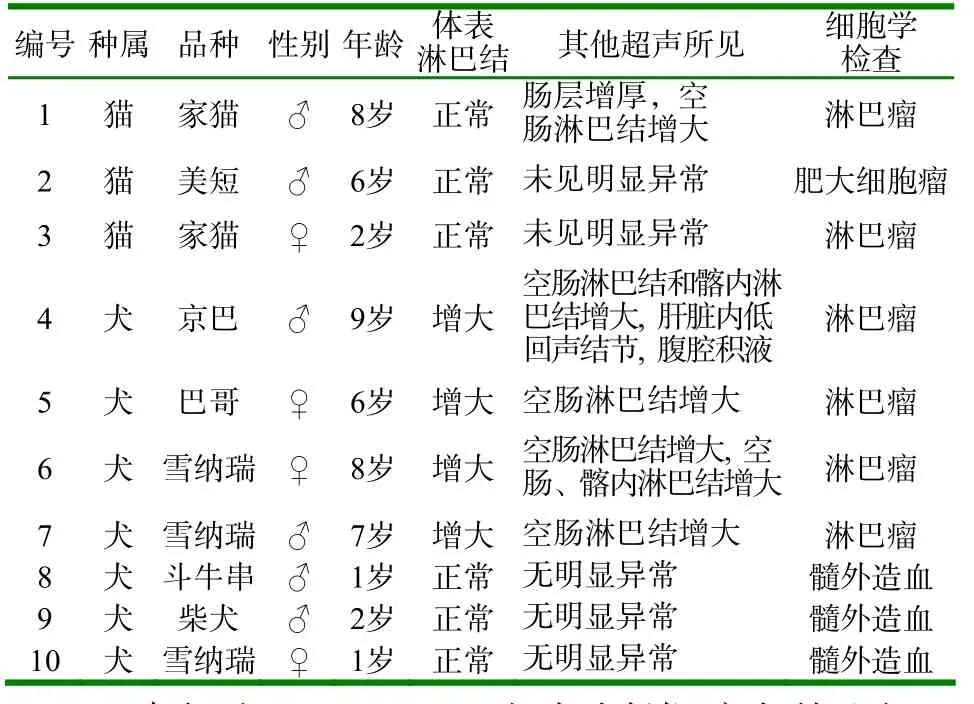
附表 病历概况
1.2 设备耗材 Mylab30VET超声诊断仪(意大利百胜),配置线阵探头(选用探头频率为7.5MHz)、医用超声耦合剂、PE手套、医用酒精、5ml注射器。
1.3 检查方法 犬猫腹部剃毛,仰卧位进行脾脏扫查[1]。对脾体所在区域的皮肤进行外科消毒,探头上涂抹耦合剂并使用PE手套包裹。在体表和包裹探头的PE手套上涂抹酒精再次进行脾脏探查。将5ml注射器吸入3ml气体,在超声引导下对脾脏不同方向进行4次前进后退穿刺针的切割采样(图2)。同一个体做4次不同区域采样,并制作细胞学涂片送检[2]。细胞学结果由2名临床病理学专家判读,且结果一致。
2 结果
所有病例在脾脏穿刺过程中未有明显不适,穿刺后30min均未见脾脏有出血并发症发生。脾脏弥散性病变超声引导细胞学检查收集样本良好,均可为细胞学判读提供样本。收集样本中淋巴瘤病例占60%,髓外造血占30%,肥大细胞瘤占10%。

图1 脾脏弥散性病变病例6的脾脏声像图,脾脏体积增大,内部呈现典型的“奶酪样”弥散性低回声特征,彩色多普勒显示脾脏血供未见明显异常。
图2 脾脏超声引导穿刺 弥散性脾脏病变时采样靶目标较大,超声探查在脾脏较大的脾体位置,直接引导穿刺。
3 讨论与小结
3.1 超声引导穿刺检查 (1)所有病例在穿刺前30min,动物皮下注射苯海拉明以防止病变为肥大细胞瘤时脱颗粒导致动物发生休克。对于不配合的动物穿刺前给予镇静可保证更好的获得样本,由于脾脏接近于体表,弥散性病灶超声引导徒手穿刺即可完成采集,且10只动物都较配合,所有病例均未再给予镇静处理。(2)穿刺前皮肤进行外科消毒处理,超声探头上涂抹耦合剂并外包裹PE手套。手套表面涂抹医用酒精,并将酒精涂抹于皮肤发挥超声耦合作用进行超声引导穿刺。此种操作简单快捷,设备简单,方便临床医生操作。(3)在获得犬猫脾脏样本进行细胞学检查时,切割技术能够获得更好的样本,采样细胞形态较为完整,且出血干扰较少[3]。而当进行细针抽吸时血液对样本的污染较为严重,故而不推荐细针抽吸采集脾脏样本。(4)穿刺侵入性小且相对易于操作,只要动物充分保定以减少脾脏损伤的风险,整个过程风险极低。穿刺后30min使用彩色多普勒超声对穿刺部位进行观察所有病例均未见到出血征象,说明超声引导穿刺采样比较安全。
3.2 不同病变的声像特征 (1)脾脏扭转时超声检查显示脾脏也是弥散性回声降低声像,但使用彩色多普勒可以很好的诊断[4],故而本实验收集的声像图病例未包括脾扭转的病例。(2)4例犬的淋巴瘤病例,体表淋巴结增大,腹腔内空肠淋巴结和髂内淋巴结不同程度增大,2例表现肝脏肿大,回声降低,并有不同程度的腹腔积液。提示当存在体表淋巴结增大及腹腔内淋巴结增大时,同样的脾脏回声弥散性降低淋巴瘤的可能性增大[5]。3例犬髓外造血病例均为青年犬,回顾性调查发现3~6月前均有不同原因的溶血病史,而未见其他声像异常。结合病史虽然可以进行髓外造血的推断,但也无法完全排除淋巴瘤及肥大细胞的可能性。(3)2例猫的淋巴瘤病例,8岁家猫表现为空肠壁增厚,分层缺失;2岁家猫未见其他超声异常。老龄猫淋巴瘤常以胃肠道型为主,同时侵袭到脾脏;幼龄猫患有淋巴瘤通常与白血病病毒感染有关联[6]。另1例猫的肥大细胞瘤除了脾脏病变外其他未见明显异常[6,7]。单独从脾脏的声像图上很难区分淋巴瘤和肥大细胞瘤病变。(4)脾脏弥散性低回声结节病变单独依靠超声表现很难区分。虽然结合其他超声检查信息可以做出更合理的鉴别诊断排序,但仍不能缩小鉴别诊断范围。脾脏超声引导穿刺检查可有助于病变的进一步确诊。
[1] Dominique Penninck. 2008. Atlas of small animal ultrasonography. USA∶ Wiley-Blackwell.
[2] Frances JB. Lorrie G, 2011. Manual of Canine and Feline Ultrasonography[M]. BSAVA.
[3] LeBlanc CJ, Head LL and Fry MM (2009) Comparison of aspiration and non-aspiration techniques for obtaining cytological samples from the canine and feline spleen. Veterinary Clinical Pathology 38,242-246.
[4] 李朋, 姜晨, 董悦农等. 犬单纯性脾扭转的超声诊断[J]. 中国兽医杂志, 2011, 47(1)∶ 74-75.
[5] 陈艳云, 董军, 郑兰等. 22例犬多中心淋巴瘤的诊断[J]. 中国兽医杂志, 2013, 49(1)∶ 59-60.
[6] Richard WN, Guillermo C, et al. 小动物内科学(第3版)[M]. 夏兆飞,张海彬, 袁占奎等译. 北京∶ 中国农业出版社, 2012∶ 1073-1098.
[7] Sato AF. Sola M, 2004. Ultrasonographic findings in abdominal mast cell disease∶ a retrospective study of 19 patients. Veterinary Radiology and Ultrasound 45, 51-57.
S857.12+1
A
1007-1733(2016)11-0006-02
2016-08-04)
北京农业职业学院2014年科研项目(XF-YF-14-15)
