小麦 TcLr19PR2基因在茉莉酸甲酯、乙烯及叶锈菌胁迫下的表达分析
2016-11-30张家瑞张艳俊王海燕刘大群
张家瑞,张艳俊,王 菲,王海燕,刘大群
(河北农业大学植物保护学院/河北省农作物病虫害生物防治工程技术研究中心,河北保定 071001)
小麦 TcLr19PR2基因在茉莉酸甲酯、乙烯及叶锈菌胁迫下的表达分析
张家瑞,张艳俊,王 菲,王海燕,刘大群
(河北农业大学植物保护学院/河北省农作物病虫害生物防治工程技术研究中心,河北保定 071001)
为揭示小麦 TcLr19PR2基因在信号分子和叶锈菌诱导下的表达情况,利用半定量RT-PCR方法分析了不同浓度茉莉酸甲酯(MeJA)和乙烯(ETH)诱导后于不同时间点该基因表达模式,明确MeJA和ETH最佳诱导浓度及诱导时间,同时分析了MeJA和ETH预处理后于不同时期接种叶锈菌后该基因在小麦中的表达特征。结果表明,MeJA和ETH的最佳诱导浓度分别为0.1和1.0 mmol·L-1。接种叶锈菌后, TcLr19PR2基因表达量在MeJA诱导后0~3 d都有明显上调,并在MeJA预处理3 d后接种叶锈菌24 h时 TcLr19PR2基因表达量达到最大,基因表达峰值的出现要早于未接菌处理;ETH预处理3 d后接种叶锈菌24 h时 TcLr19PR2基因表达水平开始升高,预处理10 d后,接菌处理的各时间点均高于未接菌处理。以上结果说明,叶锈菌和信号分子协同作用能够显著诱导 TcLr19PR2基因的表达,共同参与小麦品系TcLr19的抗叶锈病防御反应。
小麦;叶锈菌;信号分子;β-1,3-葡聚糖酶基因;表达分析
β-1,3-葡聚糖是真菌细胞壁的重要结构成分。许多真菌的菌丝尖端往往直接受到β-1,3-葡聚糖酶的攻击。β-1,3-葡聚糖酶能催化β-1,3-葡聚糖多聚体水解,水解的寡糖产物是植物防御反应的重要激发子。激发子作为植物-病原菌相互识别的重要信号分子,能诱导植物产生重要防卫反应,可对侵染真菌的菌丝壁直接进行攻击,从而抑制真菌的生长与增殖,并且催化的水解产物可以作为下游信号分子,进一步诱导防御,从而使植物表现抗病性[1-2]。β-1,3-葡聚糖酶还可以有效调节各种信号分子的胁迫,例如水杨酸(salicylic acid,SA)、脱落酸(abscisic acid,ABA)和乙烯(ethylene,ETH)[3]。Niu等[4]用茉莉酸甲酯(methyl jasmonate,MeJA)处理小麦幼苗叶片后,通过离体叶段培养法接种白粉菌(Blumeriagraminisf.sp.tritici,Bgt)进行抗性鉴定,并用实时定量PCR技术检测叶片中β-1,3-葡聚糖苷酶基因的表达量变化,结果表明,白粉菌对β-1,3-葡聚糖苷酶的诱导作用可达10~70倍,β-1,3-葡聚糖苷酶基因的表达明显增强。傅俊范等[5]用MeJA处理人参后接种锈腐菌发现,人参根系β-1,3-葡聚糖酶和几丁质酶的活性均较对照增强,表明β-1,3-葡聚糖酶和几丁质酶在MeJA诱导人参抗人参锈腐病的过程中起重要作用。
正常情况下,β-1,3-葡聚糖酶在植物体内表达很少。植物在病原真菌入侵后,β-1,3-葡聚糖酶防卫蛋白在细胞内积累会有所增加。有研究表明,水稻在纹枯菌侵染24 h后,受感染植株的β-1,3-葡聚糖酶活性较正常植株蛋白活性增强3.9倍[6],而小麦在被禾谷类镰刀菌感染后72 h,则完全诱导产生了β-1,3-葡聚糖酶[7],但这些蛋白往往表达量不够,或表达期太晚,或由于病原真菌分泌蛋白对内源 β-1,3-葡聚糖酶的抑制等,以致不能使植物体免受病害。所以现在经常将外源β-1,3-葡聚糖酶基因导入植物,可提高植物对病原菌的抗性。超表达β-1,3-葡聚糖酶增强了植株抵御真菌病害的能力。刘桂珍等[8]通过激光微束穿刺法将含有β-1,3-葡聚糖酶和几丁质酶基因的双价载体pLGC导入棉花幼胚,进而选育出对黄萎病具有较高抗性的转基因棉花株系。目前,已从青花菜[9]、指天蕉[10]、棉花[11]、荔枝[12]、毛竹[13]和甘蔗[14]等植物中分离到β-1,3-葡聚糖酶基因。在小麦与根腐菌[15]和条锈菌[16]互作中也有相关的报道。
小麦品系TcLr19携带抗叶锈病基因 Lr19,该基因是一个全生育期抗性基因,对全国大部分生理小种均有很好的抗性,具有良好的开发应用前景。本实验室前期采用RT-PCR方法在TcLr19中获得1个β-1,3-葡聚糖酶基因,命名为 TcLr19PR2,并利用半定量RT-PCR分析该基因在叶锈菌诱导不同时间后的转录情况,初步明确了该基因表达明显受小麦叶锈菌诱导,同时构建了 TcLr19PR2基因的原核表达载体pEASY- PR2并获得一个分子量约为30 kDa的融合蛋白。本研究拟利用半定量RT-PCR方法分析不同浓度MeJA和ETH诱导后于不同时间点该基因表达模式,明确MeJA和ETH最佳诱导浓度及诱导时间,同时分析了MeJA和ETH预处理后于不同时期接种叶锈菌后该基因在小麦中的表达特征,为揭示 TcLr19PR2基因在信号分子和叶锈菌诱导下的表达模式提供理论依据。
1 材料与方法
1.1 材 料
供试小麦材料为以Thatcher为遗传背景的携带小麦抗叶锈病基因 Lr19的回交6代近等基因系材料TcLr19,供试小麦叶锈菌菌株为07-10-421-3(FHJT),与TcLr19为非亲和组合(侵染型为“;”),均由河北农业大学小麦锈病研究室收集保存。
1.2 材料的处理及取样
参考张艳俊等[17]及Zambounis等[18]的方法分别配置0.01、0.05、0.1和1.0 mmol·L-1四种不同浓度的ETH和MeJA溶液,于一心一叶期,喷洒小麦叶片表面至溶液滴下,温室内培养。分别于喷施后0、6、12、24、48、72、96、120 h时,剪取叶片0.1 g,液氮速冻,于-80 ℃条件下保存,以备用于筛选最佳诱导浓度。
以上述筛选到的最佳诱导浓度的MeJA和ETH分别处理小麦叶片0、1、3、5和10 d后,采用撒粉法接种叶锈菌07-10-421-3(孢子萌发率为80%以上),同时设不接菌及清水对照;在小麦叶片上喷水雾后,置黑暗条件下保湿14~16 h,然后转入温度为18~25 ℃、光照时间为10~14 h的温室培养。分别于接种后0、24、48、72、96和120 h时取叶片0.1 g,液氮速冻,-80 ℃条件下保存,以备用于分析 TcLr19PR2基因在MeJA和ETH胁迫及接菌诱导情况下的表达模式。
1.3 总RNA提取和cDNA第一链的合成
采用Bio-Flux公司的BIOZOL提取小麦各处理样品总RNA,按照宝生物工程大连有限公司的反转录酶试剂盒说明书合成cDNA第一链。
1.4 小麦 TcLr19PR2基因的表达分析
根据前期获得的 TcLr19PR2基因全长序列,设计特异引物qTcLr19PR2-F/qTcLr19PR2-R(qTcLr19PR2-F: 5′-CAACGAGAACCAGAAG GACAGC-3′; qTcLr19PR2-R: 5′-TACGGACG GACATACGGACACT-3′)进行半定量RT-PCR分析。其中,内标为小麦中组成型表达基因甘油醛-3-磷酸脱氢酶基因(GAPDH,GenBank登录号:AF251217),其特异性引物为GAPDH-F/GAPDH-R(GAPDH-F: 5′-AACTGCCTTGC TCCTCTTGC-3′; GAPDH-R: 5′-CTGTTGTC ACCCTGGAAGTCA-3′)。以小麦叶锈菌诱导后的TcLr19小麦cDNA为模板进行PCR扩增。PCR反应体系:100 ng模板cDNA,10 μmol·L-1引物1 μL,10 mmol·L-1dNTPs 0.5 μL,2.5 U·μL-1TaqDNA聚合酶0.3 μL,10×PCR缓冲液2.5 μL,加入灭菌ddH2O至25 μL。PCR反应程序:94 ℃预变性1 min;94 ℃变性30 s,64 ℃退火1 min,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳后,通过genetools软件得出表达量大小,利用SPSS软件进行方差和显著性分析。
2 结果与分析
2.1 不同浓度MeJA诱导 TcLr19PR2基因的表达分析
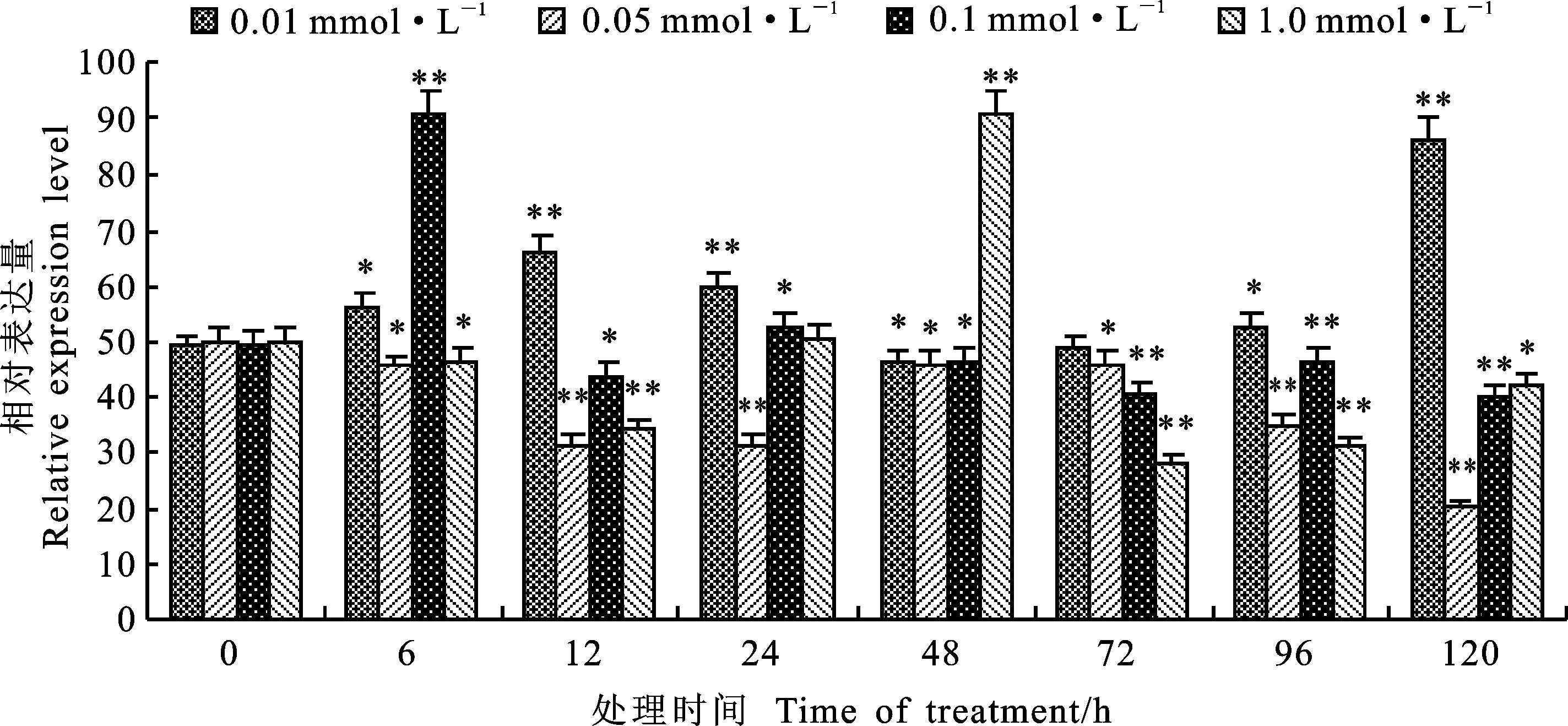
不同浓度MeJA处理小麦叶片后,与对照(0 h)相比,小麦 TcLr19PR2基因的表达量在各时间点变化明显(图1)。0.01 mmol·L-1MeJA胁迫处理后,在120 h时出现表达高峰;0.05 mmol·L-1MeJA胁迫处理后,各时间点的表达量均低于0 h;0.1 mmol·L-1MeJA胁迫处理后,在6 h时表达量显著上调并达到最大;1.0 mmol·L-1MeJA胁迫处理后,48 h时表达量有上调并达到最大。虽然0.01、0.1和1.0 mmol·L-1MeJA胁迫处理后 TcLr19PR2基因的表达出现高峰时表达量相近,但0.1 mmol·L-1MeJA胁迫处理出现高峰的时间明显早于0.01 mmol·L-1和1.0 mmol·L-1MeJA胁迫处理,综合表达高峰出现时间的早晚及表达量的高低最终明确0.1 mmol·L-1MeJA为 TcLr19PR2基因的最佳诱导浓度。
*和**分别表示与对照差异在0.05和0.01水平上显著。下同。
* and ** indicate significant difference between reagent treament and CK at 0.05 and 0.01 levels, respectively. The same as below.
图1 不同浓度MeJA处理下 TcLr19PR2基因的相对表达量
Fig.1 Expression levels of TcLr19PR2 gene induced by different concentrations of MeJA
2.2 不同浓度ETH诱导 TcLr19PR2基因的表达分析
不同浓度ETH处理小麦叶片后,与对照(0 h)相比,小麦 TcLr19PR2基因的表达量在各时间点同样变化明显(图2)。0.01 mmol·L-1ETH胁迫处理后, TcLr19PR2基因的表达量在48 h时有所上调,其余各时间点均低于0 h;0.05 mmol·L-1ETH胁迫处理后, TcLr19PR2基因的表达量在各时间点均低于0 h;0.1 mmol·L-1ETH胁迫处理后, TcLr19PR2基因的表达量6 h显著上调并达到最大;1.0 mmol·L-1ETH胁迫处理后,在24 h时其表达量急剧上升并达到最大值。虽然0.1 mmol·L-1ETH胁迫处理后 TcLr19PR2基因的表达出现高峰时间要明显早于1.0 mmol·L-1ETH胁迫处理,但表达量要低于1.0 mmol·L-1ETH胁迫处理。综合表达高峰出现时间及表达量结果,1.0 mmol·L-1ETH为 TcLr19PR2基因的最佳诱导浓度。
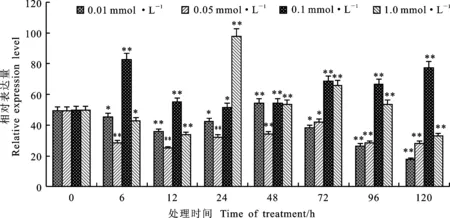
图2 不同浓度ETH处理下 TcLr19PR2基因的相对表达量
2.3 MeJA胁迫处理后不同时期接菌诱导 TcLr19PR2基因的表达分析
0.1 mmol·L-1MeJA胁迫处理0、1、3、5和10 d后清水对照与仅用MeJA胁迫处理相同时间后 TcLr19PR2基因表达趋势基本一致,无明显差异。而用0.1 mmol·L-1MeJA胁迫处理后再接种叶锈菌, TcLr19PR2基因的表达量在各时间点有所变化,以0~3 d上调较为明显,并在第3天24 h时达到最大,约为对照(0 h)的4倍(图3)。此外,MeJA胁迫处理3~10 d后接种叶锈菌, TcLr19PR2基因表达量有所降低,虽在胁迫处理5 d和10 d后接种叶锈菌,该基因分别在120 h和0 h出现了两个表达高峰,但均不高于第3天24 h时的表达量。因此,MeJA预处理后再接种叶锈菌在各时间点均会有基因的表达,但以MeJA预处理后3 d接种叶锈菌 TcLr19PR2基因表达量最高,表明MeJA预处理后3 d TcLr19PR2基因与叶锈菌协同作用最明显。
2.4 ETH胁迫处理后不同时期接菌诱导 TcLr19PR2基因的表达分析
1.0 mmol·L-1ETH胁迫处理0、1、3、5、10 d后不同时间点接种清水与仅用ETH胁迫处理相同时间后 TcLr19PR2基因表达趋势基本一致,并无明显的变化。而用1.0 mmol·L-1ETH胁迫处理后再接种叶锈菌, 结果表明,0~1 d时 TcLr19PR2基因表达量变化较大,与两种未接菌处理相比虽然个别时间点表达量有所升高,但都不高于第1天的0 h时未接菌组的表达量,随后在3~5 d基因表达量从第3天24 h开始高于未接菌处理,虽然在第5天的0 h及24 h表达有所降低,但整体水平还是高于未接菌处理的,到第10天, TcLr19PR2基因表达量在各时间点明显都高于未接菌处理,其中以96 h表达量为最大(图 4)。总体来说,用ETH预处理后再接种叶锈菌, TcLr19PR2基因在各时间点均会有所表达,只是基因的高表达均出现在后期,分析前期可能主要参与其他信号通路。总之,ETH与叶锈菌共同作用可以诱导 TcLr19PR2基因的表达。
3 讨 论
大量的研究表明,病程相关蛋白(pathogenesis-related proteins,PR)基因在植物后期的防卫反应中发挥着重要的作用,当植物受到外界不良环境条件刺激时,植物体内化学分子的含量会增加。其中β-1,3-葡聚糖酶是一类重要的病程相关蛋白(PR2),通常以基因家族形式存在。β-1,3-葡聚糖酶不仅能直接作用于病原菌细胞壁,而且其作用的产物(低聚糖)可作为诱导物诱导与其他抗病反应有关的酶系,由此促进了植保素、木质素等抗病物质的合成与积累,进而增强植物的抗病性[19-20]。孙 斌等[21]从小麦叶片中提取的β-1,3-葡聚糖酶对小麦纹枯病和烟草赤星病均具有抑制作用。此外,植物的β-1,3-葡聚糖酶活性可以由病原菌的感染而增强,也能被一些诱导物所诱导。
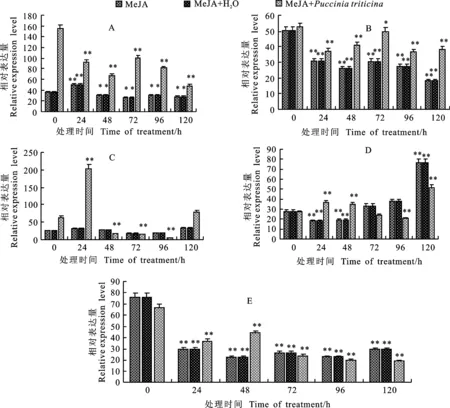
A~E表示小麦叶片经0.1 mmol·L-1MeJA分别预处理0、1、3、5和10 d。
A-E indicate wheat leaves treated with 0.1 mmol·L-1MeJA for 0, 1, 3, 5 and 10 d, respectively.
图3 0.1 mmol·L-1MeJA及接菌处理下 TcLr19PR2基因的相对表达量
Fig.3 Expression level of TcLr19PR2 under 0.1 mmol·L-1MeJA andP.triticina
MeJA作为一种信号分子,可以参与植物对病原菌的应答反应和信号传递,从而诱导植物的抗病反应[22]。宾金华等[23]报道,MeJA处理烟草幼苗可以提高幼苗抗炭疽病的能力。张智慧等[24]研究表明,MeJA处理水稻后提高了水稻幼苗的抗瘟性。本研究明确 TcLr19PR2基因明显受MeJA的诱导,外源喷施0.1 mmol·L-1的MeJA后再接种叶锈菌, TcLr19PR2基因表达量在特定时间点会有所上调,整体表达水平相对高于未接菌的处理组。其次发现接菌处理后, TcLr19PR2基因的表达量有一个从低到高继而又有所下降的趋势,原因可能是MeJA诱导抗病效果有一定的时间持续性,一定浓度的MeJA 诱导一定时间后激发相关防卫基因表达水平达到峰值,抗病效果最佳,随后植株体内MeJA 逐渐被消耗,诱导的防卫基因表达下降,抗病性有所降低[25-26],这与向妙莲等[27]的研究结果相一致。ETH在植物的抗病反应中是植物防御反应的报警信号物质,同时参与防御反应。有研究表明,植物在受病原菌侵染后,ETH的积累量会明显增加,并且可诱导激活包括葡聚糖酶(PR-2)、几丁质酶(PR-3)和抗菌肽以及渗透调节蛋白(osmotin)在内的PR的表达和积累。ETH的信号转导既能参与R基因抗病反应,又能激发活性氧自由基(reactive oxygen species,ROS)的积累,同时也能引起感病组织的PCD(programmed cell death)[28]。Lund等[29]将番茄细菌性叶斑病原菌(Pseudomonassyringaepv.tomato)接种在番茄幼苗上,发现ETH合成量有所增加,高峰持续时间也长,并且ETH合成时间与病斑形成时间一致,这表明ETH在番茄应答病害反应中与病斑的形成是有联系的。此外,SA、JA(jasmonic acid)和ETH都参与植物对病原菌侵染和外界伤害的应答反应,它们的信号途径之间存在着交叉,但SA主要诱导酸性PR基因的表达,而JA和ETH主要诱导碱性PR基因的表达。当植物受到病原菌侵染时,能够同时触发ETH和JA这两种信号途径,二者共同促进植物应答伤病的防卫基因的表达。在本研究中,用不同浓度ETH胁迫处理后发现, TcLr19PR2基因表达量是有差异的,从中筛选得到最佳诱导浓度1.0 mmol·L-1。在利用最佳浓度的ETH胁迫处理植株后接种叶锈菌,发现 TcLr19PR2基因表达量在不同时间点有所不同,但从第3天开始有所增高,到第10天时则明显高于ETH诱导处理。在第3天至第10天期间, TcLr19PR2基因表达量虽有所升高,但是总体来说上升幅度不算太大,且在某个时间点时会出现下降,但在第10天时,总体水平都较高,最大水平时约是对照的6倍,原因可能是在植株生长前期有其他信号途径在起主要作用,而ETH的作用相对出现滞后。
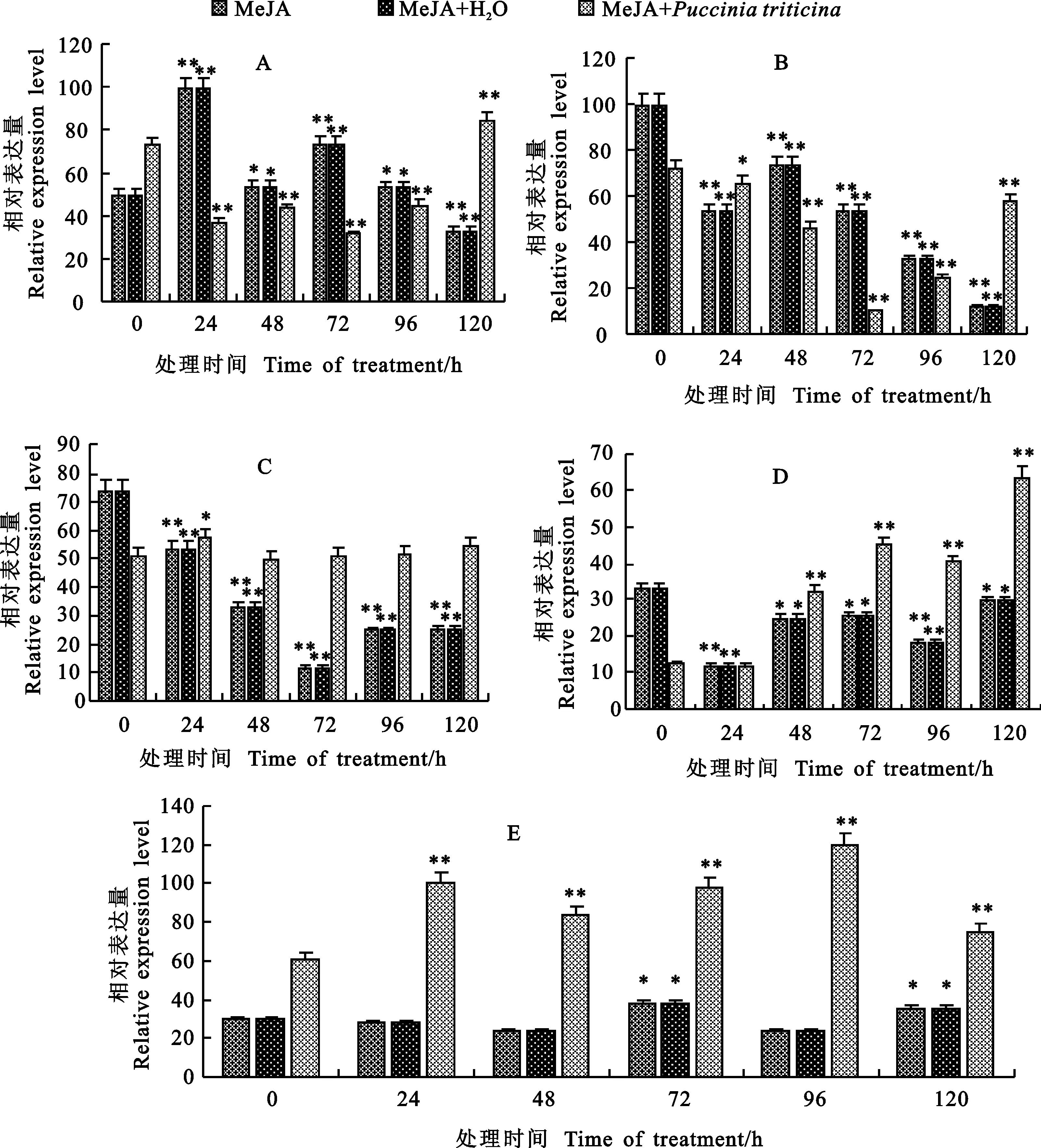
A~E表示小麦叶片经1.0 mmol·L-1ETH分别预处理0、1、3、5和10 d。
A-E indicate wheat leaves treated with 1.0 mmol·L-1ETH for 0, 1, 3, 5 and 10 d, respectively.
图4 1.0 mmol·L-1ETH及接菌处理下 TcLr19PR2的相对表达量
Fig.4 Expression level of TcLr19PR2 under 1.0 mmol·L-1of ETH andP.triticina
综上所述,经不同浓度的MeJA和ETH胁迫处理后接种叶锈菌,小麦中β-1,3-葡聚糖酶的活性在不同时间点均会出现表达高峰。而且,MeJA处理后接种叶锈菌,β-1,3-葡聚糖酶活性高峰在0 d即出现,并在第3天达到最大,而单独用MeJA处理酶活性高峰则出现晚,说明MeJA与叶锈菌协同而作用可更快诱导小麦中β-1,3-葡聚糖酶的表达。另外,用ETH胁迫处理后接种叶锈菌,β-1,3-葡聚糖酶活性在第5天有所增加,到第10天各时间点均高于前两种处理,说明ETH和MeJA可能存在协同作用,两者在病原菌侵染前后期均可发挥作用。
[1]ESQUERRÉ T M,BOUDART G,DUMAS B.Cell wall degrading enzymes,inhibitory proteins,and oligosaccha-rides participate in the molecular dialogue between plants and pathogens [J].PlantPhysiologyandBiochemistry,2000,38(1):157.
[2]KLARZYNSKI O,PLESSE B,JOUBERT J M,etal.Linear beta-1,3 glucans are elicitors of defense responses in tobacco [J].PlantPhysiology,2000,124(3):1027.
[3]CHOUDHURY S R,ROY S,SINGH S K,etal.Molecular characterization and differential expression of β-1,3-glucanase during ripening in banana fruit in response to ethylene,auxin,ABA,wounding,cold and light-dark cycles [J].PlantCellReport,2010,29(8):813.
[4]NIU J S,LIU J,MA W B,etal.The relationship of methyl jasmonate enhanced powdery mildew resistance in wheat and the expression of 9 disease resistance related genes [J].AgriculturalScience&Technology,2011,12(4):504.
[5]傅俊范,孙嘉曼,周如军,等.茉莉酸甲酯对人参β-1,3-葡聚糖酶和几丁质酶活性的影响[J].中国农学通报,2012,28(9):214.
FU J F,SUN J M,ZHOU R J,etal.Effect of methyl jasmonate on the activities of β-1,3-glucanase and chitinase in ginseng [J].ChineseAgriculturalScienceBulletin,2012,28(9):214.
[6]LEE J,BRICKER T M,LEFEVRE M,etal.Proteomic and genetic approaches to identifying defence-related proteins in rice challenged with the fungal pathogenRhizoctoniasolani[J].MolecularPlantPathology,2006,7(5):405.
[7]Geddes J,Eudes F,Laroch A,etal.Differential expression of proteins in response to the interaction between the pathogenFusariumgraminearumand its host,Hordeumvulgare[J].Proteomics,2008,8(3):545.
[8]刘桂珍,蓝海燕,田颖川,等.利用激光微束穿刺法获得抗黄萎病转基因棉花的研究[J].中国激光,2000,27(3):279.
LIU G Z,LAN H Y,TIAN Y C,etal.Studies onVerticilliumandFusariumwilt resistant cotton plants with trangenosis by laser microbeam puncture [J].ChineseJournalofLasers,2000,27(3):279.
[9]靳敏峰,侯喜林.青花菜β-1,3葡聚糖酶基因的克隆、表达分析及其植物表达载体的构建[J].南京农业大学学报,2008,31(2):27.
JIN M F,HOU X L.Cloning and characterization of β-1,3-glucanase gene cDNA fromBrassicaoleraceaL.and construction of its plant expression vector [J].JournalofNanjingAgriculturalUniversity,2008,31(2):27.
[10]翟国会,阮小蕾,吴丽婷,等.指天蕉β-1,3-葡聚糖酶基因全长cDNA的克隆及序列分析[J].中国农业科学,2011,44(15):3134.
ZHAI G H,RUAN X L,WU L T,etal.Cloning and sequence analysis of a full-length cDNA of β-1,3-glucanase gene fromMusapisangawake[J].ScientiaAgriculturaSinica,2011,44(15):3134.
[11]高玉龙,郭旺珍,王 磊,等.一个棉花β-1,3-葡聚糖酶基因全长cDNA的克隆与特征分析[J].作物学报,2007,33(8):1310.
GAO Y L,GUO W Z,WANG L,etal.Cloning and characterization of one β-1,3-glucanase gene cDNA in cotton(GossypiumbarbadenseL.) [J].ActaAgronomicaSinica,2007,33(8):1310.
[12]吴富旺,邝健飞,陆旺金,等.荔枝果实内切1,4-β-葡聚糖酶基因(EG)的克隆及其表达分析[J].园艺学报,2009,36(12):1733.
WU F W,KUANG J F,LU W J,etal.Cloning and expression analysis of EG genes in litchi fruit [J].ActaHorticulturaeSinica,2009,36(12):1733.
[13]张 艳,高 健,徐有明.毛竹β-1,3-葡聚糖酶基因的克隆及序列分析[J].分子植物育种,2010,8(3):533.
ZHANG Y,GAO J,XU Y M.Cloning and sequencing analysis of β-1,3-glucanase gene from moso bamboo [J].MolecularPlantBreeding,2010,8(3):533.
[14]方静平,苏亚春,游 倩,等.甘蔗β-1,3-葡聚糖酶基因的电子克隆与分析[J].生物信息学,2012,10(3):199.
FANG J P,SU Y C,YOU Q,etal.In silico cloning and bioinformatic analysis of β-1,3-glucanase gene(ScBG) from sugarcane(Saccharumspp.) [J].ChineseJournalofBioinformatics,2012,10(3):199.
[15]崔素萍,左豫虎,董 琳.小麦根腐离蠕孢菌诱导小麦β-1,3-葡聚糖酶基因的克隆及其表达[J].黑龙江八一农垦大学学报,2009,21(4):5.
CUI S P,ZUO Y H,DONG L.Cloning and expression of wheat β-1,3-glucanase gene induced byBipolarissorokinianum[J].JournalofHeilongjiangBayiAgriculturalUniversity,2009,21(4):5.
[16]BO L,XIAO D X,SU P C,etal.Cloning and characterization of a wheat beta-1,3-glucanase gene induced by the stripe rust pathogenPucciniastriiformisf.sp.tritici[J].MolecularBiologyReports,2010,37(2):1045.
[17]张艳俊,张家瑞,栗小英,等.不同浓度信号分子诱导的小麦 TaLr19TLP1基因的表达分析[J].河北农业大学学报,2015,38(4):13.
ZHANG Y J,ZHANG J R,LI X Y,etal.Expression analysis of wheat TaLr19TLP1 gene induced by different concentrations of signal molecules [J].JournalofAgriculturalUniversityofHebei,2015,38(4):13.
[19]ZAMBOUNIS A G,KALAMAKI M S,TANI E E,etal.Expression analysis of defense-related genes in cotton(Gossypiumhirsutum) afterFusariumoxysporumf.sp.vasinfectuminfection and following chemical elicitation using a salicylic acid analog and methyl jasmonate [J].PlantMolecularBiologyReporter,2012,30(1):225.
[19]MAUCH F,MAUCH-MAN B,BOLLER T.Antifungal hydrolases in pea tissue:II.inhibition of fungal growth by combinations of chitinase and beta-1,3-glucanase [J].PlantPhysiology,1988,88(3):936 .
[20]史 娟,李建设.枯萎病菌诱导的几丁质酶和β-1,3-葡聚糖酶与寄主抗病性的关系[J].农业科学研究,2006,27(3):24.
SHI J,LI J S.Relationship between chitinase and β-1,3-glacanase activity induced byFusariumoxysporumon resistance of cucumber toFusariumwilt [J].JournalofAgriculturalSciences,2006,27(3):24.
[21]孙 斌,李多川,慈晓燕,等.小麦叶片β-1,3-葡聚糖酶的诱导、纯化与抗菌活性[J].植物生理与分子生物学学报,2004,30(4):399.
SUN B,LI D C,CI X Y,etal.Induction,purification and antifungal activity of β-1,3-glucanase from wheat [J].ActaPhotophysiologicaSinica,2004,30(4):399.
[22]MÉTRAUX J P,NAWRATH C,GENOUD T.Systemic acquired resistance [J].Euphytica,2004,124(2):237.
[23]宾金华,姜 胜,黄胜琴,等.茉莉酸甲酯诱导烟草幼苗抗炭疽病与PAL活性及细胞壁物质的关系[J].植物生理学报,2000,26(1):1.
BIN J H,JIANG S,HUANG S Q,etal.The relationship between methyl jasmonate induced anthracnose resistance of tobacco seedlings and phenylalanine ammonia-lyase activity and cell wall substances [J].ActaPhytophysiologicaSinica,2000,26(1):1.
[24]张智慧,聂燕芳,何 磊,等.外源茉莉酸甲酯诱导水稻抗瘟性相关防御酶和内源水杨酸的变化[J].植物病理学报,2010,40(4):395.
ZHANG Z H,NIE Y F,HE L,etal.Resistance-related defense enzymes and endogenous salicylic acid induced byexo-genous methyl jasmonate in rice against blast disease [J].ActaPhytopathologicaSinica,2010,40(4):395.
[25]邹志燕,王振中.茉莉酸诱导水稻幼苗对稻瘟病抗性作用研究[J].植物病理学报,2006,36(5):432.
ZOU Z Y,WANG Z Z.Effect of jasmonic acid on induced resistance of rice seedlings toMagnaporthegrisea[J].ActaPhytopathologicaSinica,2006,36(5):432.
[26]牛吉山,倪永静,刘 靖,等.茉莉酸甲酯对小麦白粉病抗性的诱导作用[J].中国农学通报,2010,26(4):254.
NIU J S,NI Y J,LIU J,etal.Inducing effect of JA on wheat powdery mildew resistance [J].ChineseAgriculturalScienceBulletin,2009,26(4):254.
[27]向妙莲,陈 明,曾晓春,等.茉莉酸甲酯对水稻幼苗抗细菌性条斑病的诱导效应[J].江西农业大学学报,2011,33(4):679.
XIANG M L,CHEN M,ZENG X C,etal.Effects of methyl jasmonate on induced resistance of rice seedlings against bacterial leaf stripe [J].ActaAgriculturaeUniversitatisJiangxiensis,2011,33(4):679.
[28]魏源文,胡春锦,李杨瑞.乙烯在植物应答水分胁迫和病原菌浸染中的作用[J].植物生理学通讯,2006,42(5):981.
WEI Y W,HU C J,LI Y R.The role of ethylene in the responses of plants to water stress and pathogen infection [J].PlantPhysiologyCommunications,2006,42(5):981.
[29]LUND S T,STALL R E,KLEE H J.Ethylene regulates the susceptible response to pathogen infection in tomato [J].ThePlantCell,1998,10(3):371.
Expression Analysis of TcLr19PR2 Gene in Wheat TcLr19 Induced by MeJA, ETH andPucciniatriticina
ZHANG Jiarui,ZHANG Yanjun,WANG Fei,WANG Haiyan,LIU Daqun
(College of Plant Protection, Agricultural University of Hebei/Biological Control Center of Plant Disease and Plant Pests of Hebei Province,Baoding,Hebei 071000, China)
In order to identify the expression profiles of a full length β-1,3-glucanase gene, TcLr19PR2, induced by different chemical molecule and leaf rust pathogen, the gene expression levels of TcLr19PR2 induced by the optimal concentrations Methyl jasmonate(MeJA) and Ethylene(ETH) were analysed using semi-quantitative RT-PCR with TcLr19 as experiment material. These results suggested that the optimal concentrations were 0.1 mmol·L-1for MeJA and 1.0 mmol·L-1for ETH, respectively. MeJA pre-treatment prior to infection resulted in a steady increase in TaLr19PR2 expression from 0 to 3 days post inoculation(dpi), and reached the peak at 24 hour post inoculation(hpi), which appeared earlier than that in the Mock(non-inoculation). The expression level of TcLr19PR2 increased at 24 hpi after ETH pre-treatment prior to infection, and higer than that in Mock at 10 dpi after ETH pre-treatment prior to infection. All these results proved that the expression of TcLr19PR2 was induced byP.triticinaand signaling molecules together, which might be involved in the defense reaction toP.triticinaof TcLr19.
Wheat; Leaf rust pathogen; Signal molecule; β-1,3-glucanase gene; Expression analysis
时间:2016-10-08
2016-03-25
2016-09-09
河北省自然科学基金项目(C2012204005);国家重点基础研究发展计划(973计划)项目(2013CB127700)
E-mail: angelzhangjiarui@163.com(张家瑞);zyj18730222136@163.com(张艳俊,与第一作者同等贡献)
王海燕(E-mail: ndwanghaiyan@163.com);刘大群(E-mail: ldq@mail.hebau.edu.cn)
S512.1;S332.2
A
1009-1041(2016)10-1299-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161008.0932.008.html
