分子标记PM19-A1对1 015份小麦抗穗发芽基因型的筛选及其有效性验证
2016-11-30曹雪连吴曾云曹佳佳朱玉磊王升星张海萍马传喜
曹雪连,张 衡,姜 昊,吴曾云,曹佳佳,朱玉磊,王升星,常 成,张海萍,马传喜
(安徽农业大学农学院/农业部黄淮南部小麦生物学与遗传育种重点实验室,安徽合肥 230036)
分子标记PM19-A1对1 015份小麦抗穗发芽基因型的筛选及其有效性验证
曹雪连,张 衡,姜 昊,吴曾云,曹佳佳,朱玉磊,王升星,常 成,张海萍,马传喜
(安徽农业大学农学院/农业部黄淮南部小麦生物学与遗传育种重点实验室,安徽合肥 230036)
为了解与穗发芽抗性相关基因 PM19-A1在我国小麦品种资源中的分布及其分子标记PM19-A1的有效性,并筛选抗穗发芽等位基因组合,利用标记PM19-A1对1 015份小麦品种资源(包括我国253份微核心种质、603份全国主要麦区品种资源以及153份国外引进材料)进行检测,于2015年测定其中540份材料的种子萌芽指数(GI)和田间自然降雨整穗发芽率(FS),验证该基因标记的有效性;结合 TaVp-1B的基因型,筛选 PM19-A1/TaVp-1B抗穗发芽等位基因组合;并以大白皮和六月黄(携带 PM19-A1a等位基因类型)通过后熟的种子为材料,进行高温(38.5 ℃)、不同浓度ABA(50 μmol·L-1和125 μmol·L-1)以及GA(1 mmol·L-1)处理,分析该基因的表达特性。结果表明, PM19-A1基因存在两种等位基因类型( PM19-A1a和 PM19-A1b),等位基因类型为 PM19-A1a的材料,其平均GI和FS均显著低于等位基因类型为 PM19-A1b的材料,为抗穗发芽等位类型; PM19-A1a在我国微核心种质、全国主要麦区品种资源和国外引进材料中的分布频率分别是17.4%、7.7%和31.8%;筛选出抗穗发芽等位基因组合 PM19-A1a/TaVp-1Bc;高温和ABA处理均能诱导 PM19-A1基因表达上调,GA处理则抑制其表达上调;不同抗穗发芽品种中 PM19-A1基因对ABA(P<0.01)以及GA(P<0.05)的敏感性反应存在显著差异。
小麦;收获前穗发芽;种子休眠; PM19-A1; TaVp-1B
小麦籽粒临近收获时田间遭遇降雨或雨后长时间高湿天气容易发生穗发芽现象[1]。小麦穗发芽属于一种世界性自然灾害,严重影响小麦产量和品质,如美国、加拿大、澳大利亚等以小麦种植为主的国家均遭受穗发芽危害[2]。在我国,长江中下游、西南冬麦区和东北春麦区是收获季节易降雨的地区,也是穗发芽危害频繁地区,黄淮和北部冬麦区也时有发生。据统计,受穗发芽危害的麦区约占全国小麦总面积的83%[3]。
研究表明,种子休眠性是穗发芽抗性的主要遗传因素,其他因素如穗部形态(穗子疏密和大小、弯曲程度和蜡质等)、籽粒性状(种皮色泽、种皮厚度和籽粒吸水速率等)、以及颖壳内发芽抑制物质等对穗发芽抗性起修饰作用[4]。植物激素(主要为ABA和GA)和温度是影响种子休眠形成的主要因素。ABA抑制种子萌芽,诱导种子休眠,GA则打破种子休眠,促进萌芽。此外,种子休眠的诱导不仅依赖于ABA的水平,而且还决定于种子/离体胚对ABA的敏感性[5]。籽粒发育期间,尤其是发育后期的高温(26 ℃以上)不利于种子深休眠的形成,低温(15 ℃以下)则有利于种子深休眠的形成[6]。成熟收获的种子在浸润期间,高温(35 ℃、4 h)抑制其萌发,而低温(15 ℃以下)则可以增加吸涨种子的萌发能力,提高萌芽率[7]。随着全球气温的升高,使得小麦籽粒发育中后期的温度偏高,造成种子休眠/穗发芽抗性水平下降,加大了小麦收获前穗发芽的潜在风险。鉴定种子休眠性相关基因,开发功能标记,将有助于加快抗穗发芽小麦新品种的培育进程。
目前,已鉴定的与小麦种子休眠/穗发芽抗性相关的基因主要有 TaVp-1[8]、 Tamyb10-1[9]、TaMFT[10]、TaSdr[11]、TaDFR[12]和 PM19-A1[13]。其中, PM19-A1基因所在的4AL染色体区域最初由Mares等[14-16]在澳大利亚白皮抗穗发芽品种Halberd以及南非白皮抗穗发芽地方品种AUS1408和SW95-50213中初步定位,随后被不同学者共同验证[17-19],且靠近该区域的分子标记(Xbarc170、DuPw004、Xwmc650和gpw2279)在穗发芽抗性育种中的有效性也被Hickey等[20]和Singh等[21]所证实。2015年,Barrero等[13]利用多亲本高代自交群体衍生的多重近等基因系,结合RNA测序克隆了位于该区域的抗穗发芽候选基因 PM19-A1,并开发了功能标记,该基因存在两种等位变异类型,即117 bp和99 bp扩增片段,前者与种子的强休眠性相关,后者与种子的弱休眠性相关。
PM19基因编码一种质膜类蛋白,早在2002年,Ranford等[22]在大麦中就克隆了该基因,并证明该基因参与大麦胚的发育以及胚休眠的形成与维持过程,即 PM19基因在大麦胚发育的中后期特异性表达,在休眠胚中其表达水平较高,伴随胚的萌发,其表达水平显著下降;此外,该基因表达受植物激素ABA、氯化钠以及山梨醇所诱导。李永春等[23]利用RACE技术从综合抗逆性强的小麦品种洛旱2号中克隆了 TaPM19-1基因,该基因同样仅在发育中后期的种子中表达,在根系和叶片中其表达也受植物激素 ABA、干旱、高盐以及高温所诱导。
相对于目的基因紧密连锁的分子标记来说,利用基因本身开发的功能标记进行育种辅助选择无疑更准确高效。目前我国小麦品种资源中 PM19-A1基因的分布情况,及其与 TaVp-1B不同等位类型组合对穗发芽抗性的影响还不清楚。本试验利用Barrero等[13]报道的 PM19-A1基因标记,检测我国253份小麦微核心种质、全国主要麦区608份品种资源以及154份国外引进材料;结合其中部分供试材料的穗发芽抗性表型,分析其与 TaVp-1B基因不同等位类型组合的分布情况,及其与穗发芽抗性的关系;并利用定量RT-PCR技术分析小麦种子中该基因对于激素(ABA和GA)和高温的敏感性反应。本研究结果将有助于进一步深入理解小麦种子休眠/穗发芽抗性的分子调控机理,同时可以为小麦抗穗发芽分子聚合育种提供参考依据。
1 材料与方法
1.1 供试材料及其种植
用于 PM19-A1基因分子检测的材料共计1 015份,包括253份中国小麦微核心种质资源、608份全国主要麦区品种资源以及154份国外引进材料。选取上述608份品种资源中亲缘关系相对较远且穗发芽抗性不同的287份材料(Population 1, 简称Pop1)以及253份中国小麦微核心种质(Population 2, 简称Pop2)用于分析 PM19-A1基因与穗发芽抗性的关系以及筛选抗穗发芽等位基因组合。选取穗发芽抗性强、等位基因类型为 PM19-A1a的小麦地方品种六月黄和大白皮用于分析 PM19-A1基因对于ABA、GA和高温的敏感性反应。
608份全国主要麦区品种资源材料中,205份来自黄淮海冬麦区,185份来自北方冬麦区,78份来自长江中下游冬麦区,62份来自西南冬麦区,31份来自西北春麦区,30份来自东北春麦区,15份来自新疆冬春麦区,2份来自北方春麦区。154份国外引进材料中,15份来自阿根廷,12份来自澳大利亚,6份来自加拿大,41份来自法国,10份来自德国,4份来自匈牙利,8份来自日本,5份来自墨西哥,18份来自挪威,9份来自罗马尼亚,8份来自俄罗斯,4份来自土耳其,11份来自美国,2份来自意大利,1份来自英国。608份全国主要麦区品种资源中的321份材料以及154份国外引进材料由中国农科院作科所夏先春研究员提供,其余287份材料由本课题组收集。253份小麦微核心种质由中国农科院作物所贾继增研究员提供。
上述Pop1和Pop2试验材料于2014-2015年度种植于安徽农业大学合肥大杨店试验基地,每份材料种植2行,每行40粒,行长2 m,行宽20 cm,采用常规大田管理。
1.2 穗发芽抗性表型测定
采用种子萌芽指数(germination index, GI)以及田间自然降雨整穗发芽率(field sprouting, FS)来综合评价小麦穗发芽抗性。室内种子GI测定参照张海萍等[24]的方法;2015年小麦收获期间遭遇阴雨天气,田间自然降雨整穗发芽率(FS)测定参考朱玉磊等[25]的方法。
1.3 PM19-A1基因和 TaVp-1B基因的分子检测
PM19-A1基因的PCR扩增体系为10 μL,包括2.0 μL模板DNA (50~60 ng·μL-1)、1.0 μL 10×Buffer (含有2.0 mmol·L-1Mg2+)、0.8 μL 2.5 mmol·L-1dNTPs、0.11 μL 5 U·μL-1TaqDNA聚合酶、10 μmol·L-1引物各0.4 μL和5.29 μL ddH2O。PCR反应程序:94 ℃预变性5 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。引物序列为:
TaPM19-A1-5F: 5′-GAAACAGCTACCGT GTAAAGC-3′; TaPM19-A1-5R:5′-TGGTGAA GTGGAGTGTAGTGG-3′。
TaVp-1B基因的PCR扩增体系为10 μL,包括2.0 μL模板DNA (50~60 ng·μL-1)、1.0 μL 10×Buffer (含有2.0 mmol·L-1Mg2+)、0.8 μL 2.5 mmol·L-1dNTPs、0.1 μL 5 U·μL-1TaqDNA聚合酶、10 μmol·L-1引物各0.4 μL和5.3 μL ddH2O。PCR反应程序:94 ℃预变性5 min;94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸 1 min,35 个循环;72 ℃延伸10 min。引物序列为:
TaVp-1B3-F:5′-TGCTCCTTTCCCAATTG G-3′;TaVp-1B3-R:5′-ACCCTCCTGCAGCTCA TTG-3′。
用于扩增 PM19-A1基因和 TaVp-1B基因的引物均由生工生物工程(上海)有限公司合成。PCR扩增产物均采用2.5%琼脂糖凝胶电泳检测。
1.4 PM19-A1基因的表达分析
将携带 PM19-A1a等位基因类型的材料六月黄和大白皮的种子通过后熟,以水处理为对照(CK),同时进行不同浓度ABA(50 μmol·L-1和125 μmol·L-1)以及高温(38.5 ℃)处理,然后对125 μmol·L-1ABA处理后仍未萌动种子进行GA(1 mmol·L-1)处理,分析 PM19-A1基因在不同浓度ABA、高温以及GA处理后的表达水平的变化。人工气候培养箱参数为20 ℃恒温,14 h光照,湿度80%(高温38.5 ℃处理除外)。当水处理18 h的所有种子均出现萌动(以胚部破裂露白为准),高温和125 μmol·L-1ABA处理的所有种子未出现萌动,而50 μmol·L-1ABA 处理的种子中大部分出现萌动时进行第一次取样,继续对125 μmol·L-1ABA处理的种子进行GA处理,待所有种子出现萌动时进行第二次取样。取样样品用液氮速冻后置于-80 ℃保存备用。
RNA提取采用TRIzol试剂盒,利用NanoVue plus仪器测定RNA浓度。反转录试剂盒购于TransGen,其他试剂均购于北京全式金公司。QPCR体系为50 μL,包括25 μL 2×GoTaqqPCR Master Mix、2 μL Forward Primer (10 μmol·L-1)、2 μL Reverse Primer (10 μmol·L-1)、2 μL模板cDNA和9 μL ddH2O。反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 1 min,45个循环。内参为GAPDH基因。采用2-ΔΔCt方法计算目标基因的相对表达量[26]。所用引物序列如下:
Ta-PM19-F:5′-CATGTACTAGTGCACGG ATG-3′, Ta-PM19-R: 5′-CTGCGCTAGTTTC ACTACAC-3′; Ta-GAPDH-1F: 5′-TTAGACT TGCGAAGCCAGCA-3′,Ta-GAPDH-1R:5′-A AATGCCCTTGAGGTTTCCC-3′。
1.5 数据分析
利用SPSS 19.0软件进行数据分析,相关性分析采用Pearson模型。
2 结果与分析
2.1 GI和FS表型统计及两者的相关性
在Pop1中,GI平均值为0.55,变化范围为0.01~0.98,变异系数为0.57;FS平均值为0.28,变化范围为0~0.96,变异系数为0.29。在Pop2中,GI平均值为0.32,变化范围为0~0.99,变异系数为0.32;FS平均值为0.10,变化范围为0~0.82,变异系数为0.13。相关性分析表明,GI和FS在Pop1和Pop2中均呈极显著正相关(P<0.01),相关系数分别为0.531和0.686(表1)。说明种子休眠性是影响整穗发芽抗性的主要因素,但穗子形态以及颖壳等种子以外的其他因素对整穗发芽抗性的作用也不容忽视,采用GI和FS能够全面准确地评价小麦穗发芽抗性。
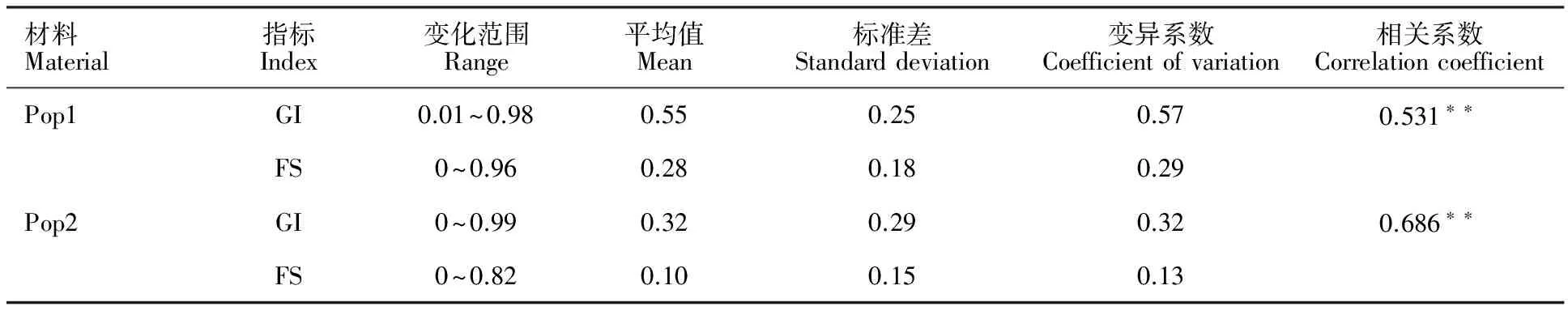
表1 GI和FS表型在Pop1和Pop2两类群体中的统计描述以及两者相关性
**:P<0.01.
2.2 PM19-A1基因的分子检测及其分布频率
PM19-A1基因在供试材料中共扩增到117 bp和99 bp 两种片段类型,即存在2种等位类型,分别命名为 PM19-A1a和 PM19-A1b。在253份小麦微核心种质中,44份(17.4%)携带 PM19-A1a,209份(82.6%)携带 PM19-A1b;608份全国主要麦区小麦品种资源中,47份(7.7%)携带 PM19-A1a,561份(92.3%)携带 PM19-A1b;154份国外引进材料中,49份(31.8%)携带 PM19-A1a,105份(68.2%)携带 PM19-A1b(表2)。上述结果表明,相对国外材料,与高水平种子休眠相关的 PM19-A1a类型在我国小麦品种资源中分布频率相对较低,尤其在我国现代品种中更低。
2.3 PM19-A1与 TaVp-1B基因不同等位类型组合与穗发芽抗性的关系
TaVp-1B基因在Pop1和Pop2群体中共存在4种等位类型,分别为 TaVp-1Ba、 TaVp-1Bb、 TaVp-1Bc和 TaVp-1Bd。在Pop1中, PM19-A1与 TaVp-1B共存在5种组合类型, PM19-A1b/TaVp-1Bc分布频率最高, PM19-A1a/TaVp-1Ba分布频率最低;在Pop2中, PM19-A1与 TaVp-1B共存在8种组合类型, PM19-A1b/TaVp-1Ba分布频率最高, PM19-A1a/TaVp-1Bb分布频率最低(表2)。
进一步对 PM19-A1不同等位类型及其与 TaVp-1B 不同等位类型组合平均GI和FS进行差异显著性分析,结果(表2)表明, PM19-A1a在Pop1和Pop2中的平均GI(0.39和0.37)和平均FS(0.24和0.08)均显著低于 PM19-A1b(P<0.05),说明等位基因类型 PM19-A1a与抗穗发芽相关,验证了Barrero等[13]的结果; PM19-A1a/TaVp-1Bc在Pop1和Pop2群体中平均GI(0.38和0.28)和平均FS(0.19和0.08)均显著低于其他组合(P<0.05),属于抗穗发芽等位基因组合类型,携带该组合的材料见表3;此外, PM19-A1a/TaVp-1Bd平均GI(0.31)和平均FS(0.03)均表现较低,因其仅存在于Pop2中,且分布频率较低,有待进一步验证。
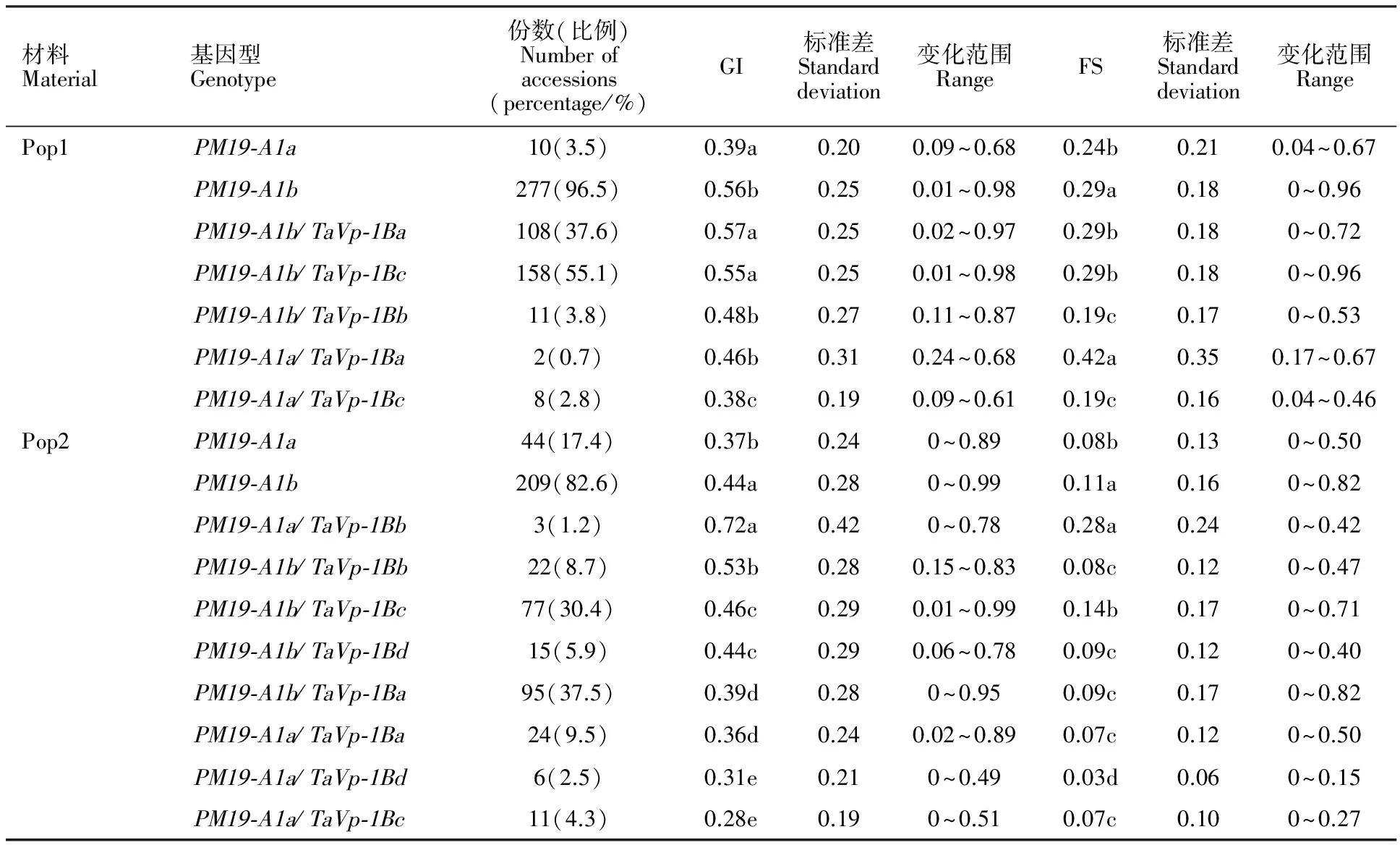
表2 Pop1和Pop2群体中 PM19-A1及其与 TaVp-1B基因不同等位类型组合的描述统计以及差异显著性分析
同列数据后不同字母表示同一群体中不同类型材料间差异显著(P<0.05)。
Different letters following dates mean significant difference among different types of materials in a population at 0.05 level.
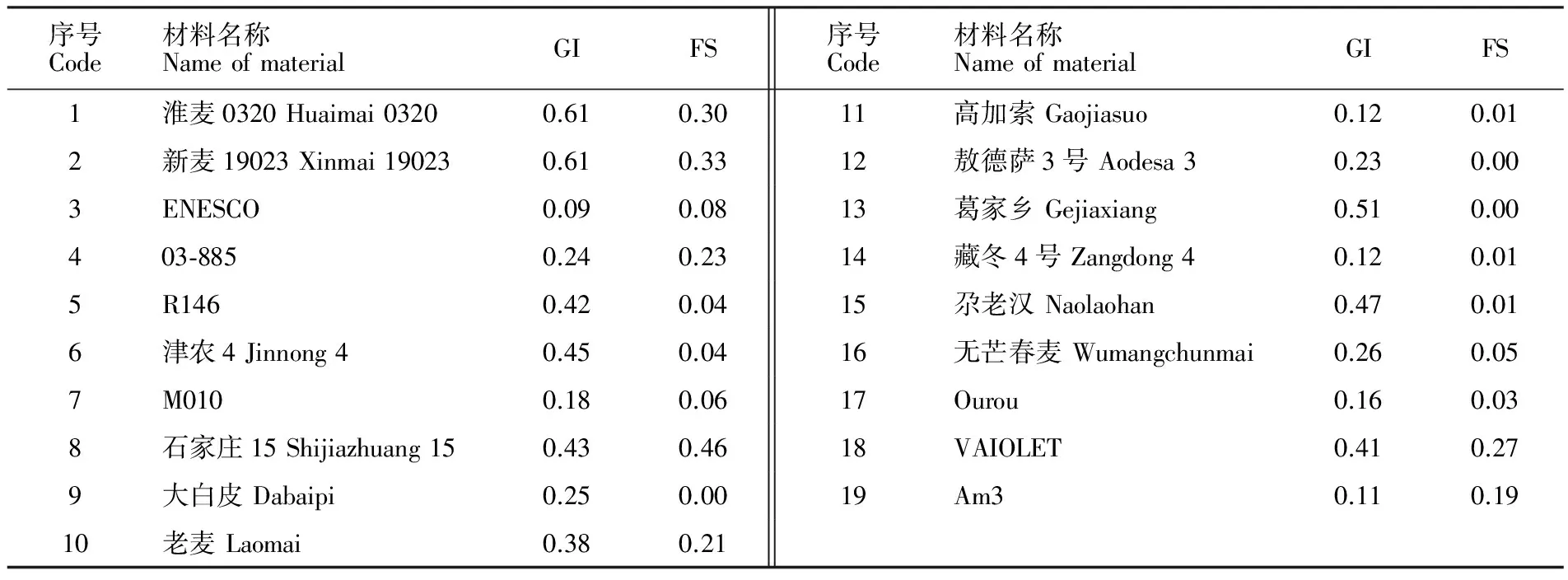
表3 携带 PM19-A1a/TaVp-1Bc抗穗发芽等位类型组合的品种名称、GI和FS表型值
2.4 PM19-A1基因的表达特性
利用定量RT-PCR分析 PM19-A1基因对于激素ABA和GA以及高温的敏感性反应,结果显示,以水处理为对照,高温(38.5 ℃)处理大白皮和六月黄浸润种子, PM19-A1基因的表达水平均明显升高;经50 μmol·L-1和125 μmol·L-1ABA处理后,大白皮中 PM19-A1基因的表达水平明显提高,而六月黄中的表达水平变化不明显。总体上, PM19-A1基因经高浓度ABA处理后表达水平明显较低浓度ABA处理提高。继续对高浓度ABA处理后未萌动的种子用GA(1 mmol·L-1)处理,大白皮中 PM19-A1基因的表达水平明显降低,而六月黄中变化不明显(图1)。上述结果表明,高温和ABA均能诱导 PM19-A1基因表达上调,而GA抑制其表达,导致表达下调,不同抗性品种中该基因对ABA(P<0.01)以及GA(P<0.05)的敏感性反应存在显著差异,但对高温的敏感性反应差异不显著。
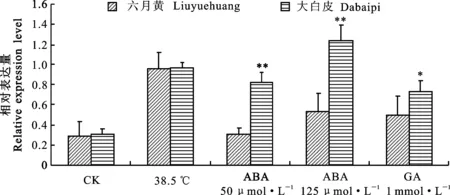
*和**分别表示两品种间差异在0.05和0.01水平上显著。
* and ** represent significant difference between Liuyuehuang and Dapaipi at 0.05 and 0.01 levels, respectively.
图1 大白皮和六月黄后熟种子浸润期间经ABA、GA和高温处理后 PM19-A1基因的表达变化
Fig.1 Expression changes of PM19-A1 gene treated with ABA, GA and high temperature during seeds incubation of Dabaipi and Liuyuehuang
3 讨 论
小麦4AL染色体上的种子休眠主效QTL被不同学者重复鉴定,临近分子标记在穗发芽抗性育种辅助选择中的有效性也被进一步验证[20-21]。Barrero等[13]克隆出该区段的候选基因 PM19-A1/A2,认为117 bp扩增片段(对应 PM19-A1a等位类型)与抗穗发芽相关,99 bp扩增片段(对应 PM19-A1b等位类型)与感穗发芽相关。本文利用该基因标记检测了我国微核心种质以及全国主要麦区的小麦品种资源,并结合GI和FS表型数据,进一步验证了 PM19-A1a等位类型与抗穗发芽的关系,但其在我国小麦品种资源中的分布频率较低,尤其在现代品种中分布更低,这也可能是近年来我国小麦生产上穗发芽抗性偏低的原因之一。
TaVp-1B基因是参与调控小麦种子休眠形成的重要转录因子,存在多种等位变异类型,其中 TaVp-1Ba属于感穗发芽类型, TaVp-1Bb和 TaVp-1Bc属于抗穗发芽类型, TaVp-1Bd与穗发芽抗性的关系还不清楚[27-28]。本文利用两类群体分析了 PM19-A1和 TaVp-1B基因不同组合类型与穗发芽抗性的关系,筛选出抗穗发芽等位基因组合类型 PM19-A1a/TaVp-1Bc,且该组合中的两种等位基因先前已分别被报道为抗穗发芽类型,更提高了本文筛选的抗穗发芽等位基因组合的可靠性。然而, PM19-A1a/TaVp-1Bb同样属于两种抗穗发芽等位基因的组合,但其平均GI和平均FS均较高,说明简单的抗穗发芽等位基因的聚合可能并不一定能得到理想中的优异性状,基因间的互作及其与环境的互作对于性状的表现影响较大。此外, PM19-A1a/TaVp-1Bd组合的平均GI和平均FS均表现较低,可能属于抗穗发芽类型,然而该组合分布频率较低,且 TaVp-1Bd与穗发芽抗性的关系先前未有相关报道,所以还需要更多材料和多年数据进一步验证。
据资料报道,植物激素ABA和GA以及温度对于种子休眠性的影响涉及到相关基因的转录水平上的变化。如Nakamura等[29]将携带3AS上抗穗发芽基因TaMFT的深休眠小麦品种Norin61(N61)在种子发育期间分别置于不同温度条件下(13 ℃和25 ℃),结果发现,13 ℃时TaMFT基因的表达量比25 ℃高约4倍,N61的休眠性显著增强,种子发芽率几乎为0;将TaMFT基因导入不成熟的离体胚瞬时表达可抑制其早熟发芽,说明种子发育期间的低温通过诱导TaMFT基因的表达来最终增强种子休眠水平。Lei等[30]对抗穗发芽品种2174进行种子萌发期间低温(4 ℃)、常温(25 ℃)以及高温(37 ℃)处理,结果发现,高温下TaMFT基因表达水平较常温下显著提高,而低温下表达水平下降,说明种子萌发期间的高温诱导TaMFT基因的表达,低温抑制其表达,这种趋势与高温诱导种子休眠、低温促进种子萌芽的趋势相吻合。Barrero等[13]分析了 PM19-A1基因在种子发育期间(花后15、25、35和45 d)的表达特性,结果发现,伴随籽粒成熟以及休眠的获得, PM19-A1基因的表达水平增加;种子发育期间的高温抑制 PM19-A1基因表达,导致种子休眠水平下降;利用100 μmol·L-1ABA处理后,发现该基因表达受ABA诱导。本文利用两个携带 PM19-A1a基因的载体材料大白皮和六月黄的后熟种子,分析了该基因在种子浸润期间经高温以及不同浓度的ABA和GA处理后的表达变化,结果发现,高温和ABA同样诱导该基因上调表达,而GA则抑制其表达上调,高浓度ABA较低浓度ABA效果更明显;且不同抗性材料中 PM19-A1a基因对于ABA以及GA的敏感性反应存在显著差异,大白皮中 PM19-A1a基因对ABA以及GA的敏感性显著强于六月黄,但对高温的敏感性反应差异不显著。该结果不仅验证了 PM19-A1a基因是种子休眠的正调控因子这一观点;同时也可以看出,同属于编码质膜蛋白类的抗穗发芽相关基因TaMFT与 PM19-A1对于植物激素(ABA和GA)和温度的反应特性较相似,说明温度以及ABA对于种子休眠性的影响可能具有部分相似的调控机理。
[1]GROOS C,GAY G,PERRETANT R M,etal.Study of the relationship between pre-harvest sprouting and grain color by quantitative trait loci analysis in a white red grain bread-wheat cross [J].TheoreticalandAppliedGenetics,2002,104:39.
[2]DERERA N F,BHATT G M,MCMASTER G J.On the problem of pre-harvest sprouting of wheat [J].Euphytica,1977,26(2):299.
[3]XIAO S H,ZHANG X Y,YAN C S,etal.Germplasm improvement for preharvest sprouting resistance in Chinese white-grained wheat:An overview of the current strategy [J].Euphytica,2002,126(1):35.
[4]孙果忠,肖世和.脱落酸与种子休眠[J].植物生理学通讯,2004,40(1):115.
SUN G Z,XIAO S H.Abscisic acid and seed dormancy [J].PlantPhysiologyCommunications,2004,40(1):115.
[5]WALKER-SIMMONS M K,GOLDMARK P J.ABA levels and sensitivity in developing wheat embryos of sprouting resistant and susceptible cultivars [J].PlantPhysiology,1987,84:61.
[6]UENO K.Effects of desiccation and a change in temperature on germination of immature grains of wheat (TriticumaestivumL.) [J].Euphytica,2002,126:107.
[7]赵同芳.成熟度与收获后各种处理对小麦休眠的影响[J].植物学报,1957,6(1):80.
ZHAO T F.The influences of the maturity and various treatment after harvest on wheat seed dormancy [J].JournalofIntegrativePlantBiology,1957,6(1):80.
[8]张海萍,常 成,冯继明,等.小麦籽粒休眠 Vp1-B1基因的等位变异检测与分离[J].分子植物育种,2009,7(2):297.
ZHANG H P,CHANG C,FENG J M,etal.Isolation and detection of allelic variations of Vp1-B1 gene associated with seed dormancy in Chinese wheat varieties [J].MolecularPlantBreeding,2009,7(2):297.
[9]李 婷,陈 杰,陈 锋,等.黄淮麦区地方小麦品种子粒颜色相关基因 Tamyb10-1等位变异检测[J].植物遗传资源学报,2014,15(5):1089.
LI T,CHEN J,CHEN F,etal.Molecular identification of the Tamyb10-1 gene controlling the grain color in landrace wheat cultivars from Huanghuai wheat region [J].JournalofPlantGeneticResources,2014,15(5):1089.
[10]LIU S B,SEHGAL S K,LI J R,etal.Cloning and characterization of a critical regulator for pre-harvest sprouting in wheat [J].Genetics,2013,195:263.
[11]ZHANG Y J,MIAO X L,XIA X C,etal.Cloning of seed dormancy genes(TaSdr) associated with tolerance to pre-harvest sprouting in common wheat and development of a functional marker [J].TheoreticalandAppliedGenetics,2014,127:855.
[12]BI H H,SUN Y W,XIAO Y G,etal.Characterization of DFR allelic variations and their associations with pre-harvest sprouting resistance in a set of red-grained Chinese wheat germplasm [J].Euphytica,2014,195:197.
[13]BARRERO J M,CAVANAGH C,VERBYLA K L,etal.Transcriptomic analysis of wheat near-isogenic lines identifies PM19-A1 and A2 as candidates for a major dormancy QTL [J].GenomeBiology,2015,16:93.
[14]MARES D J,MRVA K.Mapping quantitative trait loci associated with variation in grain dormancy in Australian wheat [J].AustraliaJournalAgriculturalResearch,2001,52:1257.
[15]MARES D J,MRVA K,TAN M K,etal.Dormancy in white-grained wheat:Progress towards identification of genes and molecular markers [J].Euphytica,2002,126:47.
[16]MARES D J,MRVA K,CHEONG J,etal.A QTL located on chromosome 4A associated with dormancy in white- and red-grained wheat of diverse origin [J].TheoreticalandAppliedGenetics,2005,111:1357.
[17]TORADA A,IKEGUCHI S,KOIKE M.Mapping and validation of PCR-based markers associated with a major QTL for seed dormancy in wheat [J].Euphytica,2005,143:251.
[18]OGBONNAYA F C,IMTIAZ M,YE G,etal.Genetic and QTL analysis of seed dormancy and preharvest sprouting resistance in the wheat germplasm CN10955 [J].TheoreticalandAppliedGenetics,2008,116:891.
[19]CHEN C X,CAI S B,BAI G H,etal.A major QTL controlling seed dormancy and pre-harvest sprouting resistance on chromosome 4A in a Chinese wheat landrace [J].MolecularBreeding,2008,21:351.
[20]HICKEY L T,DIETERS M J,DELACY I H,etal.Screening for grain dormancy in segregating generations of dormant 3 non-dormant crosses in white-grained wheat (TriticumaestivumL.) [J].Euphytica,2010,172:183.
[21]SINGH R,HUCL P,BAGA M,etal.Validation of molecular markers for pre-harvest sprouting resistance in bread wheat R [J].CerealResearchCommunications,2012,40(2):194.
[22]RANFORD J C,BRYCE J H,MORRIS P C. PM19,a barley(HordeumvulgareL.) gene encoding a putative plasma membrane protein,is expressed during embryo development and dormancy [J].JournalofExperimentalBotany,2002,53:147.
[23]李永春,张春艳,张 宁,等.小麦质膜蛋白基因 TaPM19-1的克隆及其对非生物胁迫的响应[J].中国农业科学,2012,45(12):2502.
LI Y C,ZHANG C Y,ZHANG N,etal.Cloning of a plasma membrane protein gene TaPM19-1 and its response to abiotic stresses in wheat [J].ScientiaAgriculturaSinica,2012,45(12):2502.
[24]张海萍,常 成,游光霞,等.中国小麦微核心种质及地方品种籽粒休眠特性的分子标记鉴定[J].作物学报,2010,36(10):1649.
ZHANG H P,CHANG C,YOU G X,etal.Identification of molecular markers associated with seed dormancy in mini core collections of Chinese wheat and landraces [J].ActaAgronomicaSinica,2010,36(10):1649.
[25]朱玉磊,王升星,赵良侠,等.以关联分析发掘小麦整穗发芽抗性基因分子标记[J].作物学报,2014,40(10):1725.
ZHU Y L,WANG S X,ZHAO L X,etal.Exploring molecular markers of preharvest sprouting resistance gene using wheat intact spikes by association analysis [J].ActaAgronomicaSinica,2014,40(10):1725.
[26] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod [J].Methods,2001,25(4):402.
[27]YANG Y,ZHAO X L,XIA L Q.Development and validation of a Viviparous-1 STS marker for pre-harvest sprouting tolerance in Chinese wheats [J].TheoreticalandAppliedGenetics,2007,115:971.
[28]XIA L Q,GANAL M W,SHEWRY P R,etal.Exploiting the diversity of Viviparous-1 gene associated with pre-harvest sprouting tolerance in European wheat varieties [J].Euphytica,2008,159:411.
[29]NAKAMURA S,ABE F,KAWAHIGASHI H,etal.A wheat homolog of MOTHER OF FT AND TFL1 acts in the regulation of germination [J].ThePlantCell,2011,23:3215.
[30]LEI L,ZHU X K,WANG S W,etal. TaMFT-A1 is associated with seed germination sensitive to temperature in winter wheat [J].PLoSOne,2013,8(9):e73330.
Detection and Validation of Molecular Marker PM19-A1 Associated With Pre-harvest Sprouting Resistance in 1 015 Wheat Varieties
CAO Xuelian, ZHANG Heng, JIANG Hao, WU Zengyun, CAO Jiajia, ZHU Yulei,WANG Shengxing, CHANG Cheng, ZHANG Haiping, MA Chuanxi
(College of Agronomy, Anhui Agricultural University/Key Laboratory of Wheat Biology and Genetic Improvement on Southern Yellow & Huai River Valley,Ministry of Agriculture,Hefei,Anhui 230036, China)
To investigate the distribution of PM19-A1 gene associated with pre-harvest sprouting resistance in wheat germplasm resources and select excellent allele combination conferring pre-harvest sprouting resistance,1 015 wheat varieties, including 253 Chinese mini-core collections, 608 wheat varieties from major wheat regions, and 154 foreign varieties, were detected by using molecular marker PM19-A1.Seed germination index (GI) and field sprouting (FS) were tested in 540 of the 1 015 wheat varieties to validate the effectiveness of molecular marker PM19-A1 in 2015.Combined with TaVp-1B genotypes, the excellent allele combination associated with PHS resistance was selected. To investigate sensitive response of PM19-A1 gene to plant hormone ABA,GA,and high temperature, after-ripened seeds collected from wheat landraces Dahuangpi and Liuyuehuang carrying PM19-A1a allele were treated with high temperature (38.5 ℃), ABA (50 μmol·L-1and 125 μmol·L-1), and GA (1 mmol·L-1). The results showed that PM19-A1 gene contains two allelic variations ( PM19-A1a and PM19-A1b), and the average GI and FS of the varieties carrying PM19-A1a allele, associated with PHS resistance, were significantly lower than those of the varieties carrying PM19-A1b (P<0.05). The distribution frequency of PM19-A1a was 17.4%,7.7% and 31.8% in Chinese mini-core collections, wheat varieties from major wheat regions, and foreign varieties, respectively. The allelic variation combination PM19-A1a/TaVp-1Bc was significantly associated with PHS resistance. The expression level of PM19-A1 gene was significantly up-regulated by ABA and high temperature, but down-regulated by GA. The sensitive response of PM19-A1 gene to ABA (P<0.01) and GA (P<0.05) was significant in diverse wheat varieties with different levels of PHS resistance.
Wheat; Pre-harvest sprouting; Seed dormancy; PM19-A1; TaVp-1B
时间:2016-10-08
2016-03-20
2016-09-18
国家现代农业产业技术体系建设专项(CARS-3-1);农业部公益性行业科技专项(201203033-04);国家自然科学基金项目(31401372);安徽省自然科学基金项目(1408085MC60);安徽省小麦产业技术体系项目(AHCYTX-02)
E-mail:294514864@qq.com
张海萍(E-mail: zhhp20@163.com)
S512.1;S332.2
A
1009-1041(2016)10-1283-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20161008.0932.004.html
