辽育白牛MSTN基因分子克隆及序列分析
2016-11-30王娇娇张世伟张丽君王泽英罗光彬白文林
王娇娇,张世伟,张丽君,王泽英,罗光彬,白文林
(1.沈阳农业大学畜牧兽医学院,辽宁 沈阳 110886; 2.辽宁省畜牧业经济管理站,辽宁 沈阳 110032)
辽育白牛MSTN基因分子克隆及序列分析
王娇娇1,张世伟2⋆,张丽君2,王泽英1,罗光彬1,白文林1
(1.沈阳农业大学畜牧兽医学院,辽宁 沈阳 110886; 2.辽宁省畜牧业经济管理站,辽宁 沈阳 110032)
肌肉生长抑制素(简称MSTN)是肌肉发育负调控因子,为了实现将来对辽育白牛的分子育种,本试验对MSTN分子特征及其靶MicroRNA进行了分析。以辽育白牛为研究对象,利用分子生物学技术,设计特定引物对辽育白牛MSTN基因的编码区和调控区分段PCR扩增,并进行克隆和测序。借助生物信息学分析软件,寻找各个区域的单核苷酸多态性(SNP)并分析了MSTN基因分子特征、组织表达谱以及3'非翻译区靶标m iRNA。试验表明, MSTN基因5′调控区SNPs使启动子位置和转录因子结合情况发生变化,但编码区的突变未造成氨基酸改变。辽育白牛MSTN编码区序列全长为1 128 bp,编码375个氨基酸,该蛋白存在信号肽序列,为分泌性蛋白,疏水性较弱且不稳定。辽育白牛MSTN基因在不同组织中具有表达差异性,且肌肉中表达量最高。3′UTR存在肌肉生长发育功能miRNA,且比较保守。为开展辽育白牛分子育种研究奠定理论基础。
辽育白牛;MSTN基因;MicroRNA;单核苷酸多态性
辽育白牛是辽宁省新培育出来的肉牛新品种,其生长性状具有一定的优势和典型性,由于初培育目前对辽育白牛的深入研究现在还非常少,要想让该种群扩大并保持生长性状的优越性,仅用传统的育种手段,其遗传进展无疑是缓慢的,效果也是不理想的。借助先进的分子育种技术手段找寻辽育白牛重要经济性状的主基因或与之连锁的分子标记,是提高我国辽育白牛生产水平,尤其是产肉和肉品质性状的一条有效途径[1]。
根据目前研究,国内外关于肌肉生长发育和肉质性状的研究方法有很多,一般采用定位影响肉质的主效基因的方法来实现,所涉及的主要调节肌肉生长发育因素有如下几种:肌肉生长抑制素、瘦蛋白基因、钙素基因、生肌调节因子MyoG基因[2]、肾上腺髓质基因、腺苷酸环化酶2型基因[3]、胰岛素样生长因子[4]。
肌肉生长抑制素(简称MSTN),又称GDF-8,是TGF-β(transforming growth factor beta,转化生长因子β)超家族成员。MSTN在骨骼肌中广泛表达,是功能比较专一的肌肉发育负调控因子,在控制骨骼肌生长发育与分化上起着非常重要的作用。MSTN基因实现对肌细胞生长发育的负向调控的原理,是通过抑制成肌细胞的分化抗体家族成员的转录活性来实现的,肌肉重量大小的变化表现为与MSTN基因的表达量呈显著的负相关性[5]。已有最新报道表明,在不同的家畜动物中,可以使MSTN基因失活,从而导致肌肉增大重量增加现象[6]。肌肉生长抑制素基因的研究一直是近年来国内外分子遗传领域的研究热点之一,并已取得显著成果。
MicroRNA是一类进化上高度保守的非编码的单链内源性小分子R N A[7]。目前,大约有3 000种MicroRNA已经被鉴定出来[8]。目前,已经被证实,在肌肉发育和肌肉细胞增殖和分化过程中MicroRNA具有重要的调节作用[9]。
1 材料与方法
1.1 血液与肌肉组织样品试验以辽宁省培育的新品种——辽育白牛为研究对象进行多次采样分析。样品分别由辽宁省畜牧业经济管理站联系大连雪龙集团公司与辽宁绿源肉业有限公司提供。在大连雪龙集团公司,利用加有抗凝剂EDTAK2的采集管对20头辽育白牛静脉采血,将采集的样品低温保存,带回实验室-70℃冰箱中保存备用。在辽宁绿源肉业有限公司所属的屠宰场采集平均年龄约为5岁的辽育白牛肋脊部肌肉组织,以及心、肝、脾、肺、肾、翠丸、附翠组织,用提前经过灭菌的镊子和手术刀片分别取100 g并切成小块分装,装在纱布袋里,拴好并在绳上粘上标签,立即放入液氮罐中冷冻备用。
1.2 试剂蛋白酶K(proteinase K)、Taq DNA聚合酶、5×SDS PAGE蛋白上样缓冲液、DEPC、dNTPs、6×Buffer、DL 2000 DNA Marker、RNA simple总RNA提取试剂盒、血液DNA提取试剂盒、RT-PCR反转录试剂盒、PCR试剂2×Taq PCR Master Mix、β Actin抗体等,购自天跟生物有限公司和大连宝生物工程有限公司。
1.3 引物设计及合成参考Gen Bank上公布的牛MSTN序列(登录号为NM_001001 525.2),使用Primer 5.0和Olio 6软件分别对基因的5′调控区,CDS和3′-UTR设计特异引物,由上海生工合成引物。5M1和5M2扩增5′调控区(位于编码区上游长约1 240 bp), 5M1,F:5 CTAAGGTTGAGAGTTTGA 3,R:5 TCTTTTGCTTTTGAGTAA 3,长度1 226 bp,退火温度51.0℃;5M2,F:5 AGACCTTACCCCAAATCCC 3,R: 5 AGACAACTTGCCACACCAG 3,长度 1 101 bp,退火温度61.0℃。M1、M2、M3扩增编码区(1~1 128 b p), M1,F:5 TTGGCTTGGCGTTACTCA 3,R:5 CCATCTTCTCCTGGTTCT 3,长度826 bp,退火温度57.4℃;M2,F:5 TTGGGCTTGATTGTGAT 3,R:5 GAATGGTAACCTGCGTAT 3,长度846 bp,退火温度55.0℃;M3,F:5 CCACAAAGTAGGGAT 3,R:5 CATTGGATGTAAGAA 3,长度977 bp,退火温度46.4℃。3M1、3M2、3M3扩增3′调控区(位于编码区下游长约1 058 bp),3M1,F:5 GTAGATCGCTGTGGGTGT 3,R:5 CCATAGGGAGGAGTGTGA 3,长度700 bp,退火温度54.2℃;3M2,F:5 AGGTCTTCCCCTCAACAA 3,R:5 CAGCCATTCAGCCTATTG 3,长度552 bp,退火温度53.4℃;3M3,F:5 AGGACATAAAAGCAAAAG 3,R:5 TACAATGACAGTAAACCA 3,长度194 bp,退火温度48.5℃。
1.4 基因组DNA及总RNA的提取及检测按照血液基因组DNA提取试剂盒(天根)提取基因组DNA。琼脂糖凝胶电泳检测基因组DN A纯度,紫外分光光度计测定DNA浓度,采用RNA simple总RNA提取试剂盒(天根),对辽育白牛肌肉及心、肝、脾、肺、肾、翠丸、附翠八种组织的总RNA进行提取,并用0.8%的甲醛的琼脂糖凝胶电泳检测。
1.5 产物扩增与序列鉴定本试验采用设计的上、下游特异引物,分别在各自最适退火温度条件下获得MSTN基因各个区段目的片段。编码区的引物M1、M2、M3对基因扩增时,采用的模板是辽育白牛各组织中提取的RNA反转录后获得的cDNA。用MSTN基因的5′调控区和3′-U T R区域的基因引物进行基因扩增时,需要对10头辽育白牛种公牛血样提取的DNA分别进行扩增。然后根据巢式PCR方法,将检测后成功获得的MSTN基因的5′调控区和3′-UTR区域基因扩增产物每3管混在一起,将所有成功获得的MSTN基因扩增产物进行测序。目的序列与GenBank中相应基因序列比对分析,确定基因的序列结构。利用DNAStar,DNAMAN 4.0,BLAST等软件与GenBank中序列进行比较分析。利用数据库和在线软件分别分析5′端非翻译区序列、预测TATAbox、转录因子结合位点、预测CpG岛、预测蛋白结构及功能位点、预测3′端非翻译区序列靶标MicroRNA。
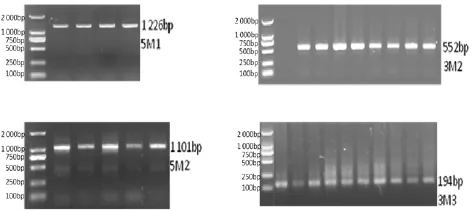
图1 MSTN基因PCR扩增产物Fig.1 PCR products of MSTN gene
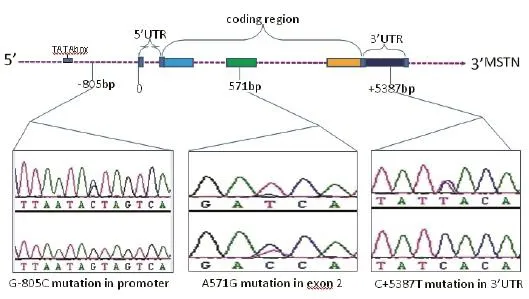
图2 MSTN基因中SNP的峰图Fig.2 Peak profile of SNPs in MSTN gene
2 结果与分析
2.1 目的基因片段扩增与测序采用设计的上、下游特异引物,在最适退火温度条件下获得MSTN基因不同区段目的片段(图1)。测序结果显示,在5′调控区-805 bp位处发生G/C突变,编码区571 bp位处发生A/G突变,3′-UTR区5 387 bp处发生C/T突变(图2)。
2.2 MSTN 基因分子特征分析测序结果分析后,在MSTN基因5′调控区发现4个突变位点,分别是-805 bp位点G/C突变、-163 bp位点T缺失突变、-156 bp位点A插入突变、-130 bp位点A插入突变。利用Berkeley Drosophila Genome Project软件对MSTN基因5′端的启动子分析预测。结果显示发生SNP突变后,在-161 bp和-137 bp位点处的两个TATA box消失,推断-163 bp位点的T缺失突变,-156 bp位点的A插入突变和-130 bp位点的A插入突变很有可能都是潜在的功能性突变位点。利用TFSEARCH转录因子结合位点预测软件,比较发现发生SNPs后,导致MSTN的5′端结合的转录因子种类和数量都发生了变化。通过methprimer cpG岛软件查找发现5′调控区存在明显的cpG Islands。
借助ORF Finder在线分析软件,参照Kozak法则(起始密码子符合CCA/GCCATG),对得到的辽育白牛MSTN的DNA序列进行阅读框架的识别,发现MSTN基因开放阅读框由3个外显子组成长度分别为373、374和381 bp,编码375个氨基酸。测序结果中发现在571 bp处发生A/G突变。
ExPASy-ProtParam分析结果表明其蛋白质氨基酸残基亲疏水性总和为-0.337,蛋白的不稳定系数为40.48(此值大于40为不稳定蛋白),说明辽育白牛MSTN蛋白的疏水性较弱,且不稳定。根据Signal P4.1和Server 4.1软件对辽育白牛MSTN基因编码的蛋白进行信号肽预测,结果显示辽育白牛的MSTN蛋白中存在明显的信号肽序列。成熟链序列(mature chain sequence)预测在19 bp、375 bp位置处,属分泌性蛋白,这与已有研究结果相一致。
通过ExPASy-ProtScale软件对辽育白牛MSTN蛋白进行蛋白疏水区的预测(图3)。从图3可见,辽育白牛MSTN基因编码蛋白的C端具有亲水性,N端具很强疏水性,位于分子内部;中间部分亲水性和疏水性表现交替出现。从总体上讲,该蛋白的亲水性更强,而疏水区相对较少。
对辽育白牛MSTN蛋白序列用SOPMA进行蛋白质二级结构预测。该蛋白二级结构中由22.93%的a螺旋(h)、21.33%的伸展链(e)、2.93%的β转角(t)和52.80%的随机线圈螺旋(c)组成。氨基酸的对应序列显示整个蛋白结构出现了3个大峰和2个较小峰,可见a螺旋结构出现的集中区域相对比较明显。
将辽育白牛MSTN蛋白序列用SWISS MODEL软件,进行搜索同源性高的三维结构建模模板。结果显示,与辽育白牛MSTN蛋白同源性最高的是Transforming growth factor beta1蛋白因子(3rjr.1.B),同源性达到84%。基于Transforming growth factor bta-1(3rjr.1.B)的三维结构,所提交的氨基酸序列构建的辽育白牛蛋白质三维结构模式(图4),其含有多个a螺旋结构域,该三维空间结构的预测结果与二级结构的预测结果相一致。
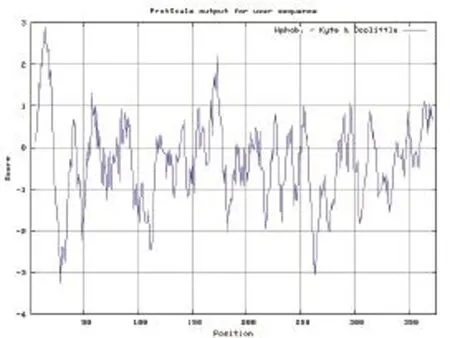
图3 ProScale预测辽育白牛MSTN亲水性分布图Fig.3 MSTN hydropathy profile in Liaoyu white cattle predicted by ProScale
2.3 MSTN MSTN基因组织表达谱辽育白牛MSTN蛋白不同组织部位表达见图5,组织部位包括翠丸、心脏、肌肉、肺、肝、脾、肾、附翠,利用β actin作为参照基因,从图可知,MSTN在心脏、肌肉和肝中的表达量相对强些,而在翠丸、脾、肾、附翠中的转录信号相对较弱,但在辽育白牛的肺中没有检测到表达信号, MSTN在肌肉中的表达信号相对最强。
2.4 MSTN基因3′-UTR-UTR靶标miRNA分析测序后通过基因序列与波峰的比对发现,在MSTN基因3′UTR区发现了三个突变位点,分别是+5 304 bp位点A到C的突变,+5 378 bp位点C到G的突变,+5 387 bp位点C到T的突变(图6)。
利用在线软件查找牛的miRNA,牛的靶标miRNA库包含687个相关miRNA,用Micro Inspector软件将MSTN基因与牛的miRNA结合情况分析后发现MSTN基因的3′U TR可以结合5个miRNA(图7)。发生突变后结合的miRNA的情况没有发生变化,结合的miRNA详细信息见表1。
3 讨论
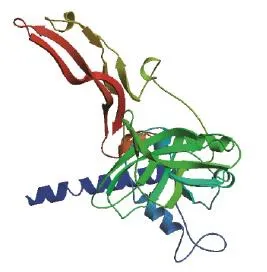
图4 辽育白牛MSTN基因编码蛋白三维空间结构预测图Fig.4 Predictions of three-dimensional structure of protein encoded by MSTN in Liaoyu white cattle
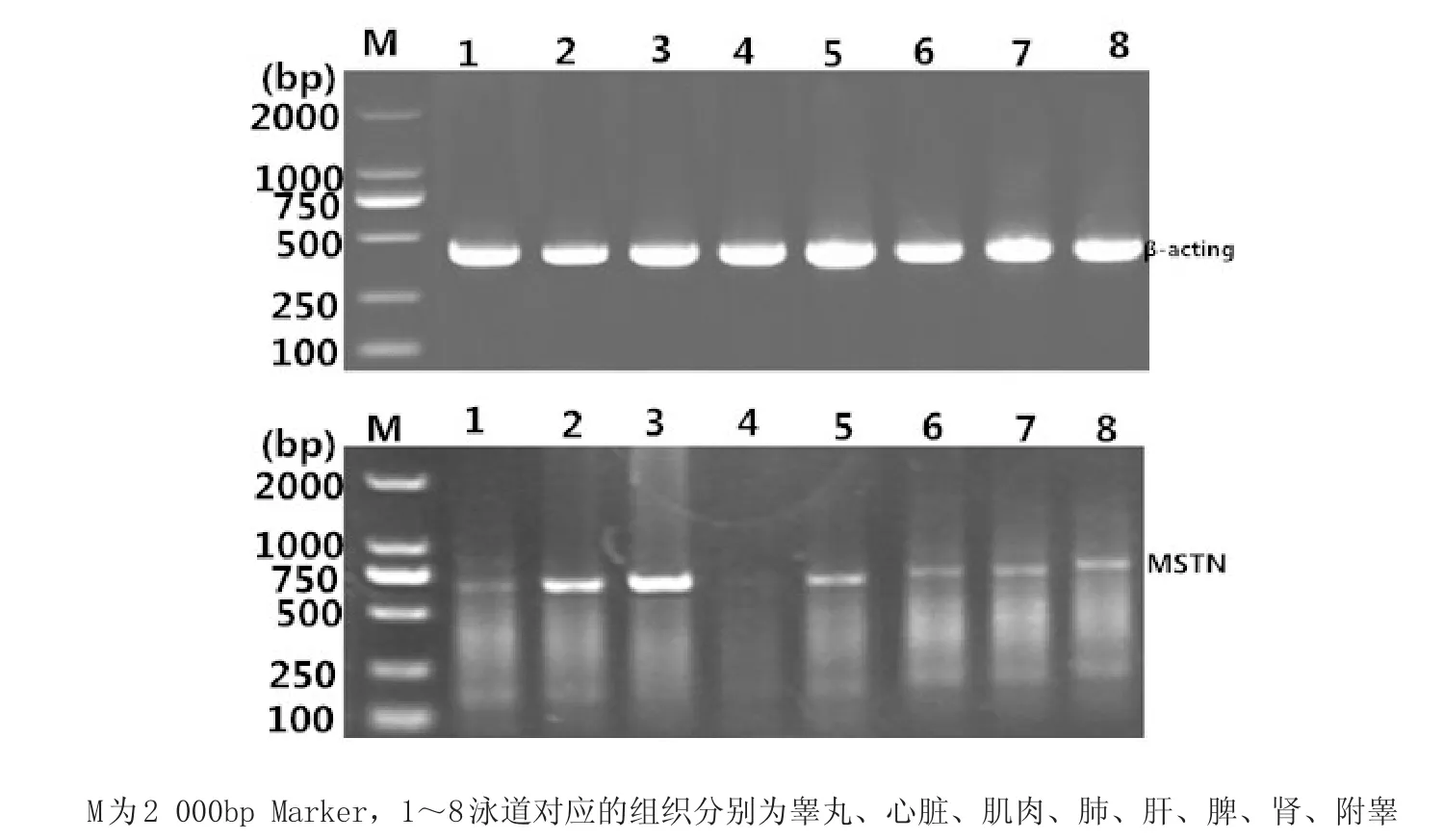
图5 MSTN基因在辽育白牛不同组织中的表达结果Fig.5 Results of MSTN gene expression in different tissues in Liaoyu white cattle
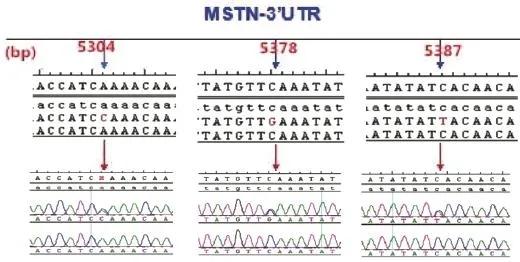
图6 辽育白牛MSTN基因3′UTR测序Fig.6 Sequencing of 3′UTR in MSTN gene of Liaoyu white cattle
启动子是基因的重要组成部分,它位于基因5′端上游,参与基因的转录表达。它通过与RNA聚合酶特异性作用,来对基因的转录水平起作用。由于启动子在转录水平的功能,当5′调控区发生SNP后,可能会造成启动子发生相应的变化。本试验已经得到辽育白牛MSTN基因的5′调控区发生SNP后,启动子位置发生了明显的变化,且原区域的TATA box消失。这表明在辽育白牛MSTN基因上存在多个潜在的启动子区段。而在很多研究中,牛基因组中的5′调控区或外显子1和2附近并没有典型的TATA框序列。转录结合因子在基因转录中具有重要的意义,它也是通过与RNA酶结合来发挥功能,影响着基因的转录,不同的转录因子,会产生不同的结合物,最后影响基因转录成不同的转录本,继而影响到后续的进程[10]。本试验通过寻找SNP前后潜在的转录因子潜在的结合位点的变化,功能性SNP使辽育白牛MSTN基因5′端结合的转录因子种类数量和结合力上都发生了改变,产生了不同的潜在结合位点,而这些潜在的结合因子共同作用可能会对MSTN基因的表达产生一定的影响。

图7 Microlnspector分析辽育白牛MSTN基因靶标miRNA结合情况Fig.7 Microinspector analysis of miRNA binding conditions targeted by MSTN gene in Liaoyu white cattle

表1 靶标miRNA的碱基序列Table1 Base sequence of target miRNA
MSTN基因在不同物种间是十分保守的:甚至小鼠、大鼠、人、猪、鸡和火鸡在C-端的同源性能达到100%,而牛羊相比只有1~3个碱基的差别,斑马鱼与其他动物比同源性最差也能达到88%。辽育白牛MSTN蛋白与多个哺乳动物MSTN蛋白序列的序列一致性都在90%以上,说明了该蛋白在哺乳动物中存在显著的相似性,因而可以认为其功能也存在保守性[11]。所以该基因在其他哺乳动物中的研究对辽育白牛的研究具有一定的借鉴意义。
MSTN在骨骼肌中广泛表达,是功能比较专一的肌肉发育负调控因子[12]。目前有关辽育白牛基因的相关研究还比较少,因此本试验将以生物信息学手段对MSTN的mRNA序列进行多物种比对并根据其保守区设计了辽育白牛MSTN基因克隆的引物,最终获得全长为1 128 b p的辽育白牛MSTN基因cD NA序列。再通过生物信息学分析对该未知序列进行初步的确认及功能预测,为后续试验确定初步的研究方向。
辽育白牛MSTN编码的蛋白总体上属于疏水性较弱、亲水性较强的分泌性蛋白,这一点与其他学者研究的普通牛MSTN相一致[13],虽然疏水区相对较少,但可以推测出这些疏水区对MSTN蛋白形成重要功能结构域上发挥一定的作用。经生物信息学分析王伟等也曾发现猪MSTN编码的蛋白质在细胞外,很有可能作为信号肽[14]。
随着动物发育时期的变化和物种的不同以及组织的不同,MSTN基因的表达也呈现一定差异[15]。Kim等[16]分析了新生牛不同时期MSTN基因在肌肉中的表达量逐渐发生变化。Sharma[17]研究在其他组织器官中MSTN蛋白的分布情况时,发现牛和绵羊心肌组织中该基因也表达。Ji等[18]发现,除骨骼肌外,在猪的心、肝、肺、肾、脑、舌、骨髓、小肠、乳腺和脂肪组织中也都有表达。本试验对于MSTN在不同组织中表达分析,发现其在辽育白牛肌肉组织中表达量相对很高,因此可以试图通过对其调控作用实现对肌肉性状的控制。MSTN基因5′端启动子、转录因子、cpG岛等都是都是在其转录水平起调控作用,可将其作为切入点实现对MSTN基因的表达进行调控。
4 结论
本试验克隆辽育白牛MSTN基因,发生SNPs后,启动子原区域两个TATA box消失,5′端结合的转录因子种类和数量都发生变化,且存在明显的cpG岛。编码区序列,全长为1 128 bp,编码375个氨基酸, MSTN蛋白存在信号肽序列,为分泌性蛋白,疏水性较弱、不稳定。辽育白牛不同组织部位MSTN基因具有组织部位差异性表达模式,且肌肉组织中表达信号最强。MSTN基因存在靶miRNAs,且比较保守。因此可将MSTN作为控制肌肉生长发育的候选基因,为开展辽育白牛分子育种研究奠定理论基础。
[1]陈宏,张春雷.中国肉牛分子育种研究进展[J].中国牛业科学,2008,34:1-5.
[2]Tajbakhsh S. Redefining the genetic hierarchies controlling skeletal myogenesis:Pax-3 and Myf-5 act upstream of MyoD[J].Cell, 1997,89:127-138.
[3]Smith P,Casas E,Rexroad C E.Bovine CAPN1 maps to a region of BTA29 containing a quantitative trait locus of meat tenderness[J]. Anim Sei,2000,78:2589-2594.
[4]Casas E,Bennett G L,Boettma C D,et al.Comprehensive linkage map of bovine chromosome 11[J].Anim Genet,2001,32:92-97.
[5]McPherron A C,Lee S J.Double muscling in cattle due to mutations in the myostatin gene[J].Proceedings of the National Academy of Sciences,1997,94:12457-12461.
[6]McPherron A C,Lee S J.Suppression of body fat accumulation in myostatin deficient mice[J].Clinical Investigation,2002,109:595-601.
[7]陈五军,尹凯,赵国军,等.MicroRNAs——脂质代谢调控新机制[J].生物化学与生物物理进展,2011,38: 781-790.
[8]Griffiths-Jones S,Grocock R J,van Dongen S. MiRBase:microRNA sequences,targets and gene no-menclature[J].Nucleic Acids Res,2006, 34:140-141.
[9]张海军,柴家科.微小R N A调节骨骼肌发育与损伤修复的作用及其机制[J].中华损伤与修复杂志, 2013,8:69-72.
[10]杜晓华,李积友,杨阳,等.甘肃西门塔尔牛高台类群MSTN基因多态性与生物信息学研究[J].畜牧兽医杂志,2015,1:13-17.
[11]吴清洪,岳敏,田雨光,等.西藏小型猪MSTN基因分子克隆及序列分析[J].中国比较医学杂志,2015, 3:18-22.
[12]Arthur P F.Double muscling in cattle:a review[J].Australian Journal of Agricultural Research,1997,46:1493-1515.
[13]高峰,邢沈阳,于海滨,等.牛MSTN基因克隆及编码区E1-224-A〉C定点突变前后生物信息学对比分析[J].中国兽医学报,2014,5:825-830.
[14]王伟,连林生,李继中.猪MSTN基因生物信息学分析[J].安徽农业科学,2012,40:5943-5945.
[15]姚力丹,祖玲玲,马晓燕,等.新疆5个品种羊不同月龄MSTN基因mRNA表达水平及其与生长性状相关性分析[J].中国畜牧兽医,2016,2:462-470.
[16]Kim H S,Liang L,Dean R G.Inhibition of preadipocyte differentiation by myostatin treatment in 3T3-L1 cultures[J].Biochemical and Biophysical Research Communications, 2001,281:902-906.
[17]Sharma M.Myostatin in Muscle Growth and Repair[J].Exercise and Sport Sciences Reviews,2001,29:153-158.
[18]Ji S,Losinski R L,Cornelius S G.Myostatin expression in porcine tissues:tissue specificity and developmental and postnatal regulation[J].American journal of physiology, 1998,275:1265-1273.
Liaoyu White Cattle MSTN Gene Molecular Clone And Sequence Analysis
Wang Jiaojiao1,Zhang Shiwei2*,Zhang Li jun2,Wang Zeying1, Luo Guangbin1,Bai Wenlin1
(1.College of Animal Husbandry and Veterinary,Shenyang Agricultural University,Liaoning Shenyang 110886; 2.Liaoning Animal Husbandry Economic Management Stations,Liaoning Shenyang 110032)
Myostatin(MSTN)are negative regulatory factors of muscle development,in order to achieved the molecular breeding of liao white cattle in the future,so this study analysesed the MSTN molecular characteristics and target of micrornas.In this research,Liaoyu white cattle were studied by means of molecular biological technology.By designing the specific primers,Coding regions and regulatory regions of MSTN ge0ne in Liaoyu white cattle were PCR amplified,cloned and sequenced separately.Based on the results of bioinformatics analysis software,to find SNPs in all areas,to analyze molecular characteristics of MSTN gene,expression differences in different tissues and target miRNAs of 3′-UTR.Experimental results showed that the SNPs in 5′regulatory region of MSTN gene could change the promoter position and the transcription factor binding conditions.But,the mutations in the Coding region had no effect on the protein composition.In Liaoyu white cattle,the full-length of Coding region sequences in MSTN gene was 1128 bp,with coding 375 amino acids which was the weak hydrophobic and unstable secreted protein containing signal peptide sequence.In different tissues of Liaoyu white cattle,there were expression differences for MSTN gene,and highest expression was appeared in muscle tissue.Conservative target miRNAs existed in 3′-UTR of MSTN gene.Through this research,the theoretical foundation of molecular breeding for Liaoyu white cattle can be laid.
Liaoyu white cattle;MSTN gene;MicroRNA;Single nucleotide polymorphisms(SNPs)
S823.25
B
1672-9692(2016)10-0021-07
2016-08-06
王娇娇(1987-),女,辽宁人,硕士,主要从事动物分子遗传育种研究。
张世伟(1968-),男,本科,研究员级高级畜牧师,主要负责牛良种繁育体系建设及技术推广等工作。
