羊传染性脓疱病毒PCR检测方法的建立与应用
2016-11-30李海利孙婷婷辛晓玲徐引弟朱文豪王克领
李海利,孙婷婷,辛晓玲,徐引弟,朱文豪,王克领
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002; 2.河南农业大学牧医工程学院,河南 郑州 450002)
羊传染性脓疱病毒PCR检测方法的建立与应用
李海利1,孙婷婷2,辛晓玲1,徐引弟1,朱文豪1,王克领1
(1.河南省农业科学院畜牧兽医研究所,河南 郑州 450002; 2.河南农业大学牧医工程学院,河南 郑州 450002)
根据羊传染性脓疱病毒GeneBank基因序列,设计合成一对引物。通过对PCR反应条件的优化,敏感性及特异性试验,成功建立了用于检测羊传染性脓疱病毒DNA的PCR检测方法。该方法成功扩增出390 bp的目的基因片段,敏感性试验证明可以检测出320×10-2ng/ L的DNA。特异性试验羊痘病毒、山羊关节炎脑炎病毒均未扩增出相应片段。重复性试验对3份羊传染性脓疱病毒阳性病料进行检测,结果均为阳性。临床应用对临床送检的16份疑似羊传染性脓疱病毒感染病料用上述建立优化的PCR方法进行检测,结果显示,9份为阳性,阳性样品的PCR扩增产物克隆后进行序列分析显示均为羊传染性脓疱病毒。证明该方法具有良好的敏感性和特异性,可以用于临床诊断。
羊传染性脓疱病毒;PCR;检测
羊传染性脓疱病(Contagious ecthyma,CE)是由羊传染性脓疱病毒(Contagious Ecthyma Virus)引起的一种山羊、绵羊的接触性、病毒性、嗜上皮性人畜共患传染病,本病也称为羊传染性脓疱皮炎、羊传染性脓疱口炎,俗称羊口疮(Or f)[1]。本病最早发现于欧洲,目前,世界各地所有养羊的地区都存在本病,我国新疆、甘肃、内蒙古、陕西、西藏、四川、云南等省区也有本病流行[2]。本病严重危害山羊和绵羊,绵羊、山羊可相互传染,而且人、骆驼、猫和海豹也可感染本病[3]。本病呈地方流行,对于首次发病羊群,幼龄羊和成年羊均可感染,而常发地区的羊群,以3~6月龄羔羊发病最多[4]。本病的病原为痘病毒科副痘病毒属,病毒核酸为双股DNA,大小为130~150 kb,G+C含量约为64%[5-6]。本病的临床症状表现为患羊嘴角及口腔出现红斑、肿胀,继而形成水疱、脓疱、溃疡破裂,最后形成较厚的灰褐色痂皮,有时还表现为羔羊发育受阻,体温正常或稍有升高,人可通过与病羊接触引发感染[7-9]。敏感羊群发病率很高,通常可达到90%,病死率达1%~25%,本病有化脓菌和坏死杆菌等继发感染,死亡率达50%。同时近年来随着全国各地肉羊产业迅速发展,该病呈暴发趋势,给养羊业造成极大的经济损失。
目前,可通过临床症状、流行病学调查对本病作出初步诊断,并通过实验室检查确诊,通过采取病羊的水疱液,病死羊的口唇部、皮肤、内脏制成病理组织切片。试验方法如电子显微镜检查、病毒分离、动物接种试验、血清中和试验、酶联免疫吸附试验、免疫电泳、P C R方法、核酸探针法等[10-11]。有国外学者采用P C R方法,特异性和敏感性较高[12]。常规的病原分离和血清学检测方法存在操作繁琐、耗时长、敏感性低、易受不确定因素如病毒毒价的准确性、细胞量的多少及生长情况、病毒血清孵育时间长短影响等缺点[13]。由于羊传染性脓疱的临床症状与羊痘、口蹄疫临床症状相似,且易继发化脓菌和坏死杆菌感染,增加了临床诊断的难度,因此本试验建立了一种简便快速、准确、特异性强、敏感度高的P C R检测方法,对快速、有效检测羊传染性脓疱病毒具有重要意义。
1 材料与方法
1.1 原材料试验所用的羊传染性脓疱病毒(Contagious Ecthyma Virus,CEV)及对照所用的羊痘病毒(Capri Pox Virus,CPV)、山羊病毒性关节炎-脑炎病毒(Caprine arthritis-encephalitis Virus, CAE)均由河南省农科院畜牧兽医研究所实验室保存。
1.2 主要试剂主要试剂:Ex Taq(5 U/μL)购自TaKaRa公司,2×Taq Mix Maste r(含染料)购自上海莱枫科技有限公司,病毒基因组DNA提取试剂盒购自生工生物工程(上海)有限公司,引物Forward Primer(10μm),Reverse Primer(10μm)由上海生物工程有限公司合成,DL 2000 DNA Marker购自TaKaRa公司,琼脂糖购自BIOWEST公司,1%琼脂糖凝胶:称取0.5 g琼脂糖溶于50 mL 1×TAE电泳缓冲液,溶化后加入5μL染色剂,50×TAE(T r is-乙酸):24.2 g Tris碱,冰乙酸10 mL,0.5 MEDTA (p H 8.0),加三蒸水定容至100 mL,工作液为1× TAE。
1.3 引物的设计与合成根据GeneBank中CE (K X579064.1)全基因序列设计一对引物,引物序列为P1(上游引物):5、-CCTACTTCTCGGAGTTCAGC-3、;P2 (下游引物):5、-GCAGCACTTCTCCTCGTAG-3、;预计扩增目的片段390 bp,引物由上海生物工程有限公司合成。
1.4 病毒基因组DNA DNA的提取按照Ezup柱式动物基因组DNA抽提试剂盒进行操作,提取的DNA保存在-20℃备用。
1.5 PCR 反应
1.5.1 PCR反应条件的优化
1.5.1.1 最适模板用量的确立分别取1、2、3、4、5、6μL DNA模板,进行PCR反应,以确定最适的模板用量。
1.5.1.2 最适引物用量的确立分别取不同用量的引物在50μL的反应体系中,上、下游引物分别加入0.1、0.3、0.5、0.7、1.0、1.2μL进行P C R扩增反应,以确定最适的引物用量。
1.5.1.3 最适变性温度的确立分别在92、93、94、95、96℃下进行PCR扩增反应,以确定最适的变性温度。
1.5.1.4 最适退火温度的确立分别在51、53、55、57、59℃下进行PCR扩增反应,以确定最适的退火温度。
1.5.2 PCR扩增反应PCR反应在50μL反应体系中进行,引物Forward Primer 1μL,Reverse Primer 1μL,DNA模板各9 μL,2×Taq Mix Master(含染料)25μL,DEPC水14 μL。反应条件为95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸30 s,35个循环,最后72℃延伸10 min,4℃保存。取5μL PCR扩增产物于1%琼脂糖凝胶电泳中进行电泳测定,以1×TAE配成50 mL 1%琼脂糖凝胶,胶内加入染色剂5μL,每份PCR样品取5μL,在90~110 V电泳30 min,于G T-1凝胶成像仪上观察结果。
1.6 PCR PCR特异性试验分别取同体积的羊传染性脓疱病毒、羊痘病毒的DNA、山羊病毒性关节炎-脑炎病毒、健康的羊皮组织及ddH2O,山羊病毒性关节炎-脑炎病毒先反转录为cDNA再进行PCR反应, ddH2O作为阴性对照,以确定建立的PCR反应特异性。
1.7 PCR PCR敏感性试验将提取的羊传染性脓疱病毒核酸用蛋白质核酸测定仪测定核酸浓度为320 ng/ μL,将DNA进行10倍系列稀释第1~8孔,其浓度依次为320 ng/μL,320×10-1ng/μ L DNA,320× 10-2ng/μL DNA,320×10-3ng/μL DNA,320× 10-4ng/μL DNA,320×10-5ng/μL DNA,320× 10-6ng/μL DNA,320×10-7ng/μL DNA。以上述浓度体系为模板进行PCR扩增,测定其敏感性。
1.8 PCR PCR重复性试验应用建立的PCR检测方法,对羊传染性脓疱病毒3份阳性病料和3份阴性病料,重复检测3次,以验证建立的PCR检测方法的稳定性。
1.9 临床应用用建立优化的PCR检测方法,对临床送检的16份疑似羊传染性脓疱病毒病料先提取DNA,应用PCR优化条件进行检测。

图1 PCR扩增产物凝胶电泳图Fig.1 Agarose gel electro phoresis of the PCR products
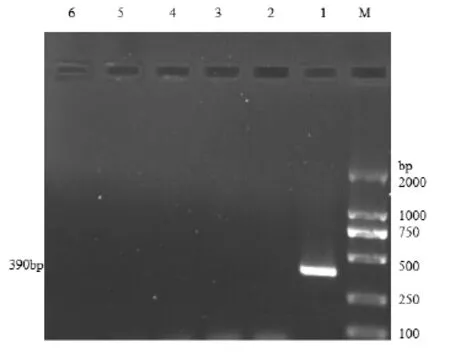
图2 PCR特异性试验结果Fig.2 The specific test results of PCR
2 结果与分析
2.1 扩增产物的检测及鉴定在G I-1凝胶成像仪上观察,结果显示,该PCR体系可以扩增出一条约为390 b p的羊传染性脓疱病毒的基因片段(图1)。PCR产物应经切胶纯化、克隆、测序,证明是该病毒的DNA。
2.2 特异性试验结果提取羊传染性脓疱病毒、羊痘病毒核酸,应用试验设计的引物,以他们的DNA为模板进行PCR扩增,山羊病毒性关节炎-脑炎病毒反转录为cDNA后进行PCR扩增,结果显示,只有羊传染性脓疱病毒能扩增出约390 b p的条带,而其他病毒、健康羊皮组织和ddH2O均未扩增出目的条带。说明建立的PCR检测方法具有良好的特异性,设计的引物与羊痘病毒、山羊病毒性关节炎-脑炎病毒核酸不能发生特异性结合(图2)。
2.3 敏感性试验结果将模板DNA经10倍系列稀释后浓度分别为320 ng/μL,320×10-1ng/μL DNA, 320×10-2ng/μL DNA,320×10-3ng/μL DNA, 320×10-4ng/μL DNA,320×10-5ng/μL DNA, 320×10-6ng/μL DNA,320×10-7ng/μL DNA。分别进行PCR扩增,在浓度3.2×10-3ng/μL时仍出现目的片段,而在浓度3.2×10-4ng/μL时不出现目的片段,可检测出浓度320×10-2ng/μL的模板,结果见图3。
2.4 重复性试验结果应用优化的PCR方法检测羊传染性脓疱病毒3份阳性病料和3份阴性病料,并重复检测3次DNA样品,检测结果均一致,证明建立优化的PCR方法稳定性良好。
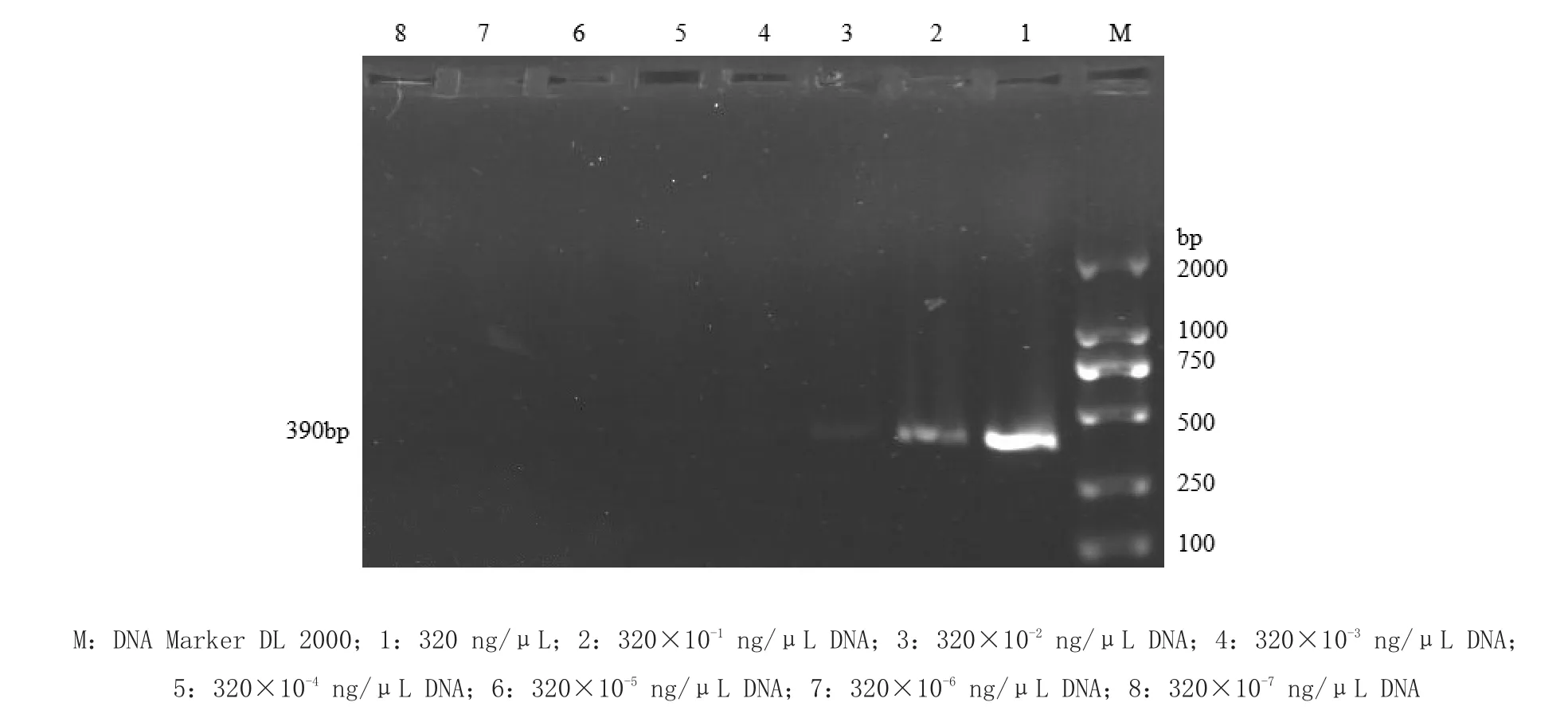
图3 PCR敏感性试验结果Fig.3 The sensitivity test results of PCR
2.5 临床应用对临床送检的16份疑似感染羊传染性脓疱病毒的动物取干痂加P BS缓冲液研磨10 min,用建立优化的PCR检测方法检测,发现有9份阳性、7份阴性。对阳性样品PCR扩增产物进行序列分析,显示均为羊传染性脓疱病毒,如图4。
3 讨论
羊传染性脓疱病毒是发生在绵羊、山羊身上的一种常见病,虽然发病率高,但病死率低,然而反复发作,给养羊业造成严重的经济损失。本病的防控与羊场的管理关系较大,做好羊场的卫生消毒工作,加强饲养管理,提高动物的抗病力,将健康羊与病羊隔离饲养,在养殖场具体实施免疫接种、药物预防、消毒、隔离等综合措施[14],可降低本病的发病率。由于本病的临床症状轻微,患羊口唇起水疱、脓疱、结痂,最后脱落,不易引起饲养人员的重视,采取的治疗措施只是在患病处涂抹2%紫药水,没有真正消灭病原,几天后虽然症状消失,但过一段时间会复发本病。
羊传染性脓疱病毒与羊痘病毒、口蹄疫病毒在临床上症状相似,且本病易继发化脓菌和坏死杆菌感染,在临床诊断上难以鉴别,易导致误诊,选错治疗方法,耗时耗力。羊传染性脓疱病,绵羊、山羊均可发病,发病后无体温升高等全身症状。本试验采用PCR检测方法,引物的选择是影响PCR成功的一个关键因素。本试验根据GeneBank公布CEV基因序列,设计合成一对引物,以CEV的DNA能扩增出390 bp的目的基因片段,而羊痘病毒、山羊病毒性关节炎-脑炎病毒DNA均不能扩增出目的条带,该PCR检测方法具有良好的特异性和敏感性,敏感性试验表明可检测出320×10-2ng/μL的病毒液。
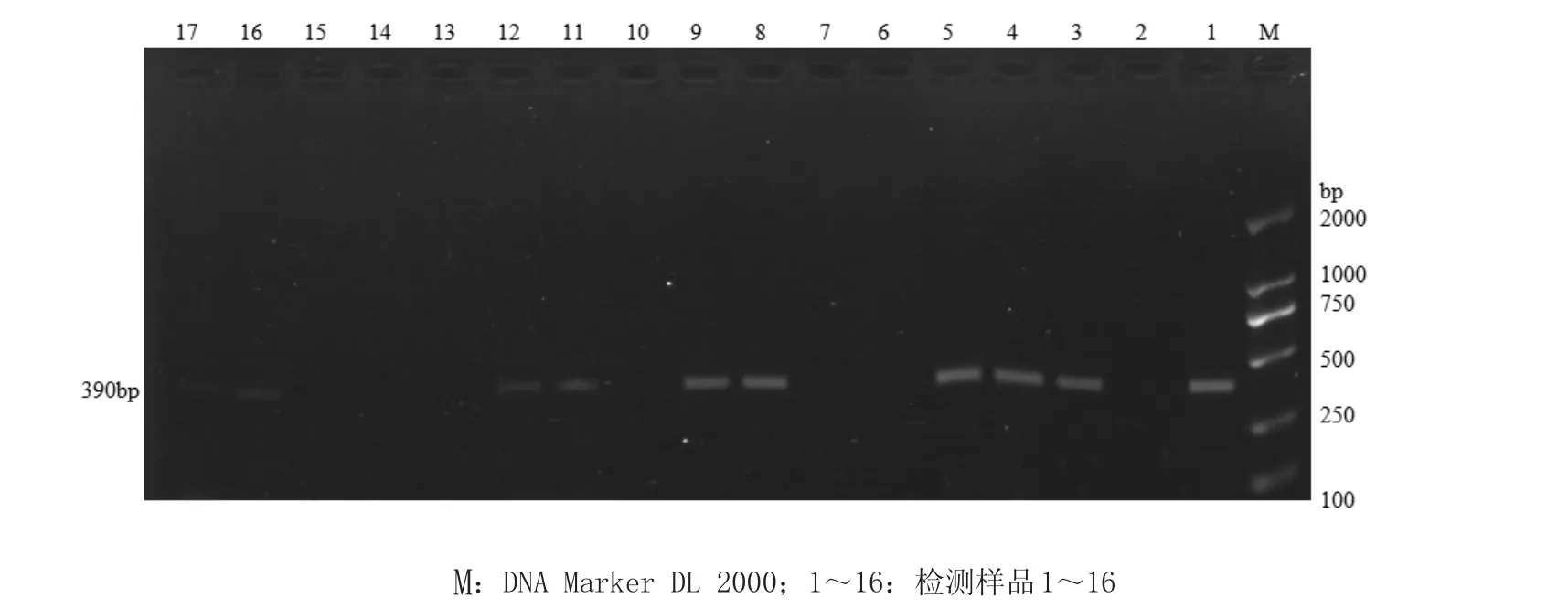
图4 临床样品的PCR检测结果Fig.4 The result of clinical samples detected by PCR
该PCR检测方法与病毒分离和血清中和试验相比,具有良好的优越性,血凝、补反、凝集等常规试验方法均无法检测羊传染性脓疱病毒,可能出现非特异性反应或交叉反应[15]。与中和试验相比, ELISA法(酶联免疫吸附试验)快速、简便、敏感,易于标准化[16-17],对流免疫电泳具有快速、简便、准确的特点[18]。应用DNA杂交技术检测CEV DNA的方法,用放射性同位素32P标记CEV DNA探针,对CEV DNA片段进行诊断和检测[19-20]。由于电子显微镜价格昂贵,病原分离培养费时费力,血清中和试验易受不确定因素的影响。应用PCR检测方法诊断羊传染性脓疱,操作简便,只需2.5 h。应用PCR检测方法对临床病料检测的检出率可达到56%,检出率高,不仅节省了开支,而且大大缩短了检测时间,可保证临床病料的及时确诊。
[1]Tomaselli M,Dalton C,Duignan P J,et al.Contagious Ecthyma,Rangiferine Brucellosis, and Lungworm Infection in a Muskox(Ovibos moschatus)from the Canadian Arctic[J].J Wildl Dis,2016,52(3):719-724.
[2]Davari SA,Sayyari M,Mohammadi A.Histopathological study and F1L gene sequence analysis of contagious ecthyma in small ruminants of Shiraz suburb,Iran[J].Trop Biomed,2015,32 (2):335-343.
[3]Wang K,Shao H,Pei Z,et al.Rapid detection of contagious ecthyma by loop-mediated isothermal amplification and epidemiology in Jilin Province China[J].J Vet Med Sci,2016, 78(1):125-128.
[4]Khalafalla AI,El-Sabagh IM,Al-Busada KA,et al.Phylogenetic analysis of eight sudanese camel contagious ecthyma viruses based on B2L gene sequence[J].Virol J,2015,12:124.
[5]O nyango J,Mata F,McCormick W,et al.Prevalence,risk factors and vaccination efficacy of contagious ovine ecthyma(or f)in England[J].V et Rec,2014,175(13):326.
[6]Tryland M,Klein J,Berger T,et al.Experimental parapoxvirus infection(contagious ecthyma)in semi-domesticated reindeer(Rangifer tarandus tarandus)[J].Vet Microbiol 2013,162(2-4):499-506.
[7]G arrido-Farina GI,Cornejo-Cortes MA,Martinez-Rodriguez A,et al.A study of the process of apoptosis in animals infected with the conta g ious ecthyma virus[J].V et Microbiol,2008,129(1-2):28-39.
[8]Vikoren T,Lillehaug A,Akerstedt J,et al.A severe outbrea k of contagious ecthyma(or f) in a free-ranging musk ox(Ovibos moschatus) population in Norway[J].Vet Microbiol, 2008,127(1-2):10-20.
[9]Abubakr MI,Abu-Elzein EM,Housawi FM,et al. Pseudocowpox virus:the etiological agent of contagious ecthyma(Auzdyk)in camels(Camelus dromedarius)in the Arabian peninsula[J].Vector Borne Zoonotic Dis,2007,7(2): 257-260.
[10]Kottaridi C,Nomikou K,Lelli R,et al.Laboratory diagnosis of contagious ecthyma:comparison of different PCR protocols with virus isolation in cell culture.J Virol Methods[J].2006,134(1-2):119-124.
[11]Scagliarini A,Dal Pozzo F,Gallina L,et al.In vitro activity of VEGF-E produced by or f virus strains isolated from classical and severe persistent contagious ecthyma. Vet Microbiol[J].2006,114(1-2):142-147.
[12]Gokce HI,Woldehiwet Z.Ehrlichia(Cytoecetes)phagocytophila predisposes to severe contagious ecthyma(Or f)in lambs[J].J Comp Pathol,1999,121(3):227-240.
[13]Degraeve C,De Coninck A,Senneseael J,et al.Recur rent contagious ecthyma(Or f)in an immunocompromised host successfully treated with cryotherapy[J].Dermatology,1999,198 (2):162-163.
[14]Azwai SM,Car ter SD,Woldehiwet Z.Immune responses of the camel(Camelus dromedarius) to contagious ecthyma(Or f)virus infection[J].Vet Microbiol,1995,47(1-2):119-131.
[15]Gameel AA,Abu Elzein EM,Housawi FM,et al. Clinico-pathological observations on naturally occur ring contagious ecthyma in lambs in Saudi Arabia[J].Rev Elev Med Vet Pays Trop, 1995,48(3):233-235.
[16]Khalafalla AI,Agab H,Abbas B.An outbreak of contagious ecthyma in camels(Camelus dromedarius)in eastern Sudan[J].Trop Anim Heal th Prod,1994,26(4):253-254.
[17]Ndikuwera J,Odiawo GO,Usenik EA,et al. Chronic contagious ecthyma and caseous lymphadenitis in two Boer goats[J].Vet Rec, 1992,131(25-26):584-585.
[18]Ali OA,Kheir SA,Abu Damir H.Camel(Camelus dromedarius)contagious ecthyma in the Sudan.A case report[J].Rev Elev Med Vet Pays Trop,1991,44(2):143-145.
[19]Hooser SB,Scherba G,Morin DE,et al.Atypical contagious ecthyma in a sheep after extensive cutaneous thermal injury[J].J Am Vet Med Assoc,1989,195(9):1255-1256.
[20]Mathiesen SD,Jorgensen T,Traavik T,et al. On contagious ecthyma and its treatment in muskoxen(Ovibos moschatus)[J].Acta Vet Scand,1985,26(1):120-126.
Establishment and Application of PCR Detection Method to Contagious Ecthyma Virus
Li Haili1,Sun Tingting 2,Xin Xiaoling1,Xu Yindi1,Zhu Wenhao1,Wang Keling1
(1.Animal Husbandry and Veterinary Research Institute,Henan Academy of Agricultural Sciences,Henan Zheng zhou 450002; 2.College of animal husbandry and medical engineering,Henan Agricultural University,Henan Zheng zhou 450002)
According to the gene sequence of Gene Bank of contagious ecthyma virus(CEV),a pair of primers were designed.The PCR test to detect CEV was successfully established.By the optimization of PCR reaction conditions,a 390 bp fragments was amplified.The sensitivity of the assay can be up to 320×10-2ng/μL.This method is specific,it can distinguish contagious ecthyma virus from sheep pox virus and caprine arthritis encephalitis virus.Repeatability test in three suspicious-positive diseases of sheep contagious ecthyma for testing,the results were positive. Clinical application of the 16 suspected contagious ecthyma disease samples which were infected, showed 9 positive results.After cloning and analyzing sequence of the positive samples' PCR amplification product,it showed that all infected with CEV.The method has good sensitivity,specificity,and it can be used for clinical diagnosis.
Contagious Ecthyma Virus(CEV);P C R;Detection
S852.65
B
1672-9692(2016)10-0001-06
2016-07-17
李海利(1982-),男,河南省开封人,助理研究员,博士,主要从事兽医传染病防控研究工作。
河南省农业科学院自主创新基金。
