白质消融性脑白质病临床与基因分析
2016-11-30叶高波
刘 宇,王 芳,叶高波,杨 琳
(西安交通大学第二附属医院儿科,陕西 西安 710004)
白质消融性脑白质病临床与基因分析
刘 宇,王 芳,叶高波,杨 琳
(西安交通大学第二附属医院儿科,陕西 西安 710004)
目的 探讨3例白质消融性脑白质病(VWM)患儿的临床表现及其分子生物学基础。方法 详细收集2014至2015年西安交通大学第二附属医院儿科收治的3例VWM患儿的临床资料、生化检查及影像学检查结果,抽取外周静脉血,提取基因组DNA,PCR扩增致病基因真核细胞翻译启动因子2B(EIF2B1~5)的外显子及外显子与内含子交界区,测序确定突变情况。结果 3例患儿临床表现、实验室检查及影像学检查均符合VWM的诊断,基因突变分析显示3例患儿中EIF2B5基因突变2例,EIF2B3基因突变1例,其中新发突变1例,为EIF2B5基因发现c.536C>T的纯合核苷酸变异。结论 临床上出现以运动倒退为主的进行性加重的神经功能减退,头颅磁共振显示脑白质弥漫性对称性受累的患儿,应该考虑患VWM的可能性,对EIF2B1~5基因分析有助于确诊。
白质消融;脑白质病;基因突变;临床特点
白质消融性脑白质病(leukoencephalopathy with vanishing white matter,VWM)也称儿童共济失调伴中枢神经系统髓鞘化不良(childhood ataxia with central nervous system hypomyelination,CACH),是一种较为少见的常染色体隐性遗传病。该病于1998年才被正式命名,尚缺乏关于发病率的报道[1]。目前已经明确它主要是由于编码真核细胞翻译启动因子2B(eukaryotic translation initiation factor2B,eIF2B)的5个亚单位eIF2Bα、β、γ、δ、ε相应编码基因(EIF2B1~5)突变导致的,其发病机制目前尚未明确,是一种临床较为罕见的疾病。本研究分析3例VWM患儿的临床、实验室检查和eIF2B基因突变情况,旨在探讨VWM临床表现极其分子生物学基础,提高对该病的认识。
1对象和方法
1.1对象
2014至2015年西安交通大学第二附属医院儿科收治的3例以运动障碍为首发表现的患儿,经体格检查、实验室检查后,考虑为VWM。经患儿家长同意,抽取外周血,提取基因组DNA进行eIF2B基因分析。
1.2基因分析方法
基因组DNA提取:采集患儿及其父母外周静脉血各4mL,以常规盐析法提取外周血白细胞基因组DNA。
突变筛查:国际报道的VWM基因突变多发生于EIF2B5,约占57%,其次为EIF2B4基因,占17%;EIF2B2占15%,EIF2B3占7%,EIF2B1占4%[2]。因此,对每例患儿首先进行EIF2B5突变筛查,随后依次筛查EIF2B4、EIF2B2、EIF2B3、EIF2B1突变。PCR扩增EIF2B5的16个外显子,EIF2B4的13个外显子,EIF2B2的8个外显子,EIF2B3的12个外显子,EIF2B1的9个外显子,以及所有外显子-内含子交界区。扩增产物经聚丙烯酰胺凝胶电泳(PAGE)检测,在ABI3700测序仪上测序。测序结果与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)网站数据库进行比对分析,以确定变异的位点和类型,并进一步与NCBI SNP和Ensemble数据库及人类基因突变数据库(Human Gene Mutation Database,HGMD)进行比对,排除变异位点为基因多态性位点,并确定其是否为未报道过的新突变位点。
2结果
2.1病历1
2.1.1临床资料
患儿,男,2岁2个月,因肢体活动障碍2个月余,2015年8月于西安交通大学第二附属医院儿科就诊。2月前患儿发热后出现肢体活动障碍,伴易惊,构音困难,不伴抽搐发作,无头痛、呕吐。1个月前出现竖头不稳,口周流涎,双下肢僵直,不能独站,外院头颅磁共振示为“脑白质弥漫性脱髓鞘改变”,住院给予“甲强龙冲击4天”,改用口服“泼尼松10mg/d”,肢体活动较前有所改善,可独站扶走。12天前活动障碍再次加重,扶走数十步后拒绝行走,无视力减退,无头痛、头晕,无恶心、呕吐,大小便无异常,来本院。患儿既往体健,发育较同龄儿慢,8个月可坐稳,1岁3个月可独走,语言表达偏慢,能达意。父母体健,非近亲婚配;有3个姐姐,体健;无特殊家族史;否认近期中毒及特殊药物接触史。查体:体重12kg,心肺腹查体无明显异常。神经系统查体:口中流涎,慌张步态,左下肢轻度拖拽,双上肢肌张力正常,双下肢肌力Ⅳ-,双下肢膝腱、跟腱反射明显活跃,双侧Babinskin征(+),脑膜刺激征(-)。
2.1.2实验室检查结果
血尿粪常规、血生化、血氨、乳酸、同型半胱氨酸、自身抗体、皮质醇、促肾上腺皮质激素(ACTH)、尿检查均未见明显异常。
2.1.3影像学检查结果
脑电图:异常范围脑电图,以慢δ节律为主,θ频率偏慢且θ波偏少;头颅磁共振:双侧大脑白质对称性长T1、长T2信号,考虑代谢病可能。
2.1.4 eIF2B基因突变分析
测序结果显示,在受检者EIF2B3基因发现c.674G>A(编码区第674号核苷酸由G变为A)的纯合核苷酸变异,该变异导致第225号氨基酸由精氨酸变为谷氨酰胺(p.R225Q),为错意突变。患儿父亲、母亲均为杂合突变,该突变位点国内外已有文献报道[3-4],属于已知突变,国内关于该基因位点报道病历临床分型为重型[4],运动功能5年内迅速减退,丧失行走能力,本例患儿因随访时间较短,尚需长时间观察。
2.1.5预后及随访
患儿此后再次于本院康复治疗1个疗程,但病情无明显好转,可扶站、扶走数步,不能独走,言语含混,构音困难,但能进行交流,后自行出院。
2.2病历2
2.2.1临床资料
患儿,男,2岁8个月,因行走不稳1个月余,2014年9月于西安交通大学第二附属医院儿科就诊。1月前患儿从床上跌下,无呕吐,无意识丧失,随后出现行走不稳,可扶走数步,不能独走,伴言语不清,无吞咽困难,大小便失禁,当地医院行头颅CT“未见明显异常”,行走不稳自行好转,但独走时步态欠稳,语言较前多。10余天前行走不稳再次加重,不愿下地,反应减慢,外院头颅磁共振示“双侧脑白质异常信号,考虑代谢性脑病”,来本院。患儿精神可,食纳可,大小便外观正常。患儿既往体健,运动发育同同龄儿,言语发育同同龄儿。父母体健,非近亲婚配,无特殊家族史,否认近期中毒及特殊药物接触史。查体:体重14kg,心肺腹查体无明显异常。神经系统查体:口中流涎,言语含混,不下地支撑,双上肢肌力可,双下肢肌力Ⅲ-。双侧膝腱、跟腱反射活跃,双侧Babinski征(+),脑膜刺激征(-)。
2.2.2实验室检查结果
血尿粪常规、血生化、血氨、乳酸、同型半胱氨酸、自身抗体、皮质醇、ACTH检查均未见明显异常。
2.2.3影像学检查结果
脑电图:异常脑电图,以δ节律为主;头颅磁共振:双侧大脑白质长T1、长T2信号。
2.2.4 eIF2B基因突变分析
测序结果显示,在受检者EIF2B5基因发现c.943C>T(编码区第943号核苷酸由C变为T)的纯合核苷酸变异,该变异导致第315号氨基酸由精氨酸变为半胱氨酸(p.R315C),为错意突变,患儿父亲、母亲均为杂合突变。该突变位点国内外已有文献报道[3-4],属于已知突变,国内关于该基因位点报道病历临床分型为重型[4]。
2.2.5预后及随访
患儿此后在本院康复治疗1个疗程,病情仍在反复,可有短暂好转,可扶走数步,但总体步态不稳较前加重,不能独站,反应慢,言语含混,自主语言减少。自行出院。
2.3病历3
2.3.1临床资料
患儿,男,3岁5个月,因行走不稳20余天,2015年6月于西安交通大学第二附属医院儿科就诊。就诊前20余天发现患儿行走不稳,右下肢拖沓,不能并脚跳,不愿走路,抓物时双手轻微抖动,说话及反应稍慢,未见明显呛咳,未见流口水,无大小便失禁。外院头颅磁共振示“双侧大脑白质信号异常”,来本院。发病以来无发热、惊厥,无精神萎靡。患儿精神可,食纳可,大小便外观正常。患儿既往体健,运动发育同同龄儿,言语发育较同龄儿落后,1岁6个月会叫人。父母体健,非近亲婚配,无特殊家族史,否认近期中毒及特殊药物接触史。查体:体重15kg,心肺腹查体无明显异常。神经系统查体:抓物时双手轻微震颤,行走不稳,步态拖曳,右下肢为著,双上肢肌力Ⅳ+,双下肢肌力Ⅳ+。双侧膝腱、跟腱反射活跃,双侧Babinski征(+),脑膜刺激征(-)。
2.3.2实验室检查结果
血尿粪常规、血生化、血氨、乳酸、同型半胱氨酸、自身抗体、皮质醇、ACTH检查均未见明显异常。
2.3.3影像学检查结果
脑电图:异常脑电图,间歇可见右侧波幅降低波率减慢;头颅磁共振:双侧大脑白质信号异常,见图1。
2.3.4 eIF2B基因突变分析
测序结果显示,在受检者EIF2B5基因发现c.536C>T(编码区第536号核苷酸由G变为T)的纯合核苷酸变异,该变异导致第179号氨基酸由丝氨酸变为苯丙氨酸(p.S179F),为错意突变,与NCBI数据库比对结果表明,该突变目前尚未见文献报道,为新突变,见图2。患儿父亲、母亲均为杂合突变。
2.3.5预后及随访
患儿此后在本院康复治疗3个疗程,但病情仍在进展,步态不稳较前加重,不能独走,不能独站,言语减少,后自行出院。
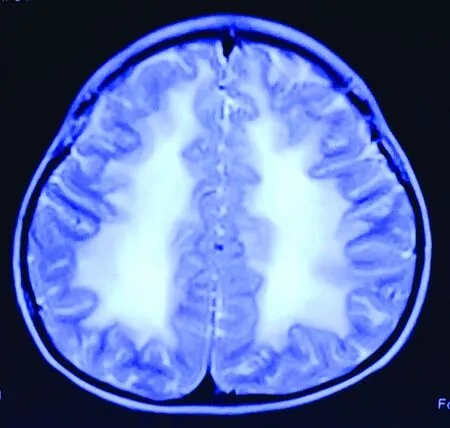
注:弥漫性对称性大脑白质液化,a为T2加权像;b为T1加权像。
图1 VWM患儿头颅磁共振示白质弥漫性对称受累
Fig.1 Diffuse and symmetric involvement of white matter revealed in MRI images
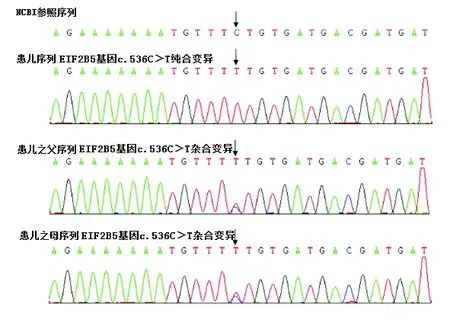
图2 患儿及其父母EIF2B5编码区测序结果
Fig.2 Sequence in EIF2B5 coding regions of patients and their parents
3讨论
本文3例患儿均为男性,2~3岁起病,早期智力、运动发育基本正常,3例均以运动障碍为首发表现,其中1例为感染后起病,1例为外伤后起病,另外1例无明确诱因,病情急性进展,期间可一过性好转,但整体呈加重趋势。3例患儿均有言语发育倒退。3例患儿神经系统查体肌力均有不同程度减低,病理反射均呈阳性。3例患儿实验室检查磁共振均显示双侧大脑白质信号异常。具有上述表现时可考虑VWM,行基因检测可明确诊断。
3.1关于发病机制
VWM是一种罕见的常染色体隐性遗传病,我国于2007年才首见报道[5],目前对该病的发病率尚无相关研究资料。其具体机制可能与内质网应激相关。但目前具体发病机制尚未明确[1]。eIF2B的5个亚单位eIF2Bα、β、γ、δ、ε相应编码基因(EIF2B1~5)突变均可导致发病。本文中2例为EIF2B5基因突变,1例为EIF2B3基因突变,发现国内外未报道新突变1例,未发现国外报道热点突变及国内发现的疑似热点突变。
3.2临床表现及分型
VWM临床表现为进行性运动、智力倒退,伴有共济失调、痉挛性瘫、视神经萎缩等多种临床表现,同时可伴抽搐发作,但惊厥发生率较低,且多不为首发表现,这与VWM白质受累从中央区逐渐向皮质下扩散有关[6],本文中3例患儿目前均未出现抽搐发作。VWM的诊断标准[7]:①早期精神、运动发育正常或存在轻度发育落后;②早期可出现进行性加重的神经功能倒退,发热、头部外伤均可引起疾病加重;③神经系统症状主要为小脑共济失调、肢体痉挛等;④头颅磁共振表现为弥漫性、对称性大脑白质受累,可累及中央区及皮质下,白质改变在T1、T2及磁共振成像液体衰减反转恢复序列(FLAIR)像逐渐进展,最终与脑脊液信号相同。根据VWM起病年龄,将该病分为5型,①先天型:妊娠晚期即刻出现症状,病情进展快,多于1岁内死亡;②婴儿型:婴儿期起病,常以肌张力低为首发表现,个别病历可于数月内死亡;③早期儿童型:也称经典型,是临床最常见类型,我国目前报道病历几乎均为该类型,本文中3例病历也属该类型。该类型多于1~5岁起病,多数发病期智力及运动发育正常,少数可有轻度落后。可于起病1~5年内死亡,也可存活数十年;④晚期儿童型/少年型:5~15岁出现症状,进展缓慢,甚至运动功能可逐渐恢复;⑤成人型:多以痴呆、癫痫或运动倒退为首发表现。
3.3影像学特点
VWM的磁共振表现具有特征性,表现为脑白质弥漫性对称性受累,仅U形纤维、胼胝体外侧、内囊和前联合未受累。随着病情进展,白质稀疏、囊变,最终液化,即“白质消融”[8]。本文中患儿磁共振即表现为上述特点。磁共振诊断标准包括:①大脑白质弥漫性对称性受累,主要累及中央区及皮质下白质;②白质可逐渐变为与脑脊液相同信号(长T1,长T2,FLAIR低信号);③T1及FLAIR像可见线状残存白质。
3.4预后及预防
VWM预后不良,本文中3例患儿目前随访时间仍较短,但目前已有1例患儿不能行走,其余2例仅能扶走,3例患儿均已出现不同程度认知损害。目前对该病无有效治疗方法,3例患儿家长均尝试康复治疗,效果不理想,自行出院。对有该病家族史家庭,应进行产前诊断。
[1]Scheper G C,van der Knaap.Vanishing White Matter Disease (CACH Syndrome)[M]//Aminoff M J,Daroff R B.Encyclopedia of the Neurological Sciences.2nd ed.Waltham:Academic Press/Elsevier,2014:595-601.
[2]Zhang H, Dai L, Chen N,etal.Fifteen novel EIF2B1-5 mutations identified in Chinese children with leukoencephalopathy with vanishing white matter and a long term follow-up[J].PLoS One,2015,10(3):e0118001.
[3]Liu R,van der Lei H D,Wang X,etal.Severity of vanishing white matter disease does not correlate with deficits in eIF2B activity or the integrity of eIF2B complexes[J].Hum Mutat,2011,32(9):1036-1045.
[4]代丽芳,吴晔,王静敏,等.中国早期儿童型白质消融性白质脑病患儿17例自然病程随访及其基因型-表型分析[J].实用儿科临床杂志,2011,26(10):773-777.
[5]吴晔,姜玉武,秦炯,等.白质消融性白质脑病临床分析[J].中华儿科杂志,2007,45(2):115-120.
[6]Sharma S, Arya R, Raju K N,etal.Vanishing white matter disease associated with ptosis and myoclonic seizures[J].J Child Neurol,2011,26(3):366-368.
[7]Elroy-Stein O,Schiffmann R.Vanishing White Matter Disease[M]//Rosenberg R N,Pascual J M.Rosenberg’s molecular and genetic basis of neurological and psychiatric disease.5th ed.Amsterdam : Elsevier Academic Press,2015:1015-1030.
[8]Meoded A, Poretti A, Yoshida S,etal.Leukoencephalopathy with vanishing white matter:serial MRI of the brain and spinal cord including diffusion tensor imaging[J].Neuropediatrics,2011,42(2):82-85.
[专业责任编辑:于学文]
Clinical and genetic analysis of leukoencephalopathy with vanishing white matter
LIU Yu, WANG Fang, YE Gao-bo, YANG Lin
(Department of Pediatrics, Second Affiliated Hospital of Xi’an Jiaotong University, Shaanxi Xi’an 710004, China)
Objective To analyze the clinical manifestations and molecular basis of 3 patients with leukoencephalopathy with vanishing white matter (VWM). Methods Clinical data, laboratory examination results and imaging results of 3 cases of VWM were collected from 2014 to 2015 in the Second Affiliated Hospital of Xi’an Jiaotong University. Genomic DNA was extracted from leukocytes of peripheral blood of patients and their parents. The exons of VWM gene and their boundaries with introns were amplified by polymerase chain reaction (RCR). The mutations of the EIF2B1-5 gene were identified by direct sequencing. Results VWM were diagnosed on the basis of comprehensive consideration of clinical manifestations, laboratory test results and imaging findings. Gene mutation test revealed that 2 of 3 cases had EIF2B5 mutation, 1 had EIF2B3 mutation. One of the patients had a new mutation, the substitution of thymine for cytosine at the position 536 of cDNA sequence of EIF2B5 gene (c.536C>T). Conclusion For patients with progressively severe nervous dysfunction mainly presenting movement backward in clinics and MRI findings of diffuse and symmetric involvement of cerebral white matter, VWM will be considered, and genetic analysis of EIF2B1-5 may be helpful to diagnosis.
vanishing white matter; leukoencephalopathy; gene mutation; clinical characteristics
2016-04-15
刘 宇(1987-),女,住院医师,硕士,主要从事儿科神经病学的研究。
杨 琳,主任医师。
10.3969/j.issn.1673-5293.2016.10.005
R742
A
1673-5293(2016)10-1181-04
