年轻肿瘤患者冻融卵巢皮质自体移植安全性研究进展
2016-11-30伍园园滕晓明
伍园园,滕晓明
(同济大学附属第一妇婴保健院生殖中心,上海 210204)
年轻肿瘤患者冻融卵巢皮质自体移植安全性研究进展
伍园园,滕晓明
(同济大学附属第一妇婴保健院生殖中心,上海 210204)
直接冷冻卵巢皮质能保存大量原始卵泡,肿瘤缓解后冻融卵巢皮质自体移植,可以恢复年轻女性患者的生殖功能和内分泌功能,是目前解决癌症患者生育能力最有希望的方法。但是,癌症患者冷冻保存的卵巢组织中可能残留恶性肿瘤细胞,移植后可能导致肿瘤复发。该文综述近年来冻融卵巢皮质自体移植后安全性方面的研究进展。
卵巢组织冷冻;卵巢组织移植;恶性肿瘤;安全性
随着诊断与治疗技术的进步和发展,年轻女性癌症患者的生存率得到明显提高。儿童及青少年恶性肿瘤患者抗癌治疗后的生存率达到70%~95%,对一些化疗高度敏感的的妇科恶性肿瘤,化疗可以达到治愈的效果[1-2]。大剂量的化疗及放疗杀灭肿瘤细胞的同时,也直接通过凋亡作用破坏生殖细胞,带来了卵巢早衰问题, 这使得许多生育年龄的肿瘤患者在重获新生的同时,又陷入另一个痛苦的深渊,严重影响其身心健康及社会角色[3]。为这部分女性患者提供有效的生育力保护技术显得非常有必要。因此,对于年轻患者,在积极治疗恶性肿瘤的同时,如何保护卵巢功能、维持生育能力成为研究者迫切需要解决的问题。到目前为止,有数种方法为有可能出现卵巢早衰和生育力丧失的女性保存生殖功能,包括胚胎冷冻、卵子冷冻及卵巢组织冷冻保存等。唯一符合美国生殖医学规范建立的方法是胚胎冷冻,但是这种方法要求患者是青春期以后的,有伴侣或使用供精,还要能耐受一个周期的卵巢刺激,当化疗必须立即开始或肿瘤的类型不允许卵巢刺激的时候此方法不能使用。卵母细胞冷冻过程中,成熟人卵母细胞冷冻后容易损伤,而未成熟卵子冷冻后体外培养成熟率低,受精率也低。直接冷冻卵巢皮质能保存大量原始卵泡,卵母细胞体积小,结构简单,代谢率低,无透明带,细胞内对低温敏感的亚细胞器较少,不易受到冷冻伤害,并且不需要卵巢刺激及等待卵子成熟,不会延误患者的放化疗[4]。等肿瘤缓解稳定后再行卵巢皮质自体移植,可以恢复患者的生殖功能和内分泌功能,并且不存在伦理问题,是目前解决癌症患者生育能力最有希望的方法。
1996年Hovatta报道第一例人类卵巢组织成功冻存,2004年Donnez等首次报道1例IV期霍奇金淋巴瘤患者,在化疗前将卵巢皮质冷冻,6年后冻融卵巢组织原位移植,自然妊娠产下一名健康的女婴,证实了人卵巢组织冷冻保存技术可以保存恶性肿瘤患者的生育功能。从已经发表的文献统计的数据来看,全世界范围已经有约60名婴儿通过冻融卵巢组织自体原位移植获得活胎妊娠的分娩[5]。随着该项技术的应用和认可,将越来越多地在全世界范围内开展。在冻融卵巢组织冷冻保存后临床应用取得令人鼓舞的成绩的同时,还有一些问题亟待解决。冻融卵巢组织自体移植是为了恢复肿瘤患者的生育力,但某些恶性肿瘤患者卵巢中可能存在微小残余癌灶,使恶性肿瘤细胞植入并导致肿瘤的复发,这是最值得关注的安全问题。现就近年来年轻肿瘤患者冻融卵巢皮质自体移植安全性方面的研究进展进行综述。
1冻融卵巢皮质移植后安全性研究现况
在要求卵巢组织冷冻保存的患者中,血液系统恶性肿瘤占了很大一部分。霍奇金淋巴瘤是最常见的,然后是白血病和非霍奇金淋巴瘤。对白血病的患者来说,恶性肿瘤细胞可能出现在血液中,所以卵巢组织中也有可能含有恶性肿瘤细胞[6]。Meirow第一个报道在病人的冷冻卵巢组织中检测到慢性粒细胞白血病细胞,通过RT-PCR方法检测BCR-ABL融合基因阳性,于是放弃移植冷冻的卵巢组织。Dolmans等对该中心行卵巢移植的患者进行统计,在6例慢性粒细胞白血病(CML)患者中,2例患者血中发现BCR-ABL白血病标记物阳性,结果显示这两例患者冻融的卵巢组织中BCR-ABL融合基因也是阳性。在12例急性淋巴细胞白血病(ALL)患者中,2例由于没有可用的分子标记物未行PCR分析。在剩下的10例中,7例冷冻保存的卵巢组织中分子标记物阳性,1例BCR-ABL阳性,1例为t(1;9)(q23;p23.3),5例为Ig和/或TCRr重排基因。在这7例ALL标记物阳性患者中,4例在卵巢皮质冷冻前未进行过化疗,有3例接受了一个疗程的化疗。卵巢组织冷冻前的化疗是否有助于清除卵巢组织中的恶性细胞?ALL患者由于治疗时间的紧迫,患者通常在冷冻卵巢组织前已经进行了生殖毒性的化疗。其研究数据显示,10例患者中,4例是取卵巢组织前未进行过任何化疗的患者,这些患者的卵巢组织中用RCR方法检测到白血病分子标记物呈阳性。其余6例冷冻卵巢组织前已经开始化疗的患者中,3例的卵巢组织中白血病标记仍然阳性,而且,这其中包括1例接受过6次完整化疗的患者,所以,要彻底清除白血病细胞,一个疗程的化疗是不够的。而Greve等[7]的研究则发现,在急性白血病的活动期取的卵巢组织中确实存在有活性的恶性细胞,但是在那些保存卵巢组织前化疗过的患者则不存在。Jahnukainen等[8]用RT-qPCR方法对那些由于白血病已经去世的患者的冷冻卵巢组织进行检测,这些组织中有些是从急性期的时候取的,有些是在完全缓解的患者取的。10例完全缓解的患者中,有2例的卵巢皮质中能检测到微量的白血病细胞,而对于急性期患者,所有患者均用RT-qPCR方法检测到恶性细胞。但是这些恶性细胞的量达到多少就可能会通过卵巢移植导致肿瘤复发尚不清楚。
霍奇金淋巴瘤和非霍奇金淋巴瘤是常见的行卵巢皮质冷冻保存的适应证。Shaw报导将患淋巴瘤的AKR小鼠的卵巢组织移植到健康小鼠,导致健康小鼠患淋巴瘤,这个实验引起了科学家们对肿瘤细胞再植风险的关注。多数研究认为对霍奇金淋巴瘤患者,卵巢组织冷冻后移植是安全的。文献报道的15例自体移植的霍奇金淋巴瘤病例中,没有1例在移植后发生淋巴瘤复发,6例非霍奇金淋巴瘤患者卵巢组织自体移植病例中,也没找到淋巴瘤复发的证据。Kim将13例霍奇金淋巴瘤和5例非霍奇金淋巴瘤的卵巢组织异种移植到SCID小鼠,也未发现小鼠有肿瘤复发的证据。
乳腺癌目前已成为女性恶性肿瘤的第一高发肿瘤,且乳腺癌的发病呈年轻化趋势,发病人群中5%的患者小于40岁。在乳腺癌中,卵巢转移的发生率在13.2%~37.8%之间,通常见于晚期乳腺癌患者。Sanchez-Serrano等[9]分析乳腺癌患者冷冻保存卵巢皮质时发现,不论是组织学还是免疫组织化学,均未发现恶性肿瘤细胞的再植。对于乳腺癌早期患者,冻融卵巢皮质自体移植是安全的(除外部分乳腺癌患者系遗传性BRCA基因突变所致,不适合行卵巢皮质组织冻融移植)。对于晚期乳腺癌患者,不能排除卵巢转移。Luyckx等[10]报道了13例进展期乳腺癌,其中5例用定量PCR方法检测到MBG2基因阳性,但卵巢组织学及免疫组织化学染色均未发现恶性肿瘤细胞,将卵巢组织异种移植到小鼠也未发现肿瘤转移的迹象。目前认为乳腺癌患者冻融卵巢皮质自体移植是安全的,但是还需要更进一步的证据,如PCR评估和异种移植后的长期追踪,对于评价乳腺癌患者卵巢皮质移植的安全性是非常有必要的。
据报道,宫颈鳞癌中0.7%~2.5%转移到卵巢,宫颈腺癌中转移到卵巢的比率约为0~6.8%。宫颈腺癌比宫颈鳞癌更倾向于波及到卵巢,因而理论上宫颈腺癌患者卵巢组织冷冻移植后肿瘤复发的风险较宫颈鳞癌要大一些。Schmidt等[11]和Donnez等[12]各报道1例宫颈癌患者卵巢组织冷冻保存后自体移植,这两例均未发生肿瘤复发的表现。而Kim[13]报道了3例宫颈癌患者术后行卵巢组织冷冻后移植,其中1例在卵巢组织移植后发现盆腔转移。
原发性神经外胚层瘤,包括髓母细胞瘤和神经母细胞瘤。发生在儿童的神经母细胞瘤和白血病属于容易向卵巢转移的肿瘤。Abir等[14]分析了8例尤文氏肉瘤患者的卵巢标本,采用组织学、免疫组织化学、RT-PCR等方法进行检测,其中1例患者的标本经RT-PCR方法检测到尤文氏肉瘤肿瘤细胞阳性。而Donnezt等[15]报道1例转移的神经外胚层肿瘤,进行卵巢组织冷冻保存后移植,在移植前卵巢组织组织学检查未发现肿瘤细胞转移。
以上综述了女性患病率较高的几类肿瘤中卵巢组织冷冻保存后再移植过程恶性肿瘤复发的风险,Sonmezer和Oktay将肿瘤再植风险分为几类:低风险、中等风险及高风险,见表1:
表1 各类型肿瘤中卵巢转移的风险
Table 1 Risk of ovarian metastasis according to cancer type
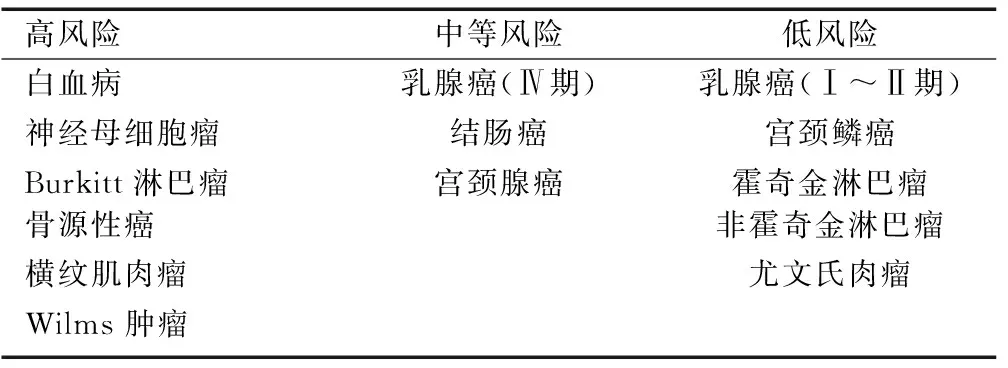
高风险中等风险低风险白血病乳腺癌(Ⅳ期)乳腺癌(Ⅰ~Ⅱ期)神经母细胞瘤结肠癌宫颈鳞癌Burkitt淋巴瘤宫颈腺癌霍奇金淋巴瘤非霍奇金淋巴瘤骨源性癌尤文氏肉瘤横纹肌肉瘤Wilms肿瘤
2卵巢组织冷冻前后的评估
对于癌症患者来说,卵巢组织自体移植存在肿瘤细胞转移的潜在风险。为了保证移植卵巢组织的安全性,在卵巢组织冷冻保存前后进行恶性肿瘤转移风险的评估至关重要。首先,肿瘤的病理类型对于卵巢移植时再种植的潜在危险性起着重要的作用,对一些来源于易侵犯卵巢的肿瘤患者的卵巢组织则不宜进行自体移植。卵巢组织移植前,建议对来源于肿瘤患者的卵巢组织进行一系列检测,以排除微小残余病灶的可能。目前,聚合酶链反应、荧光原位杂交等分子遗传学及细胞遗传学方法的临床应用将有效降低卵巢移植时将肿瘤细胞带入受者体内的风险[16]。在慢性粒细胞白血病中使用 RT-PCR技术检测BCR-ABL融合基因来确定卵巢组织中是否有白血病细胞,人abl基因位于9号染色体长臂,bcr基因位于22号染色体长臂,90%以上的CML患者的血细胞中出现Ph1染色体,t(9;22)(q34;q11),9号染色体长臂上C-abl原癌基因易位至22号染色体长臂的断裂点集中区(bcr),形成bcr/abl融合基因。由于这个特点,对CML病常用分子检测技术检测卵巢皮质中是否有白血病细胞。急性淋巴细胞白血病ALL的遗传学标志不是经常能被检测到,对于没有染色体异常的患者,常常通过检测克隆免疫球蛋白和T细胞受体基因来确定卵巢组织中是否有白血病细胞。由此看出,联合使用术前影像学、术后新鲜组织病理分析和冻融后恶性细胞敏感标记物检测等各种检查手段,可以有效地发现恶性肿瘤细胞残留,减少肿瘤种植的机率,增加移植的安全性。但不论是术后活组织病理分析,还是特异性的标志物标记,都只能对随机选取的组织的一部分进行研究,无法完全排除整个组织块中没有肿瘤细胞残留的可能。
3人卵巢皮质移植今后的方向
结合肿瘤患者的身体状况和移植过程中肿瘤细胞转移的危险性,卵巢移植技术并不适用于所有肿瘤患者。因此,发展一些卵巢移植技术的补充技术,如卵巢中卵泡的分离、体外卵泡的培养或卵母细胞冷冻保存等技术,是十分必要的。
3.1卵泡培养和卵泡的体外成熟
为了避免恶性细胞的传播,体外培养卵巢组织及卵泡成熟是一个很有吸引力的方法。原始卵泡的启动、早期生长、窦前卵泡发育至窦卵泡,卵母细胞的最后成熟,都是卵泡发育过程的重要阶段。科学家们一直尝试建立一套适合原始卵泡正常生长至成熟的窦卵泡体外培养系统。到目前为止,只有小鼠始基卵泡完全在体外培养出生后代的报道。在人类原始卵泡启动生长到次级卵泡生长,整个过程超过100天,在卵泡发育的每个阶段都需要不同的动态培养系统。这个体外培养体系需要满足卵母细胞生长发育各个不同时期的生长需要,研究者们正在考虑如何更好地优化卵泡培养的条件,最终得到具备完全发育潜能的卵母细胞[17]。
3.2人工卵巢
卵巢组织结构中,卵泡周围围绕着基底膜,将卵泡与间质分离开来,间质成分包括毛细血管、白细胞及神经细胞成分,所以将卵泡与间质分离开来,移植分离的卵泡可以防止肿瘤细胞通过卵巢移植导致肿瘤复发。1997年Oktay第一次用温和的胶原酶联合机械分离得到较多的分离的原始卵泡。将经胶原酶消化分离后得到的卵泡用不同的基质进行培养,均在24小时左右发生变性。Dolmans等将分离的卵泡异种移植后,对卵泡进行了观察,最长观察到异种移植后5个月,原始卵泡发育到窦卵泡阶段,异种移植后5个月仍然保存发育潜能,但是移植后存活率低。此后,研究者又尝试将分离的卵泡与人工的载体结合,以再造有利于卵泡生存的环境,再血管化后载体可以降解[18-19]。该技术仍在进一步实验中。
基于临床患者的迫切需求,以及近年来卵巢移植及其安全性方面的研究,相信该技术必将获得重大发展,更好地为临床服务,为癌症患者保存生育能力提供光明的前景。
[1]Ward E, DeSantis C, Robbins A,etal. Childhood and adolescent cancer statistics, 2014[J]. CA Cancer J Clin,2014, 64(2):83-103.
[2]Berlanga P,Vicente M L,Caete A,etal.Cancer in children and adolescents in Spain: incidence, treatment setting and provider specialty[J].Clin Transl Oncol,2016,18(1):27-32
[3]Cobo A, Garcia-Velasco J A, Domingo J,etal. Is vitrification of oocytes useful for fertility preservation for age-related fertility decline and in cancer patients?[J].Fertil Steril,2013, 99(6):1485-1495.
[4]Bastings L, Beerendonk C C, Westphal J R,etal.Autotransplantation of cryopreserved ovarian tissue in cancer survivors and the risk of reintroducing malignancy: a systematic review[J].Hum Reprod update, 2013, 19(5):483-506.
[5]Donnez J,Dolmans M M. Ovarian cortex transplantation: 60 reported live births brings the success and worldwide expansion of the technique towards routine clinical practice[J]. J Assist Reprod Genet, 2015, 32(8):1167-1170.
[6]Dolmans M M, Marinescu C, Saussoy P,etal. Reimplantation of cryopreserved ovarian tissue from patients with acute lymphoblastic leukemia is potentially unsafe[J]. Blood, 2010, 116(16):2908-2914.
[7]Greve T, Clasen-Linde E, Andersen M T,etal. Cryopreserved ovarian cortex from patients with leukemia in complete remission contains no apparent viable malignant cells [J]. Blood, 2012, 120(22):4311-4316.
[8]Jahnukainen K, Tinkanen H, Wikstrom A,etal. Bone marrow remission status predicts leukemia contamination in ovarian biopsies collected for fertility preservation[J]. Leukemia, 2013, 27(5):1183-1185.
[9]Sanchez-Serrano M, Novella-Maestre E, Rosello-Sastre E,etal. Malignant cells are not found in ovarian cortex from breast cancer patients undergoing ovarian cortex cryopreservation[J]. Hum Reprod, 2009, 24(9):2238-2243.
[10]Luyckx V, Durant J F, Camboni A,etal. Is transplantation of cryopreserved ovarian tissue from patients with advanced-stage breast cancer safe? A pilot study[J]. J Assist Reprod Genet, 2013, 30(10):1289-1299.
[11]Schmidt K T, Rosendahl M, Ernst E,etal. Autotransplantation of cryopreserved ovarian tissue in 12 women with chemotherapy-induced premature ovarian failure: the Danish experience[J]. Fertil Steril, 2011, 95(2):695-701.
[12]Donnez J, Dolmans M M, Pellicer A,etal. Restoration of ovarian activity and pregnancy after transplantation of cryopreserved ovarian tissue : a review of 60 cases of reimplantation[J]. Fertil Steril, 2013, 99(6):1503-1513.
[13]Kim S S.Assessment of long term endocrine function after transplantation of frozen-thawed human ovarian tissue to the heterotopic site: 10 year longitudinal follow-up study[J].J Assist Reprod Genet, 2012, 29(6):489-493.
[14]Abir R, Feinmesser M, Yaniv I,etal. Occasional involvement of the ovary in Ewing sarcoma[J]. Hum Reprod, 2010, 25(7):1708-1712.
[15]Donnez J, Squifflet J, Jadoul P,etal.Pregnancy and live birth after autotransplantation of frozen-thawed ovarian tissue in a patient with metastatic disease undergoing chemotherapy and hematopoietic stem cell transplantation[J]. Fertil Steril, 2011,95(5):1787.e1-1787.e4.
[16]Amiot C, Angelot-Delettre F, Zver T,etal. Minimal residual disease detection of leukemic cells in ovarian cortex by eight-color flow cytometry[J].Hum Reprod,2013, 28(8):2157-2167.
[17]Telfer E E, Zelinski M B.Ovarian follicle culture: advances and challenges for human and nonhuman primates[J].Fertil Steril,2013, 99(6):1523-1533.
[18]Vanacker J, Luyckx V, Dolmans M M,etal.Transplantation of an alginate-matrigel matrix containing isolated ovarian cells: first step in developing a biodegradable scaffold to transplant isolated preantral follicles and ovarian cells[J]. Biomaterials,2012,33(26):6079-6085.
[19]Luyckx V, Dolmans M M, Vanacker J,etal. A new step toward the artificial ovary: survival and proliferation of isolated murine follicles after autologous transplantation in a fibrin scaffold[J]. Fertil Steril, 2014, 101(4):1149-1156.
[专业责任编辑: 杨筱凤]
Safety studying of frozen-thawed ovarian cortex antotransplantaion on young cancer patients
WU Yuan-yuan, TENG Xiao-ming
(Shanghai First Maternity and Infant Hospital, Tongji University School of Medicine, Shanghai 210204, China)
Reimplantation of frozen-thawed ovarian tissue after tumor remission has emerged as a most potential option to restore both the reproductive function and endocrine function of young women. But the ovary tissue may harbor malignant cells in some type of malignant diseases and the possibility of reintroducing tumor cells into cancer patients by autotransplantation of ovarian tissue cannot be excluded. This review emphasized the progress of the safety after frozen-thawed ovarian cortex autotransplantation in recent years
ovarian tissue cryopreservation; ovarian tissue transplantation; malignant tumor; safety
2016-06-10
伍园园(1973-),女,副主任医师,博士,主要从事女性内分泌疾病,不孕不育的诊断、治疗及辅助生殖技术等方面的工作及研究。
滕晓明,主任医师。
10.3969/j.issn.1673-5293.2016.10.041
R318.53;R711
A
1673-5293(2016)10-1290-03
