土贝母正丁醇部位化学成分研究
2016-11-29洪宗国刘新桥向梅先
李 娟,何 峰,尹 娴,洪宗国,刘新桥,向梅先
(中南民族大学 药学院,武汉 430074)
土贝母正丁醇部位化学成分研究
李 娟,何 峰,尹 娴,洪宗国,刘新桥,向梅先*
(中南民族大学 药学院,武汉 430074)
采用薄层色谱,正相、反相硅胶,葡聚糖凝胶,半制备高效液相柱对土贝母正丁醇部位进行了分离研究.分离得到10个化合物,分别为:6-C-葡萄糖-5,7,3′,4′-四羟基黄酮 (1),胡萝卜苷 (2),胡萝卜苷棕榈酸酯(3),豆甾醇 (4),β-谷甾醇(5),β-谷甾醇棕榈酸酯 (6),正丁基-β-D-吡喃果糖苷(7),大黄素(8),大黄素甲醚(9),麦芽酚(10).除化合物(8)外,其余化合物都是首次从该植物中分离得到.
土贝母; 正丁醇部位; 化学成分研究
乳腺癌是全球妇女面临最为常见和危险的癌症,其发病率和死亡率都很高.目前对乳腺癌的治疗,早期采用切除乳房的方法;对于中晚期,癌细胞转移的患者,采用放化疗的方法,此种方法副作用大,病人生活质量低.因而,越来越多的专家将目光聚焦在中医药上,希望能在中药中寻求疗效好、副作用低的药材.中药土贝母是一种传统药材,具有较好的抗癌活性,尤其在对乳腺癌的治疗方面取得了较好的研究效果.古书记载,土贝母具清热解毒,散结消肿之功效.主治:内服治疗淋巴结结核,骨结核,乳腺炎,疮痈肿毒;外用治蛇、虫咬伤,外伤出血等症[1].现代药理研究表明:土贝母具有抗肿瘤活性[2-3].土贝母来源于葫芦科植物土贝母属土贝母Bolbostemmapaniculatum(Maxim.) Franquet,也称为藤贝母,以鳞茎入药.主要生于山坡草丛或平地,在河北、山西、陕西、山东、甘肃、宁夏、河南和云南等省区有大量分布,现有栽培.秋、冬季节采挖,洗净,掰开,煮至无白心,取出晒干保存.基于土贝母的较好的应用功效和具抗癌的潜在用途,为了弄清其抗肿瘤的物质基础,本文对土贝母的化学成分进行了相关研究.采用正相硅胶柱层析、凝胶色谱、制备薄层色谱、半制备高效液相色谱等多种方法,从土贝母正丁醇部位分离得到并鉴定了10个化合物.
1 材料和方法
1.1 材料
土贝母药材采自湖北恩施地区,经中南民族大学药学院万定荣教授鉴定为葫芦科土贝母属植物土贝母Bolbostemmapaniculatum(Maxim.) Franquet [ActinostemmapaniculatumMaxim.] 的鳞茎.
1.2 仪器
ZF-6型三用紫外光谱仪;Bruker AM-400型核磁共振仪;Finnigan LCQ-Deca型质谱仪;戴安Ultimate 3000型高效液相色谱仪;5C18-MS-Ⅱ(10mm×250mm) 型色谱柱;RE-52AA型旋转蒸发仪,上海亚荣生化仪器厂;KQ-500E型超声波清洗仪;紫外分光光度仪;Nicolet NEXUS-670傅里叶变更红外光谱仪.
1.3 试剂
石油醚、乙酸乙酯、正丁醇、乙醇、甲醇为分析纯(国药集团),95%的乙醇为工业级,色谱级甲醇(天地公司).柱层析用硅胶(100~200目,200~300目),硅胶G高效预制板(青岛海洋化工产).
1.4 提取与分离
取土贝母10 kg 淋洗后晒干,用粉碎机粉碎成粗粉.加10倍量的95% 的乙醇在室温下浸泡提取3 次,每次24 h.过滤,合并滤液,减压浓缩得浸膏2.1 kg,将浸膏用90%甲醇水溶液溶解,然后用等体积石油醚萃取.减压回收下层的甲醇溶液得浸膏,用蒸馏水溶解浸膏后,依次用等体积乙酸乙酯和正丁醇萃取,分别减压回收乙酸乙酯和正丁醇,得到乙酸乙酯提取物600 g(乙酸乙酯部位) 和正丁醇提取物900 g(正丁醇部位),余下为水部位,蒸干水分后称重(水部位) .称取正丁醇部位浸膏500 g上D101大孔树脂,依次用不同比例的乙醇-水梯度洗脱( 0%,10%,30%,50%,70%,95%),收集各洗脱液,500 mL为一馏分,TLC检测合并相同馏分后得到Fr.1~Fr.6六个部分.其中Fr.2经正相硅胶柱和半制备高效液相(HPLC)分离得到化合物豆甾醇(17 mg)和β-谷甾醇(9 mg); Fr.3经正相硅胶柱分离得化合物β-谷甾醇棕榈酸酯(21 mg)、胡萝卜苷(23 mg)和胡萝卜苷棕榈酸酯(10 mg); Fr.4经葡聚糖胶柱和半制备HPLC得化合物大黄素(6 mg)和大黄素甲醚(9 mg); Fr.5分别经正相硅胶柱和半制备HPLC分离,得到化合物麦芽酚(14 mg); Fr.6分别经正相硅胶柱和凝胶柱、半制备HPLC分离得到化合物正丁基-β-D-吡喃果糖苷(16 mg).
2 结构鉴定与结果
2.1 化合物(1)6-C-葡萄糖-5,7,3′,4′-四羟基黄酮(6-C-glucose-5,7,3′,4′-tetrahydroxy flavone)
黄色粉末,分子式:C21H20O11,MW=448.37.1H NMR(400 MHz,DMSO-d6)δ:13.54(1H,s,5-OH),7.42(2H,m,H-2′,6′),6.89(1H,d,J=8.2 Hz,H-5′),6.67(1H,s,H-3),6.48(1H,s,H-8),4.59(1H,d,J=9.8 Hz,H-1″);13C NMR(100 MHz,DMSO-d6)δ:181.9(C-4),163.7(C-7),163.4(C-2),160.7(C-5),156.2(C-9),149.8(C-4′),145.8(C-3′),121.4(C-1′),119.0(C-6′),113.3(C-2′),116.1(C-5′),108.9(C-6),103.4(C-10),102.8(C-3),93.5(C-8),81.6(C-1″),79.0(C-5″),73.1(C-2″),70.6(C-3″),70.2(C-4″),61.5(C-6″).1H NMR和13C NMR数据与文献[4-5]报道基本一致,故鉴定化合物(1)为6-C-葡萄糖-5,7,3′,4′-四羟基黄酮.
2.2 化合物(2)胡萝卜苷(Daucossterol)
EI-MSm/z显示分子离子峰为576.1H NMR(CD3OD):0.71(s,3H,CH3),0.80(brs,6H,2CH3),0.85(brs,3H,CH3),0.88(brs,3H,CH3),1.01(s,3H,CH3),5.31(brs,1H),3.40~4.60(m,11H);13C NMR (CD3OD):37.7(C-1),30.3(C-2),78.6(C-3),41.1(C-4),140.5(C-5),121.4(C-6),31.7(C-7),31.7(C-8),50.8(C-9),36.6(C-10),20.9(C-11),39.6(C-12),42.5(C-13),56.7(C-14),24.4(C-15),28.9(C-16),56.5(C-17),13.2(C-18),20.8(C-19),36.1(C-20),19.7(C-21),34.6(C-22),30.1(C-23),46.5(C-24),26.4(C-25),19.3(C-26),20.2(C-27),23.7(C-28),11.6(C-29),102.2(C-1′),75.4(C-2′),78.8(C-3′),71.6(C-4′),78.4(C-5′),62.6(C-6′).1H NMR和13C NMR数据与文献[6]报道基本一致,故鉴定化合物(2)为胡萝卜苷.
2.3 化合物(3)胡萝卜苷棕榈酸酯(Daucosterol palmitate)
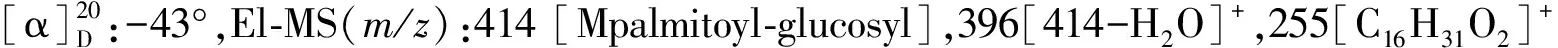
2.4 化合物(4)豆甾醇(Stigmasterol)

2.5 化合物(5)β-谷甾醇(β-sitosterol)
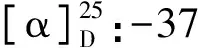
2.6 化合物(6)β-谷甾醇棕榈酸酯(β-Sitosteryl palmitate)
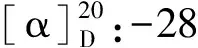
2.7 化合物(7)正丁基-β-D-吡喃果糖(n-butyl-β-D-fructopyranoside)

2.8 化合物(8)大黄素(Emodin)
EI-MS(m/z):270(M),255(M-CH3),253(M-OH),242(M-CO);分子离子峰为270.1H NMR(CD3OD):7.11(1H,s,H-2),7.28(1H,d,J=2.5 Hz,H-5),7.34(1H,s,H-4),6.68(1H,d,J=2.5 Hz,H-7),2.41(3H,s,CH3);13C NMR(CD3OD):164.2(C-1),107.7(C-2),165.2(C-3),108.6(C-4),120.4(C-5),148.3(C-6),124.2(C-7),161.0(C-8),189.5(C-9),181.4(C-10),133.1(C-11),113.6(C-12),108.7(C-13),135.4(C-14),21.3(CH3).1H NMR和13C NMR数据与文献[12]报道基本一致,故鉴定化合物(8)为大黄素.
2.9 化合物(9)大黄素甲醚(Emodin monomethyl ether)
EI-MS(m/z):284[M]+,256[M-CO]+,255[M-CH3O]+,241[M-COCH3]+.1H NMR(CD3OD):2.37(3H,s,CH3),3.86(3H,s,OCH3),6.84(1H,d,J=2.1,H-7),7.16(1H,brs,H-2),7.24(1H,brs,H-5),7.47(1H,brs,H-4);13C NMR(CD3OD):162.5(C-1),106.7(C-2),165.2(C-3),108.2(C-4),120.4(C-5),148.4(C-6),121.3(C-7),161.0(C-8),190.8(C-9),182.0(C-10),133.2(C-11),113.4(C-12),110.2(C-13),135.4(C-14),56.1(OCH3),21.3(CH3).1H NMR和13C NMR数据与文献[13]报道基本一致,故鉴定化合物(9)大黄素甲醚.
2.10 化合物(10)麦芽酚(Maltol)
EI-MS显示分子离子峰为126.1H NMR(CD3OD):2.35(3H,s,CH3),6.39(1H,d,J=5.7 Hz,H-5),7.95(1H,d,J=5.7 Hz,H-6);13C NMR(CD3OD):14.3(CH3),113.4(C-5),143.2(C-3),149.3(C-2),154.9(C-6),172.3(C-6).1H NMR和13C NMR数据与文献[14]报道基本一致,故鉴定化合物(10)麦芽酚.
3 讨论
土贝母来源于葫芦科土贝母属植物土贝母Bolbostemmapaniculatum(Maxim.) Franquet [ActinostemmapaniculatumMaxim.]. 以鳞茎入药.具清热解毒,散结消肿的功效.现代药理研究表明:土贝母具有抗肿瘤活性.那么本药材抗肿瘤的活性部位及物质基础是什么?为了弄清这个问题,本研究首先对土贝母进行了活性筛选研究,发现正丁醇部位具有较好的抗癌活性.为了进一步弄清其抗癌物质基础,接着对该部位进行了分离,采用D101大孔吸附树脂和乙醇溶液梯度洗脱,合并相同RF值馏份得Fr.1~Fr.6,然后采用正相硅胶柱层析、凝胶色谱、半制备薄层色谱、半制备高效液相色谱等多种方法,从中分离得到了10个化合物,并鉴定为:6-C-葡萄糖-5,7,3′,4′-四羟基黄酮(1);胡萝卜苷(2);胡萝卜苷棕榈酸酯(3);豆甾醇(4);β-谷甾醇(5);β-谷甾醇棕榈酸酯(6);正丁基-β-D-吡喃果糖苷(7);大黄素(8);大黄素甲醚(9);麦芽酚(10).所有化合物的结构如图1所示.查阅文献资料,除化合物(8)外,其余化合物都是首次从该植物中分离得到,下一步本课题组将对分离得到的化合物进行抗肿瘤活性的筛选,以弄清其抗肿瘤的物质基础.
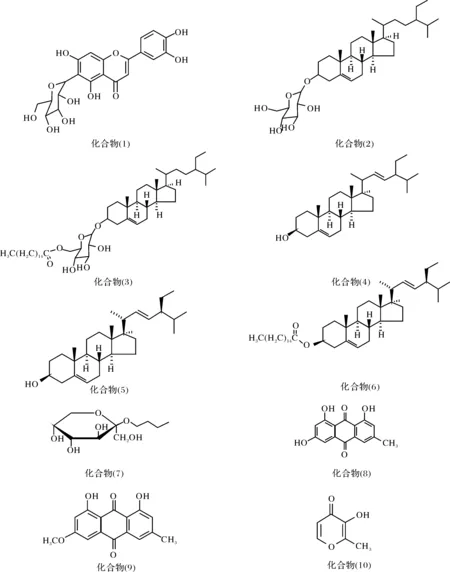
图1 化合物的结构Fig.1 Structure of the compounds
[1] 南京中医药大学编写组. 中药大辞典[M].上册.上海:科学技术出版社,2005:114.
[2] 全国中草药汇编编写组. 全国中草药汇编[M].下册.北京:人民卫生出版社,1978:323.
[3] 何 峰,向梅先,胡亚京,等. 藤贝母乙酸乙酯部位化学成分研究[J]. 华中师范大学学报(自然科学版),2015,49 (4): 563-566.
[4] NAM T G,LEE S M,PARK J H,et al. Flavonoid analysis of buckwheat sprouts[J]. Food Chem,2015,170: 97-101.
[5] XIANG M X,SU H W,SHU G W,et al. Antitumor effect ofamplexicaulea through induction of apoptosis on Human breast cancer[J]. Oncotogart,2016, 7(14): 18521-18530.
[6] 叶文才,赵守训,沈漪涟,等. 安徽银莲花化学成分的研究[J].中国药科大学学报,1990,21(3): 139.
[7] 华会明,李 铣,张海泉. 柳穿鱼中的甾体化合物[J]. 沈阳药科大学学报,2000,17(1): 40-42.
[8] 姜 勇,刘 蕾,屠鹏飞. 远志的化学成分研究III [J]. 中国天然药物,2003,1(3): 142-145.
[9] 吴新安,赵毅民.骨碎补化学成分研究[J]. 中国中药杂志,2005,30(6): 443-444.
[10] 孙红样,叶益萍,杨 可. 落新妇化学成分研究[J]. 中国中药杂志,2002,7 (10): 751-754.
[11] ZHANG C Z,XU X Z,LI C. Fructosides fromCynomoriumsongaricum[J]. Phytochemistry,1996,41 (3): 975-976.
[12] 封士兰,何 兰,王 敏,等. 百合花化学成分的研究[J]. 中国中药杂志,1994,19(10): 611-612.
[13] 胡 军,屠鹏飞,果德安,等. 秦岭大黄化学成分研究[J]. 西北药学杂志,1997,12(4): 153-155.
[14] 张丽玲,肖英龙,李向高,等. 中国红参麦芽酚的分离与鉴定[J]. 中成药,1989,11(6): 32-33.
Study on chemical compound of n-butyl alcohol fraction fromBolbostemmapaniculatum(Maxim.) Franquet
LI Juan,HE Feng,YIN Xian,HONG Zhongguo,LIU Xinqiao,XIANG Meixian
(School of Pharmaceutical Sciences,South-Central University for Nationalities,Wuhan 430074)
In the present work,thin layer chromatography (TLC),normal-phase silica gel column,reveres-phase silica gel column,Sephadex-LH,semi-preparative HPLC column were used to isolate and analyze the chemical compositions ofn-butyl alcohol fraction fromBolbostemmapaniculatum(Maxim.) Franquet. Ten compounds were obtained and identified as: 6-C-glucose-5,7,3′,4′-tetrahydroxy flavone (1),Daucossterol (2),Daucosterol palmitate (3),Stigmasterol (4),β-sitosterol (5),Sitosteryl palmitate (6),n-butyl-β-D-fructopyranoside (7),Emodin (8),Emodin monomethyl ether (9),and Maltol (10). Except for compound 8,the compounds were isolated for the first time from this plant.
Bolbostemmapaniculatum(Maxim.) Franquet;n-butyl alcohol fraction; chemical composition
2016-04-23.
武汉市科技晨光计划项目(2014070404010210).
1000-1190(2016)05-0721-05
O629
A
*通讯联系人. E-mail: xiangmeixian99@163.com.
