术前小探头超声内镜检查在早期胃癌治疗方式选择中的作用*
2016-11-29王警吴齐孙利李子禹步召德苏向前李士杰
王警,吴齐,孙利,李子禹,步召德,苏向前,李士杰
(北京大学肿瘤医院暨北京市肿瘤防治研究所恶性肿瘤发病机制及转化研究教育部重点实验室1.内镜中心;2.病理科;3.胃肠肿瘤中心,北京100142)
论著
术前小探头超声内镜检查在早期胃癌治疗方式选择中的作用*
王警1,吴齐1,孙利2,李子禹3,步召德3,苏向前3,李士杰1
(北京大学肿瘤医院暨北京市肿瘤防治研究所恶性肿瘤发病机制及转化研究教育部重点实验室1.内镜中心;2.病理科;3.胃肠肿瘤中心,北京100142)
目的评价小探头超声内镜(EUS)在早期胃癌(EGC)治疗方式选择中的作用。方法回顾性分析2011年1月-2013年12月北京大学肿瘤医院151例单发EGC临床病理资料。分析EUS判断EGC浸润深度的准确率及影响因素,评价基于EUS选择EGC治疗方法的策略。结果EUS对EGC浸润深度判断的准确率为74.8%。多因素分析结果显示,肿瘤直径>2 cm、内镜下溃疡形成及病灶位于胃中上2/3是导致分期错误的危险因素(P<0.05)。75.3%(107/142)的EGC病例通过基于EUS评估获得了适合的治疗。结论小探头EUS在EGC浸润深度评估及治疗方式选择中具有良好实用性,当病灶直径大于2 cm、合并溃疡形成或位于胃中上部时,应当谨慎对待EUS结果。
超声内镜;早期胃癌;诊断;治疗
我国胃癌发病率占恶性肿瘤第二位[1],早期胃癌(early gastric cancer,EGC)是指胃癌病变局限于黏膜层或黏膜下层,而无论有无淋巴结转移(lymph node metastasis,LNM)。胃癌LNM率与肿瘤浸润深度相关,当肿瘤局限于黏膜层(M)及黏膜下层浅层(浸润黏膜下层深度<500μm,SM1)时LNM比例低于3.0%[2]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)作为低LNM风险EGC的可选治疗手段,已得到广泛应用[3]。超声内镜(endoscopic ultrasonography,EUS)自上世纪80年代问世以来,被广泛用于消化道肿瘤的分期诊断。然而目前EUS在EGC浸润深度判断中的作用尚存在争议[4-5]。本研究回顾性分析2011年1月-2013年12月北京大学肿瘤医院151例单发EGC病例临床病理资料,初步探讨小探头EUS在EGC治疗方式选择中的作用。
1 资料与方法
1.1一般资料
回顾性分析术后病理为不伴淋巴结转移的EGC,且术前1个月内曾接受小探头EUS评估,同时术前CT(胸部、腹部和盆腔)均未见异常的EGC病例共151例。男112例,女39例;年龄25~80岁,中位年龄63岁。肿瘤部位:胃上部54例,胃中部38例,胃下部59例;所有患者术前均接受包括胃肠肿瘤中心、肿瘤科、影像科及病理科在内的多学科(multi-disciplinary team,MDT)讨论及评估后决定实施手术,患者术前签署知情同意书。
1.2仪器及设备
Olympus-260型内镜主机(CV-260SL及CLV-260SL),Olympus内镜(GIF-H260Z及GIF-2QT260M),Fujinon超声平台(SP702主机及P2620超声探头)。
1.3试验方法
1.3.1超声内镜分期检查前常规服用10.0%利多卡因胶浆10ml,胃镜观察并确定病灶位置后,胃腔内局部注入400~500ml脱气蒸馏水,采用浸泡法进行EUS检查。正常胃壁在EUS图像中由内及外可分为5层结构,第1层高回声为黏膜与水界面的反射波及黏膜浅层;第2层低回声为黏膜肌层;第3层高回声为黏膜下层;第4层低回声为固有肌层;第5层高回声为浆膜下层及浆膜层[6]。EUS中肿瘤性病变通常表现为低回声区域的扩展及正常胃壁结构的消失。第1~2层受累,而第3层高回声连续完整,定义为uT1a(与病理学pT1a分期对应)。第1~3层受累,而第4层低回声连续完整,定义为uT1b(与病理学pT1b分期对应)[7]。见图1。

图1 早期胃癌超声内镜评估肿瘤浸润深度
1.3.2治疗方法的选择根据患者EUS结果,结合日本胃癌协会(Japanese Gastric Cancer Association,JGCA)的EGC内镜下治疗适应证[8]:①不伴溃疡的分化型黏膜内癌,直径≤2 cm;②不伴溃疡的分化型黏膜内癌,直径>2 cm;③伴溃疡的分化型黏膜内癌,直径≤3 cm;④不伴溃疡的未分化型黏膜内癌,直径≤2 cm),经MDT讨论并结合患者本人意愿,建议uT1a病例接受ESD切除,uT1b病例接受根治性外科手术。
1.3.3治疗方法选择的评价根据术后病理结果,评价EUS判断EGC浸润深度的准确率、灵敏度、特异度、阳性预测值及阴性预测值,并分析相关影响因素。依据JGCA治愈性评价标准[8],对EGC病例进行分组,见图2,计算各组中EUS对EGC浸润深度判断的准确率。同时评价基于EUS结果选择EGC治疗方法的策略。

图2 早期胃癌内镜下切除的治愈性评价
1.4统计学方法
采用SPSS 20.0统计软件进行分析,计数资料频数比较采用四格表χ2检验;相关危险因素比较采用Logistic回归分析法,用比值比(odd ratio,O)及其95%可信区间(confidence interval,CI)表示相对风险度;采用SAS 9.3软件基于精确的二项式分布计算检测灵敏度、特异度、阳性预测值及阴性预测值的95%CI。检验水准为α=0.05。
2 结果
2.1EUS分期与病理分期比较
151例EGC中,EUS分期为uT1a者110例,uT1b者41例。术后病理分期为pT1a者96例,pT1b者55例,其中包括SM1者39例,SM2(黏膜下层深层)者16例。EUS判断黏膜下层受侵与否的灵敏度及特异度分别为87.5%(95%CI:78.8%~93.1%)及52.7%(95%CI:38.9%~66.1%),其阳性预测值及阴性预测值分别为76.4%(95%CI:67.1%~83.7%)及70.7%(95%CI:54.3%~83.3%)。EUS对EGC病例浸润深度判断的准确率为74.8%(95%CI:67.1%~81.5%)。见表1。
2.2影响EUS浸润深度判断准确性的因素
本研究中,EUS分期正确者113例,EUS分期错误者38例。单因素分析结果显示,肿瘤直径、内镜下是否合并溃疡以及病灶部位与EUS分期准确性相关(P<0.05),而病灶大体形态及组织学类型则与分期准确性无关(P>0.05)。见表2。
多因素分析结果表明,肿瘤直径>2cm、内镜下溃疡形成及病灶位于胃中上2/3,是导致EUS分期错误的危险因素)。见表3。
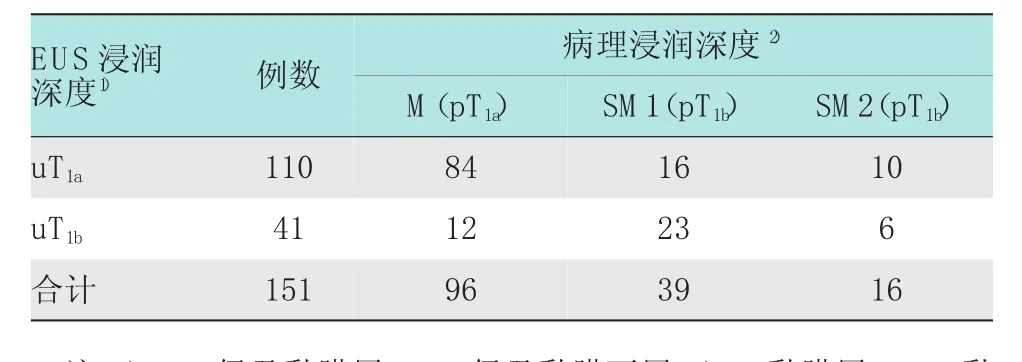
表1 EUS分期与肿瘤浸润深度比较例

表2 影响超声内镜分期准确性的单因素分析
在uT1a病例中,26例(23.6%)存在分期不足,在uT1b病例中,12例(29.3%)存在分期过度。多因素分析显示,肿瘤直径>2 cm(P=0.036,O=3.14,95%CI:1.079~9.124)、内镜下溃疡形成(P=0.009,O=3.98,95%CI:1.422~11.147)及病灶位于胃中上2/3(P= 0.021,O=4.22,95%CI:1.247~14.271)是导致EUS分期不足的危险因素;而内镜下溃疡形成也与EUS分期过度有关(P=0.043,O=4.93,95%CI:1.054~23.083)。
2.3评价基于EUS的选择EGC治疗方式的策略
151例EGC经EUS评估后,110例患者适合内镜下切除,建议行ESD治疗,41例患者不适合内镜下切除,建议行外科手术治疗。6例EUS评估为uT1b的患者因拒绝外科手术而行ESD治疗(见表4,病例1~6);3例uT1a的病例ESD未达到完全切除(病灶整块切除且水平切缘及基底切缘无癌细胞残留),其中2例为侧切缘阳性,1例为合并脉管癌栓及侧切缘阳性(见表4,病例7~9)。这9例患者未纳入基于EUS的EGC治疗策略选择评价,见图3。
依据JGCA治愈性切除标准对治愈性进行分类[8],75.3%(107/142)的病例通过基于EUS的评估接受了适合的治疗:在107例获得完全切除的ESD病例中,符合治愈性切除者56例(52.3%),符合扩大的治愈性切除者34例(31.8%),非治愈性切除者17例(15.9%),即84.1%的病例适合内镜切除,而15.9%的病例需要追加外科手术治疗;在35例接受外科手术的病例中,符合治愈性切除者1例(2.8%),符合扩大的治愈性切除者17例(48.6%),非治愈性切除者17例(48.6%),即48.6%的病例适合外科手术,但51.4%的病例可选择内镜下切除以避免胃切除。见图3。
在142例基于EUS选择治疗方法的EGC病例中,符合治愈性切除者EUS的准确率为98.2%,高于符合扩大的治愈性切除者(64.7%,33/51)及非治愈性切除者(52.9%),且差异具有统计学意义(χ2= 20.88,P=0.000及χ2=28.77,P=0.000),而符合扩大的治愈性切除者与非治愈性切除者间的差异不具有统计学意义(χ2=1.18,P=0.278)。在符合扩大的治愈性切除病例中,存在SM1浸润者EUS的准确率(45.5%)最低。见图4。

表3 影响超声内镜分期准确性的多因素分析
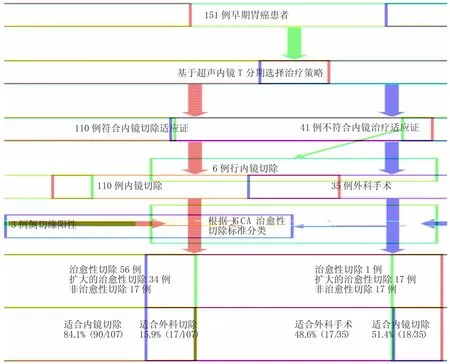
图3 基于超声内镜的早期胃癌治疗方式选择
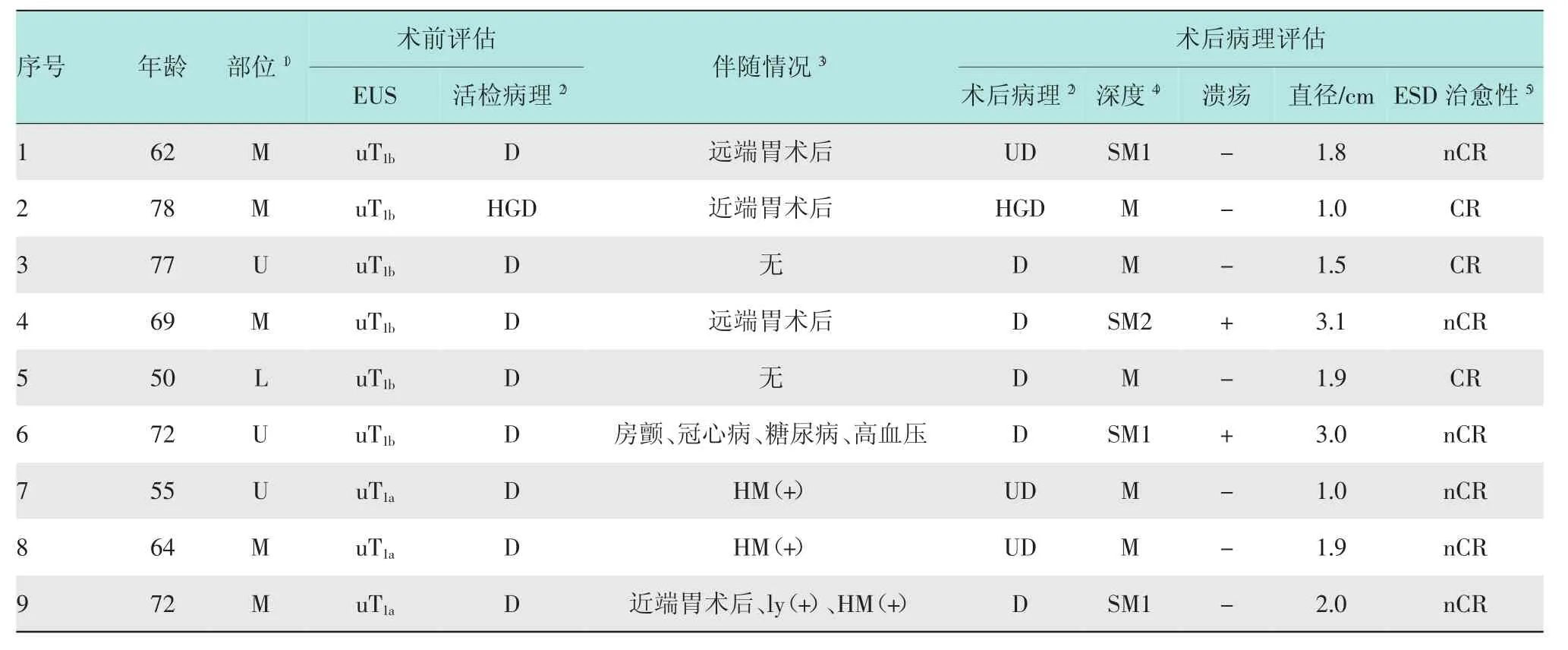
表4 未纳入基于EUS的EGC治疗策略的病例临床病理资料
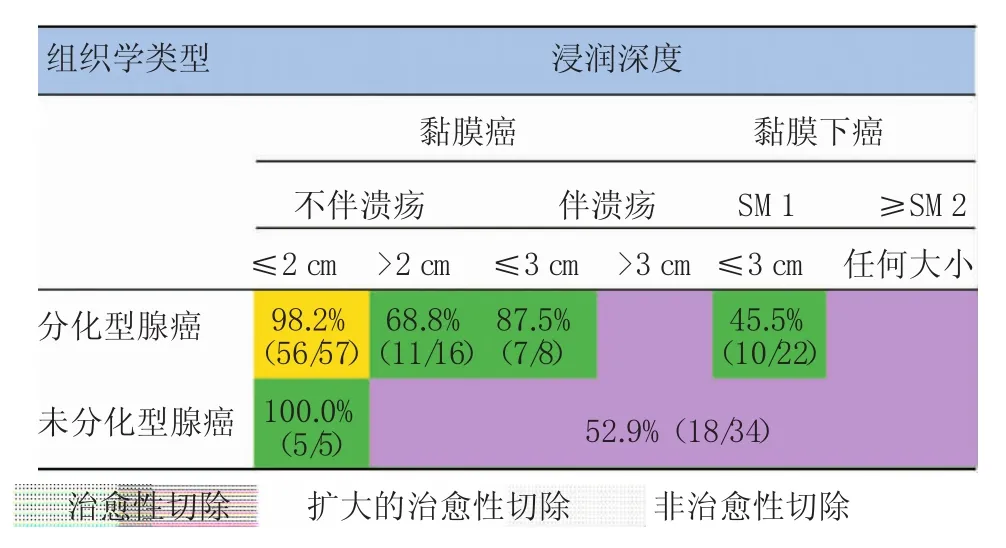
图4 各内镜下切除适应证组EUS分期准确率
3 讨论
我国作为胃癌高发国家,近年来由于内镜筛查的广泛应用及影像学技术的快速发展,临床中EGC的比例在不断提高,ESD在低LNM风险EGC治疗中的价值已得到了广泛认可[9]。鉴于胃癌LNM与肿瘤浸润深度相关[2],术前精确评估浸润深度对于EGC治疗方式的选择具有重要的意义。
文献报道采用20 MHz小探头EUS判断EGC浸润深度的准确率为48.3%~91.0%[6,10-12]。本研究中EUS判断黏膜下层是否受侵的准确率为74.8%,与上述结果近似。影响EUS对EGC浸润深度判断准确性的因素包括病变自身特征、EUS设备以及操作者经验等[5]。文献报道,EUS准确性随EGC病变直径增大而降低,在本研究中,病灶直径>2 cm者EUS准确率为55.0%低于直径≤2 cm者(81.1%),这与Okada等[10]及Lee等[12]的结果一致。Mandai等[13]的研究显示直径大于2 cm的病灶容易被过度分期,而在本研究中病灶直径大于2 cm则是导致分期不足的危险因素,笔者认为这与小探头EUS有效扫查范围较小有关,当对较大范围病变进行评估时可能遗漏局灶黏膜下浸润的区域,故而出现分期不足的情况。本研究显示合并溃疡形成是导致EUS浸润深度判断准确率下降的另一因素,与其他报道一致[6,10,13]。溃疡引起的组织水肿及纤维化,干扰EUS对于EGC病灶本身浸润深度的判断,从而导致EUS准确率的下降。笔者建议若怀疑病灶处溃疡系由既往活检造成,可给予抗溃疡治疗2周后再行EUS检查,同时对于可疑EGC的病灶应尽量避免多次深挖活检以减少人工溃疡对EUS诊断准确性带来的影响。研究显示,胃上部[14]及中上部[11]病变的EUS诊断准确率较低,本组的结果与之类似。其原因与胃底黏膜下层相对较薄,而血管密度较高,使得小探头难以评估黏膜下层是否受累有关。此外当EUS评估胃中上部特别是胃底病灶时,探头的轴线往往与病灶以成角,而非以平行的形式扫查,可能遗漏一些病灶细节特征,从而对准确率造成一定影响。在病灶大体形态方面,有报道显示凹陷型(0~Ⅱc型及0~Ⅲ型)病变的EUS诊断率较低,可能与其容易合并溃疡有关[6];而某些隆起型(0~Ⅰ型)病变,由于病灶往往较厚,以致EUS难以观察黏膜下层,导致其EUS准确率亦较低[15]。本研究中凹陷型病变的EUS准确率偏低,但与非凹陷型病变相比,差异不具有统计学意义。由于未分化型腺癌容易在早期出现黏膜下层微小浸润及脉管浸润,但这些微小改变尚不足以反映在EUS图像中,故容易出现分期不足的情况[16]。本研究中未分化型腺癌的EUS准确率(67.9%)低于分化型腺癌(76.4%),但差异不具有统计学意义,考虑与本组未分化型病例的数量较少有关。除此以外,良好的EUS图像质量[11]以及经验丰富的操作者[5]都能够提高EUS对EGC浸润深度判断的准确率。
关于EUS在EGC治疗策略选择中的作用目前尚存争议。Mandai等[13]联合采用20MHz小探头EUS及普通EUS(GF-UM2000,Olympus)将EGC分为黏膜层或黏膜下层浅层浸润(EUS-M/SM1)及黏膜下层深层浸润(EUS-SM2),并比较超声内镜T分期与术后病理结果的符合程度及是否适合内镜下切除。结果发现92.8%的EUS-M/SM1病例适合内镜下切除,虽然56.5%的EUS-SM2病例术后病理证实为M/SM1,但由于这部分病例合并溃疡的比例高达65.6%,可能导致内镜切除困难。因此,笔者认为这些病例更适合外科手术治疗。在本研究中,通过基于EUS的评估,最终84.1%的ESD组病例适合内镜切除,而48.6%的外科手术组病例适合接受外科手术,与上述结果类似但准确率略低,可能与本组60.9%(92/151)病变位于胃中上部,而在上述研究中仅有23.9%的病灶位于胃中上部有关,因为胃中上部恰是EUS诊断率偏低的部位。Lee等[17]对同一组病例分别进行白光内镜及普通EUS(GF-UM2000,Olympus)评估,并与术后病理结果比较,发现EUS与白光内镜相比并未提高治疗方法选择的正确率(71.5%比75.3%,P>0.05),而且在pT1a的病例中,EUS组治疗方法的正确率甚至低于白光内镜(81.4%比88.1%,P<0.05)。但作者指出其研究的局限性在于没有采用小探头EUS进行评估,已有研究表明在肿瘤浸润深度评估方面,小探头EUS具有更高的准确率;同时所有病例均为分化型腺癌、且EUS评估和普通内镜评估为非盲都可能造成选择的偏移。在Kim等[6]的前瞻性研究中,将小探头EUS(20MHz)结果与术后病理及术后治愈性分组相比较,在发现符合扩大治愈性切除的病例EUS准确率低于符合治愈性切除者(83.6%比97.6%,P=0.040),当病灶合并溃疡或SM1浸润时EUS准确率更低(79.2%及42.9%)。笔者的结果与其近似,符合治愈性切除者EUS的准确率(98.2%)高于符合扩大的治愈性切除者(64.7%)及非治愈性切除者(52.9%),存在SM1浸润的符合扩大的治愈性切除者EUS的准确率最低(45.5%)。Tsujii等[18]对同一组病例采用普通内镜及小探头EUS进行了检查,发现虽然两种方法各自的诊断准确率无明显差异,但联合使用EUS及普通内镜后,诊断准确率明显升高(P<0.001),而且EUS有助于发现普通内镜分期过度的病例(61.9%)。
综上所述,小探头EUS在EGC浸润深度评估及治疗方式选择中具有良好实用性,但准确性仍不够理想,对于直径大于2 cm、合并溃疡形成或位于胃中上部的病变,应当谨慎对待EUS结果,通过联合多种检查手段以提高EGC浸润深度评估准确率,使患者获得最大的收益。
致谢:感谢北京大学肿瘤医院遗传研究室张超亭在本研究统计学部分给予的支持。
[1]Zeng H,Zheng R,Guo Y,et al.Cancer survival in China,2003-2005:a population-based study[J].Int J Cancer,2015,136(8):1921-1930.
[2]Gotoda T,Yanagisawa A,Sasako M,et al.Incidence of lymph node metastasis from early gastric cancer:estimation with a large number of cases at two large centers[J].Gastric Cancer,2000,3(4):219-225.
[3]Gotoda T,Kusano C,Moriyasu F.Future perspective of gastric cancer endotherapy[J].Ann Transl Med,2014,2(3):25.
[4]Yoshinaga S,Hilmi IN,Kwek BE,et al.Current status of endoscopic ultrasound for the upper gastrointestinal tract in Asia[J]. Dig Endosc,2015,27(Suppl 1):2-10.
[5]Pei Q,Wang L,Pan J,et al.EUS for staging depth of invasion in early gastric cancer:A meta-analysis[J].JGastroenterol Hepatol,2015,30(11):1566-1573.
[6]Kim GH,Park Do Y,Kida M,et al.Accuracy of high-frequency catheter-based endoscopic ultrasonography according to the indications for endoscopic treatment of early gastric cancer[J].J Gastroenterol Hepatol,2010,25(3):506-511.
[7]Edge S,Byrd DR,Compton CC,et al.AJCC cancer staging manual[M].7th ed.New York:Springer-Verlag,2010:143-164.
[8]日本胃癌學會.胃癌治療ガイドライン(改訂第4版)[M].東京:金原出版株式会社,2014.
[9]中华医学会消化内镜学分会.中国早期胃癌筛查及内镜诊治共识意见(2014年,长沙)[J].中华消化杂志,2014,34(7):433-448.
[10]Okada K,Fujisaki J,Kasuga A,et al.Endoscopic ultrasonography is valuable for identifying early gastric cancers meeting expanded-indication criteria for endoscopic submucosal dissection[J].Surg Endosc,2011,25(3):841-848.
[11]Yamamoto S,Nishida T,Kato M,et al.Evaluation of endoscopic ultrasound image quality is necessary in endosonographic assessment of early gastric cancer invasion depth[J].Gastroenterol Res Pract,2012,2012:194530.
[12]Lee HH,Lim CH,Park JM,et al.Low accuracy of endoscopic ultrasonography for detailed T staging in gastric cancer[J].World J Surg Oncol,2012,10:190.
[13]Mandai K,Yasuda K.Accuracy of endoscopic ultrasonography for determining the treatment method for early gastric cancer[J]. Gastroenterol Res Pract,2012,2012:245390.
[14]Park JM,Ahn CW,Yi X,et al.Efficacy of endoscopic ultrasonography for prediction of tumor depth in gastric cancer[J].J Gastric Cancer,2011,11(2):109-115.
[15]Tsuzuki T,Okada H,Kawahara Y,et al.Usefulness and problems of endoscopic ultrasonography in prediction of the depth of tumor invasion in early gastric cancer[J].Acta Med Okayama,2011,65(2):105-112.
[16]Choi J,Kim SG,Im JP,et al.Comparison of endoscopic ultrasonography and conventional endoscopy for prediction of depth of tumor invasion in early gastric cancer[J].Endoscopy,2010,42(9):705-713.
[17]Lee JY,Choi IJ,Kim CG,et al.Therapeutic decision-making using endoscopic ultrasonography in endoscopic treatment of early gastric cancer[J].Gut Liver,2016,10(1):42-50.
[18]Tsujii Y,Kato M,Inoue T,et al.Integrated diagnostic strategy for the invasion depth of early gastric cancer by conventional endoscopy and EUS[J].Gastrointest Endosc,2015,82(3):452-459.
(吴静编辑)
Effects of mini-probe endoscopic ultrasonography for therapeutic decision-making in early gastric cancer prior to operation*
JingWang1,QiWu1,Li Sun2,Zi-yu Li3,Zhao-de Bu3,Xiang-qian Su3,Shi-jie Li1
[1.Departmentof Endoscopy Center;2.Departmentof Pathology;3.Department of Gastrointestinal Surgery,Key Laboratory of Carcinogenesis and Translational Research(Ministry of Education),Cancer Hospital of Peking University&Beijing Institute for Cancer Research,Beijing 100142,China]
Objective To evaluate the clinical value of mini-probe endoscopic ultrasonography(EUS)in determining the therapeutic strategy for early gastric cancer(EGC)before surgery.Methods 151 EGC lesions were enrolled in the study.The accuracy of EUS-determined depths were compared with histopathologic results,and the effects of EUS-based therapeutic decision-making plan was evaluated.Results The overall accuracy of EUS-determined T staging was 74.8%.Multivariate analysis revealed that tumor size larger than 2 cm,endoscopic ulceration and tumor located at upper two thirds of the stomach were associated with EUS misdiagnosis(P<0.05).75.3%(107/142)of the EGC patients
proper treatment according to EUS-based therapeutic selection.Conclusions Mini-probe EUS is a useful utility in T-staging and therapeutic strategy selection for EGC.Special attention should be paid when tumor diameter exceeds 2 cm,co-existence of ulcer or tumor located in the upper two-thirds portion of the stomach.
endoscopic ultrasonography;early gastric cancer;diagnosis;therapy
R 735.2
A
10.3969/j.issn.1007-1989.2016.02.004
1007-1989(2016)02-0015-07
2015-09-22
北京市属医院科研培育计划(No:PX2016057)
李士杰,E-mail:ourhere@126.com;Tel:010-88196168
