支气管内超声引导针吸活检标本检测3种microRNA对肺癌分型的价值
2016-11-29李玺林劲松陈桂阳陈明真卢燕珊荣福
李玺,林劲松,陈桂阳,陈明真,卢燕珊,荣福
(广东省佛山市顺德区第一人民医院 呼吸内科,广东 佛山 528300)
支气管内超声引导针吸活检标本检测3种microRNA对肺癌分型的价值
李玺,林劲松,陈桂阳,陈明真,卢燕珊,荣福
(广东省佛山市顺德区第一人民医院 呼吸内科,广东 佛山 528300)
目的 探讨支气管内超声引导针吸活检术(EBUS-TBNA)获取标本联合检测3种microRNA对肺癌分型的价值。方法 收集2014年10月-2016年1月在该院住院的肺癌患者35例,同期收集肺部良性病变者20例为对照组,经EBUS-TBNA获取标本,用实时定量PCR方法检测其miRNA-21、miRNA-205、miRNA-375的表达水平,评价其在肺癌病理分型的价值。结果 肺癌组EBUS-TBNA标本miRNA-21、miRNA-205和miRNA-375的相对表达量明显高于对照组,差异有统计学意义(均P <0.01)。miRNA-21在腺癌患者EBUS-TBNA标本中的表达水平明显高于肺鳞癌,差异有统计学意义(P <0.05);miRNA-205在肺鳞癌患者EBUS-TBNA标本中的表达水平明显高于肺腺癌,差异有统计学意义(P <0.05);miRNA-375在小细胞肺癌患者EBUS-TBNA标本中的表达水平明显高于鳞癌和腺癌,差异有统计学意义(P <0.01)。根据受试者工作特征曲线(ROC),miRNA-21取1.955为诊断肺腺癌的临界值时,其敏感度和特异度分别为65.00%和100.00%;miRNA-205取2.305为诊断肺鳞癌的临界值时,其敏感度和特异度均分别为91.67%和100.00%。结论 EBUS-TBNA标本行miRNA检测是可行的,联合检测miRNA-21、miRNA-205和miRNA-375有助于肺癌的诊断和病理分型。
支气管内超声;经支气管针吸活检;微小RNA;肺癌;诊断;分型
2015年我国估算有73.3万例新发肺癌病例和60.0万例死亡病例,居恶性肿瘤发病率和死亡率的首位,与美国相比,中国肺癌的预后更差、生存期更短[1]。支气管内超声引导针吸活检术(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)是临床上常用的细针穿刺技术,对肺癌的诊断有良好的价值且安全性较好[2]。但在所有的肺癌小标本中,诊断为非小细胞癌组织学亚型不明确(non-small cell carcinoma not otherwise specified,NSCC-NOS)约占30.00%~50.00%,随着分子靶向治疗的发展,世界卫生组织建议减少NSCC-NOS的诊断[3]。目前大量研究表明,微小RNA(microRNA)有助于肺癌分型[4]。本研究收集中低分化肺癌患者经EBUS-TBNA获取的小标本,通过实时定量PCR方法检测其miRNA-21、miRNA-205和miRNA-375,探讨miRNA在肺癌病理分型中的价值。
1 资料与方法
1.1一般资料
所有研究对象均为2014年10月-2016年1月在广东省佛山市顺德区第一人民医院住院肺癌患者(肺癌组)35例。其中,男24例,女11例;年龄33~75岁,平均年龄(59.71±9.88)岁;鳞癌12例,腺癌20例,小细胞肺癌3例。所有肺癌患者检查前均未行放化疗或靶向治疗。同期收集有肺部良性病变且无肿瘤病史的患者(对照组)20例。其中,男11例,女9例,年龄26~79岁,平均年龄(58.00±15.32)岁。本研究经医院伦理委员会批准,所有研究对象都签署了知情同意书。
1.2EBUS-TBNA取材
1.2.1仪器 日本Olympus公司内镜设备:包括常规纤支镜、超声内镜、图像处理系统及配套的穿刺针。
1.2.2术前准备 ①术前完善血常规、凝血功能、心电图和胸部CT等检查;②禁饮食6 h以上。
1.2.3EBUS-TBNA-TBNA标本的获取 局麻下经鼻腔入镜或全麻下经喉罩入镜,将内镜探头置于拟穿刺部位,打开超声图像,确定穿刺病点,穿刺,穿入后可见病灶内穿刺针强回声。抽吸获取标本后固定,送常规病理检查。在同一穿刺点再次穿刺,将标本置入EP管中,随后放进-80℃冰箱保存。每个穿刺点穿刺3~6次。穿刺后禁饮食2 h,密切观察有无并发症发生。
1.3miRNA检测
当患者肺内原发灶活检经两名高年资病理科医生一致诊断为鳞癌、腺癌或小细胞肺癌,其EBUSTBNA标本见中低分化癌细胞但未能明确病理类型时,病理科对EBUS-TBNA标本进一步行免疫组化甲状腺转录因子-1(thyroid transcription factor,TTF-1)和P63检查,同时-80℃保存标本行miRNA检查。
1.3.1主要试剂、仪器和耗材 TRIzol® Reagent(Life technologies)、RNase free吸头和RNase free EP管(Axygen)、K2800核酸分析仪(北京凯奥)、Agarose(Biowest)、Nucleic Acid Stain 核酸染料(北京鼎国昌盛)、电泳仪(北京君意)、全自动凝胶成像分析系统(上海培清)、冷冻离心机(珠海黑马)、Geneseed® First Strand cDNA Synthesis Kit和Geneseed® qPCR SYBR®Green Master Mix(Geneseed)、实时荧光定量PCR仪(ABI 7500)。
1.3.2RNA RNA提取 ①标本融化后充分混匀,取300.0μl EBUS-TBNA样本,加入1.0 ml Trizol后,室温静置5 min,使其充分裂解;②按200.0μl氯仿/ml Trizol的比例加入氯仿,用手剧烈振荡15 s,室温放置15 min;③4℃,12 000 g离心15 min;④溶液分为3层,RNA溶解在水相中,把上层水相吸引出来,移至另一离心管中;⑤按1.0 ml 75%乙醇/ml Trizol的比例加入75%乙醇,温和振荡离心管,悬浮沉淀;⑥4℃ 7 500 g离心5 min,尽量弃上清;⑦室温晾干5~10 min,加入40.0μl DEPC水溶解沉淀;⑧RNA质量和完整性检测:测OD值定量RNA,1%琼脂糖凝胶电泳检测 RNA完整性。
1.3.3引物合成 广州吉赛生物科技有限公司合成。
1.3.4 .3.4 逆转录反应 20.0 μl反应体系:2 ×RT Mix 5.0 μl,Geneseed® Enzyme Mix 1.0 μl,has-miR-21 RT引物0.5 μl,has-miR-205 RT引物0.5 μl,has-miR-375 RT引物0.5 μl,U6 RT引物0.5 μl,Total RNA 1 μg,加RNase free dd H2O至20.0 μl。反应条件:25℃ 5 min,50℃ 30 min,85℃ 5 min。
1.3.5实时定量PCRPCR实验 用SYBE-GREEN法。20.0μl反应体系:Geneseed® qPCR SYBR® Green Master Mix 10.0 μl,Forward primer(10 μmol/L)0.5 μl,Reverse primer(10 μmol/L)0.5μl,50x ROX Reference Dye 2 0.4 μl,模板DNA 2,加灭菌蒸馏水至20.0μl。反应程序设置:预变性95℃ 5 min,循环反应40个循环95℃ 10 s、60℃(采集信号)34 s,熔解曲线95℃15 s,60℃ 60 s,95℃ 15 s。
1.3.6实时定量PCRPCR数据处理 以U6为内参。根据2-△△Ct公式计算目标基因表达情况。△Ct=Ct目标miRNACtU6,△△Ct=肺癌组△Ct-对照组△Ct=肺癌组(Ct目标miRNACtU6)-对照组(Ct目标miRNA- CtU6)=X。则肺癌组样本内miRNA的表达水平为对照组样本内的2-X倍。
1.4统计学方法
使用SPSS 17.0软件进行统计学分析。所有计量资料均进行正态性检验,正态分布资料以均数±标准差表示,两组间比较采用独立样本t检验。多组间比较,方差齐用LSD和SNK-q检验、方差不齐用Kruskal-Wallis检验。资料不符合正态分布时采用秩和检验。P <0.05表示差异有统计学意义。作受试者工作曲线(receiver operating characteristic curve,ROC)来评价miRNA-21、miRNA-205和miRNA-375诊断肺癌和肺癌病理分型的能力,分别计算曲线下面积(AUC)来评估其诊断效能,并确定临界值及其相关的灵敏度、特异度。
2 结果
2.1miRNA-21、miRNA-205和miRNA-375在肺癌组和对照组EBUS-TBNA标本的相对表达量
肺癌组EBUS-TBNA标本miRNA-21、miRNA-205和miRNA-375的相对表达量明显高于对照组,差异有统计学意义(均P <0.01)。见表1。
2.2EBUS-TBNA标本检测miRNA-21、miRNA-205和miRNA-375对肺癌的诊断价值
作ROC曲线来评价EBUS-TBNA标本中miRNA-21、miRNA-205和miRNA-375的相对表达量对肺癌的诊断价值。miRNA-21、miRNA-205和miRNA-375的曲线下面积(area under curve,AUC)分别为0.944(95%可信区间:0.877~1.000)、0.973(95%可信区间:0.936~1.000)和0.991(95%可信区间:0.975~1.000),AUC均在0.900以上,提示有较高的准确性。miRNA-21取1.635为诊断肺癌的临界值时,其敏感度、特异度和准确度分别为82.86%、95.00%和77.86%;miRNA-205取1.475为诊断肺癌的临界值时,其敏感度、特异度和准确度分别为94.25%、95.00%和89.29%;miRNA-375取4.505为诊断肺癌的临界值时,其敏感度、特异度和准确度分别为100.00%、90.00%和90.00%。上述数据表明EBUSTBNA标本的miRNA-21、miRNA-205和miRNA-375相对表达量对诊断肺癌有较高的诊断效能。
表1 miRNA-21、miRNA-205和miRNA-375的相对表达量
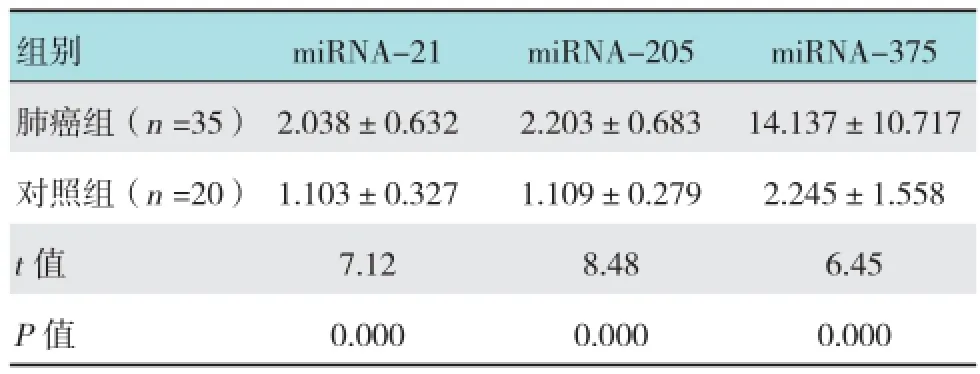
表1 miRNA-21、miRNA-205和miRNA-375的相对表达量
组别miRNA-21miRNA-205miRNA-375肺癌组(n =35)2.038±0.6322.203±0.68314.137±10.717对照组(n =20)1.103±0.3271.109±0.2792.245±1.558 t值7.128.486.45 P值0.0000.0000.000
2.3EBUS-TBNA标本的miRNA-21、miRNA-205和miRNA-375的表达水平对肺癌病理分型的价值
EBUS-TBNA标本miRNA-21、miRNA-205和miRNA-375在肺鳞癌、腺癌和小细胞肺癌的相对表达量不全相同,差异有统计学意义(均P <0.01),见表2。进一步两两比较发现,miRNA-21在鳞癌患者EBUS-TBNA标本的表达水平明显低于腺癌,差异有统计学意义(P <0.05);miRNA-205在鳞癌患者EBUS-TBNA标本的表达水平明显高于腺癌,差异有统计学意义(P <0.05);miRNA-375在小细胞肺癌患者EBUS-TBNA标本的表达水平明显高于鳞癌和腺癌,差异有统计学意义(均P <0.05)。
2.4非小细胞肺癌患者EBUS-TBNA标本检测miRNA-21对肺腺癌的诊断价值,并与免疫组化指标TTF-1比较
作ROC曲线来评价miRNA-21诊断肺腺癌的价值,miRNA-21的AUC为0.854(95%可信区间:0.718~0.990);取1.955为诊断临界值时,以肺癌原发灶活检的组织病理结果为金标准,miRNA-21诊断肺腺癌的Kappa值为0.582,一致性一般,与肺腺癌的TTF-1阳性表达(图1)比较,其诊断腺癌的特异度同TTF-1,但敏感度低于TTF-1。见表3。
表2 肺癌EBUS-TBNA标本miRNA-21、miRNA-205和miRNA-375的相对表达量

表2 肺癌EBUS-TBNA标本miRNA-21、miRNA-205和miRNA-375的相对表达量
组别miRNA-21miRNA-205miRNA-375鳞状细胞癌(n =12)1.552±0.198 2.905±0.622 12.932±6.379腺癌(n =20)2.286±0.670 1.788±0.336 10.430±4.795小细胞肺癌(n =3)2.330±0.684 2.393±0.462 43.673±7.460 F值12.6922.24-H值--46.75 P值0.0010.0000.000
2.5非小肺癌患者EBUS-TBNA标本检测miRNA-205对肺鳞癌的诊断价值,并与免疫组化指标P63比较
作ROC曲线来评价miRNA-205诊断肺鳞癌的价值,miRNA-205的AUC为0.971(95%可信区间:0.920~1.000),取2.305为诊鳞癌的临界值时,以肺癌原发灶活检的组织病理结果为金标准,miRNA-205诊断肺鳞癌的Kappa值为0.932,一致性较好,与肺鳞癌的P63阳性表达(图2)比较,其诊断鳞癌的特异度和敏感度均高于P63。见表4。
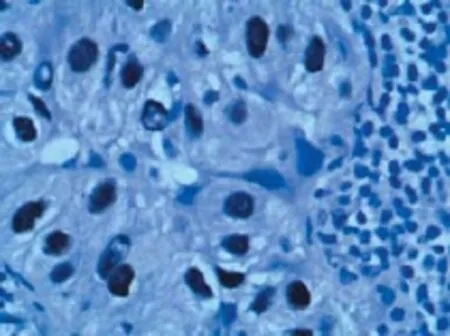
图1 TTF-1表达于肺腺癌的细胞核 (SP法,×400)
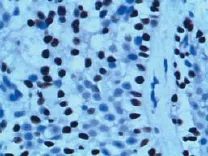
图2 P63表达于肺鳞癌的细胞核 (SP法,×400)
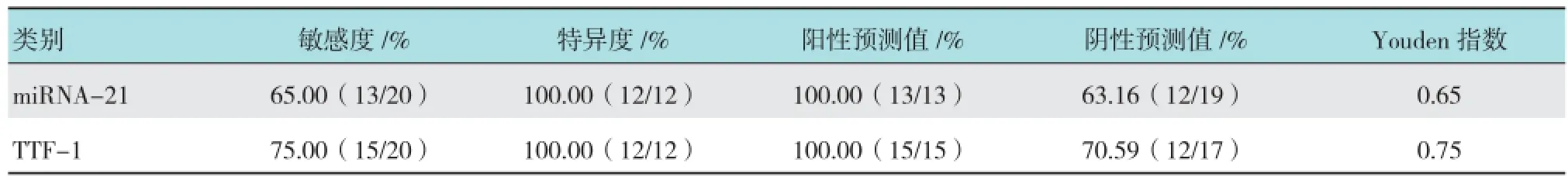
表3 EBUS-TBNA标本检测miRNA-21和TTF-1诊断肺腺癌的敏感性、特异性、阳性预测值、阴性预测值和Youden指数
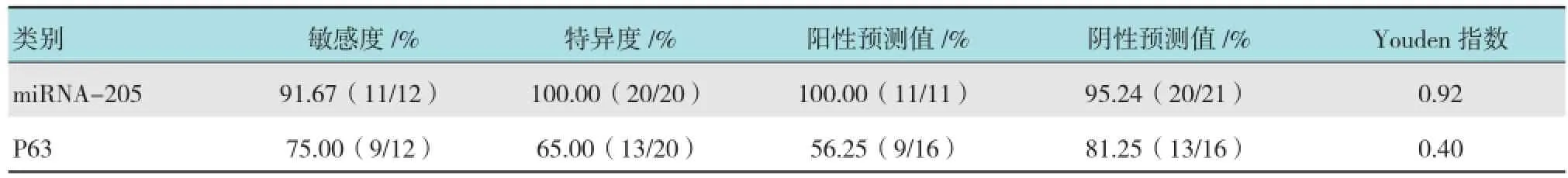
表4 EBUS-TBNA标本检测miRNA-205和P63诊断肺鳞癌的敏感性、特异性、阳性预测值、阴性预测值和Youden指数
3 讨论
近些年来,随着精准医学的发展,对肺癌的准确分型要求越来越高。一方面肺癌的分子靶向治疗要求更精确的组织学分类,如表皮生长因子受体(epidermal growth factor receptor,EGFR)/间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)/受体酪氨酸激酶(ROS proto-oncogene 1,receptor tyrosine kinase,ROS1)等基因活化主要发生在腺癌,程序性死亡受体-1(programmeddeath-1,PD-1)单抗Nivolumab仅仅在晚期鳞癌中获批;另一方案培美曲塞和贝伐单抗等药物仅在非鳞非小细胞肺癌中获批。如果鳞癌患者使用贝伐单抗或培美曲赛治疗可能出现严重甚至致死性的不良反应,而小细胞肺癌使用贝伐单抗作用不大。明确病理分型是肺癌个体化药物治疗的基础。肺癌手术切除标本可以准确的病理分型和进行详尽的分子生物学研究,但术后多年后复发的患者并不能用之前手术切除标本进行分析,因为转移复发灶的生物学特点可能与原发灶不同;另外,约2/3的患者在进行肺癌诊治时已是晚期,无法获取手术切除的组织标本,多数能取到的就是纤支镜活检或细针穿刺标本。EBUSTBNA是一项常用的肺癌诊断和分型的细针穿刺技术,能够使大部分肺癌得到准确的诊断[2],但同时也有一部分无法分型或错误分型[5],尤其是低分化癌、活检小标本所含肿瘤细胞不多、缺乏组织结构或组织本身的有较大异质性时,准确分型的难度就更大[6-7]。免疫组化在一定程度上能提高肺癌分型的准确性,但免疫组化方法也有其不足[8-10],其诊断和分型的能力有限。因此,有必要寻求一种新型的、更加准确的肺癌分型方法。近年来对miRNA的研究为解决之一难题提供了契机。
国外多项研究表明,检测肺癌手术切除标本的miRNA可以成功的鉴别肺鳞癌和腺癌,其准确度达90.00%~100.00%[6,11-14]。GILAD等[11]研究451份肺癌及肺部良性病变标本的8种miRNAs(miRNA-106a、miRNA-125a、miRNA-129、miRNA-205、miRNA-21、miRNA-7、miRNA-375和miRNA-29b)发现,miRNA准确鉴别肺部良性肿瘤、小细胞肺癌、鳞状细胞癌和腺癌的准确度达93.70%,即使是临床上难以鉴别的细胞学标本通过检测miRNAs也能准确的进行病理分型。PATNAIK等[6]研究发现,使用常规的组织学方法进行非小细胞肺癌的病理分型,有21.00%是无法分型或错误分型的,联合检测miRNA-205和miRNA-375可提高准确鉴别肺鳞腺癌率至96.00%。有研究人员使用PCR方法检测肺癌组织和正常肺组织的石蜡包埋标本的miRNA-205和miRNA-375的表达水平发现,miRNA-205在鳞癌中的表达水平明显上调,miRNA-375在小细胞肺癌中的表达水平明显上调[12]。LEBANONY等[13]评价miRNA-205和miRNA-21的表达水平对鉴别肺鳞腺癌的意义,他们发现miRNA-205在鳞腺癌中的表达水平明显升高,被认为是肺鳞癌的特异性生物标志物,其准确分型的敏感性为96.00%,特异性为90.00%,AUC为0.960。BISHOP等[14]旨在比较miRNA-205和miRNA-21的表达水平与非小细胞肺癌显微镜下病理结果联合免疫组化结果的吻合率,发现结果100.00%吻合。目前多个研究证实了miRNA-21、miRNA-205和miRNA-375有助于肺癌分型,其他miRNA是否有助于肺癌的分型尚需进一步研究验证。因此,本研究选取了上述3种miRNAs进行研究,且是检测EBUSTBNA标本而不是肺癌手术标本。本研究结果显示:miRNA-375在小细胞肺癌EBUS-TBNA标本的表达水平明显高于鳞癌和腺癌,提示miRNA-375可以鉴别小细胞肺癌和非小细胞肺癌;在非小细胞肺癌中,miRNA-21在腺癌EBUS-TBNA标本的表达水平明显高于鳞癌,而miRNA-205在腺癌患者的EBUS-TBNA标本的表达水平明显低于鳞癌,提示miRNA-21和miRNA-205具有鉴别肺鳞腺癌的能力。联合检测EBUS-TBNA标本的miRNA-21、miRNA-205和miRNA-375,对肺癌病理分型有较高的价值。
目前免疫组化被认为是肺癌分型有效的补充手段,TTF-1是肺腺癌公认的免疫组化标志物,P63是肺鳞癌公认的标志物。将无明确腺癌或鳞癌形态特征,且不表达肺癌常见表面标志物的一类肿瘤定义为NSCC-NOS,此时,需要结合患者的影像学特征,排除肺转移瘤的可能。这种形态学肿瘤,若其TTF-1表达阳性,则称之为NSCC-NOS,倾向于腺癌;若P63表达阳性,则称之为NSCC-NOS,倾向于鳞癌[3]。本研究对miRNA-21、miRNA-205鉴别肺鳞腺癌的效能和免疫组化指标TTF-1、P63相比较,发现miRNA-21对诊断腺癌的特异度同TTF-1、但敏感度略低于TTF-1,而miRNA-205对诊断鳞癌的敏感度和特异度均优于P63。
本研究还比较了35例肺癌患者和20例肺部良性病变患者的EBUS-TBNA标本的miRNA-21、miRNA-205和miRNA-375的表达情况,发现肺癌患者EBUS-TBNA标本的miRNA-21、miRNA-205和miRNA-375的相对表达量明显高于肺部良性病变者,它们的敏感度和特异度分别为82.86%和95.00%、94.25%和95.00%、100.00%和90.00%,表明它们对肺癌的诊断有较高的价值。与既往研究结果相符[15-16]。
本研究证明了EBUS-TBNA标本进行miRNA的检测是可行的。EBUS-TBNA获取标本的miRNA-21、miRNA-205和miRNA-375表达水平对肺癌的诊断和病理分型均有较大价值,尤其是对于无法获取肺癌原发灶标本而仅能获取EBUS-TBNA标本的患者或常规病理无法准确分型的中低分化肺癌患者,其应用价值更大,进一步提高EBUS-TBNA技术的临床应用价值,对肺癌患者的个体化精准治疗有一定的指导意义。但本研究样本量小,尤其是小细胞肺癌仅3例,需进一步扩大样本量验证。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics inChina, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] 陈升, 刘爱群, 刘立义, 等. 超声支气管镜引导下针吸活检术结合免疫组化及基因学检测在肺癌诊治中的应用[J]. 中国内镜杂志, 2016, 22(5): 6-11.
[3] TRAVIS W D, BRAMBILLA E, NICHOLSON A G, et al. The 2015 World Health Organization Classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classifi cation[J]. J Thorac Oncol, 2015, 10(9): 1243-1260.
[4] DEL VESCOVO V, GRASSO M, BARBARESCHI M, et al. Micro RNAs as lung cancer biomarkers[J]. World J Clin Oncol, 2014,5(4): 604-620.
[5] WALLACE W A, RASSL D M. Accuracy of cell typing in nonsmall cell lung cancer by EBUS/EUS-FNA cytological samples[J]. Eur Respir J, 2011, 38(4): 911-917.
[6] PATNAIK S, MALLICK R, KANNISTO E, et al. MiR-205 and MiR-375 microRNA assays to distinguish squamous cell carcinoma from adenocarcinoma in lung cancer biopsies[J]. J Thorac Oncol,2015, 10(3): 446-453.
[7] FIELD R W, SMITH B J, PLATZ C E, et al. Lung cancer histologic type in the surveillance, epidemiology, and end results registry versus independent review[J]. J Natl Cancer Inst, 2004, 96(14): 1105-1107.
[8] AU N H, GOWN A M, CHEANG M, et al. P63 expression in lung carcinoma: a tissue microarray study of 408 cases[J]. Appl Immunohistochem Mol Morphol, 2004, 12(3): 240-247.
[9] JORDA M, GOMEZ-FERNANDEZ C, GARCIA M, et al. P63 differentiates subtypes of nonsmall cell carcinomas of lung in cytologic samples: implications in treatment selection[J]. Cancer,2009, 117(1): 46-50.
[10] KHAYYATA S, YUN S, PASHA T, et al. Value of P63 and CK5/6 in distinguishing squamous cell carcinoma from adenocarcinoma in lung fine-needle aspiration specimens[J]. Diagn Cytopathol,2009, 37(3): 178-183.
[11] GILAD S, LITHWICK-YANAI G, BARSHACK I, et al. Classification of the four main types of lung cancer using a microRNA-based diagnostic assay[J]. J Mol Diagn, 2012, 14(5): 510-517.
[12] 金怡. MicroRNA-375、MicroRNA-205在肺癌中的表达及相关靶基因的研究[D]. 上海:复旦大学, 2013.
[13] LEBANONY D, BENJAMIN H, GILAD S, et al. Diagnostic assay based on hsa-miR-205 expression distinguishes squamous from nonsquamous non-small-cell lung carcinoma[J]. J Clin Oncol,2009, 27(12): 2030-2037.
[14] BISHOP J A, BENJAMIN H, CHOLAKH H, et al. Accurate classification of non-small cell lung carcinoma using a novel microRNA-based approach[J]. Clin Cancer Res, 2010, 16(2): 610-619.
[15] JIN Y, LIU Y, ZHANG J, et al. The expression of miR-375 is associated with carcinogenesis in three subtypes of lung cancer[J]. PLoS One, 2015, 10(12): e0144187.
[16] MARKOU A, TSAROUCHA E G, KAKLAMANIS L, et al. Prognostic value of mature microRNA-21 and microRNA-205 overexpression in non-small cell lung cancer by quantitative realtime RT-PCR[J]. Clin Chem, 2008, 54(10): 1696-1704.
(吴静 编辑)
Classifi cation of lung cancer using three microRNAs in endobronchial ultrasound-guided tranbronchial needle aspiration samples
Xi Li, Jing-song Lin, Gui-yang Chen, Ming-zhen Chen, Yan-shan Lu, Fu Rong
(Department of Respiratory Medicine, the First People’s Hospital, Shunde, Guangdong 528300, China)
Objective To explore the signifi cance of three microRNAs expression in endobronchial ultrasoundguided transbronchial needle aspiration (EBUS-TBNA) samples for classification of lung cancer. Methods With qRT-PCR, the expression of miRNA-21, miRNA-205 and miRNA-375 were detected in EBUS-TBNA samples of 35 lung cancer patients. A group of 20 patients with benign mediastinal lymphadenopathy served as a control. The value of miRNA expressions for classifi cation of lung cancer was evaluated. Results The expressions of miRNA-21,miRNA-205 and miRNA-375 were significantly higher in EBUS-TBNA samples of lung cancer patients than those in control samples. The expressions of miRNA-21 were signifi cantly higher in EBUS-TBNA samples of lung adenocarcinoma than those in lung squamous cell carcinoma. The expressions of miRNA-205 were significantly higher in EBUS-TBNA samples of lung squamous cell carcinoma than those in lung adenocarcinoma. The expressions of miRNA-375 were signifi cantly higher in EBUS-TBNA samples of small cell lung cancer than those in non- smallcell lung cancer. ROC curve analysis showed that taking 1.945 as a cutoff value, the sensitivity and specifi city for miRNA-21 expression in EBUS-TBNA samples of lung adenocarcinoma were 65.00% and 100.00%; taking 2.305 as a cutoff value, the sensitivity and specifi city for miRNA-205 expression in EBUS-TBNA samples of lung squamous cell carcinoma were 91.67% and 100.00%. Conclusion EBUS-TBNA samples were suitable for detection of miRNA. Detecting miRNA-21, miRNA-205 and miRNA-375 expression could help diagnosis and classifi cation of lung cancer.
endobronchial ultrasound; transbronchial needle aspiration; microRNA; lung cancer; diagnosis;sub-classifi cation
R734.2
A
10.3969/j.issn.1007-1989.2016.10.014
1007-1989(2016)10-0060-06
2016-05-04
荣福,E-mail:rongfu828@sina.com;Tel:13702349838
