腹腔镜下早期卵巢癌全面分期手术的随访观察
2016-11-29余炜昶王燕郎雁黄燕明段洁杜欣金晶李红英陈璐冯同富
余炜昶,王燕,郎雁,黄燕明,段洁,杜欣,金晶,李红英,陈璐,冯同富
(湖北省妇幼保健院 妇科,湖北 武汉 430070)
腹腔镜下早期卵巢癌全面分期手术的随访观察
余炜昶,王燕,郎雁,黄燕明,段洁,杜欣,金晶,李红英,陈璐,冯同富
(湖北省妇幼保健院 妇科,湖北 武汉 430070)
目的 随访腹腔镜治疗早期卵巢癌(EOC)的临床效果,探讨腹腔镜EOC全面分期手术的有效性和安全性。方法 回顾性分析2012年5月-2015年8月在湖北省妇幼保健院手术治疗的EOC患者42例。其中,腹腔镜组19例,开腹组23例,比较两组手术时间、术中出血量、淋巴结切除数目、术后排气时间、住院时间,术后并发症发生率、分期上升率及术后化疗率。结果 两组患者均顺利完成手术,未发生术中并发症。与开腹组比较,腹腔镜组术中出血量明显减少(124.7±63.5)vs(328.7±155.5)ml(P <0.05),术后肛门排气时间(1.5±0.5)vs(2.7±0.9)d及术后住院时间(8.9±1.5)vs(14.3±3.8)d均明显缩短(P <0.05)。两组手术时间、淋巴结切除数目、术后并发症发生率、分期上升率和术后化疗率差异均无统计学意义(P >0.05)。随访7~46个月,平均24.6个月,两组复发率、死亡率差异无统计学意义(P >0.05)。腹腔镜组和开腹组的无瘤生存率分别为94.7%和91.3%,总生存率分别为94.7%和100.0%。结论 EOC腹腔镜手术具有出血少、创伤小和恢复快等优势,近期疗效确切,安全可行。
早期卵巢癌;腹腔镜手术;开腹手术;随访研究
卵巢癌是一种恶性程度极高的妇科肿瘤,死亡率居妇科恶性肿瘤首位。由于其发病隐匿,早期诊断较为困难,仅约19.0%的卵巢癌确诊时为国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)Ⅰ期[1]。早期(FIGOⅠ期)和晚期(FIGO Ⅱ~Ⅳ期)卵巢癌的5年生存率差异很大,早期可达93.0%,晚期只有31.0%[1]。因此,能否早期全面的诊断与治疗直接关系到卵巢癌患者的预后。早期卵巢癌(early-stage ovarian cancer,EOC)是指局限于一侧或双侧卵巢,且没有局部或远处转移的卵巢恶性肿瘤。全面而彻底的分期手术是EOC治疗的首要要求。1990年REICH等首次报道了应用腹腔镜治疗Ⅰ期卵巢癌,但由于分期不充分,存在肿瘤破裂、播散和穿刺孔转移等潜在风险[2],腹腔镜用于EOC全面分期手术仍是妇科肿瘤学界争论的焦点之一。湖北省妇幼保健院于2012年5月-2015年8月应用腹腔镜治疗EOC患者19例,疗效确切,并与同期23例开腹手术进行比较。现报道如下:
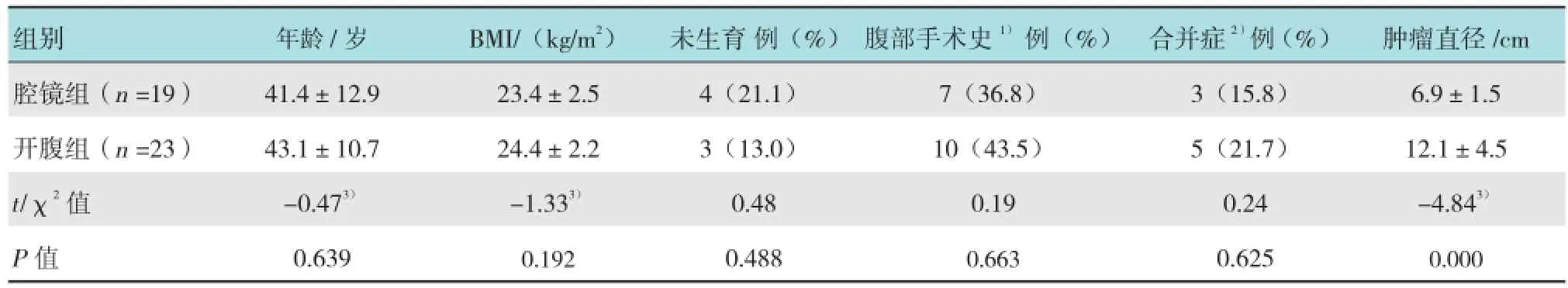
表1 两组患者一般资料比较
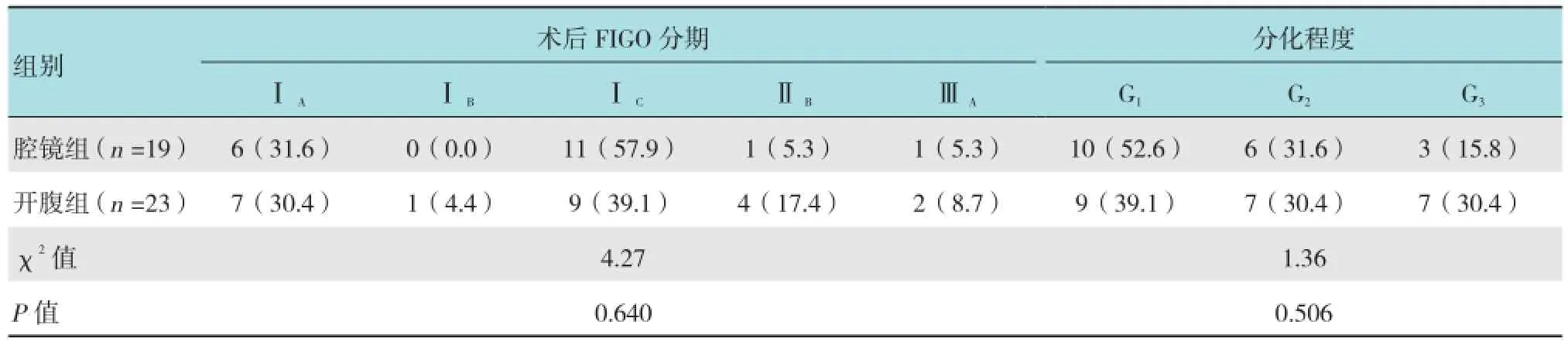
表2 两组肿瘤术后分期及分化程度比较 例(%)
1 资料与方法
1.1一般资料
收集2012年5月-2015年8月湖北省妇幼保健院妇科手术治疗的卵巢癌患者的临床资料,术中拟诊为EOC 42例。其中,19例行腹腔镜下全面分期手术(腔镜组),23例行开腹全面分期手术(开腹组)。所有患者均经术后病理确诊。腹腔镜及开腹手术由同一术者完成。所有患者均符合以下标准:①术前检查和术中探查无腹水或仅有少量盆腹腔积液;②肿瘤病灶局限于一侧或双侧卵巢;③术中探查盆腹腔腹膜、大网膜及其他部位无肉眼可见肿瘤转移灶;④腹腔镜组患者术前超声检查肿瘤最大直径<10 cm,开腹组患者肿瘤直径大小不限。即术中探查拟诊为FIGO分期ⅠA~ⅠC期患者。需要保留生育功能者满足以下条件:肿瘤分期为ⅠA期;肿瘤局限在一侧卵巢,对侧卵巢外观正常;细胞分化程度好(G1);“高危区域”(子宫直肠陷凹、结肠侧沟、肠系膜、大网膜和腹膜后淋巴结)探查阴性;术后有随诊条件。两组患者年龄、体质指数(body mass index,BMI)、生育情况、腹部手术史和合并症等一般资料,肿瘤术后病理分期、分化程度及组织学类型比较,除肿瘤直径外差异均无统计学意义(P >0.05),具有可比性。见表1~3。
1.2手术方式选择
在患者充分知情同意的条件下,卵巢肿瘤以囊性为主,包膜完整,要求保留生育功能者行肿瘤剥除;肿瘤以实性为主,无生育要求者行患侧附件切除。
1.3手术方法
两组患者术前均常规阴道、肠道准备3 d,清洁脐部,术前禁食并清洁灌肠。气管插管静脉复合麻醉后腹腔镜组患者取膀胱截石、头低臀高位,经阴道放置举宫器。于脐孔上3 cm穿刺建立气腹,气腹压力设定为13或14 mmHg,10 mm Trocar穿刺置入腹腔镜。于左、右侧下腹部相当于麦氏点部位分别置入第2、3个5 mm Trocar,第4个Trocar选择在左锁骨中线脐水平线下方约2 cm处。进入腹腔后,常规探查,留取腹水或腹腔冲洗液行细胞学检查;依次探查子宫、双附件、双侧结肠旁沟、小肠及其系膜、阑尾、肝、脾、胃、大网膜和横膈;检查全腹膜表面,对任何疑有转移灶的腹膜表面或粘连处均进行选择性切除或活检;将欲剔除的卵巢肿瘤置入取物袋内,尽量在袋内剔除肿瘤;或完整切除患侧附件后置入取物袋内。经术中快速病检确诊为阳性,则继续行全面分期手术,即全子宫+双侧附件+大网膜+阑尾切除+盆腔淋巴结清扫+腹主动脉旁淋巴结清扫+盆腹腔腹膜多点活检术。保留生育功能者只切除患侧附件,保留子宫,其余手术步骤相同。将切除组织装袋后经阴道取出,甲硝唑、生理盐水冲洗盆腹腔,可吸收线连续缝合阴道残端。术毕,拔出Trocar后将各穿刺点与该处腹膜缝合。开腹手术组患者取腹部正中向左绕脐切口长度约15~20 cm,手术范围同腹腔镜手术。两组患者术后均常规抗炎、对症支持、预防下肢深静脉血栓治疗,根据术后常规病检结果确定分期,酌情给予相应的后续治疗。
1.4观察指标及其定义
比较两组患者手术时间、淋巴结切除数目、术中出血量、输血率,术后肛门排气时间、住院时间、并发症发生率、分期上升率及术后化疗率。术后定期按随访要求进行随访。
手术时间指从切皮到手术完成所用的时间。术中出血量指手术完成后实际测量的出血量,腹腔镜组出血量=吸引瓶内的液体量-冲洗液量;开腹组出血量=吸引瓶内的出血量+纱布吸血量(每块纱布吸血量计为50 ml)。淋巴结切除数目以术后病理回报结果为准。术后住院时间截止至患者体温及血象正常、胃肠功能恢复正常,化疗开始前。
1.5统计学方法
采用SPSS 17.0统计学软件进行数据分析。计量资料以均数±标准差表示,采用独立样本t检验;计数资料采用χ2检验。以P <0.05为差异有统计学意义。
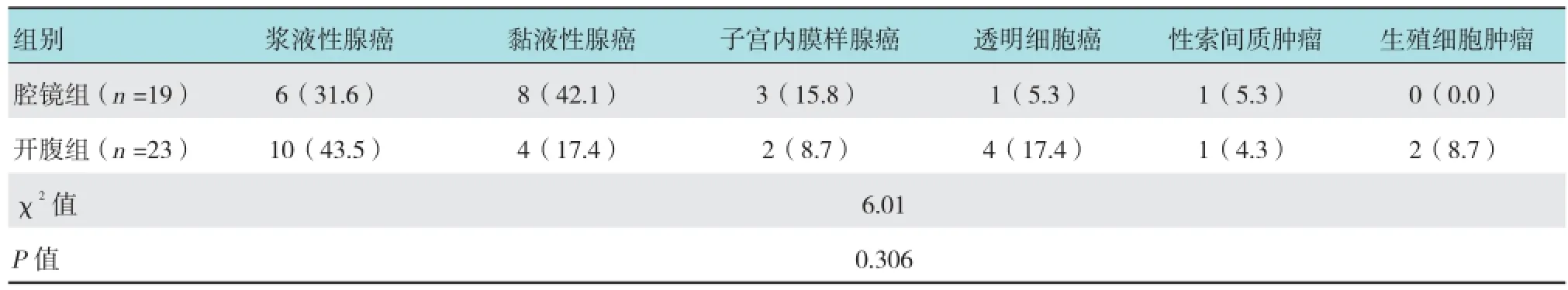
表3 两组肿瘤组织学类型比较 例(%)
2 结果
2.1两组术中情况比较
两组患者均顺利完成手术,未发生术中并发症。两组手术时间和切除淋巴结数目差异均无统计学意义(P >0.05)。腹腔镜组4例,开腹组3例行保留生育功能的分期手术,两组子宫切除比例差异无统计学意义(P >0.05)。腹腔镜组术中出血量、输血率均明显低于开腹组,差异有统计学意义(P <0.05)。见表4。
2.2两组术后情况比较
腹腔镜组术后肛门排气时间、术后住院时间均明显低于开腹组,差异有统计学意义(P <0.05)。两组术后并发症发生率、术后化疗率差异均无统计学意义(P >0.05)。腹腔镜组2例,开腹组6例术后病检提示乙状结肠表面、盆侧壁腹膜、淋巴结转移,手术-病理分期上升至ⅡB和ⅢA期,两组间比较差异无统计学意义(P >0.05)。见表5。
2.3随访
42例患者随访7~46个月,平均24.6个月,需化疗患者均完成所需疗程化疗。随访期间,腹腔镜组所有病例均未发生穿刺孔转移。腹腔镜组1例中分化子宫内膜样腺癌ⅠC期患者于术后22个月发现盆腹腔广泛粟粒样复发,行开腹再次肿瘤细胞减灭术,于术后27个月死亡。开腹组2例低分化浆液性腺癌患者复发,1例术中诊断ⅠC期术后分期上升为ⅢA期,于术后17个月发现盆腹腔广泛粟粒样复发;1例术中诊断ⅠC期术后分期上升为ⅡB期,于术后21个月发现阴道残端复发,均再次行肿瘤细胞减灭术并化疗,现无瘤存活。其余病例均无瘤生存,继续随访。两组随访时间、复发率和死亡率差异均无统计学意义(P >0.05)。见表6。腹腔镜组和开腹组的无瘤生存率分别为94.7%和91.3%,总生存率分别为94.7%和100.0%。
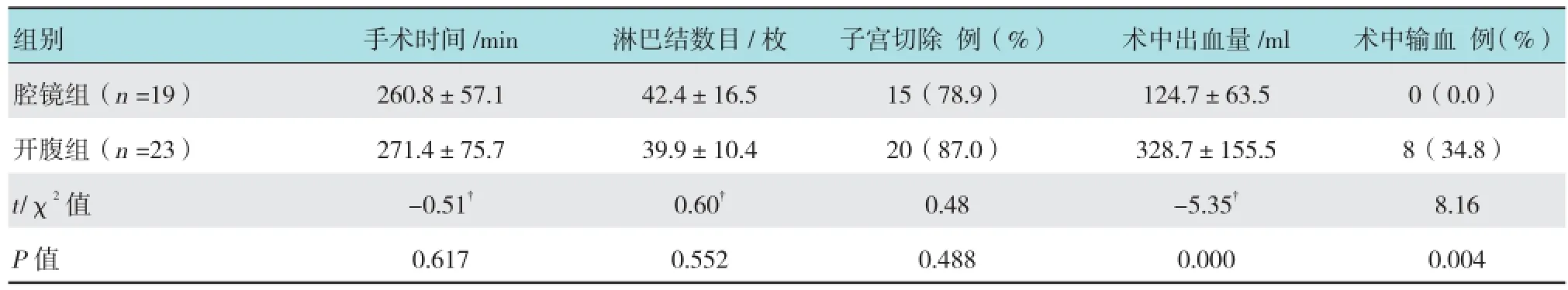
表4 两组术中情况比较
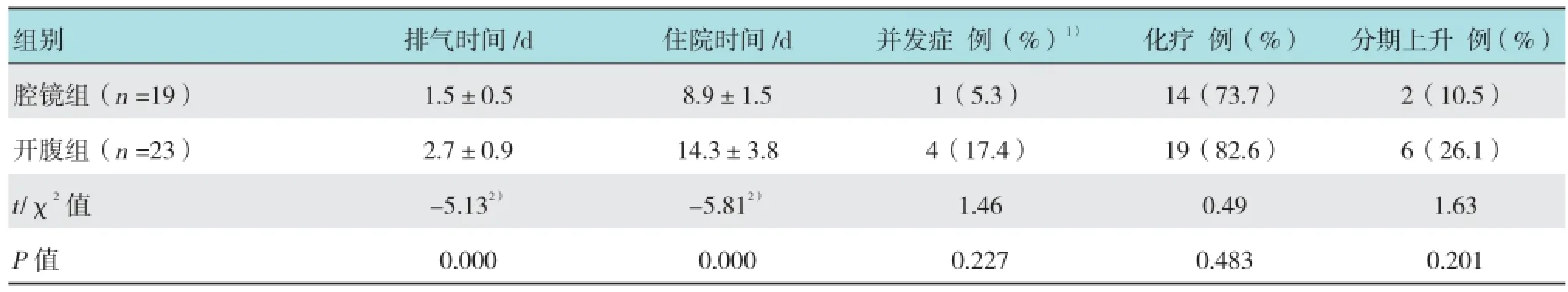
表5 两组术后情况比较
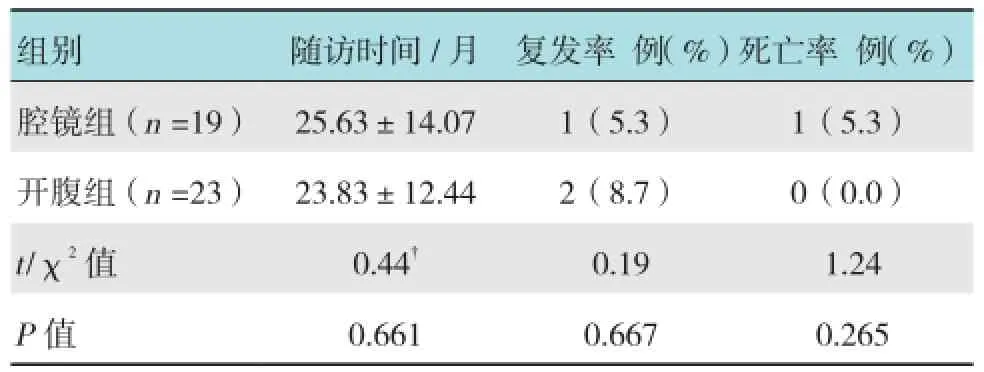
表6 两组随访情况比较
3 讨论
3.1腹腔镜下卵巢癌全面分期手术的适应证
随着腹腔镜技术和设备的不断改进和完善,其在早期宫颈癌和子宫内膜癌的手术治疗中得到了广泛应用。鉴于卵巢癌临床解剖和生物学行为的特殊性,腹腔镜是否适用于卵巢恶性肿瘤,一直存在较大争议。近十多年来,广大学者对腹腔镜下卵巢癌分期手术进行了大胆尝试并取得了较大进展,目前技术较为成熟的是早期(FIGOⅠ期)卵巢癌。EOC的首选治疗为手术,全面分期手术对于判断患者的预后极为重要,并为进一步治疗提供依据。国外一些研究小组比较了腹腔镜和开腹手术治疗Ⅰ期卵巢癌的手术分期效果和生存率,认为Ⅰ期卵巢癌患者行腹腔镜下全面分期手术是安全、可行的[3-5]。要在腹腔镜下完成理想的全面分期手术,应进行严格的术前评估,谨慎选择病例。患者应无严重的内科合并症、术前或术中探查拟诊为Ⅰ期、肿瘤直径小于10 cm、盆腹腔粘连不明显。本研究入组卵巢癌患者42例,均术中拟诊为早期,按手术途径的不同分为腹腔镜组和开腹组。两组病例的一般资料、肿瘤术后病理分期、分化程度及组织学类型比较差异均无统计学意义。仅腹腔镜组术前肿瘤直径明显小于开腹组,这与LECURU等[6]报道一致。相关文献中未见肿瘤直径影响肿瘤分期及预后的报道,故认为两组病例具有可比性。考虑到较大体积的卵巢肿瘤腹腔镜手术过程中操作困难,尤其是先行卵巢肿瘤剔除的患者,可能会导致肿瘤破裂而使分期上升,从而影响患者的预后,故腹腔镜组病例选择肿瘤直径小于10 cm。
3.2腹腔镜下EOC全面分期手术的临床效果
本研究中,腹腔镜组的手术时间略短于开腹组,但差异无统计学意义,这与LIU等[7]的报道一致。文献报道中,也有腹腔镜组的手术时间较开腹组明显延长[8]或明显缩短[9]的报道。手术时间的长短与病例的选择、术中等待冰冻病理结果的时间、术者的熟练程度和手术团队人员的相互配合等多种因素密切相关。在我院手术开展初期,手术时间接近同期开腹组,随着手术例数的增加和经验的积累,手术时间明显缩短,尤其是切除大网膜和阑尾的时间明显减少。此外,手术团队的默契配合和良好的手术设备也是保证手术成功的一个重要因素。既往的对比研究结果[8-9]都提示,腹腔镜组的术中出血量、输血率均较开腹组明显减少,本研究结果也支持这一观点。分析其原因,除了开腹组病例肿瘤直径较大、手术操作难度较大外,还与腹腔镜手术的特点有关:腹腔镜的放大作用使视野更清晰,解剖层次更清楚,更有利于术者辨别深部及异常血管并提前凝闭;同时,术中的正压环境和能量器械使用均减少了术中出血量,降低了输血率。考虑到子宫是否切除可能对术中出血量和手术时间存在一定影响,本研究中对两组术中子宫切除率进行了比较,结果差异无统计学意义。本研究中,腹腔镜组的术后肛门排气时间、术后住院时间均较开腹组明显缩短,这与文献报道[7-9]一致。说明腹腔镜手术对腹腔脏器的干扰较小,术后胃肠功能恢复更快,住院时间更短。
全面准确的分期手术是影响EOC预后的重要因素。本研究中42例患者均顺利完成手术,未发生术中并发症,19例腹腔镜手术无1例中转开腹。就手术效果而言,两组淋巴结切除数目差异无统计学意义,充分说明腹腔镜下全面分期手术的范围是足够的。两组术后化疗率和肿瘤分期上升率差异均无统计学意义。就手术安全性而言,42例患者均未发生术中大血管、神经损伤,输尿管、膀胱等邻近脏器损伤等严重并发症。术后不全肠梗阻、淋巴囊肿等手术相关并发症的比较差异无统计学意义。这表明,腹腔镜下EOC全面分期手术能达到预期效果。
复发率和死亡率也是评估手术有效性和安全性的重要指标。本研究中两组病例随访7~46个月,腹腔镜组1例复发并死亡,开腹组2例复发,两组复发率和死亡率差异均无统计学意义,这与BOGANI等[4]的报道一致。文献报道[10]随访时间最长(平均随访时间55.9个月)的36例EOC腹腔镜手术,复发率为8.3%,总生存率100.0%。由于EOC的5年生存率本身较高,加之本研究随访时间较短,样本量较小,腹腔镜分期手术的远期疗效仍有待长期的随访证实。
综合本研究和文献报道[8-9,11-12],有经验的妇科肿瘤医师在严格掌握适应证的前提下,对EOC患者实施腹腔镜下全面分期手术,不仅安全可行,而且具有出血少、创伤小和恢复快等微创优势,手术效果和近期疗效与开腹手术相当。
3.3腹腔镜下EOC全面分期手术可能存在的风险
当然,腹腔镜手术并非尽善尽美。较高的肿瘤破裂发生率、二氧化碳CO2气腹导致的肿瘤播散以及穿刺点转移等仍是腹腔镜分期手术面临的主要风险。术中卵巢肿瘤破裂可导致手术-病理分期上升,特别是EOC,一旦破裂可能引起腹腔内种植甚至转移。但是否影响患者的预后,学术界一直存在争论,VERGOTE等[13]对6个临床研究共计1 545例Ⅰ期卵巢癌患者的分析认为,卵巢肿瘤破裂是影响预后的独立因素。而SJOVALL等[14]报道了247例有破裂风险的EOC患者,术中肿瘤包膜完整与破裂者相比,生存率差异无统计学意义;另一方面,术前肿瘤破裂和术中破裂比较,生存率有明显差异,从而提示,术中导致肿瘤破裂对患者结局无负面影响。无论研究结果如何,本组在手术过程中都应严格遵循无瘤操作原则,尽量完整切除肿瘤,避免肿瘤细胞溢出。既往观察认为,CO2气腹对术后肿瘤细胞的种植、转移可能有促进作用,这一效应与气腹压力、烟囱效应和局部免疫调节等相关。但较新的研究发现[15],CO2正压时具有抑制肿瘤细胞生长的作用,CO2气腹并非造成卵巢癌术后肿瘤播散的原因。ABU-RUSTUM等[16]报道12年间1 288例妇科肿瘤患者进行了1 335次腹腔镜手术,与腹腔镜有关的皮下肿瘤种植发生率仅1.0%。有全腹腔广泛转移、腹腔积液中发现癌细胞、诊断或姑息性手术以及低分化肿瘤可能是腹腔镜术后发生穿刺点转移和种植的高危因素,而在早期卵巢恶性肿瘤中发生率极低。腹膜缝合可明显降低穿刺点转移的风险[17]。
本研究表明,腹腔镜下EOC全面分期手术具有良好的临床应用价值,也正在被越来越多的妇科肿瘤医师所接受,但腹腔镜手术对于卵巢癌生物学行为的影响及其远期疗效,尚有待大样本的前瞻性随机对照研究予以证实。
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30.
[2] GHEZZI F, MALZONI M, VIZZA E, et al. Laparoscopic staging of early ovarian cancer: results of a multi-institutional cohort study[J]. Ann Surg Oncol, 2012, 19(5): 1589-1594.
[3] PARK H J, KIM D W, YIM G W, et al. Staging laparoscopy for themanagement of early-stage ovarian cancer: a metaanalysis[J]. Am J Obstet Gynecol, 2013, 209(6): 592-593.
[4] BOGANI G, CROMI A, SERATI M, et al. Laparoscopic and open abdominal staging for early-stage ovarian cancer: our experience,systematic review, and meta-analysis of comparative studies[J]. Int J Gynecol Cancer, 2014, 24(7): 1241-1249.
[5] KOO Y J, KIM J E, KIM Y H, et al. Comparison of laparoscopy and laparotomy for the management of early-stage ovarian cancer: surgical and oncological outcomes[J]. J Gynecol Oncol, 2014,25(2): 111-117.
[6] LECURU F, DESFEUX P, CAMATTE S, et al. Impact of initial surgical access on staging and survival of patients with stage I ovarian cancer[J]. Int J Gynecol Cancer, 2006, 16(1): 87-94.
[7] LIU M, LI L, HE Y, et al. Comparison of laparoscopy and laparotomy in the surgical management of early-stage ovarian cancer[J]. Int J Gynecol Cancer, 2014, 24(2): 352-357.
[8] LEE M, KIM S W, PAEK J, et al. Comparisons of surgical outcomes, complications, and costs between laparotomy and laparoscopy in early-stage ovarian cancer[J]. Int J Gynecol Cancer,2011, 21(2): 251-256.
[9] PARK J Y, KIM D Y, SUH D S, et al. Comparison of laparoscopy and laparotomy in surgical staging of early-stage ovarian and fallopian tubal cancer[J]. Ann Surg Oncol, 2008, 15(7): 2012-2019.
[10] NEZHAT F R, EZZATI M, CHUANG L, et al. Laparoscopic management of early ovarian and fallopian tube cancers: surgical and survival outcome[J]. Am J Obstet Gynecol, 2009, 200(1): 83.e1-e6.
[11] BROCKBANK E C, HARRY V, KOLOMAINEN D, et al. Laparoscopic staging for apparent early stage ovarian or fallopian tube cancer. First case series from a UK cancer centre and systematic literature review[J]. Eur J Surg Oncol, 2013, 39(8): 912-917.
[12] 诸一鸣, 朱滔. 早期卵巢癌腹腔镜手术治疗的安全性和有效性分析[J]. 中国内镜杂志, 2016, 22(7): 42-45.
[13] VERGOTE I, DE BRABANTER J, FYLES A, et al. Prognostic importance of degree of differentiation and cyst rupture in stage I invasive epithelial ovarian carcinoma[J]. Lancet, 2001,357(9251): 176-182.
[14] SJOVALL K, NILSSON B, EINHORN N. Different types of rupture of th e tumor capsule and the impact on survival in early ovarian carcinoma[J]. Int J Gynecol Cancer, 1994, 4(5): 333-336.
[15] BOURDEL N, MATSUZAKI S, BAZIN J E, et al. Postoperative peritoneal dissemination of ovarian cancer cells is not promoted by carbon-dioxide pneumoperitoneum at low intraperitoneal pressure in a syngenic mouse laparoscopic model with controlled respiratory support: a pilot study[J]. J Minim Invasive Gynecol,2008, 15(3): 321-326.
[16] ABU-RUSTUM N R, RHEE E H, CHI D S, et al. Subcutaneous tumor implantation after laparoscopic procedures in women with malignant disease[J]. Obstet Gynecol, 2004, 103(3): 480-487.
[17] AGOSTINI A, ROBIN F, JAIS J P, et al. Peritoneal closure reduces port site metastases: results of an experiment in a rat ovarian cancer model[J]. Surg Endo sc, 2002, 16(2): 289-291.
(吴静 编辑)
Follow-up study of comprehensive laparoscopic surgical staging in early ovarian cancer
Wei-chang Yu, Yan Wang, Yan Lang, Yan-ming Huang, Jie Duan, Xin Du,Jing Jin, Hong-ying Li, Lu Chen, Tong-fu Feng
(Department of Gynecology, Hubei Maternal and Child Health Hospital, Wuhan, Hubei 430070, China)
Objective To observe the efficacy of laparoscopic staging in early ovarian cancer (EOC) and evaluate its feasibility and safety. Methods The outcomes of 42 patients with EOC who underwent laparoscopic (LPS group, n =19) or laparotomic surgical staging (LPT group, n =23) from May 2012 to August 2015 were retrospectively analyzed. The parameters including operation time, intraoperative blood loss, number of resected lymph nodes,gastrointestinal recovery time, hospital stay, postoperative complications, chemotherapy and postoperative upstaging rate were compared between the two groups. Results All operations completed successfully in two groups, and no intraoperative complications were observed. LPS group had less intraoperative blood loss (124.7 ± 63.5) vs (328.7 ± 155.5) ml, shorter gastrointestinal recovery time (1.5 ± 0.5) vs (2.7 ± 0.9) d and shorter hospital stay (8.9 ± 1.5)vs (14.3 ± 3.8) d when compared with LPT group (P <0.05). No signifi cant difference was found in operation time,number of resected lymph nodes, postoperative complications, chemotherapy and postoperative upstaging rate between the two groups (P >0.05). A total of 42 patients were followed up for 7~46 months, with an average of 24.6 months. There was no signifi cant difference in the recurrent and survival rate between the two groups (P >0.05). The disease-free survival and overall survival in LPS group is 94.7% and 94.7%, respectively. In LPT group is 91.3% and 100.0%. Conclusion Laparoscopy and laparotomy had similar surgical staging adequacy and accuracy, whereas laparoscopy shows more favorable operative outcomes, such as less blood loss during the operation, minor traumaand more rapid recovery. Laparoscopic surgical staging is feasible and safe for EOC in a short term, and its long-term outcomes are to be further investigated.
early-stage ovarian cancer; laparoscopic surgery; open surgery; follow-up study
R737.31
A
10.3969/j.issn.1007-1989.2016.10.009
1007-1989(2016)10-0037-06
2016-05-06
王燕,E-mail:echowy12@163.com;Tel:13886064802
