淫羊藿次苷Ⅱ葡萄糖醛酸代谢产物的制备与表征
2016-11-29孟繁兴李妍卢芳刘树民
孟繁兴,李妍,卢芳,刘树民*
(1.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040;2.中国科学院大连化学物理研究所药用资源开发组,辽宁 大连 116023)
淫羊藿次苷Ⅱ葡萄糖醛酸代谢产物的制备与表征
孟繁兴1,李妍2,卢芳1,刘树民1*
(1.黑龙江中医药大学药物安全性评价中心,黑龙江 哈尔滨 150040;2.中国科学院大连化学物理研究所药用资源开发组,辽宁 大连 116023)
目的:鉴定淫羊藿次苷II葡萄糖醛酸代谢产物,并进行制备与结构表征。方法:应用人肝微粒体孵育体系对淫羊藿次苷II葡糖醛酸结合代谢途径进行鉴定,并应用重组UGT1A1高效制备葡萄糖醛酸代谢产物,最后经NMR对该产物结构进行表征。结果:淫羊藿次苷II在人肝微粒体中的主要代谢产物为淫羊藿次苷II-7-O-葡萄糖醛酸代谢产物。结论:采用体外孵育方法可以高效特异地制备淫羊藿次苷II的葡萄糖醛酸代谢产物。
淫羊藿次苷Ⅱ;人肝微粒体;葡萄糖醛酸代谢产物;核磁共振
具有8位异戊烯基的黄酮及其衍生物是淫羊藿化学成分的重要组成部分[1-3]。淫羊藿苷被认为是淫羊藿最为主要的黄酮苷类化合物之一[4-7],与朝藿定A、B、C均可在肠道菌的作用下转化为淫羊藿次苷II,进而被吸收入血后发挥药效作用[8]。体外药理实验结果显示,淫羊藿次苷Ⅱ具有抗肿瘤[9]、抗衰老[10-11]、抗骨质酥松[12-13]及抗阴茎勃起功能障碍[14]等多种药理活性。但是,淫羊藿次苷II经口服吸收后受首过效应影响显著,大鼠体内的生物利用度仅为4.1%[15],葡萄糖醛酸化反应是其在大鼠体内最为重要的生物转化途径。但对淫羊藿次苷II在人体内的代谢情况研究较少,本研究采用体外孵育方法鉴定淫羊藿次苷II葡萄糖醛酸代谢产物,并对该代谢产物进行高效特异地制备及结构表征。
1 仪器与材料
1.1 药品与试剂
淫羊藿次苷Ⅱ(批号150627,纯度98.0%,成都普菲德生物技术有限公司);尿苷二磷酸葡萄糖醛酸(UDPGA,批号069K7017V,美国Sigma-Aldrich公司);聚乙二醇十六烷基醚(Brij 58,批号055K0045,美国Sigma-Aldrich公司);氯化镁(批号20100110,天津市科密欧化学试剂有限公司);Tris碱(批号527K073,北京索莱宝科技有限公司);甲酸(色谱纯,批号A0326132,美国Acros organics公司);盐酸(分析纯,批号20150818,天津市科密欧化学试剂有限公司);人肝微粒体(批号LPS,上海瑞德肝脏疾病研究(上海)有限公司);甲醇和乙腈(色谱纯,美国Fisher Scientific公司);二甲基亚砜(批号14010920,美国TEDIA公司);去离子水(自制)。
1.2 仪器
UFLC色谱仪,LC-30AD高压泵,SPD-20A紫外/可见光检测器,CBM-20A系统控制器,DGU-20A真空在线脱气机,SIL-30AC自动进样器,CTO-30A柱温箱,LabSolutions 5.81数据处理系统(日本SHIMADZU公司);超导核磁共振仪(Avance III 400 MHz,瑞士Brucker 公司);旋转蒸发器(上海申生科技有限公司);涡旋振荡器(LAB DANCER S25,德国IKA公司);低温高速离心机(HERAEUS X1R,美国Thermo Scientific公司);恒温混匀仪(Thermo-Shaker MS-100,美国Thermo Scientific公司);分析天平(BSA224S,赛多利斯科学仪器(北京)有限公司);超纯水制备系统(Milli-Q,美国MILLIPORE公司);制冰机(IMS-20,江苏省常熟市雪科电器有限公司)。
2 方法
2.1 分析条件
色谱柱:VP-ODS C18色谱柱(5 μm,150.0 mm×2.1 mm);柱温:40 ℃;流动相:A(乙腈) 和 B(0.2%甲酸水),流速0.4 mL/min,梯度洗脱程序:0~7.0 min,90% B~10% B;7.0~8.0 min,10% B;8.0~9.0 min,10% B~90% B;9.0~12.0 min,90% B。检测波长:270 nm;进样量:5 μL。
2.2 淫羊藿次苷II葡萄糖醛酸结合代谢途径的鉴定
100 μM淫羊藿次苷Ⅱ,50 mM Tris-HCl缓冲液(pH值7.4),5 mM MgCl2, 2 mM UDPGA,1 mg/mL Brij 58,0.5 mg/mL人肝微粒体蛋白,每个样本体积为200 μL,双样本。37 ℃预孵育3 min,加入UDPGA启动反应,孵育60 min后加入200 μL冰乙腈终止反应,立即涡旋混匀,14000 rpm,4 ℃离心20 min,取上清液置UFLC检测。
2.3 淫羊藿次苷II葡萄糖醛酸代谢产物制备与表征
采用500 μM的淫羊藿次苷II与蛋白浓度为0.5 mg/mL的人重组酶UGT1A1进行代谢产物制备,37 ℃孵育24 h,加入等体积乙腈终止反应,离心移取上清液置旋转蒸发仪中,采用减压蒸发除去有机溶剂。残留液通过SPE固相萃取柱(C18WAX,北京华谱新创科技有限公司)进行富集和选择性洗脱。富集前依次使用甲醇和蒸馏水活化,上样同时检测上样流出液,上样后依次用6 mL水,12 mL甲醇和12 mL含5%甲酸的甲醇进行洗脱,洗脱液采用UFLC进行目标产物监测。所得产物经氘代DMSO溶解后采用1H-NMR、13C-NMR方法进行结构表征。
3 结果
3.1 淫羊藿次苷II葡萄糖醛酸结合代谢途径的鉴定
淫羊藿次苷II在人肝微粒体反应体系中出现一个保留时间为4.6 min的色谱峰,见图1。该色谱峰在不加UDPGA对照组中没有出现。经推测,该色谱峰为淫羊藿次苷Ⅱ-7-O-葡萄糖醛酸化代谢产物。

Figure 1 UFLC chromatograms of icariside Ⅱ and its glucuronide in human liver microsomes
3.2 淫羊藿次苷II葡萄糖醛酸代谢产物结构表征
淫羊藿次苷Ⅱ与其葡萄糖醛酸代谢产物核磁结构表征结果见表1。经鉴定,并与文献对照[16],该代谢产物为7-O-葡萄糖醛酸化产物。
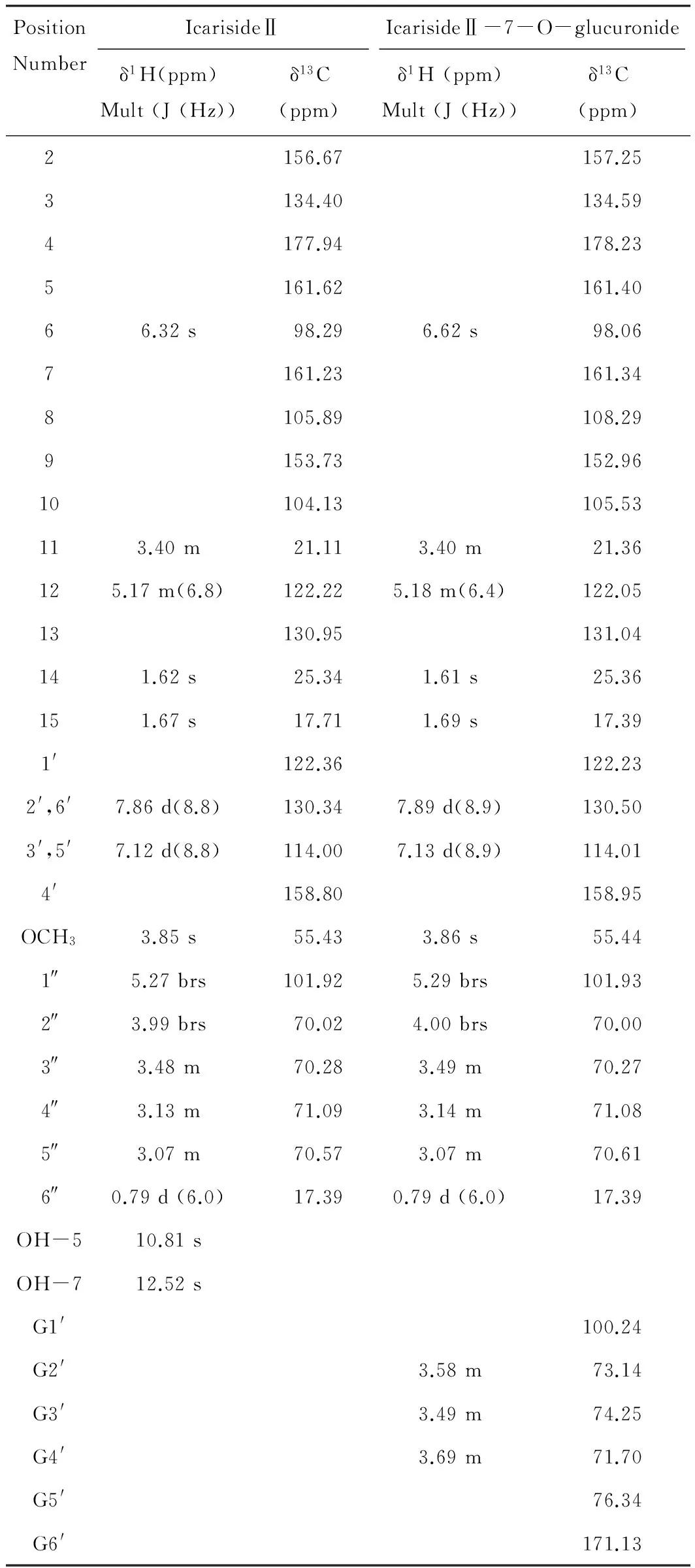
Table.1 1H and 13C NMR data for icarisideⅡ and its glucuronide
4 讨论
葡萄糖醛酸化反应是由尿苷二磷酸葡萄糖醛酸转移酶介导的代谢反应,肝脏是最为重要的葡萄糖醛酸化反应器官,运用肝微粒体可以进行药物体外代谢途径研究,还可以预测药物在体内的清除速率[17]。体外代谢酶归属研究中发现,UGT1A1是肝脏中参与淫羊藿次苷II葡萄糖醛酸代谢的主要UGT酶,所以采用实验室重组表达的UGT1A1高效转化淫羊藿次苷Ⅱ,在37 ℃条件下孵育24 h后底物转化率可达81%。在产物制备过程中,未转化的淫羊藿次苷II可以被甲醇溶液选择性洗脱,代谢产物可以被5%甲酸甲醇溶液选择性洗脱,同样达到了高效特异制备淫羊藿次苷II葡萄糖醛酸代谢产物的目的。
[1] Ma H,He X,Yang Y,et al.The genus Epimedium: an ethnopharmacological and phytochemical review[J].Journal of ethnopharmacology,2011,134(3):519-541.
[2] 赵文静,王历,王芝兰,等.淫羊藿的药理作用及临床应用研究进展[J].中医药信息,2016,33(2):105-108.
[3] 薛迪,杨晓旭,王宇,等.基于性激素样作用的淫羊藿有效组分筛选研究[J].中医药信息,2015,32(5):13-17.
[4] 尹志峰,刘敬闪,张兰桐.淫羊藿苷的含量测定方法[J].中国医院药学杂志,2003,23(8):493-495.
[5] 訾慧,卢健,张红梅,等.淫羊藿提取物中淫羊藿苷及其代谢产物在骨质疏松模型大鼠肾脏中的分布研究[J].中医药信息,2014,31(5):60-63.
[6] 郭宝林,肖培根.5种淫羊藿的不同部位的黄酮类成分分析[J].中国中药杂志,1996,21(9):523-525.
[7] 朱瑞清,李志忠,周建,等.淫羊藿苷及其拟代谢物的雌激素样作用研究[J].中医药学报,2012,40(3):15-20.
[8] 韩惠,单淇,周福军,等.淫羊藿中活性成分的代谢产物研究进展[J].现代药物与临床,2013,28(1):78-81.
[9] Li H.Icariside Ⅱ prevents high-glucose-induced injury on human cavernous endothelial cells through Akt-eNOS signaling pathway[J].Andrology,2015,3(2):408-416.
[10] Zhang D.Herba epimedii flavonoids suppress osteoclastic differentiation and bone resorption by inducing G2/M arrest and apoptosis[J].Biochimie,2012,94(12):2514-2522.
[11] 张玉昆,牛雯颖,姜广坤,等.淫羊藿对雌性大鼠双侧卵巢摘除模型的影响[J].中医药学报,2016,44(3):24-26.
[12] 翟远坤,葛宝丰,陈克明,等.淫羊藿苷与其代谢产物淫羊藿次苷Ⅱ对骨髓间充质干细胞成骨性分化影响的比较研究[J].中药材,2010,33(12):1896-1900.
[13] 姚暄,贾立群,谭煌英,等.补肾壮骨中药对大鼠乳腺癌骨转移模型骨痛及骨质破坏的影响[J].中医药学报,2012,40(2):14-16.
[14] 周欣,翟所迪.选择性磷酸二酯酶5抑制剂治疗阴茎勃起功能障碍的临床评价[J].中国医院用药评价与分析,2009,9(6):408-410.
[15] Cheng T,Zhang Y,Zhang T,et al.Comparative Pharmacokinetics Study of Icariin and Icariside II in Rats[J].Molecules,2015,20(12):21274-21286.
[16] Xia Q.Preparation of icariside II from icariin by enzymatic hydrolysis method[J].Fitoterapia,2010,81(5):437-442.
[17] Sun D.In vitro glucuronidation of Armillarisin A:UDP-glucuronosyltransferase 1A9 acts as a major contributor and significant species differences[J].Xenobiotica,2014,44(11):988-995.
Preparation and Characterization of the Glucuronide of IcarisideⅡMENG
Fan-xing1,LI Yan2,LU Fang1,LIU Shu-min1*
(1.DrugSafetyEvaluationCenter,HeilongjiangUniversityofChineseMedicine,,Harbin150040,China; 2.LaboratoryofPharmaceuticalResourceDiscovery,DalianInstituteofChemicalPhysics,ChineseAcademyofSciences,Dalian116023,China)
Objective:To prepare and characterize the glucuronide of icarisideⅡ. Methods:The incubation system in human liver microsomes was used to identify the glucuronidation of icarisideⅡ. The recombinant UGT1A1 was applied to prepare the glucuronide. The structure of the glucuronide was characterized by NMR spectrometry. Results:The major metabolite of icarisideⅡ was 7-O-glucuronide in human liver microsomes. Conclusion:The method of in vitro incubation can be used to prepare the glucuronide of icarisideⅡ efficiently and specificly.
IcarisideⅡ; Human liver microsomes; Glucuronide; Nuclear magnetic resonance
国家重点基础研究发展计划(973计划)项目(No.2013CB531800)
孟繁兴(1981-),男,博士研究生,主要研究方向:药效物质基础及药物代谢动力学。
刘树民*(1963-),男,博士,教授,博士研究生导师,主要研究方向:中药药性理论及药效物质基础。
2016-02-10
R28
A
1002-2406(2016)05-0004-03
修回日期:2016-03-25
