丹参多酚酸盐对过氧化氢所致乳鼠心肌细胞损伤保护作用的研究
2016-11-29李兵
李兵
(邯郸市中心医院,河北 邯郸 056001)
丹参多酚酸盐对过氧化氢所致乳鼠心肌细胞损伤保护作用的研究
李兵
(邯郸市中心医院,河北 邯郸 056001)
目的:研究丹参多酚酸盐(Salvianolate)对过氧化氢(H2O2)所致乳鼠心肌细胞损伤的保护作用及其机制。方法:分离并培养乳鼠心肌细胞72 h后随机分为空白对照组、H2O2组、丹参多酚酸盐(50、100和200 mg/L)+H2O2组,每组设8个复孔;给药干预24 h后,通过光学显微镜观察细胞形态,MTT法测定细胞存活率;检测细胞中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量,测定培养液中谷草转氨酶(AST)、磷酸肌酸激酶(CPK)、乳酸脱氢酶(LDH)含量;ELISA法测定培养液中TNF-α、IL-1、IL-6含量;通过Flow Cytometry检测细胞凋亡状况并计算细胞凋亡率。结果:与H2O2组比较,丹参多酚酸盐各干预组乳鼠心肌细胞生存状态呈不同程度好转,其中以丹参多酚酸盐(200 mg/L)+H2O2组效果最为显著;丹参多酚酸盐(100和200 mg/L)+H2O2组细胞存活率显著升高,SOD、CAT活性显著升高且MDA含量显著降低,培养液中AST、CPK、LDH含量显著降低,TNF-α、IL-1、IL-6水平均显著降低;丹参多酚酸盐各干预组心肌细胞凋亡状况呈不同程度改善,其中丹参多酚酸盐(100和200 mg/L)+H2O2组凋亡率显著降低,上述差异均具有统计学意义(P<0.05,P<0.01)。结论:丹参多酚酸盐能够通过改善细胞生存状态、提高细胞存活率、降低氧化应激损伤、抑制炎症反应、抑制细胞凋亡而对H2O2所致乳鼠心肌细胞损伤起到保护作用。
丹参多酚酸盐;过氧化氢;乳鼠;心肌细胞;保护
中药丹参为唇形科植物丹参的干燥根及根茎,始载于《神龙本草经》,其味苦、微寒,具有活血通络、祛瘀止痛、凉血消痈、清心除烦之功效,广泛应用于心血管疾病的治疗[1]。丹参多酚酸是中药丹参的主要活性成分之一[2],王强等[3]通过动物实验研究发现,丹参多酚酸能够通过改善抗氧化酶活性、降低氧化应激损伤以及抑制神经细胞凋亡而对脑缺血再灌注损伤大鼠起到保护作用;但丹参多酚酸是否对心肌缺血再灌注损伤后细胞凋亡具有抑制作用尚未见文献报道。本实验将通过过氧化氢(H2O2)诱导制备乳鼠心肌细胞损伤模型,研究丹参多酚酸盐对H2O2所致乳鼠心肌细胞损伤的保护作用,并探讨其可能的作用机制。
1 材料和方法
1.1 药物与试剂
丹参多酚酸盐(上海绿谷制药有限公司,规格:50 mg/瓶,批号150307);DMEM培养基、胎牛血清(美国Gibco公司);甲基四唑蓝(MTT,美国Sigma公司);SOD、CAT、MDA试剂盒(北京博奥森生物技术有限公司);AST、CPK、LDH试剂盒(深圳迈瑞生物医疗电子股份有限公司);ROS 检测试剂盒,AnnexinV-FITC细胞凋亡检测试剂盒,NF-kB单克隆抗体(碧云天生物技术有限公司);TNF-α、IL-1、IL-6检测试剂盒(南京建成生物工程研究所)。
1.2 动物
清洁级雄性SD大鼠1~3 d乳鼠[3],购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003,动物合格证号:1506013。
1.3 主要仪器
VD-650-U型超净工作台(上海楚度仪器设备有限公司);MCO- 175型CO2培养箱(日本三洋集团);UV-1800 PC型紫外-可见分光光度计(广州科晓科学仪器有限公司);BS-300型全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司);Model-680 型酶标仪(美国 BIO-RAD公司);FACS Aria型流式细胞仪(美国BD公司)。
1.4 细胞的分离与培养
参照李澎等[4]报道的实验方法分离和培养乳鼠心肌细胞:于无菌环境下开胸取心脏并剪取心室组织,剪碎后加入0.1%的胰酶后于37℃振荡消化6 min,去上清取沉淀继续用0.1%胰酶于37℃振荡消化6 min,如此循环直至组织碎块消化完毕,收集消化上清液,1500 rpm离心10 min,取沉淀,加入心肌细胞培养基(10%胎牛血清 DMEM,内含105U/L的青霉素和链霉素),吹打均匀,壁立1.5 h。收集未贴壁细胞,调整细胞至6×108个/L,接种于35 mm培养器皿中,37℃,5% CO2,100%湿度,培养72 h后,将状态良好的原代乳鼠心肌细胞随机分为:空白对照组、H2O2组、丹参多酚酸盐(50、100和200 mg/L)+H2O2组,每组设8个复孔;经药物干预24 h后,检测细胞及其培养液中各指标。
1.5 细胞形态的观察
经药物干预24 h后,去培养液取细胞,经PBS溶液冲洗2次后用去离子水洗剂,直至显微镜下细胞间隙清晰止,晾干后通过倒置光学显微镜下观察细胞形态并照相保存。
1.6 细胞存活率的检测
将细胞接种于96孔培养板(n=6),每孔加入20 μl MTT溶液(5 mg/ml),37℃孵育4 h后弃上清,每孔加入150 μl二甲基亚砜(DMSO)振荡15 min后,通过酶标仪检测490 nm处OD值,计算细胞存活率。
细胞存活率(%)=(实验组OD值/空白对照组OD值)×100%
1.7 细胞中SOD、CAT活性和MDA含量的测定
取细胞并通过超声波细胞破碎仪冰浴中破碎后,经低温(4℃)离心取上清液,通过紫外-可见分光光度计平行测定各组细胞裂解液中SOD、CAT活性和MDA含量。
1.8 培养液中AST、CPK、LDH含量的测定
取各组细胞培养液并按照各试剂盒操作方法进行处理后,通过全自动生化分析仪平行测定各组细胞培养液中AST、CPK、LDH含量。
1.9 培养液中TNF-α、IL-1、IL-6含量水平的测定
分别取各组细胞培养液,按照ELISA试剂盒操作步骤:包被、加样、加酶标抗体、加底物液显色、终止反应,通过酶标仪平行测定各组细胞培养液中TNF-α、IL-1、IL-6含量水平。
1.10 细胞凋亡的检测及细胞凋亡率的计算
经0.25%的胰酶消化后离心弃上清液,应用PBS溶液将冲洗2次后,按照细胞凋亡检测试剂盒操作方法步骤依次进行处理后通过Flow Cytometry检测,观察各组细胞凋亡状况并在流式二维图中计算凋亡率。
1.11 统计学处理
2 结果
2.1 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞形态的影响
空白对照组细胞形态及生存状态未见异常:单层簇状生长,伪足多而饱满,搏动明显,节律一致;而H2O2组细胞呈现明显的病理性形态学变化:胞浆出现空泡、伪足减少,细胞脱落、悬浮、溶解坏死,搏动减弱、频率降低、节律不齐等;较H2O2组,丹参多酚酸盐各组乳鼠心肌细胞形态呈不同程度好转,其中以丹参多酚酸盐(100、200 mg/L)+H2O2组效果最为显著,见图1。

图1 各组乳鼠心肌细胞形态注:A:空白对照组;B:H2O2组;C:丹参多酚酸盐(50 mg/L)+H2O2组;D:丹参多酚酸盐(100 mg/L)+H2O2组;E:丹参多酚酸盐(200 mg/L)+H2O2组。
2.2 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞存活率的影响
经MTT检测发现,H2O2组乳鼠心肌细胞存活率较空白对照组显著降低(P<0.01);较H2O2组,丹参多酚酸盐(100、200 mg/L)+H2O2组细胞存活率显著升高(P<0.01),见表1。

表1 各组乳鼠心肌细胞存活率比较±s,n=8)
注:与空白对照组比较,bP<0.01;与H2O2组比较,dP<0.01。
2.3 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞SOD、CAT活性和MDA含量的影响
H2O2组乳鼠心肌细胞SOD、CAT活性较空白对照组显著降低(P<0.01),MDA含量显著升高(P<0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组SOD、CAT活性均显著升高(P<0.05,P<0.01),MDA含量显著降低(P<0.01),见表2。
2.4 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞培养液中AST、CPK、LDH含量的影响
H2O2组乳鼠心肌细胞培养液中AST、CPK、LDH活性较空白对照组显著升高(P<0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组AST、CPK、LDH活性均显著降低(P<0.05,P<0.01),见表3。
2.5 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞培养液中TNF-α、IL-1、IL-6含量水平的影响
H2O2干预组乳鼠心肌细胞培养液中TNF-α、IL-1、IL-6含量水平较空白对照组显著升高(P<0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2干预组培养液中TNF-α、IL-1、IL-6含量水平显著降低(P<0.05,P<0.01),结果见表4。
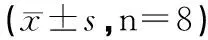
表2 各组乳鼠心肌细胞SOD、CAT活性和MDA含量
注:与空白对照组比较,bP<0.01;与H2O2组比较,cP<0.05,dP<0.01。
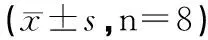
表3 各组乳鼠心肌细胞培养液中AST、CPK、LDH含量
注:与空白对照组比较,bP<0.01;与H2O2组比较,cP<0.05,dP<0.01。
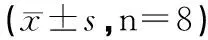
表4 各组乳鼠细胞培养液中TNF-α、IL-1、IL-6水平比较
注:与空白对照组比较,bP<0.01;与H2O2组比较,cP<0.05,dP<0.01。
2.6 丹参多酚酸盐对H2O2损伤乳鼠心肌细胞凋亡的影响
采用Flow Cytometry检测分析发现:H2O2组凋亡细胞数量较空白对照组明显增多;而较H2O2组,丹参多酚酸盐各组乳鼠心肌细胞凋亡状况呈不同程度好转,其中以丹参多酚酸盐(200 mg/L)+H2O2组效果优最为显著,见图2。H2O2组乳鼠心肌细胞凋亡率较空白对照组显著升高(P<0.01);与H2O2组比较,丹参多酚酸盐(100、200 mg/L)+H2O2组细胞凋亡率显著降低(P<0.01),见表4。

表4 各组乳鼠心肌细胞凋亡率±s,n=8)
注:与空白对照组比较,bP<0.01;与H2O2组比较,dP<0.01。
3 讨论
近年来,随着人们生活水平的提高、饮食结构的改变,冠心病及其所诱发的急性心肌梗死的发病率逐年上升,已经发展成为危害人类生命健康的主要疾病之一。临床上通过溶栓、介入手术等治疗手段及时恢复血流供应,能够极大地缓解缺血症状并降低死亡率,但 “再灌注损伤”并发症的存在严重影响着患者愈后[5-11]。近年来,Chen O等[12]和史婷婷等[13]通过动物实验研究发现,再灌后随着氧的大量涌入,氧自由基(ROS)过剩而引发的广泛的氧化应激损伤以及继发的细胞凋亡,是缺血再灌注损伤发生发展的重要病理机制。
Lartigue A等[14]和Jin Y等[15]研究发现,正常生理状态下,体内ROS的生成与清除处于动态平衡,在ROS的还原清除过程中有多种抗氧化酶参与,其中被称为体内防御ROS损伤“第一道屏障”的超氧化物歧化酶(SOD)能够提供氢原子配体而催化还原ROS生成H2O2,并在GSH-Px或CAT的催化作用下进一步还原生成对人无害的H2O和O2,所以SOD、GSH-Px、CAT的活性能够直接反映机体抗氧化能力;而脂质过氧化终产物丙二醛(MDA)的含量也能够间接反映心肌细胞损伤程度。正常生理状态下,血清中心肌酶含量非常低,而当细胞膜受氧自由基攻击而受损后将导致细胞中心肌酶(AST、CPK、LDH)迅速释放入血,导致血清中AST、CPK、LDH活性陡然增高,因此血清中三者的活性水平能够敏感地反映心肌细胞受损程度[16]。细胞凋亡是一种有多种基因参与调控的程序化死亡过程,是一种继发行为,氧化应激损伤是其最重要的诱发因素之一[17-18]。
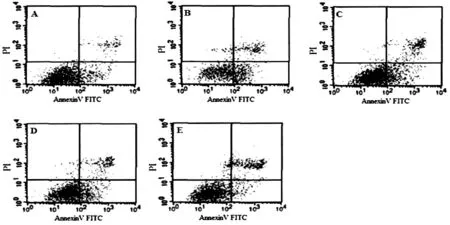
图2 各组细胞凋亡状况注:A:空白对照组;B:H2O2组;C:丹参多酚酸盐(50 mg/L)+H2O2组;D:丹参多酚酸盐(100 mg/L)+H2O2组;E:丹参多酚酸盐(200 mg/L)+H2O2组。
本实验通过过氧化氢诱导损伤乳鼠心肌细胞进行体外研究发现,与H2O2组比较,经丹参多酚酸盐干预24 h能够有效提高H2O2诱导损伤乳鼠心肌细胞存活率,改善SOD、GSH-Px、CAT活性,降低MDA和培养液中心肌酶(AST、CPK、LDH)含量,抑制细胞凋亡,提示丹参多酚酸盐对H2O2所致乳鼠心肌细胞损伤具有保护作用,作用机制可能与其能够有效改善抗氧化酶活性、降低氧化应激损伤、抑制细胞凋亡有关。
[1] 苟占平,吕应年,龚先玲,等.丹参类中药的品种与鉴定研究概述[J].时珍国医国药,2008,19(12):2869-2871.
[2] 温薇.丹参的药理作用及临床应用[J].中医药信息,2007,24(4):54-55.
[3] 王强,张一,李璐,等.丹参多酚酸盐对大鼠脑缺血再灌注过氧化损伤的保护作用[J].右江医学,2010,38(6):665-667.
[4] 李澎,王建农,卢树杰,等.山楂叶原花青素对乳鼠心肌细胞缺血再灌注损伤的保护作用[J].中国中药杂志,2009, 34(1): 96-99.
[5] 裴志萍,牛文革,柴静波,等.黄芪预处理对大鼠肠系膜缺血再灌注损伤保护作用的研究[J].中医药信息,2016,33(3):20-25.
[6] 曹明明,高彦宇,马育轩,等.黄芪化学成分及对心肌缺血再灌注损伤保护作用的研究进展[J].中医药信息,2015,32(3):120-123.
[7] 韩宇博,田苗,郭维毅,等.苓桂术甘汤预防性给药对心肌缺血再灌注损伤NO、NOS含量的影响[J].中医药信息,2014,31(5):84-86.
[8] 马育轩,郭蕊珠,周海纯,等.心肌缺血再灌注损伤的中医药治疗研究进展[J].中医药信息,2013,30(5):116-118.
[9] 张洋,王明春,阿日棍,等.丹参(冻干)粉针对大鼠心肌缺血/再灌注损伤的IL-6和IL-10的影响[J].中医药学报,2016,44(3):30-32.
[10] 马育轩,郭蕊珠,周海纯,等.丹参抗心肌缺血再灌注损伤的研究进展[J].中医药学报,2013,41(5):91-93.
[11] 李冀,曹明明,高彦宇.乌腺金丝桃与丹参配伍对心肌缺血模型动物影响的研究[J].中医药学报,2012,40(1):17-19.
[12] Chen O,Ye Z,Cao Z,et al.Methane attenuates myocardial ischemia injury in rats through anti-oxidative,anti-apoptotic and anti-inflammatory actions[J].Free Radic Biol Med,2015,90:1-11.
[13] 史婷婷,白建平,梁月琴,等.芹菜素对大鼠缺血/再灌注心肌细胞凋亡及相关蛋白Bcl-2、Bax、Caspase-3表达的影响[J].中国药理学通报,2011,27(5):666-671.
[14] Lartigue A, Burlat B, Coutard B, et al. The megavirus chilensis Cu, Zn-superoxide dismutase: the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J].J Virol,2014,2588(14):254-261.
[15] Jin Y, Liu K, Peng J, et al. Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROS-NF-κB signal pathway[J].Toxicol Lett, 2014,232(1):149-158.
[16] 潘蓉,李玲.丹参水提物对心肌缺血/再灌注损伤大鼠心率及心肌酶谱的影响[J].中国实验方剂学杂志,2012,18(4):232-234.
[17] 陈良金,石孟琼,贺海波,等.珠子参总皂苷对H2O2诱导新生大鼠心肌细胞凋亡的抑制作用[J].中国临床药理学与治疗学,2012,17(8):860-867.
[18] 王艳华,张慧萍,田珏,等.NO水平下降通过氧化应激引起人胎盘滋养细胞凋亡[J].中国药理学通报,2014,30(9):1287-1292.
Protective Effect of Salvianolate on Cardiomyocytes Damage of Neonatal Rats Induced by H2O2
LI Bing
(HandanCentralHospital,Handan056001,China)
Objective:To investigate the protective effect of Salvianolate on cardiomyocytes damage of neonatal rats induced by H2O2. Methods:Cardiomyocytes damage of neonatal rats was induced for 72 hours and they were divided into the following groups: normal control group, H2O2group, Salvianolate (50, 100, 200 mg/L)+H2O2groups(n=8). Twelve hours after the drugs were given,and the morphology changes were observed; the survival rate was detected by MTT; the activities of SOD, CAT and the content of MDA in cardiomyocytes were determinted; the activities of AST, CPK, LDH in culture medium were detected; the levels of TNF-α, IL-1 and IL-6 were detected by ELISA; the cardiomyocytes apoptosis was observed by flow cytometry and the apoptosis rate was calculated. Results:Compared with H2O2group, the morphology in Salvianolate groups was significantly improved; the survival rates in Salvianolate (100, 200 mg/L)+H2O2groups were significantly increased; the activities of SOD, CAT in cardiomyocytes were significantly increased and the contents of MDA were significantly decreased; the activities of AST, CPK, LDH in culture medium were significantly decreased; the levels of TNF-α, IL-1, IL-6 were significantly decreased; the cardiomyocytes apoptosis was improved and the apoptosis rates were significantly decreased. All of the differences were significant(P<0.05,P<0.01). Conclusion:Salvianolate can effectively improve morphology, improve the activity of antioxidase, depress oxidative stress and inhibit inflammatory response, suggesting that Salvianolate has a protective effect on cardiomyocytes damage of neonatal rats induced by H2O2.
Salvianolate; H2O2; Neonatal rats; Cardiomyocytes; Protection
河北省卫生厅重点科技研究计划项目(No.20130359)
李兵(1978-),男,主治医师,主要研究方向:急诊内科疾病研究。
2016-01-27
R285.5
A
1002-2406(2016)05-0007-05
修回日期:2016-02-10
