抗胆碱酯酶联合免疫抑制剂治疗眼肌型重症肌无力临床分析
2016-11-29王昆祥慧孟淑红张春野
王昆祥 杨 慧孟淑红 张春野
佳木斯大学附属第一医院 1)神经二科 2)儿科 3)急诊科 佳木斯 154002
抗胆碱酯酶联合免疫抑制剂治疗眼肌型重症肌无力临床分析
王昆祥1)杨 慧1)孟淑红2)张春野3)
佳木斯大学附属第一医院 1)神经二科 2)儿科 3)急诊科 佳木斯 154002
目的 观察抗胆碱酯酶联合免疫抑制剂在眼肌型重症肌无力临床治疗中的效果。方法 80例眼肌型重症肌无力患者随机分为A组和B组,A组采用他克莫司+溴吡斯的明治疗,B组采用硫唑嘌呤+溴吡斯的明治疗。比较2组治疗效果,治疗前后眼球活动障碍改善情况,治疗前后AchR-QM、AchR-HM滴度变化情况。结果 A组总有效率87.5%,B组总有效率65%,A组总有效率显著高于B组(P<0.05)。A组治疗后患者眼球活动受限评分显著低于B组,差异有统计学意义(P<0.05)。2组治疗后AchR-QM、AchR-HM滴度显著低于治疗前,A组改善效果更显著(P<0.05)。结论 他克莫司联合溴吡斯的明治疗眼肌型重症肌无力临床效果显著,可显著改善眼球活动障碍。
他克莫司;溴吡斯的明;硫唑嘌呤;重症肌无力
重症肌无力是指神经-肌肉接头传递功能障碍的一种获得性自身免疫性疾病,主要由乙酰胆碱受体抗体介导[1],细胞免疫依赖,补体参与破坏神经-肌肉接头突出后膜上的乙酰胆碱受体而致病。患者临床表现为部分/全身骨骼肌无力,或极易疲劳,症状易波动,在活动后加重,给予抗胆碱酯酶治疗或休息后减轻,严重影响患者的劳动能力及生活质量[2-3]。本研究选择我院2009-12—2013-12收治的80例重症肌无力患者为研究对象,观察抗胆碱酯酶联合免疫抑制剂治疗的临床效果,现报道如下。
1 资料与方法
1.1 一般资料 本次研究对象为我院2009-12—2013-12收治的80例重症肌无力患者,入院时均符合重症肌无力的临床诊断标准[4],并经电生理、抗乙酰胆碱受体抗体检查、新斯的明试验等确诊。采用简单随机分组法将80例患者随机分为A组和B组各40例。A组男24例,女16例,男:女=1.5;年龄18~80岁,平均(49.5±4.6)岁;单纯上睑下垂28例,单纯眼外肌麻痹1例,上睑下垂伴眼外肌麻痹11例。B组男23例,女17例,男:女=1.35;年龄19~80岁,平均(49.6±4.2)岁;单纯上睑下垂29例,单纯眼外肌麻痹1例,上睑下垂伴眼外肌麻痹10例。2组患者性别、年龄等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准 经病史、体征、新斯的明试验、疲劳试验、肌电图检查确诊为重症肌无力;治疗期间未同时合并其他疾病,治疗前无肌无力危象及肌萎缩。初发表现为单侧/双侧眼肌型重症肌无力。
1.3 排除标准 排除胸腺瘤及胸腺增大需行手术治疗的患者,排除重症肌无力危象患者,排除合并心、肝、肾、造血系统等严重原发性疾病患者,排除过敏体质患者。
1.4 治疗方法 2组患者均采用抗胆碱酯酶+免疫抑制剂治疗。A组采用他克莫司+溴吡斯的明治疗,给予他克莫司1 mg/次,1次/d,口服,连续治疗5 d。再增量至1 mg/次,2次/d,连续治疗5 d。1个月后检测他克莫司血药浓度,结合患者重症肌无力严重程度、肝肾功能等调整他克莫司剂量,调整为2~6 mg/d,餐前1 h口服。溴吡斯的明60~120 mg,每3~4 h口服1次。
B组采用硫唑嘌呤+溴吡斯的明治疗。硫唑嘌呤初始剂量为50 mg/d,每周增加50 mg至药物剂量达150 mg/d。溴吡斯的明用法同A组。
1.5 观察内容 参考Vrinten C的相关标准判定治疗效果[5],即:治疗后患者肌无力症状基本消失,临床症状、体征显著好转,治疗药物减少超过50%,1个月以上患者未见复发为显效;治疗后,患者肌无力症状部分好转,临床症状、体征有所改善,治疗药物减少超过25%,1个月以上未见复发为有效;治疗后患者肌无力症状未见好转,临床症状、体征未见改善甚至恶化为无效。
参考卫生部北京医院关于眼球活动受限计分法判定治疗前后眼球活动改善情况[6]。外展露白+内收露白≤2 mm为0分;2 mm<外展露白+内收露白≤4 mm记为1分;4 mm<外展露白+内收露白≤8 mm记为2分;8 mm<外展露白+内收露白≤12 mm记为3分;外展露白+内收露白>12 mm记为4分。
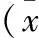
2 结果
2.1 2组疗效比较 A组治疗总有效率为87.5%,B组为65%。A组总有效率显著高于B组(P<0.05)。见表1。

表1 2组疗效比较 [n(%)]
2.2 2组治疗前后眼球活动障碍改善情况比较 2组治疗前眼球活动受限评分差异无统计学意义(P>0.05),治疗后2组评分均显著低于治疗前,且A组改善情况更显著(P<0.05)。见表2。

表2 2组治疗前后眼球活动受限评分比较±s,分)
注:与本组治疗前比较,*P<0.05,与B组比较,△P<0.05
2.3 2组治疗前后AchR-QM、AchR-HM滴度变化情况比较 2组治疗后AchR-QM、AchR-HM滴度显著低于治疗前,A组改善效果更显著(P<0.05)。见表3。
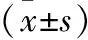
表3 2组治疗前后AchR-QM、AchR-HM滴度变化
注:与治疗前比较,*P<0.05,与B组比较,△P<0.05
3 讨论
3.1 重症肌无力发生机制 重症肌无力病因及发病机制复杂,至今尚未完全阐清。可能与下列因素有关:(1)乙酰胆碱抗体可通过与AchR结合物引起吞噬作用,使AchR降解加快,从而使突触后膜AchR数量不足,导致终板功能破坏;与AchR结合形成膜攻击复合体,使抗体触发补体瀑布链,引起突触后膜溶解。(2)肌肉特异性激酶作为神经末梢分泌的集聚素受体,而集聚素可诱导AchR聚合成束,利于Ach与AchR间发生最佳相互作用。血清中抗MuSK抗体可干扰AchR聚合束的形成,血清MuSK抗体阳性与MG起病早晚、性别差异存在一定相关性[7]。眼肌型重症肌无力为临床症状最轻,发病早期的重症肌无力,眼肌型重症肌无力患者首发症状多为上睑下垂及复视,约85%的患者在病程中可有眼外肌受累症状[8],且肌无力可累及面肌、咽喉部肌肉,使患者出现构音障碍、吞咽困难、颈部肌肉无力、面部表情受限等表现。值得注意的是,50%~60%的眼肌型重症肌无力患者[9],可发展为全身型重症肌无力,且大多数患者在发病后1~2 a内转化为全身型重症肌无力,给患者的工作及日常生活带来极大影响。
3.2 重症肌无力临床治疗 重症肌无力临床治疗方法多种多样,包括糖皮质激素疗法、免疫抑制剂、血浆置换、胸腺切除、胆碱酯酶抑制剂等。多数学者认为糖皮质激素联合胆碱酯酶抑制剂为有效的常规治疗方法[10],不仅改善眼部临床症状,也可预防2 a内向全身型重症肌无力转化。本研究中分别采用他克莫司与硫唑嘌呤免疫抑制剂+溴吡斯的明抗胆碱酯酶药物治疗,A组治疗效果优于B组,分析原因可能与药物药理特点有关,即硫唑嘌呤为6-巯基嘌呤的咪唑衍生物,为具有免疫抑制作用的抗代谢剂,可通过产生烷基化作用,阻断SH族群,抑制核酸生物合成,防止细胞增生,引起DNA损害。他克莫司为亲免素结合剂,可通过抑制辅助性T细胞活性,发挥明显的免疫抑制作用。国内外的临床应用显示,全身型MG患者接受他克莫司治疗1个月、3个月、6个月、12个月总有效率为81.2%、87.6%、92.2%、93.8%。且他克莫司可减少患者激素剂量,疗效及起效时间均显著优于硫唑嘌呤。
本组研究中比较了2组AchR-Ab(乙酰胆碱受体抗体)滴度水平,为目前国内外公认的诊断重症肌无力及判断重症肌无力治疗效果的评定标准,包括AchR-QM(抗乙酰胆碱受体抗体前膜)与AchR-HM(抗乙酰胆碱受体抗体后膜)。结果显示,A组滴度较B组及治疗前显著下降,提示他克莫司+溴吡斯的明治疗眼肌型重症肌无力可显著改善体液免疫血AchR-Ab滴度水平。2组治疗前后眼球活动障碍改善情况差异有统计学意义,提示两种治疗方案均可改善眼球活动障碍,且A组改善情况更显著。
综上所述,他克莫司联合溴吡斯的明治疗眼肌型重症肌无力临床效果显著,可显著改善眼球活动障碍,但对患者免疫功能的影响尚有待进一步研究。
[1] 马良赟,伍硕允,陈志锦,等.重症肌无力的围手术期抗胆碱酯酶药物的应用[J].中华胸心血管外科杂志,2003,19(1):42.
[2] Boldingh MI,Dekker L,Maniaol AH,et al.An up-date on health-related quality of life in myasthenia gravis -results from population based cohorts[J].Health Qual Life Outcomes,2015,13(1):115.
[3] Badachi S,Sarma GR,Mathew T,et al.Rare case of myasthenia gravis associated with situs inversus totalis:Implications in management[J].Neurol Indi,2015,63(4):561-563.
[4] Sun1 L,Xing L,Zhang GH,et al.A new method to induce myasthenia gravis models and the protective effect of soluble decay accelerating factors[J].Genet Mol Res,2015,14(3):7 782-7 792.
[5] Vrinten C,Lipka AF,van Zwet EW,et al.Ephedrine as add-on therapy for patients with myasthenia gravis:protocol for a series of randomised,placebo-controlled n-of-1 trials[J].BMJ Open,2015,5(7):e007 863.
[6] Wang L,Zhang Y,He M.Study of the association of β2-adrenergic receptor gene polymorphism with Myasthenia Gravis associated with thymus abnormality[J].Zhonghua Yi Xue Za Zhi,2015,95(19):1 518-1 521.
[7] Malkki H.Improved diagnostic sensitivity can aid the correct choice of treatment for patients with myasthenia gravis[J].Nat Rev Neurol,2015,11(8):428.
[8] 王志强,张志坚.重症肌无力的新型免疫抑制剂研究进展[J].医学综述,2008,14(10):1 550-1 552.
[9] Zhang Y,Zhao J,Zhu Z,et al.Over-expression of CCL21 up-regulates the antigen presentation-related genes of CK8/18 positive thymic epithelial cells in patients with myasthenia gravis[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2015,31(7):957-960.
[10] Wang CC,Li H,Zhang M,et al.Caspase-1 inhibitor ameliorates experimental autoimmune myasthenia gravis by innate dendric cell IL-1-IL-17 pathway[J].J Neuroinflammation,2015,12(1):118.
(收稿2015-11-10)
R743.33
A
1673-5110(2016)21-0053-02
