促红细胞生成素对脊髓源性神经干细胞分化能力的影响
2016-11-28李小波王少滨杜怡斌尹宗生
李小波,张 辉,王少滨,刘 杰,余 涛,杜怡斌,尹宗生
促红细胞生成素对脊髓源性神经干细胞分化能力的影响
李小波1,张 辉1,王少滨2,刘 杰1,余 涛1,杜怡斌1,尹宗生1
目的 探讨成体大鼠脊髓源性神经干细胞(NSCs)在促红细胞生成素(EPO)的作用下体外分化的形态学表现,为成体脊髓源性NSCs移植治疗脊髓损伤提供理论基础。方法 利用无血清悬浮培养,体外分离培养SD大鼠脊髓源性NSCs,随后以含血清培养基贴壁诱导分化培养7 d,行免疫细胞化学染色,以抗巢蛋白(Nestin)鉴定NSCs,以抗微管相关蛋白2(MAP2)和胶质纤维酸性蛋白(GFAP)免疫荧光染色检测NSCs的分化情况。选取第3代NSCs,向培养基中添加EPO, 使EPO的终浓度为10 IU/ml,并设不添加EPO的对照组,免疫荧光共聚焦显微镜下分别观察并计数各组神经元/细胞总数得出百分率。结果 SD大鼠脊髓组织体外悬浮培养可获得大量神经球,所获得的神经球均表达Nestin蛋白,以含血清培养基贴壁诱导分化培养,可检测出MAP2和GFAP阳性细胞;EPO组诱导分化后,表达MAP2阳性细胞较对照组显著提高(P<0.05)。结论 SD大鼠脊髓体外培养可获得NSCs,EPO可促进成体脊髓源性NSCs向神经元方向分化。
神经干细胞;促红细胞生成素;神经元;分化
脊髓损伤是骨科临床工作中一种常见损伤,随着医学的发展和进步,其死亡率已经明显降低,但致残率仍很高,主要原因是损伤后神经功能的恢复目前医学界仍没有行之有效的治疗措施。神经干细胞(neural stem cells,NSCs)是能够自我更新、增殖和分化的一类细胞,有产生神经元和胶质细胞的多向分化潜能,在神经系统的损伤方面具有巨大的前景,应用NSCs移植治疗脊髓损伤也一直是当前的主导研究方向,但研究[1]表明移植的NSCs生理状态下神经生发的比例很低,大部分会分化成为胶质细胞形成瘢痕,阻碍损伤脊髓的恢复。促红细胞生成素(erythropoietin,EPO)是一种水溶性的糖蛋白,可促进红系祖细胞增殖、分化以及成熟。近来有研究[2]显示EPO还可以降低神经元对低氧缺血的敏感性,增强神经元的存活能力等神经保护作用。该实验拟通过对EPO调控大鼠脊髓源性NSCs分化方向的研究,为提高神经生发比例探索新的途径,为NSCs移植治疗脊髓损伤提供新的研究方向。
1 材料与方法
1.1 材料 SD大鼠,SPF级,7~9 d龄,由安徽医科大学实验动物中心提供。DMEM/F12(1 ∶1)培养基、B27、左旋多聚赖氨酸、左旋谷氨酸、胎牛血清均购自美国Gibco公司;表皮生长因子(epidermal growth factor,EGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)均购自美国Peprotech公司;大鼠抗巢蛋白(Nestin)抗体、小鼠抗微管相关蛋白2(microtubule associated protein,MAP2)抗体均购自美国Santa Cruz公司;兔胶质纤维酸性蛋白(glialfibrillary acidic protein,GFAP)抗体、山羊抗小鼠IgG/FITC、山羊抗兔IgG/TRITC均购自北京中杉金桥生物技术有限公司;24孔板购自美国 Corning公司。
1.2 方法
1.2.1 脊髓源性NSCs的体外培养和鉴定
1.2.1.1 NSCs的分离、培养 参考文献[3]方法,7~9 d龄SD大鼠,以颈椎脱臼法处死,置于75%酒精中浸泡5 min消毒。消毒后在超净台内剪开背部皮肤,经椎管剪开,显露脊髓组织;取出胸腰段脊髓,剥离组织表面的血管和脊膜,眼科剪剪碎至0.5 mm3大小;反复吹打后200目钢网滤去组织杂质,收集悬液,以1 000 r/min离心5 min,弃上清液;沉淀用NSCs培养基重悬,以1×106/ml细胞密度接种于培养瓶;37 ℃、5% CO2培养箱培养,每2~3 d加入NSCs培养液,约7~9 d以机械吹打法传代。
1.2.1.2 NSCs的Nestin免疫染色鉴定 参考文献[4]方法,取生长状态良好的第3代细胞,接种至24孔培养板中(预置有涂布100 μg /ml多聚赖氨酸的盖玻片),40 g/L多聚甲醛固定20 min,PBS 1 ml/孔,漂洗3次,5 min/次,0.5% Triton X-100破膜10 min,PBS 1 ml/孔,漂洗3次,5 min/次,10%山羊血清封闭后置于37 ℃、5% CO2培养箱孵育1 h,吸弃山羊血清,滴加小鼠抗Nestin(1 ∶200)一抗,4 ℃冰箱过夜,PBS 1 ml/孔,漂洗3次,5 min/次,加入二抗山羊抗小鼠IgG /FITC (1 ∶100),37 ℃、5% CO2培养箱避光孵育1 h,PBS 1 ml/孔,漂洗3次,5 min/次,加入10 μg/ml Hoechst核染5 min,PBS 1 ml/孔,漂洗3次,5 min/次,封片,倒置荧光显微镜下观察并拍照。
1.2.1.3 神经干细胞分化免疫化学染色 将NSCs接种于24孔培养板中(预置有涂布多聚赖氨酸的盖玻片),每孔平均接种30个神经球,加入含有10%胎牛血清(FBS)的NSCs培养液500 μl, 37 ℃、5% CO2培养箱中静置培养,每2~3 d换液1次,7 d后终止培养,收集贴有细胞的盖玻片,分别做MAP-2、GFAP免疫荧光染色,免疫荧光显微镜下观察并拍照。
1.2.2 EPO掺入实验
1.2.2.1 实验分组 取第3代NSCs悬液接种于添加EPO的无血清培养基中,使EPO的终浓度为10 IU/ml,另设不加EPO的对照组,37 ℃、5% CO2的恒温培养箱中静置培养,待形成神经球后,将EPO组和对照组分别接种于含10% FBS的分化培养基中,贴壁分化7 d。每组实验重复3次。
1.2.2.2 MAP2免疫荧光染色 两组NSCs贴壁分化7 d,分别行MAP2免疫荧光染色。然后在荧光显微镜下观察并拍照,每组随机取20个视野,计数MAP2阳性细胞数占细胞总数的百分率,然后进行统计学分析。每组实验重复3次。

2 结果
2.1 NSCs鉴定
2.1.1 倒置相差显微镜下观察结果 原代分离的NSCs呈单个悬浮状,分散存在, 3~4 d后细胞逐渐聚集生长形成体积大小不一、形状不规则的细胞团(图1A),待培养至7~9 d,细胞团逐渐增大至典型的球形 (图1B),部分体积较大细胞球的中心部位折光性差,颜色偏深,周边边境清晰,考虑可能为中心死亡细胞释放毒性物质及周边细胞阻碍营养吸收有关,此时细胞生长速度较慢,可用机械吹打法行细胞传代。
2.1.2 免疫细胞化学染色 收集生长状态良好的第3代神经球,Hoechst标记细胞核(图2A),并行Nestin抗体免疫化学染色,结果显示Nestin蛋白在NSCs胞质内呈阳性表达,神经球被染成绿色(图2B),提示细胞球为神经干细胞球。

图1 NSCs培养过程中的形态 ×200

图2 NSCs的Nestin鉴定 ×200
贴壁分化培养7 d,普通光学显微镜下可见神经球周缘细胞向外迁移,突起呈放射状延伸(图3A),MAP2:免疫荧光显微镜下可见在部分细胞及突起中呈阳性表达,被染成绿色(图3B),GFAP:免疫荧光显微镜下可见在部分细胞及突起中呈阳性表达,被染成红色(图3C)。
2.2 EPO作用下MAP2免疫化学染色 贴壁分化7 d后,两组NSCs分别行MAP2免疫化学染色,在荧光显微镜下,每组随机取20个视野,计算神经元分化比率,结果显示对照组为(12.70±2.74)%,EPO组为(33.85±5.54)%,两组比较差异有统计学意义(t=12.744,P<0.01)。见图4。
3 讨论
本实验探讨了EPO对成体脊髓源性NSCs分化的调控作用,通过分离培养成体脊髓组织,体外成功获得大量悬浮生长的神经球。免疫化学染色显示神经球呈Nestin阳性,而Nestin目前是公认的NSCs标志物[5],表明本实验培养的细胞为NSCs。在添加10%FBS的培养基中NSCs贴壁分化7 d后,行免疫组化染色显示分化细胞中可见MAP2阳性和GFAP阳性细胞,表明成体脊髓源性NSCs体外培养,有分化为神经元和星形胶质细胞的能力。以上结果初步证实了从成体脊髓组织分离培养的细胞具有自我更新和多向分化的潜能,具备了NSCs的基本属性,为NSCs的定向分化和移植研究提供了良好应用价值的实验材料。
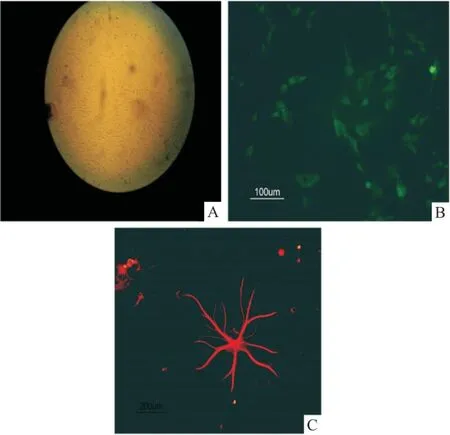
图3 NSCs分化
A:神经球贴壁分化7 d(普通光镜) ×200;B:神经球贴壁分化7 d,免疫细胞化学示MAP2阳性细胞(免疫荧光显微镜) ×200;C:神经球贴壁分化7 d,免疫细胞化学示GFAP阳性细胞(免疫荧光显微镜) ×100

图4 对照组和EPO组MAP2免疫化学染色 ×200
A:神经元Hochest细胞核染色;B:神经元MAP2染色;1:对照组;2:EPO组
自1992年Reynolds et al[6]首先报道培养获得NSCs以来,NSCs在神经损伤修复方面已经取得了明显的进展,但相关研究主要集中在胚胎源性NSCs应用于脑组织方面,而对于成体脊髓源性NSCs在脊髓组织的研究则相对较少[7],从某种意义上来说成体脊髓源性NSCs的临床意义可能更大,因为在中国神经损伤更多发于成年人,据不完全统计,现有截瘫患者约40万,每年新增约1万患者,这些患者中大约有82%是16~32岁的青壮年男性。而且近来的研究[8]表明,神经生发区如前脑室下带和海马齿状回的亚颗粒带等区域存在较多的NSCs,而在非神经生发区如纹状体、脊髓、小脑等虽然也存在NSCs,但数量很少,并且它们在体内主要生成胶质细胞,而脊髓损伤的功能恢复主要依靠分化的神经元重建神经通路,但大量分化为胶质细胞会阻碍通路的重建,因此应用成体脊髓源性NSCs修复神经损伤,促进NSCs向神经元方向定向分化,尤其是对NSCs发生与分化的调控因素及其调控机制的研究已逐渐成为当前的热点。
EPO是一种调节细胞生成的体液因子,其主要的生理功能是促进红系祖细胞增生和分化进而调节红细胞生成,近年来不断有研究[9-10]表明EPO还有非促红细胞生成的作用,主要表现抗炎症、抗凋亡以及神经保护等方面。其实EPO对体外培养的NSCs功能影响的实验研究并不新鲜,已有相关文献[11]报道EPO可抑制NSCs凋亡、促进其增殖及向神经元方向的定向分化,但目前的研究基本集中于胎鼠的脑组织,对成体脊髓源性NSCs研究甚少。本实验以此作为研究背景,采用成体脊髓源性NSCs为实验对象,以10 IU/ml EPO作用于体外培养的NSCs,观察NSCs的分化方向。结果提示,与对照组相比,EPO组的NSCs向神经元方向分化的比例显著提高。不过对于EPO如何调控NSCs向神经元方向分化却鲜有文献进行报道,目前的研究[12-14]表明NSCs分化的调控机制主要与以下3个方面有关:微环境、基因和信号通路。本研究表明体外培养条件下EPO可以促进成体脊髓源性NSCs向神经元方向分化,可能的原因为EPO与NSCs表面的EPO-R结合后诱导Jak2磷酸化,然后进一步激活下游的信号传导通路来调控神经干细胞的分化方向。下一步将从信号通路方面深入探讨EPO促进脊髓源性NSCs向神经元方向分化的机制。
综上所述,成体大鼠脊髓组织体外分离培养可成功获得能增殖、传代并且有分化潜能的NSCs,EPO可促进体外培养的成体脊髓源性NSCs向神经元方向定向分化,为进一步研究EPO促进NSCs的分化机制及NSCs移植治疗脊髓损伤等提供理论基础和实验依据。
[1] Pluchino S,Cusimano M,Bacigaluppi M,et al.Remodelling the injured CNS through the establishment of atypical ectopic perivascular neural stem cell niches[J].Arch Ital Biol,2010,148(2):173-83.
[2] Yu X,Shacka J J,Eells J B,et al.Erythropoietin receptor signaling is required for normal brain development[J].Development,2002,129(2):505-16.
[3] Yin Z S,Zhang H,Wang W,et al.Wnt-3a protein promote neuronal differentiation of neural stem cells derived from adult mouse spinal cord[J].Neurol Res, 2007 ,29(8):847-54.
[4] 张 硕,杜怡斌,杜公文,等. 骨髓源性EPCs对脊髓源性NSCs增殖分化的影响[J].安徽医科大学学报,2015,50(1):20-4.
[5] Ke C L,Chen B L,Guo S L,et al.Differentiation of embryonic versus adult rat neural stem cells into dopaminergic neuronsinvitro[J].Neural Regen Res,2008,3(8):832-6.
[6] Reynolds B A,Weiss S.Generation of neurons and astrocytes from isolated cells of the adult mamrnalian central nervous system[J]. Science,1992,255(5052):1707-10.
[7] Bellenchi G C,Volpicelli F,Piscopo V,et al.Adult neural stem cells:an endogenous tool to repair brain injury[J].J Neurochem,2013,124(2):159-67.
[8] Song H,Stevens C F,Gage F H.Astroglia induce neurogenesis from adult neural stem cells[J].Nature,2002,417(6884):39-44.
[9] Sinor A D,Greenberg D A.Erythropoietin protects cultured cortical neurons,but not astroglia,from hypoxia and AMPA toxicity[J].Neuronsci Lett,2000,290(3):213-5.
[10] Siren A L,Fratelli M,Brines M,et al.Erythropoietin prevents neuronal apoptosis after cerebral ischemia and metabolic stress[J].Proc Natl Acad Sci USA,2001,98(7):4044-9.
[11] 赵舒武,高英茂,张晓丽,等.EPO对体外培养的神经干细胞增殖、分化和凋亡的影响[J].神经解剖学杂志,2007,23(5):549-53.
[12] Seki T.Microenvironment elements supporting adult hippocampal neurogenesis [J].Anat Sci Int,2003,78(2):69-78.
[13] Nieto M,Schuurmans C,Britz O,et al.Neural bHLH genes control the neuronal versus glial fate decision in cortical progenitors[J].Neuron,2001,29(2):401-13.
[14] Gaiano N, Nye J S,Fishell G.Radial glial identity is promoted by Notch1 signaling in the murine forebrain[J].Neuron,2000,26(2):395-404.
Li Xiaobo1, Zhang Hui1, Wang Shaobin2, et al
Effect of erythropoietin on the differentiation of adult spinal cord-derived neural stem cellsinvitro
(1Dept of Orthopaedics,The First Affiliated Hospital of Anhui Medical University,Hefei 230022;2DeptofOrthopaedics,TheFourthAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022)
Objective To investigate the promotion of the differentiation of erythropoietin(EPO) on the differentiation of the neural stem cells(NSCs)invitrofrom spinal cord of SD rats,and to provide experimental basis for the treatment of spinal cord injury by transplantating neural stem cells.Methods The spinal cord was isolated and cultured in serum-free suspension, then a differentiation suspension cultured in serum culture medium for 7 days was applied to the NSCs.Nestin was used to detect the NSCs,the differentiation ratio of NSCs into neurons and glia cells was detected by immunofluorescent histochemistry for microtubule-associated protein 2(MAP2) and glia fibrillary acid protein (GFAP).After obtained the third passage (P3) of NSCs, EPO was added to the medium on a final concentration of 10 IU/ml,control group without EPO, the differentiation proportion of MAP2-positive cells to total cells was identified by immunofluorescence staining.Results The results showed that the separated cells from spinal cord of SD rats formed neurospheres, in which nestin-positive cells were detected. GFAP and MAP2-positive cells were detected after differentiation culture.The proportion of MAP2-positive cells in the EPO group showed an significant increase compared with the control group(P<0.05).Conclusion The results indicate that NSCs can be obtained from the separated spinal cord of SD rats; EPO can increase the differentiation rate of NSCs into neurons.
neural stem cells;erythropoietin; neuron;differentiation
时间:2015-12-30 14:38
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.008.html
国家自然科学基金 (编号:81171173)
1安徽医科大学第一附属医院骨科,合肥 230022
2安徽医科大学第四附属医院骨科,合肥 230022
李小波,男,硕士研究生;
尹宗生,男,教授,主任医师,博士生导师,责任作者,E-mail:yinzongsheng1961@sina.com
R 651.21
A
1000-1492(2016)01-0014-04
2015-09-30接收
