TLR4乙酰化对LPS-TLR4-NF-κB通路的影响及其在妊娠期糖尿病发病机制中的作用
2016-11-28方慧琴
李 松,丛 林,袁 静,方慧琴,陈 薇,李 琴,杨 琴
TLR4乙酰化对LPS-TLR4-NF-κB通路的影响及其在妊娠期糖尿病发病机制中的作用
李 松,丛 林,袁 静,方慧琴,陈 薇,李 琴,杨 琴
目的 研究Toll样受体4(TLR4)乙酰化在妊娠期糖尿病(GDM)孕妇外周血单核细胞(PBMC)中的表达及其在内毒素(LPS)-TLR4-核因子κB(NF-κB)通路中的作用,进一步探讨GDM的炎症发病机制。方法 选取正常孕妇、GDM孕妇各30例,抽取静脉血15 ml,密度梯度离心法分离PBMC进行体外培养,并保留血清用于检测LPS的量;将研究分成正常组(对照组)、正常+LPS组、GDM组和GDM+LPS组。PBMC用于免疫共沉淀法、Western blot法检测TLR4乙酰化和NF-κB蛋白的表达量;上清液用于ELISA法检测炎症因子肿瘤坏死因子α(TNF-α)、白介素-1(IL-1)、白介素-10(IL-10)的水平。结果 正常孕妇、GDM孕妇体内LPS量的差异有统计学意义(P<0.05)。GDM组发生TLR4乙酰化变化,而对照组未检测到TLR4乙酰化;LPS干预后,正常+LPS组、GDM+LPS组TLR4乙酰化的程度明显增加,且GDM+LPS组TLR4乙酰化程度明显高于GDM组和正常+LPS组,差异有统计学意义(P<0.05)。4组NF-κB的表达和炎症因子TNF-α、IL-1、IL-10水平的差异均有统计学意义(P<0.05)。各组TLR4乙酰化与NF-κB蛋白表达量之间具有正相关性(P<0.05)。 结论 TLR4乙酰化通过影响LPS-TLR4-NF-κB通路的活化介导炎症因子的释放,促进孕妇体内抗炎-致炎的失衡,从而参与GDM的发生。
妊娠期糖尿病;炎症;Toll样受体4;乙酰化
妊娠期糖尿病(gestational diabetes mellitus,GDM)的发病率在逐年上升,其近、远期并发症给母儿健康带来了严重的危害。为预防和治疗GDM,其发病机制的研究显得尤为重要。目前认为,胰岛功能受损、胰岛素抵抗(insulin resistant,IR)是GDM的主要病因。GDM孕妇体内慢性炎症状态、抗炎-致炎失衡、Toll样受体(Toll-like receptor,TLR)途径等参与了胰岛功能受损和IR的形成过程[1-2]。GDM也被认为是一种慢性炎症性疾病。TLR4过度表达导致的机体异常炎症反应状态已成为许多炎症性疾病的病理基础[3]。前期研究[4]证实内毒素(lipopolysaccharide,LPS)- Toll样受体4(TLR4)-核因子κB(nuclear factor-κB,NF-κB)通路激活导致的炎症因子的释放可能参与了GDM的发病。蛋白质乙酰化是一种动态可逆的翻译后修饰,在调控蛋白质功能上具有简单的开关作用[5-6]。文献[7]报道,经LPS刺激培养后,单核细胞内TLR4可发生乙酰化,并且正向调控炎症通路的激活及炎症因子的表达。目前关于TLR4乙酰化在GDM体内是否表达并发挥一定作用仍不明确。该研究旨在通过探讨TLR4乙酰化在LPS-TLR4-NF-κB通路中的作用,进一步阐述GDM的炎症发病机制。
1 材料与方法
1.1 病例资料 选取在安徽医科大学第一附属医院内分泌实验室行口服葡萄糖耐量实验(OGTT)的妊娠24~28周的孕妇为研究对象,GDM孕妇、正常孕妇各取30例。GDM的纳入采用国际妊娠期糖尿病研究组(IADPSG)诊断标准[8],同时排除GDM的高危因素。GDM孕妇年龄21~34(31.04±2.67)岁,孕24~28(26.24±1.26)周;正常孕妇年龄22~34(30.91±1.60)岁,孕24~28(25.68±3.41)周,且两组差异无统计学意义。本研究获得受试者知情同意,并经我院伦理委员会讨论通过。
1.2 试剂 Ficoll淋巴细胞分离液(上海华精生物公司);LPS、台盼蓝(美国Sigma公司);RPMI-1640培养液(美国Hyclone公司);胎牛血清(美国Gibco公司);RIPA裂解液、5×和2×蛋白上样缓冲液、蛋白A+G琼脂糖珠(上海碧云天公司);小鼠抗人TLR4抗体、小鼠抗人泛乙酰化赖氨酸抗体(英国Abcam公司);小鼠抗人NF-κB p65抗体、β-actin(美国CST公司);山羊抗小鼠二抗(北京中杉公司);ECL显影液(美国Thermo公司); 鲎试剂盒(厦门鲎试剂公司); ELISA试剂盒(上海源叶生物科技公司)。
1.3 标本采集与细胞培养 采集受试者晨起空腹静脉血15 ml,室温静置30 min后血液不凝。Ficoll淋巴细胞分离液分离外周血单核细胞(peripheral blood mononuclear cell,PBMC),洗涤提纯后细胞计数板计数,台盼蓝测定细胞活力(>95%)。调整细胞浓度后,将细胞接种于24孔板内,加RPMI-1640培养基(含10%的胎牛血清,青、链霉素1 ml/100 ml)将每孔总体积调至1 ml,放入37 ℃、5% CO2培养箱中培养。
1.4 实验分组 细胞培养48 h后,向24孔板内加入终浓度为1 μg/ml的LPS干预24 h,每种处理设3个复孔,并将处理后的细胞标记为正常组(对照组)和正常+LPS组、GDM组和GDM+LPS组。24 h后收集细胞用于后续实验。LPS浓度设定参考前期实验[9]。
1.5 血清LPS含量的检测 血清LPS检测按照鲎试剂盒说明书操作。
1.6 Western blot法检测NF-κB p65的表达 RIPA裂解细胞,离心取上清液加入5×蛋白上样缓冲液,煮蛋白10 min。10%SDS-PAGE电泳分离总蛋白,转移至PVDF膜,5%脱脂奶粉封闭2 h,洗膜后放入NF-κB p65抗体(1 ∶250)和β-actin(1 ∶1 000)中4 ℃过夜。洗膜,放入二抗(1 ∶1 000)37 ℃孵育2 h,ECL显影液显影。采用Image J和GraphPad Prism5.0分析软件进行蛋白显影后图像分析。
1.7 免疫共沉淀法和Western blot法检测TLR4乙酰化的表达 冰上裂解细胞,离心取上清液置于离心管中加入2 μg TLR4抗体。离心使其向离心管内加入再悬浮后的蛋白A+G琼脂糖珠20 μl;4 ℃孵育过夜;离心使颗粒沉淀,弃上清液;颗粒洗涤3遍,每次离心均弃上清液;加2×蛋白上样缓冲液10 μl重悬沉淀物;煮沸10 min。12.5%SDS-PAGE电泳分离总蛋白,转移至PVDF膜,5%脱脂奶粉封闭2 h,洗膜后放入泛乙酰化抗体(1 ∶800)和TLR4抗体(1 ∶400)中4 ℃过夜。洗膜,放入二抗(1 ∶1 000)37 ℃孵育2 h,ECL显影液显影。采用Image J和GraphPad Prism5.0分析软件进行蛋白显影后图像分析。
1.8 ELISA法检测肿瘤坏死因子(tumor necrosis factor α,TNF-α)、白介素-1(interleukin-1,IL-1)、白介素-10(interleukin-10,IL-10)的水平 培养液中TNF-α、IL-1、IL-10的检测均按照ELISA试剂盒说明书进行操作。

2 结果
2.1 血清LPS的检测结果 GDM组血清LPS水平[(0.92±0.03) IU/ml]明显高于对照组[(0.53±0.02)IU/ml],差异具有统计学意义(P<0.05)。
2.2 TLR4乙酰化的检测结果 GDM组检测到TLR4发生乙酰化修饰,而对照组TLR4则未检测到乙酰化的修饰。LPS干预培养后,正常+LPS组和GDM+LPS组TLR4乙酰化的程度均显著增加,且GDM+LPS组高于GDM组和正常+LPS组,差异有统计学意义(P<0.05)。见图1。

图1 各组 TLR4乙酰化的水平
2.3 Western blot法检测NF-κB p65表达的结果 GDM组NF-κB p65的表达高于对照组,差异有统计学意义(P<0.05);LPS干预处理后,正常+LPS组、GDM+LPS 组NF-κB p65的表达明显高于对照组,GDM+LPS组高于正常+LPS组和GDM组,差异有统计学意义(P<0.05)。见图2。
2.4 ELISA法检测炎症因子TNF-α、IL-1、IL-10的表达结果 GDM组、正常+LPS组、GDM+LPS组TNF-α、IL-1、IL-10的表达均高于对照组,差异有统计学意义(P<0.05);LPS干预处理后,正常+LPS组TNF-α、IL-1、IL-10的表达均高于对照组,差异有统计学意义(P<0.05), GDM+LPS组高于正常+LPS组和GDM组,差异有统计学意义(P<0.05)。见表1、图3。

表1 各组TNF-α、IL-1、IL-10表达水平的比较
与对照组比较:*P<0.05;与GDM+LPS组比较:#P<0.05
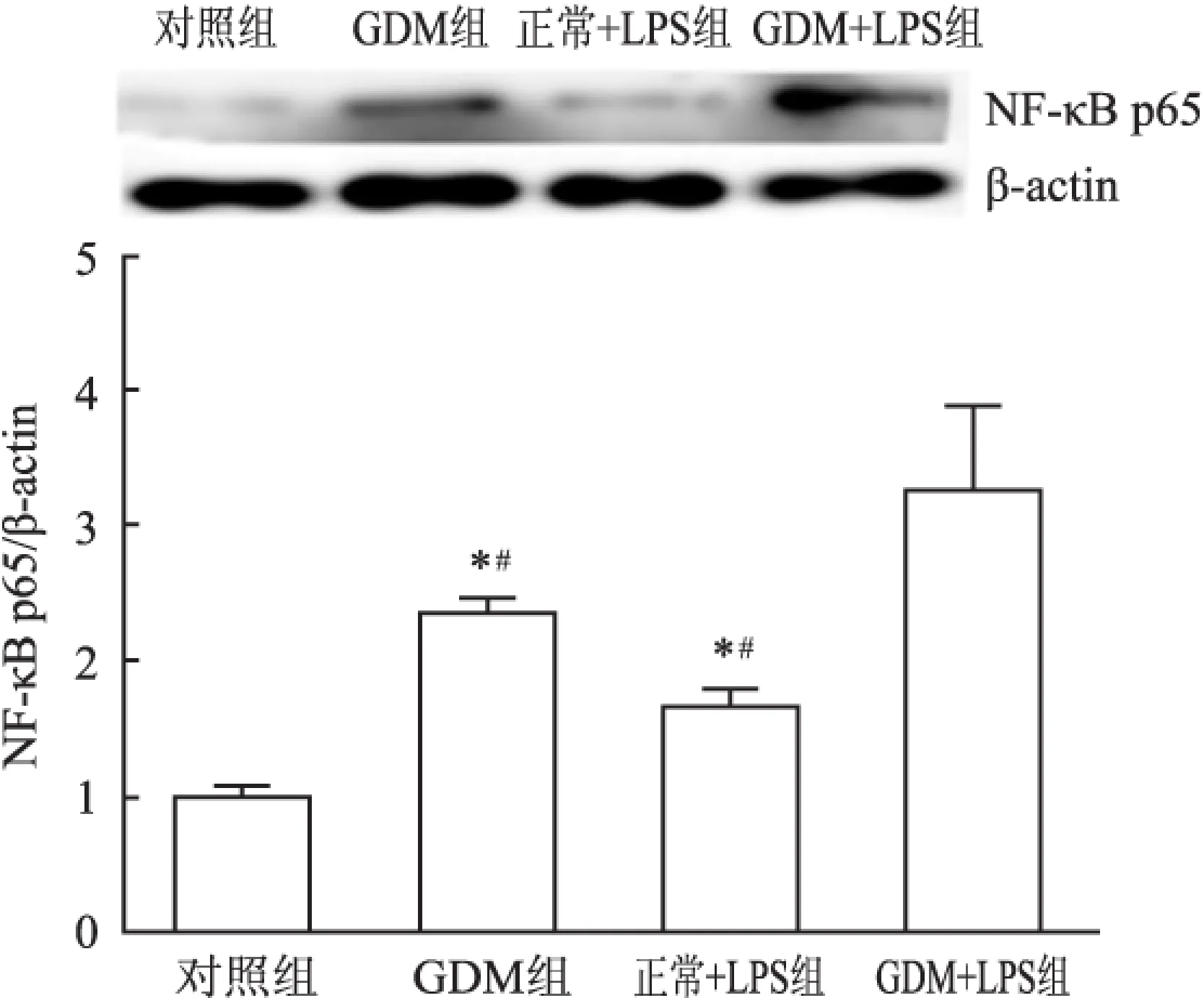
图2 各组NF-κB p65的水平

图3 各组TNF-α、IL-1、IL-10的水平
A:TNF-α;B:IL-1;C:IL-10;与对照组比较:*P<0.05;与GDM+LPS组比较:#P<0.05
2.5 各组TLR4乙酰化、NF-κB p65蛋白表达的相关性分析 Pearson相关分析显示,GDM组、正常+LPS组、GDM+LPS组TLR4乙酰化、NF-kB p65蛋白表达量之间呈正相关性(r=0.901、0.870、0.942,P<0.001)。
3 讨论
TLR4为Ⅰ型跨膜蛋白受体,在其介导的炎症通路中具有“闸门”的作用[10]。NF-κB是TLR4信号通路下游最重要的介质,激活后的NF-κB进入细胞核与靶基因特定序列结合,促进炎症因子的合成和释放。LPS-TLR4-NF-κB是TLR4信号通路中的经典炎症通路,现已成为GDM炎症发病机制的研究热点。研究[1]表明,单核细胞内TLR4 mRNA和蛋白表达的增加与GDM的发生密切相关,前期研究[4,9]则通过对TLR4、NF-κB mRNA及炎症因子表达的相关性分析得出,LPS-TLR4-NF-κB通路的激活是GDM发病的关键。蛋白质乙酰化是重要的翻译后修饰过程,不仅在细胞核内具有重要作用,同时调控着不同的细胞质过程,包括细胞的骨架动力学、能量代谢、内吞、细胞膜信号转导等[11]。TLR4蛋白存在翻译后修饰,包括甲基化、乙酰化、磷酸化等,其中乙酰化促进炎症因子的表达,其存在是TLR4炎症通路活化的必要条件。
本研究显示,GDM孕妇外周血LPS含量高于正常孕妇,且TLR4乙酰化的修饰仅存在于GDM孕妇PBMC,而正常孕妇并未检测到TLR4乙酰化变化;另外,GDM组炎症因子TNF-α、IL-1和IL-10的表达水平高于对照组,这与前期研究[4,9]和国外的报道[12]是一致的。妊娠期孕妇体内环境会发生适应性改变,肠道菌群产生的LPS可异位进入外周循环,进入外周循环后的LPS除可独立诱导机体产生IR外,还可诱导多种细胞的TLR4活化,激活炎症通路[13]。推测LPS可能通过上调TLR4乙酰化进而影响炎症通路的活化,促进了炎症因子的表达。进一步研究显示,LPS干预培养后,正常+LPS组、GDM+LPS组TLR4乙酰化的表达明显增加,且GDM+LPS组明显高于GDM组和正常+LPS组,提示配体的增加对TLR4乙酰化的表达有促进作用。GDM孕妇体内存在氧化应激和代谢的紊乱,如饱和脂肪酸、活性氧自由基、热休克蛋白等的增加[14],这些均可作为TLR4的内源性配体,GDM孕妇体内紊乱的代谢环境可能促进了TLR4乙酰化的表达介导炎症因子的释放,导致GDM疾病的进展,但这些有待于进一步研究证实。
IL-1、TNF-α、IL-10的升高可导致IR的形成和胰岛功能的损伤。另外,IL-10不仅是体内最重要的抗炎细胞因子,还可作为NF-κB的抑制剂,抑制炎性细胞产生炎症因子,从而影响炎症反应的强度。本研究中,LPS干预培养后,TNF-α、IL-1和IL-10的表达水平明显增高,且GDM+LPS组高于正常+LPS组;此外,IL-10的升高幅度低于TNF-α和IL-1。说明GDM孕妇体内低度炎症状态可能通过增加TLR4乙酰化的敏感性从而加剧了抗炎-致炎的失衡。
TLR4乙酰化和NF-κB蛋白表达的相关性分析,也说明了TLR4通过翻译后的乙酰化修饰作用调控着孕妇体内LPS-TLR4-NF-κB通路的活化程度。本研究仅在体外环境下进行,然而人体内的复杂环境是否对TLR4乙酰化修饰产生影响,仍需要大量研究来证明。目前,针对蛋白质乙酰化的药物已在治疗肿瘤等疾病上取得了一定的成果[15]。后期研究将会对TLR4的乙酰化位点进行检测,并评估这些位点的作用,以期为GDM的靶向治疗提供理论依据。
[1] Xie B G, Jin S, Zhu W J. Expression of toll-like receptor 4 in maternal monocytes of patients with gestational diabetes mellitus[J].Exp Ther Med, 2014, 7(1): 236-40.
[2] Kuzmicki M, Telejko B, Wawrusiewicz-Kurylonek N, et al. The expression of genes involved in NF-κB activation in peripheral blood mononuclear cells of patients with gestational diabetes[J].Eur J Endocrinol, 2013, 168(3): 419-27.
[3] Kolek M J, Carlquist J F, Muhlestein J B, et al. Toll-like receptor 4 gene Asp299Gly polymorphism is associated with reductions in vascular inflammation, angiographic coronary artery disease, and clinical diabetes[J].Am Heart J, 2004, 148(6): 1034-40.
[4] 丛 林, 李从青, 姚 洁, 等. LPS-TLR4-NF-κB 通路在妊娠期糖尿病, 正常孕妇及育龄妇女外周血单核细胞中的表达[J]. 现代妇产科进展, 2010, 19(11): 820-2.
[5] Ito K, Charron C E, Adcock I M. Impact of protein acetylation in inflammatory lung diseases[J].Pharmacol Ther, 2007, 116(2): 249-65.
[6] Lu C T, Lee T Y, Chen Y J, et al. An intelligent system for identifying acetylated lysine on histones and nonhistone proteins[J].Biomed Res Int, 2014, 2014:528650.
[7] 王居平. TLR4 乙酰化/甲基化修饰激活对炎症免疫的调节[D]. 杭州:浙江大学, 2011.
[8] International Association of Diabetes and Pregnancy Study Groups ConsensusPanel, Metzger B E, Gabbe S G, et al. International association of diabetes and pregnancy study groups recommendations on the diagnosis and classification of hyperglycemia in pregnancy[J].Diabetes Care, 2010, 33(3): 676-82.
[9] 李从青, 姚 洁, 刘长明, 等. 内毒素对妊娠期糖尿病患者外周血单核细胞 TLR4 mRNA 及 NF-κB mRNA 表达的影响[J]. 安徽医科大学学报, 2011, 46(3): 254-7.
[10] Medzhitov R, Preston-Hurlburt P, Janeway C A Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity[J].Nature, 1997, 388(6640): 394-7.
[11] Matthias P, Yoshida M, Khochbin S. HDAC6 a new cellular stress surveillance factor[J].Cell Cycle, 2008, 7(1): 7-10.
[12] Volpe L, Di Cianni G, Lencioni C, et al. Gestational diabetes, inflammation, and late vascular disease[J]. J Endocrinol Invest, 2007, 30(10): 873-9.
[13] Liang H, Hussey S E, Sanchez-Avila A, et al. Effect of lipopolysaccharide on inflammation and insulin action in human muscle[J].PLoS One, 2013, 8(5): e63983.
[14] Beg A A. Endogenous ligands of Toll-like receptors: implications for regulating inflammatory and immune responses[J].Trends Immunol, 2002, 23(11): 509-12.
[15] Geng H, Harvey C T, Pittsenbarger J, et al. HDAC4 protein regulates HIF1α protein lysine acetylation and cancer cell response to hypoxia[J].J Biol Chem, 2011, 286(44): 38095-102.
Li Song,Cong Lin,Yuan Jing,et al
(PrenatalDiagnosisCenter,DeptofObstetricsandGynecology,TheFirstAffiliatedHospitalofAnhuiMedicalUniversity,Hefei230022)
Effect of TLR4 acetylation on LPS-TLR4-NF-κB pathway and its role in pathogenesis of gestional diabetes mellitus
Objective To study TLR4 acetylation for analysing the expression in peripheral blood mononuclear cells of gestional diabetes mellitus(GDM) patients, and the impact on LPS-TLR4-NF-κB pathway, discussing the inflammatory pathogenesis of GDM. Methods 30 normal pregnant women and 30 GDM patients were picked and 15 ml peripheral blood was drawn per subject respectively. Peripheral blood mononuclear cells(PBMC) were extractedviadensity gradient centrifugation and were culturedinvitro, Serum was used for detecting the level of lipopolysaccharide(LPS). The research was divided into four groups: normal group (control group), normal+LPS group, GDM group and GDM+LPS group. PBMC were adopted into immunoprecipitation and Western blot was used to detect the expression of TLR4 acetylation, the supernatant was used in ELISA for detecting different levels of inflammatory cytokines,TNF-α,IL-1 and IL-10. Results Levels of LPS were statistically significant in woman with GDM and normal pregnant woman(P<0.05). TLR4 acetylation appeared in GDM group, and was negative in the control group.After the LPS intervention,the degree of TLR4 acetylation was enhanced evidently in both normal+LPS group and GDM+LPS group. And the latter was obviously higher than that of GDM group and normal+LPS group (P<0.05). The differences among levels of these four inflammatory cytokines,TNF-α,IL-1 and IL-10, had stastistical significance(P<0.05). There was a positive correlation between TLR4 acetylation and NF-κB protein expression levels(P<0.05).Conclusion TLR4 acetylation mediates the release of inflammatory cytokines by influencing the activation of LPS-TLR4-NF-κB pathway, which contributes to promoting antiinflammatory-proinflammatory imbalance in pregnant woman, thereby involves in the occurrence of GDM.
gestional diabetes mellitus;inflammation;TLR4;acetylation
时间:2015-12-30 14:38
http://www.cnki.net/kcms/detail/34.1065.R.20151230.1438.014.html
安徽省自然科学基金项目(编号:1208085MH172),安徽高校省级自然科学研究项目(编号:KJ2011Z215)
安徽医科大学第一附属医院妇产科产前诊断中心,合肥 230022
李 松,男,硕士研究生;
丛 林,女,教授,主任医师,博士生导师,责任作者,E-mail: conglin1957@163.com
R 714.5
A
1000-1492(2016)01-0026-05
2015-10-20接收
