Exendin-4对高糖培养肾小球系膜细胞ECM分泌的影响及相关机制
2016-11-27林晓璐张红夏小慧陈娟张日东章向成李伟
林晓璐 张红 夏小慧 陈娟 张日东 章向成 李伟
·论著·
Exendin-4对高糖培养肾小球系膜细胞ECM分泌的影响及相关机制
林晓璐 张红 夏小慧 陈娟 张日东 章向成 李伟
目的研究exendin-4对高糖培养大鼠肾小球系膜细胞(GMCs)细胞外基质分泌的影响及相关机制。方法体外培养GMCs,分为4组:正常对照组(NC组)、正常对照+exendin-4组(NCE组)、高糖组(HG组)、高糖+exendin-4组(HGE组);HGE组细胞分别给予3,5,10,15,30 nmol/L exendin-4培养12,24,48 h,采用细胞增殖与活性检测试剂盒(Cell Counting Kit-8,CCK8)法测定细胞增殖情况,确定exendin-4的最适作用时间与浓度。ELISA测定细胞上清中细胞外基质蛋白纤维连接蛋白(FN)和Ⅳ型胶原蛋白水平。RT-PCR检测FN、Ⅳ型胶原蛋白及单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)、细胞间黏附分子-1(ICAM-1)、转化生长因子-β1(TGF-β1)mRNA的表达。Western印迹测定核因子-κB的表达。结果(1)高糖培养的GMCs给予10 noml/L exendin-4培养24 h后,其细胞增殖率较3 nmol/L、5 nmol/L的exendin-4明显降低(F=120.808,Plt;0.05);与15 nmol/L、30 nmol/L相比,10 noml/L(HGE组)的exendin-4对GMCs增殖率无明显变化(P均gt;0.05)。(2)与NC组、NCE组相比,HG组FN、Ⅳ型胶原蛋白分泌及mRNA以及MCP-1、TNF-α、ICAM-1、TGF-β1mRNA的表达均显著升高(F=6.894~166.914,P均lt;0.05);与HG组相比,HGE组FN、Ⅳ型胶原蛋白分泌及mRNA以及TNF-α、MCP-1、ICAM-1、TGF-β1mRNA表达量明显降低(F=6.894~166.914,P均lt;0.05)。(3)与NC组、NCE相比,HG组核因子-κB蛋白的表达明显增多(F=133.1,Plt;0.05)。与HG组相比,HGE组核因子-κB蛋白的表达则明显受到抑制(F=133.1,Plt;0.05)。结论Exendin-4抑制高糖培养GMCs的细胞外基质分泌,与其抑制核因子-κB介导的炎性反应有关。
Exendin-4;肾小球系膜细胞;炎症;核因子-κB
糖尿病肾病(DN)是糖尿病慢性微血管并发症之一,其基本病理改变为系膜细胞增生、基底膜增厚、细胞外基质(ECM)积聚及肾小球硬化、肾脏纤维化,最终导致肾功能衰竭。代谢紊乱和血流动力学异常作为启动子,激活了肾组织内多种炎性分子及炎性信号通路,这些因素共同导致了肾脏的结构和功能的异常[1]。更好地了解DN中的炎性反应,将有助于找到新的治疗人类糖尿病肾脏疾病的新策略。
胰高血糖素样肽(GLP)-1与GLP-1受体(GLP-1R)结合后,通过促进胰岛β细胞分泌胰岛素、抑制胰岛α细胞分泌胰高血糖素、抑制食欲、延缓胃排空等途径降低血糖[2]。Exendin-4与人GLP-1有53%的同源性,与GLP-1R高度亲和,其特殊的分子结构使还其能有效抵抗二肽基肽酶Ⅳ的降解[3-4]。国内、外研究发现,exendin-4干预治疗可改善糖尿病大鼠尿白蛋白排泄、肾小球肥大、系膜基质扩张,不仅能抑制ECM成分的合成,还能增强ECM成分的降解[5-6]。目前,exendin-4发挥肾脏保护作用的具体机制尚未研究透彻。本研究旨在通过建立体外模型,观察exendin-4对高糖环境下的大鼠肾小球系膜细胞(GMCs)ECM分泌及炎性反应信号的影响,初步探讨其中的机制。
1 材料与方法
1.1 主要试剂 低糖及高糖DMEM培养基、胎牛血清购自Gibco公司,exendin-4购自Ana Spec公司,细胞增殖与活性检测试剂盒(CCK8)购自上海七海复泰生物科技有限公司,ELISA试剂盒购自美国RB SCIENTIFIC公司,Trizol总RNA抽提试剂盒购自美国Invitrogen公司,反转录试剂盒、BCA蛋白浓度测定试剂盒(增强型)购自上海碧云天生物技术研究所, 兔抗核因子-κB p65单克隆抗体购自德国CST公司,磷酸酶标记山羊抗兔IgG购自上海优宁维生物科技有限公司。PCR引物由生工生物工程(上海)股份有限公司合成。
1.2 实验方法
1.2.1 细胞培养 选取大鼠GMCs HBZY-1(细胞株名称,徐州医学院药理学实验室),在无菌条件下0.25%胰酶消化2 min,观察细胞分散成拉网状,终止消化。加入DMEM培养液反复轻柔吹打,并均匀接种,置37℃、5%CO2温箱中孵育,传代,3~6代细胞用于实验。当细胞接近亚融合状态时改用无血清培养液培养24 h以同步化,随后以GMCs为实验对象。采用含10%胎牛血清的完全培养基培养,置于37℃、5%CO2的培养箱内。
1.2.2 实验分组 (1) 正常对照组(NC组):采用含糖5.6 mmol/L的DMEM培养基培养。(2)正常对照+exendin-4组(NCE组):采用exendin-4(10 nmol/L)预处理24 h,弃去培养基,然后加入低糖(5.6 mmol/L)培养基和exendin-4(10 nmol/L)共孵育。(3)高糖组(HG组):采用含糖30 mmol/L的DMEM培养基培养。(4)高糖+exendin-4组(HGE组):分别采用exendin-4(3,5,10,15,30 nmol/L)预处理24 h,弃去培养基,然后加入高糖(30 mmol/L)培养基和exendin-4(3,5,10,15,30 nmol/L)共孵育,记为HGE3组、HGE5组、HGE组、HGE15组、HGE30组。细胞同步化24 h后分别按上述要求处理细胞用于实验。
1.2.3 CCK-8法测定GMCs的增殖情况以确定exendin-4的最适作用时间与浓度 取对数生长期的GMCs,按每孔3 000个细胞悬液100 μl接种在96孔培养板上,待细胞贴壁后,换用无血清的培养基饥饿24 h,使细胞同步于G0期后,HGE组细胞分别予3,5,10,15,30 nmol/L exendin-4培养,每组设5个复孔,另外设空白对照孔(只有培养液,无细胞)。分别将培养板放入37℃、5%CO2恒温培养箱中培养12,24,48 h后,选择450 nm波长,在酶联免疫检测仪上测定各孔吸光值,记录结果,所得exendin-4最适作用时间与浓度结果在以下的实验数据中均用HGE组表示。
1.2.4 ELISA测定细胞上清中ECM纤维连接蛋白(FN)和Ⅳ型胶原蛋白水平 收集24 h处理组细胞上清液,按ELISA试剂盒说明书操作,相同标本设3个复孔,重复3次,在酶标仪450 nm测定吸光度值,根据标准曲线及吸光度值计算各样本的相应浓度。
1.2.5 RT-PCR检测FN、Ⅳ型胶原蛋白、单核细胞趋化蛋白-1(MCP-1)、肿瘤坏死因子-α(TNF-α)、细胞间黏附分子-1(ICAM-1)、转化生长因子-β1(TGF-β1) mRNA表达 按照Trizol法提取组织总RNA,采用紫外分光光度法测定RNA在260 nm和280 nm的吸光度,计算RNA含量,逆转录合成cDNA。PCR引物序列见表1,反应体系为25 μl,反应条件:94℃ 3 min,94℃ 30 s,55℃ 30 s,72℃ 1 min,72℃ 5 min 30个循环。取各样本目的基因PCR产物6 μl、β-actin产物2 μl,用2.0%琼脂糖凝胶电泳分离,110 V电泳50 min,EB染色。凝胶成像分析系统采集电泳图像,用Image J软件计算目的基因相对于内参β-actin的灰度值。
1.2.6 Western印迹检测核因子-κB蛋白的表达 取GMCs消化后,用PBS清洗3遍后,加入裂解液,裂解30 min后移入1.5 ml EP管中,于4℃下12 000 r/min(r=9.5 cm),离心10 min,取上清分装于0.5 ml离心管中并置于-80℃保存。采用BCA法测定总蛋白浓度,取15 μl(7.5 μg)蛋白样品进行SDS-PAGE电泳,转膜,BSA封闭2 h,4℃置于一抗(1∶1 000)孵育过夜,TBST摇动漂洗10 min×3次,加入二抗(1∶1 000)并于室温下孵育2 h,TBST洗膜3次各10 min,显色,扫描仪记录实验结果。应用Image J软件分析目的蛋白及内参蛋白灰度值,计算相对灰度值。
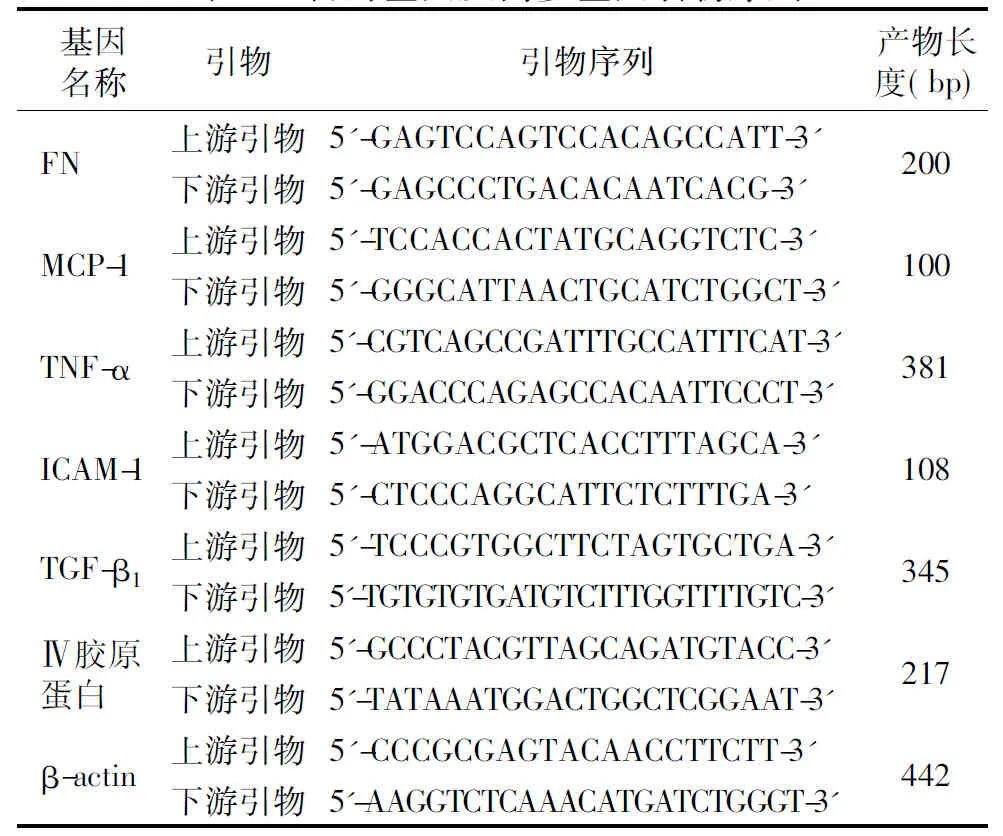
表1 目的基因及内参基因引物序列
注:FN:纤维连接蛋白;MCP-1:单核细胞趋化蛋白-1;TNF-α:肿瘤坏死因子-α;ICAM-1:细胞间黏附分子-1;TGF-β1:转化生长因子-β1;β-actin:β-肌动蛋白
2 结果
2.1 Exendin-4最适作用时间与浓度 高糖培养的GMCs给予10 noml/L的exendin-4培养,其HGE组细胞增殖率较HGE3组、HGE5组明显降低(Plt;0.05);与HGE15组、HGE30组相比,10 noml/L的exendin-4 HGE组对GMCs增殖率无明显变化(Pgt;0.05)。同时高糖培养下GMCs给予10 nmol/L的exendin-4处理24 h,其细胞增殖率较12 h、48 h均明显降低(Plt;0.05),见表2。
2.2 Exendin-4对GMCs细胞上清FN和Ⅳ型胶原蛋白的影响 与NG组、NGE组相比,HG组FN、Ⅳ型胶原蛋白的表达升高(F=72.139、140.519,P均lt;0.05);与HG组相比,HGE组的FN及Ⅳ型胶原蛋白表达降低(F=72.139、140.519,P均lt;0.05),见图1。
2.3 Exendin-4对GMCs FN、Ⅳ型胶原蛋白、MCP-1、TNF-α、ICAM-1、TGF-β1mRNA表达的影响 与NG组、NGE组相比,HG组FN、Ⅳ型胶原蛋白、MCP-1、TNF-α、ICAM-1、TGF-β1mRNA的表达升高(F=6.894~166.914,P均lt;0.05);与HG组相比,HGE组FN、Ⅳ型胶原蛋白、MCP-1、TNF-α、ICAM-1、TGF-β1mRNA表达降低(F=6.894~166.914,P均lt;0.05),见图2。
2.4 Exendin-4对GMCs核因子-κB表达的影响 与NG组、NGE组相比,HG组GMCs中核因子-κB的表达量明显增多(F=133.1,Plt;0.05);与HG组相比,HGE组核因子-κB的表达量降低(F=133.1,Plt;0.05),见图3。
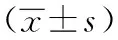
表2 Exendin-4对GMCs增殖的影响
注:与NG组相比,aPlt;0.05;与HG组相比,bPlt;0.05;NG组:低糖组;HG组:高糖组;HGE3、HGE5、HGE、HGE15、HGE30组:高糖加3、5、10、15、30 nmol/L exendin-4组;GMCs:肾小球系膜细胞
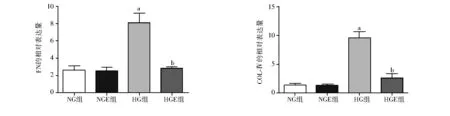
注:与NG组、NGE组相比, aPlt;0.05;与HG组相比,bPlt;0.05;NG组:低糖组;NGE组:低糖加exendin-4(10 nmol/L)组;HG组:高糖组;HGE组:高糖加exendin-4(10 nmol/L)组;FN:纤维连接蛋白;COL-Ⅳ:Ⅳ型胶原蛋白图1 Exendin-4对高糖条件下系膜细胞FN、Ⅳ型胶原蛋白的影响
3 讨论
DN是糖尿病最常见的微血管并发症,早期出现肾小球内高压以及肾小球滤过率增加,肾小球ECM合成增加及基底膜增厚,导致肾小球系膜区扩张,逐渐发展成为肾脏的纤维化和硬化,最终导致肾功能衰竭。DN的发病机制复杂,迄今尚未完全清楚。由高血糖介导的代谢异常和血流动力学改变是导致DN的主要原因。最近越来越多的研究发现,氧化应激、蛋白质非酶糖基化、蛋白激酶C途径以及肾素-血管紧张素系统激活、炎性反应(如炎性细胞、炎性细胞因子激活)等途径也与DN的发生、发展有关[7]。这些途径均可以引起核因子-κB活性增强,活化后的核因子-κB进一步启动许多与DN相关基因的转录。因此,核因子-κB在DN发生、发展中起重要作用[8]。
ECM是肾小球系膜区围绕系膜细胞的非弥散的固相介质,能够调节系膜细胞增生和分泌各种活性物质,其中FN和Ⅳ型胶原蛋白是构成ECM的重要成分。本实验选取大鼠GMCs,并对细胞上清中FN和Ⅳ型胶原蛋白的分泌及表达进行测定,证实高糖可使FN和Ⅳ型胶原蛋白的含量明显升高,这与Nahman等[9]的研究结果一致。
核因子-κB在GMCs、毛细血管内皮细胞、肾小管上皮细胞和经血液循环进入肾脏的免疫细胞中都存在,其作为一个重要的转录因子,可以被许多细胞外刺激激活,活化后的核因子-κB进入细胞核内,与多种炎性因子启动子区域中κB序列结合,参与细胞凋亡、炎性反应等多种条件下的基因调控[10]。近年来研究亦表明,核因子-κB在GMCs活化、增生和炎性介质产生中处于中心地位[11]。
有研究表明,核因子-κB可诱导多种细胞因子(如白细胞介素-2、白细胞介素-6)、黏附因子[ICAM-1、血管细胞黏附分子(VCAM)-1、趋化因子(MCP-1、C3)]等编码基因的表达[12]。本研究发现,在高糖诱导的GMCs中炎性相关因子MCP-1、ICAM-1表达明显升高,给予exendin-4干预后MCP-1、ICAM-1 mRNA的表达受到抑制。而已有研究表明,在DN动物模型中,MCP-1、ICAM-1表达明显增加,敲除MCP-1基因的1型糖尿病和2型糖尿病大鼠,其肾损伤明显减轻[13]。而敲除ICAM-1基因小鼠DN的发生延迟[14]。因此,exendin-4可以通过减少黏附因子与趋化因子的表达来对GMCs进行保护,且这种机制与抑制核因子-κB通路有关。
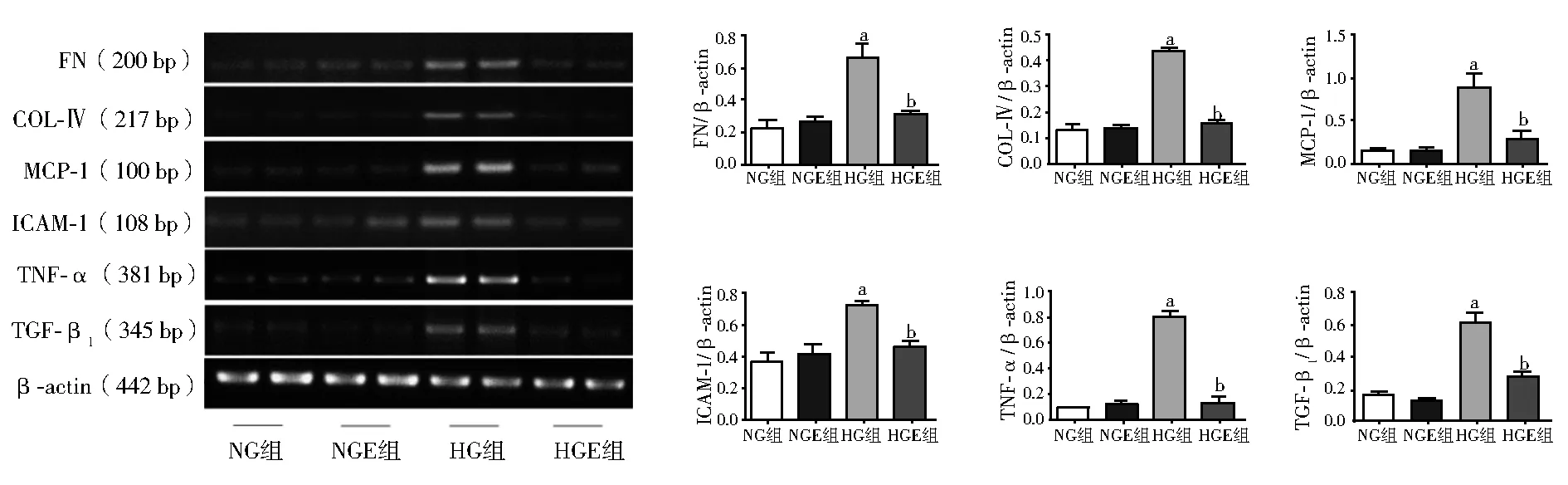
注:与NG组、NGE组相比,aPlt;0.05;与HG组相比,bPlt;0.05;NG组:低糖组;NGE组:低糖加exendin-4(10 nmol/L)组;HG组:高糖组;HGE组:高糖加exendin-4(10 nmol/L)组;FN:纤维连接蛋白;COL-Ⅳ:Ⅳ型胶原蛋白;MCP-1:单核细胞趋化蛋白-1;ICAM-1:细胞间黏附分子-1;TNF-α:肿瘤坏死因子-α;TGF-β1:转化生长因子-β1图2 Exendin-4对高糖条件下系膜细胞FN、Ⅳ型胶原蛋白、MCP-1、TNF-α、ICAM-1、TGF-β1 mRNA的影响
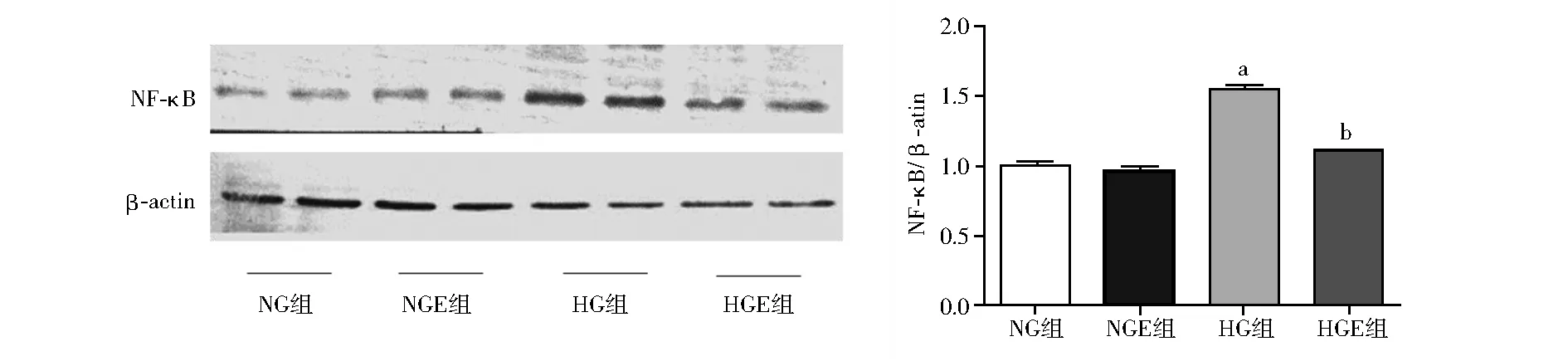
注:与NG组相比,aPlt;0.05;与HG组相比,bPlt;0.05;NG:低糖组;NGE组:低糖加exendin-4(10 nmol/L)组;HG:高糖组;HGE组:高糖加exendin-4(10 nmol/L)组;NF-κB:核因子-κB图3 Exendin-4对高糖培养肾小球系膜细胞核因子-κB蛋白表达的影响
TNF-α在肾组织中主要由GMCs、肾小球细胞和内皮细胞、肾间质树突状细胞等产生,在实验性糖尿病大鼠肾脏中TNF-α的表达明显增多[15]。TNF-α作为一种高效的促炎细胞因子,可以直接刺激系膜细胞产生多种炎性介质如MCP-1和ICAM-1[16]。其还可通过膜受体逐级激活,最后使游离的核因子-κB激活,这两种因子相互作用,进一步加重肾脏损害。本研究发现大鼠GMCs在高糖的影响下TNF-α mRNA表达较NC组明显升高,而给予exendin-4干预后,其表达受抑制,同时与核因子-κB的表达有关。
TGF-β1是一种多功能、能多向调节的中心细胞因子,它不仅可以直接促使肾脏肥大,还可以通过诱导ECM沉积而具有强烈促纤维化作用使肾小球硬化,并且能诱导炎性细胞浸润和成纤维细胞增生。大量研究已经证实,TGF-β1与DN的发生、发展关系密切[17-18]。Mirza等[19]研究发现,TGF-β1的活化剂转谷酰氨酶的前体由核因子-κB调控,进一步研究表明,缺乏TGF-β1的大鼠会表现出异常的核因子-κB激活(主要是通过Toll样受体4),最后会因严重炎性反应综合征而死亡[20]。由此推测,肾组织中核因子-κB的活化,可促使TGF-β1表达增加,导致ECM合成增加,在DN的发病过程中具有重要作用。
作为GLP-1的类似物,exendin-4不仅具有降血糖的作用,而且对于DN也有一定的保护作用[21]。目前应用于临床的exendin-4类药物为人工合成多肽产物艾塞那肽(exenatide),其与exendin-4有50%的结构同源性。本研究发现,和ECM的分泌、炎性相关介质变化类似,高糖作用下核因子-κB的活性升高,经exendin-4干预后活性则明显被抑制,说明exendin-4抑制高糖培养下大鼠GMCs ECM的分泌,与其抑制核因子-κB介导的炎性反应有关,其可有效阻止DN的进一步发展。这一研究结果为exendin-4对DN的保护作用提供了强有力的理论依据,但其具体的分子机制尚不明确,需深入研究。
[1] 张红, 章向成, 朱大龙. 炎性反应与糖尿病肾病[J]. 国际内分泌代谢杂志, 2015, 35(1): 49-52. DOI:10.3760/cma.j.issn.1673-4157.2015.01.012.
[2] McCray BA, Taylor JP. The role of autophagy in age-related neurodegeneration[J].Neurosignals,2008,16(1):75-84.
[3] Rautou PE, Mansouri A, Lebrec D,et al. Autophagy in liver diseases[J].J Hepatol,2010,53(6):1123-1134. DOI: 10.1016/j.jhep.2010.07.006.
[4] Kume S, Thomas MC, Koya D. Nutrient sensing, autophagy, and diabetic nephropathy[J].Diabetes,2012,61(1):23-29. DOI: 10.2337/db11-0555.
[5] Hartleben B, Gödel M, Meyer-Schwesinger C,et al. Autophagy influences glomerular disease susceptibility and maintains podocyte homeostasis in aging mice[J].J Clin Invest,2010,120(4):1084-1096. DOI: 10.1172/JCI39492.
[6] Bachar-Wikstrom E, Wikstrom JD, Ariav Y,et al. Stimulation of autophagy improves endoplasmic reticulum stress-induced diabetes[J].Diabetes,2013,62(4):1227-1137. DOI: 10.2337/db12-1474.
[7] Bachar-Wikstrom E, Wikstrom JD, Ariav Y,et al. Stimulation of autophagy improves endoplasmic reticulum stress-induced diabetes[J].Diabetes,2013,62(4):1227-1237. DOI: 10.2337/db12-1474.
[8] Mezzano S, Aros C, Droguett A,et al. NF-kappaB activation and overexpression of regulated genes in human diabetic nephropathy[J].Nephrol Dial Transplant,2004,19(10):2505-2512.
[9] Nahman NS Jr, Leonhart KL, Cosio FG,et al. Effects of high glucose on cellular proliferation and fibronectin production by cultured human mesangial cells[J].Kidney Int,1992,41(2):396-402.
[10] Vallabhapurapu S, Karin M. Regulation and function of NF-kappaB transcription factors in the immune system[J].Annu Rev Immunol,2009,27:693-733. DOI: 10.1146/annurev.immunol.021908.132641.
[11] Baldwin AS Jr. Series introduction: the transcription factor NF-kappaB and human disease[J].J Clin Invest,2001,107(1):3-6.
[12] Chen FE, Ghosh G. Regulation of DNA binding by Rel/NF-kappaB transcription factors: structural views[J].Oncogene,1999,18(49):6845-6852.
[13] Chow FY, Nikolic-Paterson DJ, Ma FY,et al. Monocyte chemoattractant protein-1-induced tissue inflammation is critical for the development of renal injury but not type 2 diabetes in obese db/db mice[J].Diabetologia,2007,50(2):471-480.DOI:10.1007/s00125-006-0497-8.
[14] Güler S, Cakir B, Demirbas B,et al. Plasma soluble intercellular adhesion molecule 1 levels are increased in type 2 diabetic patients with nephropathy[J].Horm Res,2002,58(2):67-70.
[15] Mensah-Brown EP, Obineche EN, Galadari S,et al. Streptozotocin-induced diabetic nephropathy in rats: the role of inflammatory cytokines[J].Cytokine,2005,31(3):180-190.DOI:10.1016/j.cyto.2005.04.006.
[16] Sheryanna A, Bhangal G, McDaid J,et al. Inhibition of p38 mitogen-activated protein kinase is effective in the treatment of experimental crescentic glomerulonephritis and suppresses monocyte chemoattractant protein-1 but not IL-1beta or IL-6[J].J Am Soc Nephrol,2007,18(4):1167-1179.DOI:10.1681/ASN.2006010050.
[17] De Borst MH, Prakash J, Melenhorst WB,et al. Glomerular and tubular induction of the transcription factor c-Jun in human renal disease[J].J Pathol,2007,213(2):219-228.DOI:10.1002/path.2228.
[18] Sakai N, Wada T, Furuichi K,et al. Involvement of extracellular signal-regulated kinase and p38 in human diabetic nephropathy[J].Am J Kidney Dis,2005,45(1):54-65.
[19] Mirza A, Liu SL, Frizell E,et al. A role for tissue transglutaminase in hepatic injury and fibrogenesis, and its regulation by NF-kappaB[J].Am J Physiol,1997,272(2 Pt 1):G281-G288.
[20] McCartney-Francis N, Jin W, Wahl SM. Aberrant Toll receptor expression and endotoxin hypersensitivity in mice lacking a functional TGF-beta 1 signaling pathway[J].J Immunol,2004,172(6):3814-3821.
[21] Kodera R, Shikata K, Kataoka HU,et al. Glucagon-like peptide-1 receptor agonist ameliorates renal injury through its anti-inflammatory action without lowering blood glucose level in a rat model of type 1 diabetes[J].Diabetologia,2011,54(4):965-978. DOI: 10.1007/s00125-010-2028-x.
Effectsandmechanismofexendin-4onextracellularmatrixsecretionofmesangialcellsculturedinhighglucose
LinXiaolu*,ZhangHong,XiaXiaohui,ChenJuan,ZhangRidong,ZhangXiangcheng,LiWei.
*GraduatedSchoolofXuzhouMedicalCollege,Xuzhou221000,China
Correspondingauthor:LiWei,Email:Liwei.190@hotmail.com
ObjectiveTo explore the effects and mechanism of exendin-4 on the secretion of extracellular matrix in high glucose-cultured glomerular mesangial cells (GMCs).MethodsGMCs were culturedinvitroand divided into 4 groups: normal control (NC) group, normal control with exendin-4 (NCE) group, high glucose (HG) group, high glucose with exendin-4 (HGE) group. Cells in HGE group were treated with 3, 5, 10, 15 or 30 nmol/L exendin-4 for about 12, 24 or 48 hours, respectively. The proliferation and cell activity of GMCs were used to assess the most suitable culture time and concentration using Cell Counting Kit-8. The levels of fibronectin (FN) and collagen type Ⅳ in the cell supernatant were measured by ELISA. The levels of collagen type Ⅳ, FN, monocyte chemotactic protein-1(MCP-1), tumor necrosis factor (TNF)-α, intercellular cell adhesion molecule-1(ICAM-1), transforming growth factor-β1(TGF-β1) were evaluated by RT-PCR. The expression of nuclear factor-κB (NF-κB) in each group was analyzed by Western blotting.Results(1) After treated by 10 nmol/L exendin-4 for 24 hours, the growth rate of GMCs cultured in high glucose was significantly decreased compared with 3 nmol/L or 5 nmol/L (F=120.808,Plt;0.05), but not different from 15 nmol/L or 20 nmol/L (allPgt;0.05). (2)Compared with NC group and NCE group,the expression of FN, collagen type Ⅳ, as well as their mRNA level and the inflammatory mediators such as MCP-1, TNF-α, ICAM-1 and TGF-β1were significantly increased in HG group(F=6.894-166.914, allPlt;0.05). Compared with HG group, the protein and mRNA level of FN and collagen type Ⅳ, and the expression of TNF-α, MCP-1, ICAM-1 and TGF-β1were inhibited greatly in HGE group (F=6.894-166.914, allPlt;0.05).(3)Compared with NC group and NCE group, the expression of NF-κB increased significantly in HG group (F=133.1,Plt;0.05). Compared with HG group, the expression of NF-κB was suppressed significantly in HGE group (F=133.1,Plt;0.05).ConclusionExendin-4 inhibits the secretion of extracellular matrix of GMCs cultured in high glucose, and the mechanism is associated with the inhibition of inflammation induced by NF-κB.
Exendin-4; Glomerular mesangial cells; Inflammation; Nuclear factor-κB
国家自然科学基金资助项目(81200595,81400807);江苏省卫计委科研项目(H201253)
10.3760/cma.j.issn.1673-4157.2016.05.05
221000 徐州医学院研究生院(林晓璐,夏小慧);223001 南京医科大学附属淮安第一医院内分泌科(陈娟,张日东,章向成,张红);221000 徐州医学院附属医院内分泌科(李伟)
李伟,Email:Liwei.190@hotmail.com
FundprogramNational Natural Science Foundation of China(81200595,81400807);Jiangsu Provincial Commission of Health and Family Planning(H201253)
2015-10-28)
