糖肝康对糖尿病急性肝损伤大鼠肝脏结构和PON表达的影响
2016-11-24钱卫斌钱秋海蔡欣蕊张新颖王营营
钱卫斌 钱秋海 蔡欣蕊 张新颖 王营营
·短篇论著·
糖肝康对糖尿病急性肝损伤大鼠肝脏结构和PON表达的影响
钱卫斌 钱秋海 蔡欣蕊 张新颖 王营营
目的观察中药糖肝康对糖尿病急性肝损伤模型大鼠肝脏病理结构和对氧磷酶(PON)表达的影响。方法选择健康雄性Wistar大鼠100只,其中90只大鼠采用链脲佐菌素(STZ)诱发糖尿病模型,选取造模成功的50只采用随机数字法分为5组,每组10只:模型对照组,护肝宁对照组,糖肝康小、中、大剂量组。另设10只大鼠为正常对照组。其中,模型对照组和正常对照组给予生理盐水10 ml/kg ig;护肝宁对照组给予护肝宁混悬液0.04 g/ml ig;糖肝康小、中、大剂量组分别给予浓度为1 g/ml、2 g/ml、4 g/ml的糖肝康ig。给药观察12周后,除正常对照组外,其余各组均分别给予硫代乙酰胺(TAA)200 mg/kg腹腔注射,以诱发糖尿病大鼠急性肝损伤,24 h内麻醉大鼠并开腹取出肝脏,光镜观察肝脏病理结构及免疫组化法观察各组大鼠肝脏组织PON的表达。结果给予TAA后,模型对照组大鼠的肝组织结构改变,部分肝细胞肿胀,有团块再生,脂肪变性坏死,并可见肝小叶结构不清,汇管区有大量成纤维细胞、纤维细胞和胶原纤维。经糖肝康治疗后,上述异常得到改善。模型对照组肝脏组织PON表达较正常对照组显著降低(F=3.130,Plt;0.01);糖肝康小、中、大剂量组及护肝宁对照组与模型对照组相比,PON表达升高(F=3.130,Plt;0.05)。结论糖肝康对TAA所致急性肝损伤病理改变可起到一定的保护作用,其机制可能是通过升高PON的表达水平。
糖肝康;糖尿病;肝损伤
糖尿病肝损伤是指继发于糖尿病的肝脏组织学和功能变化的病变,是以肝功能损害为主要临床症状的慢性并发症。糖尿病肝损伤严重影响糖尿病的治疗及患者的身体健康。炎性反应、自由基产生和脂质过氧化均可破坏肝细胞结构和功能,在肝病的发生和发展中起着十分重要的作用[1]。临床上多种原因可引起糖尿病肝损伤,以糖尿病合并非酒精性脂肪性肝病最为常见,据报道2型糖尿病患者并发脂肪肝的患病率为21%~78%,平均约50%[2-3]。糖尿病肝损害最初可发生酶学的改变,或出现脂肪肝,继而可引起肝纤维化,最终可导致肝功能衰竭坏死[4]。钱秋海根据多年临床经验,总结出糖尿病肝损伤的基本病机是“脾气亏虚、肝失条达、瘀毒互结”,并据此研制出具有健脾补肾、清热化湿、活血通络之效的糖肝康方,临床应用疗效显著[5-8]。本实验采用链脲佐菌素(STZ)+硫代乙酰胺(TAA)造成糖尿病急性药物性肝损伤模型大鼠,观察和验证糖肝康对肝脏组织病理结构及对氧磷酶(PON)免疫组化表达水平的影响,以探讨糖肝康的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与饲料 健康雄性Wistar大鼠100只,体重(200±20)g,由山东中医药大学实验动物中心提供,动物合格证号:SCXK(鲁)20110003。常规饲料由山东中医药大学实验动物中心提供。
1.1.2 药品与试剂 治疗组用药:糖肝康颗粒:由山东中医药大学附属医院药剂科加工而成,由黄芪(内蒙古)、白术(浙江)、柴胡(山西)、黄芩(内蒙古)、茵陈(陕西)、炒栀子(江西)、大黄(甘肃)、白芍(安徽)、当归(甘肃)、丹参(山东)、鳖甲(湖北)、羚羊角粉(安徽)、荷叶(安徽)、山楂(山东)、甘草(新疆)等组成,实验时将糖肝康颗粒水煎煮开后制成糖肝康煎剂,浓度为1 g/ml、2 g/ml及4 g/ml。对照组用药:护肝宁:片剂,0.35 g/片,由贵州信邦制药股份有限公司生产,批准文号:国药准字Z20033118,产品批号:20120303041,浓度约0.04 g/ml。
实验试剂:STZ购自美国Sigma公司,批号:020106;TAA购自上海展云化工有限公司,批号:1106017;一抗Anti-PON购自北京博奥森生物技术有限公司,批号bs-1375R,为多克隆抗体;SP-9000 HistostainTM-Plus kits免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,批号20090921;浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司,批号20091021。
1.1.3 实验仪器 美国强生血糖分析仪,由武汉绿森林科技发展有限公司生产;Reichert-Jung超薄切片机,由山东省医学科学院提供;LEICA ASP600全自动生物脱水机,由LEICA公司生产;LEICA ASP2135病理切片机,批号:19990321B;OLYMPUS CX51显微镜;医学图像分析系统,型号HPIAS1000,由同济医科大学千屏影像工程公司生产。
1.2 方法
1.2.1 造模方法 选择Wistar大鼠90只,给予普通饲料,适应性饲养3 d后,禁食12 h,按30 mg/kg体重的剂量腹腔内注射新鲜配制的2%STZ(柠檬酸缓冲液,pH4.2),72 h后尾静脉取血测血糖,血糖高于16.7 mmol/L者确定为糖尿病模型制作成功。选取50只造模成功大鼠进入实验。
1.2.2 分组与给药 将50只入选大鼠采用随机法分为5组,每组50只:模型对照组,护肝宁对照组,糖肝康小、中、大剂量组。另取10只正常大鼠作为正常对照组。其中,模型对照组和正常对照组给予无菌0.9%生理盐水ig;护肝宁对照组给予护肝宁混悬液0.04 g/ml ig;糖肝康小、中、大剂量组分别给予浓度为1 g/ml、2 g/ml、4 g/ml的糖肝康ig。各组给药容积均为10 ml/kg,均每日灌胃1次,正常饲料饮食。连续给药12周后,禁食8 h,以无菌0.9%生理盐水配制剂量不等的TAA溶液[9]。除正常对照组外,其余各组分别给予TAA 200 mg/kg腹腔注射,制成糖尿病急性肝损伤模型。
1.2.3 标本采集 腹腔注射TAA,24 h内断尾取血用强生血糖分析仪检测空腹血糖(取血前禁食8 h),然后用戊巴比妥钠40 mg/kg腹腔注射麻醉,开腹取出肝脏,用生理盐水冲洗后,入中性福尔马林液4℃固定24 h,脱水后常规石蜡包埋,制成蜡块,切成4 μm厚的连续切片,贴于预先涂有铬钒明胶的载玻片上,一部分备测大鼠肝脏病理结构,另一部分引用免疫组化方法检测模型大鼠肝脏组织中PON表达的影响。
1.2.4 镜下观察 病理标本的制作:切片后HE染色,光镜下观察肝脏病理结构变化。
1.2.5 免疫组化检测 标本0.01 mol/L PBS冲洗5 min×3次;3%双氧水孵育10 min;滴加试剂A(封闭用正常山羊血清工作液)37℃孵育20 min,倾去,不洗;滴加1∶200稀释的一抗,5℃过夜,阴性对照用PBS液代替一抗;0.01 mol/L PBS冲洗5 min×3次;滴加试剂B(生物素化二抗工作液)37℃孵育20 min,0.01 mol/L PBS冲洗5 min×3次;滴加试剂C(辣根酶标记链酶卵白素工作液)37℃孵育20 min,0.01 mol/L PBS冲洗5 min×3次;DAB显色剂显色,显微镜下观察显色情况,显色充分后自来水终止反应;苏木素复染,无水酒精脱水,二甲苯透明,中性树胶封片;显微镜下取10×10视野下观察标本,照相。
每张切片于镜下随机选取5个视野观察肝脏阳性产物的分布、染色情况。黄光源下为浅黄色背景,标记阳性产物在细胞质,呈棕黄色颗粒着色。对每例切片,采取半定量积分法判断结果:A(按切片中阳性细胞占切片中总细胞数的比例评分):未见阳性细胞为0分,阳性细胞占整个视野细胞数的1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;B(按切片中阳性细胞显色有无及深浅评分):无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。每例积分=A×B,两者积分相乘结果作为阳性表达强度。
2 结果
2.1 糖肝康对TAA所致急性肝损伤模型大鼠肝脏光镜病理结构的影响 肝组织大体标本观察发现,正常对照组肉眼观察显示肝脏表面光滑,未见渗出物,未见结节,质软,暗红色。模型对照组及糖肝康治疗组和护肝宁对照组肉眼观察显示肝脏表面呈结节状,质硬,边缘锐利,结节间薄层纤维组织包绕。
光镜下观察显示:正常对照组肝细胞结构正常,无炎性细胞浸润,无胶原纤维增生。而造模后,模型对照组部分肝细胞肿胀,有团块再生,脂肪变性坏死,并可见肝小叶结构不清,汇管区有大量成纤维细胞、纤维细胞和胶原纤维。糖肝康中、大剂量组肝细胞脂变和纤维增生程度较轻,肝细胞再生活跃。糖肝康小剂量组纤维化程度和护肝宁对照组相当,提示糖肝康中、大剂量组优于护肝宁对照组(图1,封3)。
2.2 糖肝康对TAA所致急性肝损伤模型大鼠肝脏PON免疫组化表达的影响 免疫组化结果及阳性评分结果显示:肝脏血管周围细胞质内有PON表达,其表达呈棕黄色或棕褐色颗粒。各组PON表达程度均不相同。造模后,与正常对照组相比,模型对照组PON阳性颗粒数目最多,着色明显增强,PON免疫组化阳性积分显著降低(F=3.130,Plt;0.01)。经治疗后,糖肝康小、中、大剂量组、护肝宁对照组与模型对照组相比,阳性颗粒数目均较少,着色均较浅,PON阳性积分明显升高(F=3.130,Plt;0.05),见图2(封3),图3。
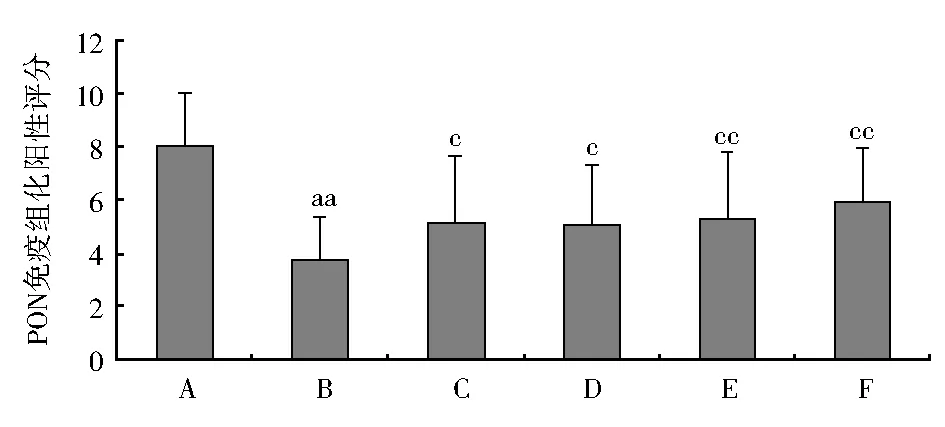
注:A:正常对照组;B:模型对照组;C:护肝宁对照组;D:糖肝康小剂量组;E:糖肝康中剂量组;F:糖肝康大剂量组;PON:对氧磷酶;TAA:硫代乙酰胺;与A比较,aPlt;0.05,aaPlt;0.01;与B比较,cPlt;0.05,ccPlt;0.01图3 糖肝康对TAA急性肝损伤模型大鼠肝脏PON免疫组化表达的影响
3 讨论
现代医学认为糖尿病肝损伤的发生不仅与糖脂代谢紊乱有关,而且是一个多因素参与的复杂病理过程。炎性反应、自由基产生和脂质过氧化均可破坏肝细胞结构和功能。PON是一类催化磷酸酯键水解的芳香酯酶,1953年Aldridge[10]首先发现生物体内存在可水解有机磷化合物的酶类。因该酶多以对氧磷为底物,故命名为PON。其基因家族包括PON1、PON2和PON3,基因表达主要受到Sp1、Ap-1、PPAR等转录因子的调控[1]。人血清PON主要由肝脏分泌,其还广泛分布于哺乳动物的血液、肾脏、脾脏及脑组织中[1]。PON具有调节氧化应激平衡、抗纤维化、抑制细胞凋亡等作用[11]。研究证明,血清PON1活性变化与肝损伤的严重程度密切相关,即肝损伤程度越严重,酶活性下降越明显[1]。因此,研究和探讨PON活性变化与慢性肝损伤的关系对肝损伤机制的深入了解具有重要意义。
笔者根据多年临床观察经验,总结出脾虚气弱是糖尿病肝损伤的重要发病基础,肝失条达为糖尿病肝损伤发生、发展的重要环节,瘀毒互结为糖尿病肝损伤的重要病理变化,并贯穿于病程始终。因此治疗上以健脾益气治其本,调肝解毒活血治其标为治疗原则,组成糖肝康以健脾益气、调肝解毒活血,从而改善肝功能,降低血糖、血脂,改善血流变及胰岛素水平[12]。本方由生黄芪、白术、茵陈、黄芩、柴胡、炒栀子等药物组成。重用生黄芪、白术,二者相伍,共为君药,以健脾益气。取柴胡、黄芩、茵陈、炒栀子、大黄、白芍、羚羊粉为方中臣药,配合君药以健脾益气、调肝活血、清热解毒。取荷叶、山楂为佐药,共奏化湿、活血消食之功效。甘草为方中使药,清热解毒且调和药性。诸药合用共奏健脾益气、调肝解毒、清热化湿活血之功。
本研究结果表明,以健脾益气、调肝解毒活血为组方原则研制的糖肝康对糖尿病肝损伤大鼠肝脏组织的病理结构有明显的预防保护作用,提示本方对糖尿病肝损伤病变有显著的防护作用。且模型大鼠肝脏中PON的表达较正常对照组大鼠表达降低,而糖肝康可改善PON在肝脏的表达,效果与护肝宁对照组无明显差异。提示糖肝康可能通过改善PON在肝脏表达起到对机体代谢的影响,进而起到保护肝脏的作用。
[1] 黄凯,李燕. 对氧磷酶与慢性肝损伤[J]. 国际药学研究杂志,2011,4(38):112-116. DOI:10.3969/j.issn.1674-0440.2011.02.005.
[2] Williams CD, Stengel J, Asike MI, et al. Prevalence of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis among a largely middle-aged population utilizing ultrasound and liver biopsy: a prospective study[J].Gastroenterology,2011,140(1):124-131.DOI: 10.1053/j.gastro.2010.09.038.
[4] 张晓静,宋鲁成. 糖尿病肝损害的中西医认识[J]. 内蒙古中医药,2009,28(2): 95-96. DOI:10.3969/j.issn.1006-0979.2009.02.101.
[5] 李志颖,钱秋海,蔡欣蕊,等.糖肝康治疗糖尿病非酒精性脂肪肝的临床研究[J]. 中华中医药学刊,2014,32(11):2740-2743.
[6] 钱秋海,钱卫斌,蔡欣蕊,等. 健脾益气调肝解毒活血法治疗糖尿病脂肪肝经验[J]. 河北中医,2013,35(4):527-528. DOI:10.3969/j.issn.1002-2619.2013.04.05.
[7] 肖月星,倪青,钱秋海. 糖肝康胶囊治疗糖尿病性肝损伤30例临床研究[J]. 中国中医药信息杂志,2006,13(7):17-19. DOI:10.3969/j.issn.1005-5304.2006.07.009.
[8] 李红专,钱秋海,钱卫斌,等. 糖肝康方对糖尿病脂肪肝患者的治疗作用及其对血清瘦素水平的影响[J]. 山东大学学报(医学版),2012, 5(4):10-14. DOI:10.6040/j.issn.1671-7554.2012.04.003.
[9] 杨天翼. 健脾化湿解毒方对TAA诱导的急性肝衰竭小鼠模型的影响[D].北京中医药大学,2013.
[10] Aldridge WN. Serum esterases. Ⅱ. An enzyme hydrolysing diethylp-nitrophenyl phosphate (E600) and its identity with the A-esterase of mammalian sera[J].Biochem J,1953,53(1):117-124.
[11] Camps J, Marsillach J, Rull A,et al. Interrelationships between paraoxonase-1 and monocyte chemoattractant protein-1 in the regulation of hepatic inflammation[J].Adv Exp Med Biol,2010,660:5-18. DOI: 10.1007/978-1-60761-350-3_2.
[12] 钱秋海,钱卫斌,蔡欣蕊,等. 糖肝康对糖尿病脂肪肝大鼠肝脏PGC-1α、PPARα表达的影响[J]. 中华中医药杂志,2015,30(7):2525-2528.
EffectsofTanggankangonliverstructureandexpressionofPONindiabeticratswithacuteliverinjury
QianWeibin*,QianQiuhai,CaiXinrui,ZhangXinying,WangYingying.
*SchoolofMedicine,TottoriUniversityFacultyofMedicine,Yonago683-8503,Japan
Correspondingauthor:QianQiuhai,Email:qianqiuhai@126.com
ObjectiveTo observe the effects of Tanggankang on liver structure and expression of paraoxonase (PON) in diabetic rats with acute liver injury.MethodsA total of 90 adult male Wistar rats were selected to establish diabetic model by thioacetamide. A total of 50 successful model were divided into 5 groups (10 rats in each group): model control group, Huganning control group, Tanggankang small, medium and large dose groups according to random number method. The other 10 rats were assigned as normal control group. Rats in model control group and normal control group were given normal saline 10 ml/kg ig. Rats in Huganning control group were given Huganning mixed suspension 0.04 g/ml ig. Rats in Tanggankang small, medium and large dose groups were given Tanggankang 1 g/ml, 2 g/ml, 4 g/ml ig, respectively. After 12 weeks of administration, the rats in each group were treated with TAA 200 mg/kg intraperitoneally to induce acute liver injury. After 24 hours of anesthesia, rats were sacrificed and the liver were removed. The liver pathology were observed by Light microscope, and the expression of PON in liver tissues of rats were observed by immunohistochemistry.ResultsThe structure of liver tissue was changed in rats after treated with TAA, such as hepatic cell swelling, fatty degeneration and necrosis, ambiguous hepatic leaflets, fibroblasts and collagen fibers in portalarea. After treatment with Tanggankan, the disorders mentioned above were improved. The expression of PON was reduced in model control group compared with normal control group (F=3.130,Plt;0.01). Compared with model control group, the expression of PON were increased in different dose of Tanggankang group and Huganning group (F=3.130,Plt;0.05).ConclusionTanggankan may improve the pathological changes of acute liver injury induced by TAA, through the mechanism of increasing the expression of PON.
Tanggankang; Diabetes mellitus; Liver injury
山东省自然科学基金资助项目(ZR2012HM093);山东省中医药科学技术研究项目(2011-038)
10.3760/cma.j.issn.1673-4157.2016.05.06
6838503 鸟取,日本鸟取大学医学部(钱卫斌);250011 济南,山东中医药大学附属医院内分泌科(钱秋海,张新颖);250002 济南,山东省职业卫生与职业病防治研究院,山东省医学科学院(蔡欣蕊); 250002 济南市市中区人民医院(王营营)
钱秋海,Email:qianqiuhai@126.com
FundProgramProject of Natural Science Foundation of Shandong Province(ZR2012HM093); Science and Technology Research Project of Traditional Chinese Medicine in Shandong Province(2011-038)
2015-09-06)
