尿激酶辅助脑脊液引流治疗脑室出血及脑脊液炎症因子变化
2016-11-27陈尚军左毅王海燕李宝明惠军王辉谢国强张彬吴东飞马京库
陈尚军 左毅 王海燕 李宝明 惠军 王辉 谢国强 张彬 吴东飞 马京库
(陕西省核工业215医院:1神经外科; 2麻醉科,陕西 咸阳 712000)
·论著·
尿激酶辅助脑脊液引流治疗脑室出血及脑脊液炎症因子变化
陈尚军1左毅1王海燕2*李宝明1惠军1王辉1谢国强1张彬1吴东飞1马京库1
(陕西省核工业215医院:1神经外科;2麻醉科,陕西 咸阳 712000)
目的观察尿激酶对重度脑室出血(SVH)术后患者脑脊液中肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)表达的影响,探讨尿激酶治疗重度脑室出血减少继发性神经功能损害的理论依据。方法所有患者行侧脑室额角穿刺外引流术+腰大池引流术。术后治疗组向侧脑室注入10万U UK,对照组注入2万U UK。两组患者术后0.5 h、24 h、72 h、5 d、7 d从侧脑室引流管抽取引流脑脊液,拔除侧脑室引流管后,行腰大池引流术,第5天、第7天、第10天、第14天、第26天经腰大池引流管抽取脑脊液,采用双抗体夹心酶联免疫法检测脑脊液中上述细胞因子。结果治疗组脑脊液中TNF-α和IL- 1β水平显著低于对照组,临床疗效好于对照组,两组比较差异有统计学意义(Plt;0.05)。结论尿激酶可尽快清除重度脑室出血患者脑室内血肿,减少颅内感染,降低脑积水发生率,降低脑脊液中TNF-α、IL-1β因子含量,减轻神经功能损害,提高患者生存率及生活质量。
重度脑室出血; 大剂量尿激酶; 脑脊液; 肿瘤坏死因子-α; 白细胞介素- 1β
重度脑室出血(severe ventraventicular hemorrhage,SVH ),常采取侧脑室引流术,术后向脑室引流管注入尿激酶,溶解血凝块。近年关于脑出血后,患者血清中细胞因子含量变化报道较多,而脑脊液中细胞因子变化报道较少,特别是大剂量尿激酶对脑脊液中细胞因子影响,减少继发神经功能损害方面,更是鲜有报道。为观察大剂量尿激酶对SVH患者脑脊液中肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、白介素-1β (interleukin-1β,IL-1β)表达的影响,研究减少继发神经功能损害方法。我们自2013年6月至2015年8月,采用10万U注入治疗SVH,并观测脑脊液中 TNF-α和IL- 1β因子含量,旨在探讨大剂量尿激酶治疗SVH的疗效及机制。以期为SVH继发神经损害治疗提供新的视角。
对象与方法
一、一般资料
选取2013年6月至2015年8月我院收治的原发性脑室出血患者72例作为研究对象,男52例,女20例,年龄36~81岁,平均(54.37±10.29)岁;纳入标准:①均符合全国第四届脑血管病学术会议修订的标准。②经头颅CT或MRI和全脑血管造影证实。③根据Timothy等[1]改良的Graeb脑室出血临床分级标准,均为SVH。④发病到手术时间≤6 h。排除标准:①高血压造成脑实质出血未破入脑室者。②外伤性脑室血肿形成。③脑疝晚期者。④合并严重心脏、肝肾疾病或其他原因致凝血系列异常者。⑤发病到手术时间gt;7 h除外。经过医院伦理委员会批准、患者家属自行同意的情况下,按年龄、出血量、病情采用分层随机化原则,将患者分为治疗组与对照组。
二、临床表现
1.治疗组:37例,男28例,女9例,年龄39~81岁,平均(61.42±11.27)岁;浅昏迷 6例、中度昏迷 21 例、深昏迷11例;脑室出血量26~47 ml,平均36.5 ml。
2.对照组:35例,男24例,女11例,年龄36~79岁,平均(58.21±10.14)岁;浅昏迷 5 例、中度昏迷18例、深昏迷12例;脑室出血量24~45 ml,平均34.5 ml。两组的性别、年龄、病情及脑室出血量比较,经t检验差异无统计学意义,具有可比性。
三、分组
治疗组:行脑室外引流术后向侧脑室注入大剂量UK+腰大池引流术,对照组:行脑室外引流术后向侧脑室注入常规剂量UK+腰大池引流术。
四、影像学检查
所有患者均经Philips 128排头颅CT检查,为重度脑室出血,第三四脑室铸型。出血量经CT机自带软件(Philips Extended Brilliance Workplace V4.5)测量,治疗组出血量21~43 ml,平均(37±4.12)ml。双侧脑室铸型21例,一侧脑室铸型11例,5例为全脑室铸型。对照组出血量19~41 ml,平均(36±2.24)ml。双侧脑室铸型23例,一侧脑室铸型9例,3例全脑室铸型。
五、手术治疗
1.所有患者行侧脑室额角微创穿刺外引流术:治疗组:第1天用UK 5万IU+生理盐水5 ml注入一侧脑室,另一侧开放,2次/d,观察患者无不良反应,第2天改为UK 10万IU+生理盐水5 ml交替注入侧脑室,并夹管1 h,持续2~7 d。对照组:用UK 2万IU+生理盐水5 ml注入双侧脑室,2次/d;连续2~10 d。常规动态每天复查头颅CT。待脑室内血肿明显减少或消失,室间孔、中脑导水管、第三、四脑室已通畅,停止注射尿激酶。并夹闭引流管24 h,观察患者临床症状稳定,则予拔管。请麻醉科施行腰大池置引流管,持续引流脑脊液。两组治疗前后全程每天监测凝血四项指标变化。
2.侧脑室额角微创穿刺外引流术后0.5 h、24 h、72 h、7 d从侧脑室引流管抽取引流脑脊液,拔除侧脑室引流管后,行腰大池引流术,第5天、第7天、第14天、第26天经腰大池置管抽取脑脊液用双抗体夹心酶联免疫法检测细胞因子。
五、疗效标准
按第五届全国脑血管病学会议通过的“脑卒中患者临床神经功能缺损程度评分标准”进行后期疗效评定。
六、统计学方法

结 果
72例脑出血患者中,治疗组脑脊液中TNF-α和IL- 1β水平显著低于对照组(Plt;0.05,表1,2)。脑出血患者脑脊液中TNF-α和IL- 1β值,从发病时,开始上升,IL- 1β于发病后3天,脑脊液中数值最高,TNF-a值在脑出血后48 h达最高值。以后随时间推移逐渐降低。由研究发现脑脊液中IL- 1β值高于TNF-α值。经大剂量尿激酶注入后,脑脊液中TNF-α和IL- 1β值均低于对照组,且较对照组下降趋势明显,说明大剂量尿激酶可显著降低SVH患者脑脊液中细胞因子TNF-α和IL- 1β,并且未见对凝血指标有所影响,所有患者术后病情稳定后。经脑血管造影发现动脉瘤15例,未见异常57例。
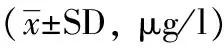

Groupn0.5h24h72h7d10d14d26d Treatment3721.36±10.2744.25±14.38a89.15±15.43a43.19±10.73a27.56±17.29a19.20±11.32a6.12±10.11a Control3522.28±18.5184.24±20.18136.21±41.1886.34±21.4060.15±23.5434.21±16.3417.19±11.26
aPlt;0.05,vscontrol group.
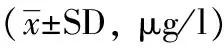

Groupn0.5h24h72h7d10d14d26d Treatment3773.42±19.2491.43±19.42a145.16±37.26a80.15±22.58a53.34±22.14a29.13±22.37a11.08±12.46a Control3576.15±20.19191.24±29.51243.56±37.42171.48±38.49121.45±38.1984.75±16.5736.44±19.26
aPlt;0.05,vscontrol group.
表3 两组临床疗效比较(例数,%)
Tab 3 Comparison of clinical effects between two groups (cases,%)
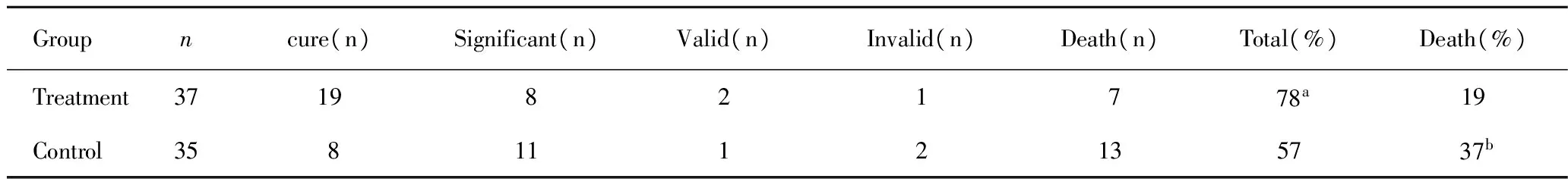
Groupncure(n)Significant(n)Valid(n)Invalid(n)Death(n)Total(%)Death(%) Treatment3719821778a19 Control3581112135737b
aPlt;0.05,vscontrol group;bPlt;0.05,vscontrol group.
讨 论
脑室出血(intraventricular hemorrhage,IVH)其致残率,死亡率均极高。分为原发性和继发性脑室出血。继发性脑室出血是脑实质出血或蛛网膜下腔出血破入脑室[1]。SVH国内平均死亡率43.2%,国外平均死亡率54.07%[2]。主要危害为:脑室内积血,造成脑室系统梗阻,使脑室急剧膨胀,颅内压增高,脑深部结构破坏,压迫丘脑下部及脑干,引起高热,呼吸循环功能障碍。血液破坏成分刺激等损伤,继发造成多脏器功能受损或衰竭而死亡。SVH手术技术已成熟。但脑室内血肿溶解慢,引流管留置时间长,颅内感染,脑积水发生率高。其高致残率目前还没有得到明显的改观。所以尽快溶解血肿,打通脑脊液循环通路,减少继发神经损害及脑积水,在提高SVH患者的预后及生活质量方面,有着至关重要的作用。SVH对患者造成的损伤除血肿对周围组织压迫产生的直接破坏作用外,还可刺激机体产生凝血酶、铁和亚铁血红蛋白等免疫反应,激活大量炎性细胞产生细胞因子,使其浓度在血液、脑脊液等体液中明显增高,对脑组织及神经产生毒害作用。包括IL-1、IL-6、IL-10、TNF-α等因子。其中最主要的是因子TNF-α、IL-1。TNF-α可以刺激各种炎性细胞释放白细胞介素,同时激活白细胞和血小板产生血小板激活因子。促进和维持炎症反应的发生、发展,造成脑血管和组织的进一步破坏[4]。IL-1主要由单核巨噬细胞产生,包括 IL-1α、和 IL-1β,IL-1γ3种类型,IL-1β与脑出血密切相关。SVH后患者脑脊液中IL- 1β因子含量增高,可能与血脑屏障破坏,局部IL- 1β进入蛛网膜下腔,也可能是出血后刺激神经胶质细胞表达IL- 1βmRNA增强,使其分泌增加[5]。IL-1β在急性颅脑损伤早期的高水平表达可能是引起继发性脑水肿、脑组织缺血以及缺氧的病理生理学基础[6]。相关研究证实,患者病情越重,炎性免疫反应越强烈,对脑组织细胞的损害也越严重[7,8]。如何快速降低这些有害细胞因子在SVH治疗中显得尤为重要。传统SVH治疗常采用侧脑室外引流术,经验性用生理盐水5 ml加小剂量尿激酶(urokinase,UK)(1万~3万U)注入。术后行腰椎穿刺释放血性脑脊液。血肿溶解慢,引流管留置时间长,颅内感染,脑积水发生率高。而(5万~10万U)UK为大剂量[9]。我们采用10万U注入,可快速溶解脑室积血,改变脑脊液中 TNF-α和IL- 1β因子含量,减轻神经功能损害。大多数学者研究脑实质内出血后,血清及脑脊液中细胞因子变化,经科技查新证实目前国内没有人研究,SVH患者脑室注入大剂量(10万U)尿激酶后,脑脊液中细胞因子变化情况。
我们认为IVH后患者机体发生应激反应激活了体内单核巨噬细胞系统,激发TNF-α产生,再通过细胞因子级联反应诱导其他细胞因子,如IL-1 和 IL-6等产生加重脑损伤。过量的TNF-α可引起患者免疫病理损伤,同时还可导致机体免疫调节机制的紊乱[10]。因此,下调 TNF-a水平对保护神经元有重要意义。本组研究发现,在SVH术后脑脊液中TNF-α和IL-1β因子逐渐上升,在30 min、24 h、48 h、72 h、7 d、10 d、14 d、26 d脑脊液标本中发生规律性变化。出血30 min在患者脑脊液中就能检测到,后逐渐上升,一般在72 h达到最高值,后逐渐下降。26 d时对照组脑脊液中仍能检出。治疗组TNF-α和IL-1β因子含量在注入大剂量尿激酶后明显低于对照组,两组间有统计学差异(Plt;0.05)。由(表1,2)发现SVH术后TNF-α和IL-1β因子含量在注入大剂量尿激酶后,仍继续规律上升,但上升幅度降低,峰值减小,速度减缓,仍旧在72 h达到高峰,随后逐渐下降,下降速度较对照组明显增快,在14 d时,脑脊液中只能检出极少量因子,而对照组TNF-α和IL-1β因子含量仍旧维持在较高水平。通过(表3)发现治疗组SVH术后TNF-α和IL-1β水平较高者的临床神经功能缺损严重,治疗组总有效率为78%,对照组为57%,两组间统计学差异明显(Plt;0.05)。提示TNF-α和IL-1β是导致SVH后炎症反应的重要介质,是判断预后和治疗效果的重要指标。有研究表明IL-1β在颅内参与几乎所有的病理过程,与脑卒中密切相关,并随颅脑损伤的加重而逐渐升高[11,12]。因此减少SVH患者脑脊液TNF-α和IL- 1β 含量,减少由此继发的神经功能损伤显得尤为重要。脑脊液TNF-α和IL- 1β数值越大,患者脑损伤越严重,预后越差。故患者脑脊液中TNF-α和IL- 1β含量与患者预后密切相关。可通过脑脊液中TNF-α和IL- 1β含量,判断患疾病严重程度及预后。本组中治疗组患者治愈率明显高对照组,病死率明显低于对照组,研究表明SVH患者血肿量的大小可作为患者预后判断的指标之一。SVH后炎性细胞因子的水平变化、血肿量与疾病的转归密切相关。血肿量越大,脑脊液中炎性细胞因子含量越高,炎症反应越重,预后越差。我们发现:应用大剂量尿激酶早期清除血肿,可减少血肿对周围组织压迫,减少血肿周围继发性缺血、凝血酶、血红蛋白分解、炎症细胞浸润等多种细胞因子损害,减轻神经损害,保护神经功能,减轻脑积水,研究表明:患者形成交通性脑积水的发生率无变化[13],形成梗阻性脑积水的几率下降。故尽快打通脑脊液循环,可减少梗阻性脑积水的发生。对改善预后及降低病死率,提高生活质量至关重要。本研究测定SVH患者术后脑脊液中细胞因子,并研究注入大剂量尿激酶后对其影响,研究其含量与大剂量尿激酶关系,较常规观察患者血清中细胞因子变化更直观,明确,准确性更高。更能反映出血后血肿灶中细胞因子的真实变化。
本研究首次提出大剂量尿激酶注入脑室,对SVH患者脑脊液中TNF-α和IL- 1β的影响。为减少SVH后患者神经功能损害及脑积水形成提供依据。证明大剂量尿激酶对细胞因子有改善作用,可减轻神经功能损害改善患者预后。为SVH患者外科治疗开辟新途径,对改善患者预后有重要临床价值。
1Morgan TC,Dawson J,Spengler D,et al. The modified Graeb Score:an enhanced tool for intraventricular hemorrhage measurement and prediction of functional outcome [J]. Stroke,2013,44 (3):635 -641.
2Ziai W,Moullaali T,Nekoovaght-Tak S,et al. No exacerbation of perihematomal edema with intraventricular tissue plasminogen activator in patients with spontaneous intraventricular hemorrhage [J]. Neurocrit Care,2013,18(3):354-361.
3张明伟,彭俊,刘阳,等. 高血压脑出血患者血清和颅内血肿液中IL-1β、IL-6、TNF-α的含量研究 [J]. 中华神经外科疾病研究杂志,2010,9(2):138-141.
4张健,陈干涛. 急性脑出血患者IL-6和TNF-α水平与预后的关系 [J]. 实用癌症杂志,2012,27(6):652.
5李娜,时丹丹,程晋成,等. 脑出血患者脑脊液和血清中白介素-1β差异表达及其意义 [J]. 中国现代医学杂志,2014,24(36):55-57.
6Reinsfelt B,Ricksten SE,Zetterberg H,et al. Cerebrospinal fluid markers of brain injury,inflammation,and blood brain barrier dysfunction in cardiac surgery [J]. Ann Thorac Surg,2012,94(2):549-555.
7李万峰,任徊明. 奥拉西坦应用于高血压脑出血患者的临床疗效观察 [J]. 中国伤残医学,2012,20(12):72-73.
8王创国,代鲜鸽,宁静,等. 早期应用丹参注射液治疗高血压脑出血80 例 [J]. 陕西医学杂志,2010,39(9):1222-1224.
9熊章盛. 穿刺引流术中应用尿激酶治疗老年高血压脑出血的疗效观察 [J]. 中国实用神经疾病杂志,2015,24(18):46-47.
10闫金磊,左毅,李宝明. 高血压脑出血术后残余血肿量对脑脊液细胞因子的影响 [J]. 中华神经外科疾病研究杂志,2013,12(4):332-335.
11Song B,Li C,Sun L,et al. The relationship between interlukin-1 gene polymorphism and ischemic stroke [J]. Acta Academic Med Qingdao Univ,2012,48(4):313-316.
12Stemkowski PL,Smith PA. Long-term IL-1β exposure causes ganglion neuron excitability subpopulation-dependent alterations in rat dorsal root ganglion neuron excitability [J]. J Neurophysiol,2012,107(6):1586-1597.
13付禹尧,顾应江. 脑室出血的研究进展 [J]. 国际神经病学神经外科学杂志,2013,40 (5):439-442.
EffectofcerebrospinalfluiddrainagecombinedwithurokinaseinthetreatmentofsevereintraventricularhemorrhageandthechangesofCSFinflammationfactors
CHENShangjun1,ZUOYi1,WANGHaiyan2,LIBaoming1,HUIJun1,WANGHui1,XIEGuoqiang1,ZHANGBin1,WUDongfei1,MAJingku1
1DepartmentofNeurosurgery;2DepartmentofAnesthesia,NuclearIndustry215HospitalofShaanxiProvince,Xianyang712000,China
ObjectiveThe effect of urokinase on the expressions of tumor necrosis factor-α and interleukin-1β in cerebrospinal fluid after severe intraventricular hemorrhage (SVH) was observed and the theoretical basis of urokinase ameliorating the secondary neurological damage was studied.MethodsAll the patients were performed the lateral venticulopuncture drainage combined with lumbar drainge. The treatment group was injected 100000 IU UK after operation,while the control group was injected 20000 IU UK. In both two groups,TNF-α and IL-1β of CSF from lateral ventricle drainage tube were detected at 0.5 h,24 h,72 h,5 d,7 d after operation,and they were detected at 5 d,7 d,10 d,14 d,26 d by the lumbar drainage after removing the lateral ventricle drainage tube. Expressions of TNF-α and IL-1β of CSF were tested by enzyme-linked immunoassay.ResultsThe expressions of TNF-α and IL-1β in treatment group were significantly lower than those of control group and the clinical effect was better than that of the control group with the significant statistical difference (Plt;0.05).ConclusionThe treatment of urokinase injection can remove the brain hematoma quickly,reduce the intracranial infection and hydrocephalus and the expressions of TNF-α and IL-1β in CS,alleviate the neurological damage,improve the patients' survival rate and the quality of life.
SVH; high-dose urokinase injection; Cerebrospinal fluid; TNF-α; IL-1β
1671-2897(2016)15-338-04
R 651.1
A
陕西省社会发展科技攻关基金资助项目(2015SF006)
陈尚军,副主任医师,E-mail:chenshangjun3@163.com
*通讯作者:王海燕,副主任医师,E-mail:wanghaiyan2000@163.com
2015-09-03;
2016-04-20)
