NAC调控HIF-1α抑制胶质瘤细胞生长的作用研究
2016-11-27谢江涛苏永永吴鹏昌向毅王世峰武兴兴姜海涛
谢江涛 苏永永 吴鹏昌 向毅 王世峰 武兴兴 姜海涛
(1咸阳市中心医院神经外科,陕西 咸阳 712000; 2西安交通大学一附院神经外科,陕西 西安 710061)
·论著·
NAC调控HIF-1α抑制胶质瘤细胞生长的作用研究
谢江涛1*苏永永1吴鹏昌1向毅1王世峰1武兴兴1姜海涛2
(1咸阳市中心医院神经外科,陕西 咸阳 712000;2西安交通大学一附院神经外科,陕西 西安 710061)
目的研究N-乙酰半胱氨酸(NAC)通过抑制低氧诱导因子-1α(HIF-1α)表达,进而抑制SHG-44胶质瘤细胞生长的作用研究。方法对照组为常规培养的SHG-44胶质瘤细胞,NAC组为常规培养基础上加入N-乙酰半胱氨酸,两组培养48 h后实时荧光定量逆转录酶聚合酶联反应(RT-PCR)检测HIF-1αmRNA的表达,四甲基偶氮唑盐比色法(MTT)检测SHG-44胶质瘤细胞增殖情况,流式细胞仪检测SHG-44胶质瘤细胞凋亡情况。结果NAC组HIF-1α mRNA的表达水平明显低于对照组,差异有统计学意义(Plt;0.05)。MTT检测SHG-44胶质瘤细胞增殖情况,NAC组明显低于对照组,差异有统计学意义(Plt;0.05)。NAC组早期凋亡率、晚期凋亡及坏死率均高于对照组,差异有统计学意义(Plt;0.05)。结论N-乙酰半胱氨酸具有下调低氧诱导因子-1α表达,进而抑制SHG-44胶质瘤细胞生长,加速凋亡的作用。
N-乙酰半胱氨酸; 胶质瘤; 低氧诱导因子-1α
胶质瘤是颅内最常见的原发性恶性肿瘤,胶质瘤预后较差及高复发率至今仍是困扰神经外科的难题,因此积极探索针对胶质瘤的治疗靶点具有重要的理论及实际意义。胶质瘤瘤体的快速增殖使其处于一种相对低氧的状态,在这种条件下低氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)表达增高,从目前的研究得知HIF-1α可诱导激活多种靶基因表达相应的下游产物从而使胶质瘤细胞适应低氧应激反应[1,2]。因此抑制HIF-1α的表达降低胶质瘤细胞适应微环境从而抑制胶质瘤细胞生长有可能成为辅助治疗的一个新靶点。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)是一种典型的外源性抗氧化剂,NAC的作用机制主要是通过细胞膜脂质双分子层进入细胞质后进行乙酰化反应,具有拮抗氧化应激的作用,且研究指出NAC可下调HIF-1α的表达[3]。本次试验拟研究NAC通过抑制HIF-1α表达,进而抑制SHG-44胶质瘤细胞生长的作用,为研究胶质瘤的生物学行为及治疗靶点提供新的思路和理论依据。
材料与方法
一、主要材料与仪器
胶质瘤SHG-44瘤株购于中科院上海细胞研究所,N-乙酰半胱氨酸购于SIGMA公司,细胞凋亡检测试剂盒购于健康元生物医药有限公司,实时荧光定量聚合酶联反应试剂盒购于Fermentas公司。流式细胞分析仪(美国BD FACSCalibur,型号:DICKIN SON),多重实时荧光定量PCR仪(型号:Bio-Rad iQTM5)等。
二、细胞系的培养与实验分组
SHG-44胶质瘤细胞株采用DMEM细胞培养液在 37℃,5%CO2培养箱中培养。对照组:常规培养SHG-44胶质瘤细胞。NAC组:常规培养SHG-44胶质瘤细胞+N-乙酰半胱氨酸(浓度为10 mmol/L,培养48 h)。
三、实时荧光定量逆转录酶-聚合酶联反应(real-time reverse transcriptase polymerase chain reaction,RT-PCR)检测HIF-1α的mRNA表达
两组到达培养时间后,RNA提取试剂盒(RNAfast200)快速抽提RNA。设定反应条件后置于多重实时荧光定量PCR仪中进行反应,反应中止后采集实验数据(实时PCR iQTM5专用软件),扩增曲线及溶解曲线分析。
四、四甲基偶氮唑盐比色法(4-dimethylthiahiazo,MTT)检测细胞增殖
两组到达培养时间后,接种于96孔板,每孔加入20 μl MTT溶液(5 mg/ml),孵育4 h,使MTT还原为蓝色结晶物Formazan,吸弃上清加入二甲亚枫(dimethyl sulfoxide,DMSO)150 μl,产物完全溶解,MK3酶标仪(波长:492 nm)检测每孔吸光度(optical density,OD值)并计算各组相对抑制率。
五、流式细胞仪检测细胞凋亡
两组到达培养时间后,转入10 ml离心管中离心,弃上清后再离心一次并弃上清,每孔加入500 μl的BindingBuffer,加入5 μl细胞凋亡检测试剂(Annexin V-FITC),再加入10 μl Propidium lodide,轻轻混匀后转入1.5 ml EP管中,室温下避光反应15 min。随后使用流式细胞仪(488 nm激发波长530 nm发射波长)检测细胞凋亡。
六、数据统计
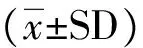
结 果
一、RT-PCR检测HIF-1α的mRNA表达情况
实验原始数据采用比较Ct法2-△△CT(2-△△CT=2-(实验组目的基因-实验组参照基因)-(对照组目的基因-对照组参照基因))进行统计学数据分析NAC组1.07±0.36与对照组0.22±0.06,HIF-1a及β-actin的溶解曲线和扩增曲线(图1)。对照组及NAC之间进行t检验,存在统计学差异(Plt;0.05)。NAC组HIF-1a的mRNA表达明显低于对照组,差异有统计学意义(Plt;0.05)。
二、MTT法检测SHG-44胶质瘤细胞增殖情况
数据采用t检验的统计方法分析,Plt;0.05表示存在统计学差异。NAC组较对照组细胞的吸光度(OD值)明显下降,差异有统计学意义(Plt;0.05)。NAC组较对照组相对抑制率明显升高,差异有统计学意义(Plt;0.05)(表1)。
三、流式细胞仪检测各组细胞凋亡率
数据采用流式软件分析后的原始数据表示,数据采用χ2检验的统计方法分析,Plt;0.05表示存在统计学差异。对照组及NAC组早期凋亡率、晚期凋亡及坏死率如下表示(表2、图2),对照组早期凋亡率、晚期凋亡及坏死率均低于NAC组,差异有统计学意义(Plt;0.05)。

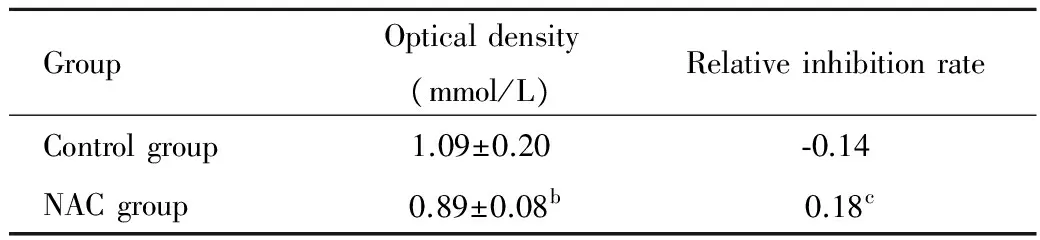
GroupOpticaldensity(mmol/L)Relativeinhibitionrate Controlgroup1.09±0.20⁃0.14 NACgroup0.89±0.08b0.18c
bPlt;0.05,vscontrol group;cPlt;0.05,vscontrol group.
表2 流式细胞仪检测对照组及NAC组细胞凋亡率
Tab 2 Apoptosis rate between the control group and NAC group detected by flow cytometry

GroupEarlyapoptosisrate(%)Apoptosisandnecrosisrate(%) Controlgroup3.22d16.00e NACgroup9.6618.72
dPlt;0.05,vsNAC group;ePlt;0.05,vsNAC group.

图1 实时荧光定量PCR的溶解曲线和扩增曲线
Fig 1 Dissolution curve and amplification curve of RT-PCR
A:Amplification curve of HIF-1α; B:Dissolution curve of HIF-1α; C:Amplification curve of β-actin; D:Dissolution curve of β-actin.
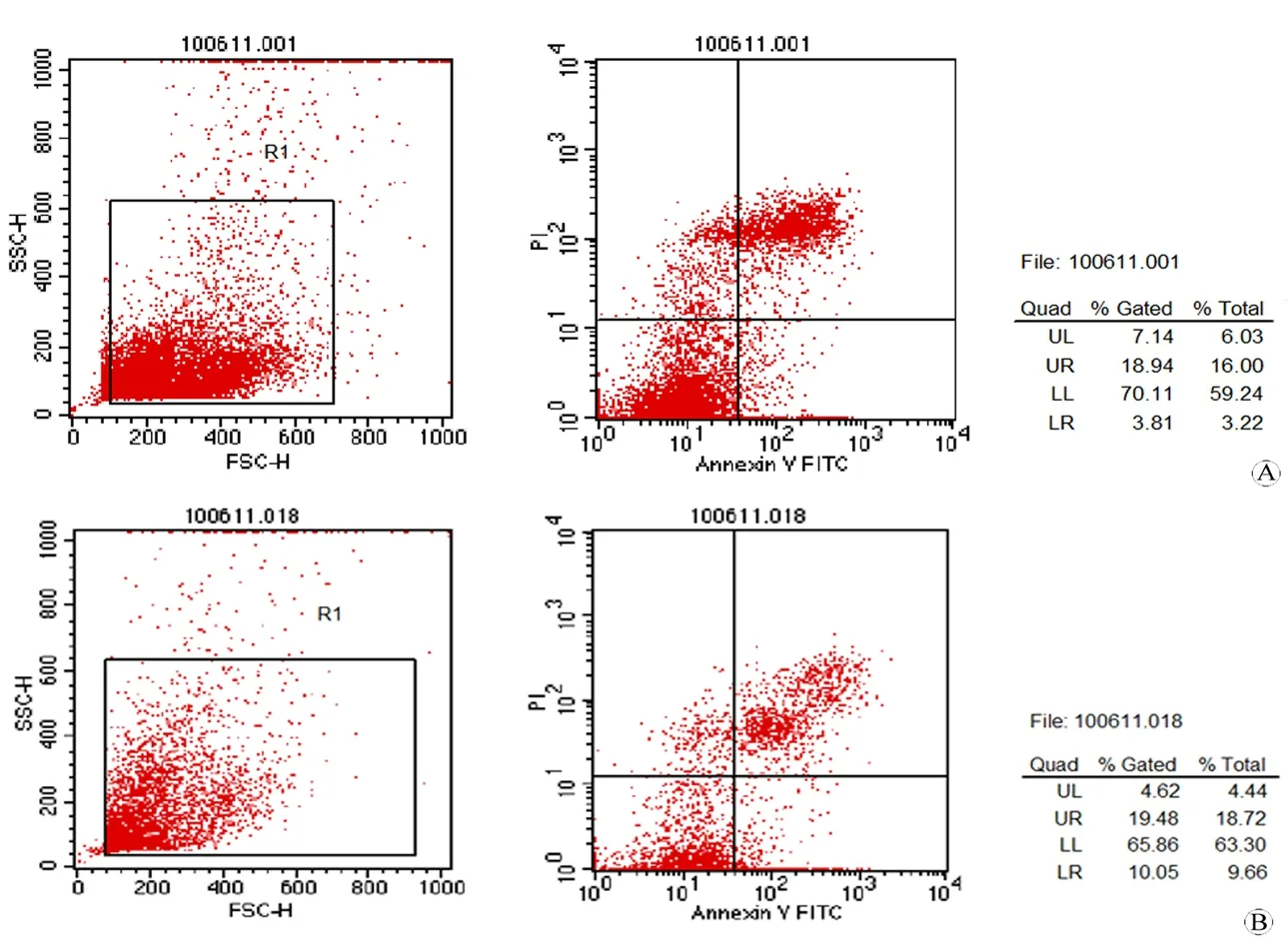
图2 对照组及NAC组的早期凋亡、晚期凋亡及坏死率
Fig 2 The early apoptosis rate,apoptosis and necrosis rate in control group and NAC group
A:Control group; B:NAC group.
讨 论
人脑胶质瘤是中枢神经系统最常见的原发性恶性肿瘤,尽管对于胶质瘤的治疗采取了积极的手术切除及术后放疗和化疗等综合治疗方法,但胶质瘤预后较差及高复发率仍是困扰神经外科的难题,因此积极探索针对胶质瘤的治疗靶点具有重要的理论及实际意义。
胶质瘤与其他实体性肿瘤相类似,瘤细胞因生长失控使其增殖、代谢异常旺盛,其内部瘤细胞总是处于一种相对低氧的状态,在这种低氧条件下低氧诱导性因子-1α(HIF-1α)表达明显增高。HIF-1α在应对低氧微环境时,能调节多种涉及低氧应激下细胞适应和存活的靶基因,增加其转录活性并表达相应的产物以适应低氧应激反应,从而维持肿瘤的生长、代谢及其侵袭性,使其适应缺氧微环境,因此对HIF-1α的调控必然成为胶质瘤适应低氧微环境的核心点[4]。
肿瘤组织因生长失控,局部的血管系统已经不能为快速生长的肿瘤组织提供足够的氧气,其内部组织细胞总是处于一种相对低氧的状态,肿瘤细胞在低氧情况下以糖酵解的代谢方式为主,通过抑制线粒体呼吸链、降低线粒体的膜电位,因此线粒体有氧呼吸电子转运链有可能因受阻而产生活性氧[5]。
活性氧[6]是线粒体的电子转运链在运氧过程中电子遗漏,基态氧通过转运链时接受漏出的电子转变的一种氧化应激物。肿瘤细胞在低氧情况下以糖酵解的代谢方式为主,因此线粒体有氧呼吸电子转运链有可能因受阻而产生活性氧,已有研究证实NAC可显著拮抗活性氧氧化应激的作用[7]。
NAC是一种典型的外源性抗氧化剂[8],其作用机制主要是通过N-乙酰半胱氨酸中的巯基基团, 穿过细胞膜脂质双分子层进入细胞质后进行乙酰化反应并由N-乙酰半胱氨酸转变成半胱氨酸,而半胱氨酸上的巯基基团是NAC抗氧化作用的活性基团,巯基基团到达作用位点后可结合活性氧中的超氧阴离子自由基(O2·-),进而拮抗活性氧氧化应激的作用。有研究认为NAC可通过拮抗活性氧进而调控HIF-1α[9,10]。本次实验中也发现NAC作用后HIF-1α mRNA的表达水平明显低于对照组,进一步验证了这一观点。
通过本实验的研究明确NAC具有下调HIF-1α表达,进而抑制SHG-44胶质瘤细胞生长,加速凋亡的作用。提示抑制HIF-1α的表达降低胶质瘤细胞适应微环境从而抑制胶质瘤细胞生长有可能成为辅助治疗的一个新靶点。本实验为抗氧化剂NAC辅助治疗胶质瘤提供了新的思路和理论依据,为进一步研究抗氧化剂在胶质瘤的辅助治疗中的应用打下了一定的基础。
1Huimin Lu,Yan Li,M Shu,et al. Hypoxia-inducible factor-1a blocks differentiation of malignant gliomas [J]. J FEBS,2009,276(24):7291-7304.
2唐彬秩,赵凤艳,屈艺,等. 低氧诱导因子-1α:调节肿瘤生物学行为的关键因子 [J]. 生命的化学,2009,29(2):184-188.
3Tajima M,Kurashima Y,Sugiyama K,et al. The redox state of glutathione regulates the hypoxic induction of HIF-1 [J]. Eur J Pharmacol,2009,606(1-3):45 -49.
4Yee Koh M,Spivak-Kroizman TR,Powis G,et al. HIF-1 regulation:not so easy come easy go [J]. Trends Biochem Sci,2008,33(11):526-534.
5Shen SC,Wu MS,Lin HY,et al. Reactive oxygen species-dependent nitric oxide production in reciprocal interactions of glioma and microglial cells [J]. J Cell Physiol,2014,229(12):2015-2026.
6Hamanaka RB,Chandel NS. Mitochondrial reactive oxygen species regulate hypoxic signaling [J]. Cell Biology,2009,21(15):894-899.
7Spagnuolo G,D'Anto V,Cosentino C,et al. Effect of N-acetyl-L-cysteine on ROS production and cell death caused by HEMA in human primary gingival broblasts [J]. Biomaterials,2006,12(7):1803-1809.
8Tajima M,Kurashima Y,Sugiyama K,et al. The redox state of glutathione regulates the hypoxic induction of HIF-1 [J]. Eur J Pharmacology,2009,606(1-3):45-49.
9Galanis A,Pappa A,Giannakakis A,et al. Reactive oxygen species and HIF-1 signalling in cancer [J]. Cancer Letter,2008,266(1):12-20.
10Ganguli A,Choudhury D,Datta S,et al. Inhibition of autophagy by chloroquine potentiates synergistically anti-cancer property of artemisinin by promoting ROS dependent apoptosis [J]. Biochimie,2014,107(Pt B):338-349.
NACregulatingHIF-1αinhibitsthegrowthofgliomacells
XIEJiangtao1,SUYongyong1,WUPengchang1,XIANGYi1,WANGShifeng1,WUXingxing1,JIANGHaitao2
1DepartmentofNeurosurgery,XianyangCentralHospital,Xianyang712000;2DepartmentofNeurosurgery,TheFirstAffiliatedHospitalofXi'anJiaotongUniversity,Xi'an710061,China
ObjectiveThe N-acetyl-L-cysteine (NAC) inhibits the expression hypoxia-inducible factor-1α (HIF-1α) and further inhibits the growth of SHG-44 glioma cells.MethodsSHG-44 glioma cells for conventional culture was control group. N-acetyl-L-cysteine was added in NAC group. The mRNA expressions of HIF-1α was detected by RT-PCR after 48 h; 4-dimethylthiahiazo (MTT) detection was used to test the proliferation of SHG-44 glioma cells and the apoptosis of SHG-44 glioma cells was detected by flow cytometry method.ResultsThe expression of HIF-1α mRNA in NAC group was significantly lower than that in the control group (Plt;0.05). The proliferation of SHG-44 glioma cells was detected by MTT assay,and the proliferation in the NAC group was significantly lower than that of the control group (Plt;0.05). The early apoptosis rate,apoptosis and necrosis rate in NAC group were significantly higher than those in control group (Plt;0.05).ConclusionNAC could down-regulate the expression of HIF-1α,which could accordingly inhibit the growth of SHG-44 glioma cells and accelerate the apoptosis.
N-acetyl-L-cysteine; Glioma; Hypoxia-inducible factor-1α
1671-2897(2016)15-321-04
R 739.41
A
谢江涛,硕士,主治医师,E-mail:Jack.198376@163.com
*通讯作者:谢江涛,硕士,主治医师,E-mail:Jack.198376@163.com
2015-07-20;
2016-01-10)
