超声针联合微泡干预尿激酶溶解体外血凝块
2022-03-22唐君辉唐家伟廖依依徐亚丽
唐君辉,唐家伟,朱 琼,廖依依,徐亚丽,刘 政
(陆军军医大学新桥医院超声科,重庆 400037)
颅内血肿常继发于脑血管意外和颅脑外伤,如不能及时清除,其占位效应引起的颅内压剧烈增高及周边脑组织毒性水肿可致脑疝、神经损伤等一系列不可逆损伤[1-3];及时清除脑血肿对改善预后极为重要[4],但传统开颅手术可引起脑组织损伤、脑室间隔压差改变及术后感染等风险[5]。
超声空化效应可破坏血栓内部纤维蛋白,增加组织间隙,为纤维蛋白溶解药提供更多结合位点,进而增强溶栓效果[6-8];超声联合微泡可降低空化阈值,增加空化强度,破坏血栓作用更为显著[9-13];声辐射力带动周边流体形成的声流可进一步加速药物向血栓内部渗透[14]。
超声针为变幅杆式微创超声治疗设备,有别于一般超声于病变外进行辐照的治疗方式[15],其压电陶瓷换能器后置,利用一根前置变幅杆将能量及振幅传递至针尖处,并达到最大能量,可避免直接接触病变组织对陶瓷晶片的损伤,同时纤细的变幅杆可作为穿刺针靶向病变组织,实现病变内超声治疗。本研究观察超声针联合微泡对尿激酶溶解体外血凝块的干预效果。
1 材料与方法
1.1 制备体外血凝块 以移液枪将5%氯化钙溶液200 μl与10 ml无菌抗凝新生牛全血(北京索莱宝生物科技有限公司)在半切离心管(50 ml离心管沿25 ml刻度线切开)内混合,于37℃恒温水浴锅中孵育3 h,形成血凝块。
1.2 设备与方法
1.2.1 设备及主要参数 超声针(定制于江苏百航超声科技有限公司),中心频率29.62 kHz,针尖直径1.8 mm,工作时针尖前后、上下、左右3个方向的振幅分别为69.17、1.03、0.61 μm,针杆外附直径2.5 mm针鞘,用于注射药物。见图1。
1.2.2 干预方法 将40个血凝块随机分为5组,每组8个,分别予以不同干预。单纯超声组:将超声针插入血凝块中心,以铁架台固定,治疗8 min;单纯尿激酶组:将100 000 IU尿激酶冻干粉(武汉人福药业有限公司)溶解于20 ml 0.9%生理盐水,制成5 000 IU/ml尿激酶溶液,采用微量注射泵(LD-P2020II,上海兰德医疗光学仪器有限公司)以15 ml/h流率经针鞘注入血凝块中,注射时间8 min,注射量2 ml;超声针+尿激酶组:超声针治疗8 min,注射2 ml尿激酶溶液;超声+生理盐水组:超声针治疗8 min,注射2 ml生理盐水;超声针+尿激酶+微泡组:于超声针+尿激酶组干预基础上,在尿激酶溶液中加入0.01 ml自制微泡(脂氟显,全氟丙烷脂质微泡,0.45×107~0.85×107MB)。将血凝块在37℃水浴锅中孵育1 h,以细针沿离心管管壁小心分离后,以磷酸盐缓冲液(phosphate buffer saline, PBS)清洗3次并以滤纸吸干血凝块表面液体,采用电子天平(UTP-313,中国上海花潮电器有限公司)称重(Wafter)。计算血凝块溶解量(W0)及溶解率。W0=Wbefore-Wafter,溶解率=W0/Wbefore×100%。Wbefore为治疗前血凝块质量。
1.2.3 扫描电镜及大体标本观察 血凝块称重后,于超声+生理盐水组之外的4组分别随机挑选3个血凝块,沿针道采集样本,置于2.5%戊二醛(北京索莱宝生物科技有限公司)中48 h,以PBS清洗,再经25%~100%乙醇梯度脱水后用叔丁醇法干燥。将样本置于扫描电镜(ZEISS, Crossbeam340)下观察。以4%多聚甲醛固定其余血凝块24 h后,沿针道切开观察。
1.2.4 药物渗透试验 将细胞膜特异性橙红色荧光染料1,1′-双十八烷基-3,3,3′,3′-四甲基吲哚羰花青高氯酸盐(DiI)以1∶10(mg∶ml)溶解于二甲亚砜(dimethyl sulfoxide, DMSO)。取9个体外血凝块,随机分为3组,每组3个。对照组:将超声针插入血凝块中,不启动,仅采用微量注射泵(LD-P2020II,上海兰德医疗光学仪器有限公司)以15 ml/h流率将2 ml DiI溶液经针鞘注入其内;超声组:超声针治疗8 min,同时注射2 ml DiI溶液;超声+微泡组:在超声组基础上向DiI溶液中加入0.01 ml自制微泡。完成干预后即刻以PBS清洗血凝块3次,行冰冻切片;以荧光显微镜(Olympus, BX63)观察DiI渗透情况。
1.3 统计学分析 采用SPSS 23.0统计分析软件。计量资料以±s表示,多组间比较采用单因素方差分析,以LSD-t法两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 W0及溶解率 干预前各组血凝块质量Wbefore总体差异无统计学意义(P>0.05),干预后各组W0及溶解率总体差异均有统计学意义(P均<0.01);组间两两比较,超声+尿激酶组与超声+尿激酶+微泡组间W0及溶解率差异均无统计学意义(P均>0.05),其余3组间W0及溶解率两两比较差异均有统计学意义(P均<0.05)。见表1。
表1 各组干预前血凝块质量及干预后W0、溶解率比较(±s)

表1 各组干预前血凝块质量及干预后W0、溶解率比较(±s)
组别Wbefore(g)W0(g)溶解率(%)单纯超声组(n=8)11.16±0.290.23±0.102.00±0.90超声+生理盐水组(n=8)11.26±0.130.40±0.13∗3.58±1.13∗单纯尿激酶组(n=8)11.17±0.250.61±0.19∗#5.44±1.62∗#超声+尿激酶组(n=8)11.20±0.222.44±0.14∗#△21.75±1.45∗#△超声+尿激酶+微泡组(n=8)11.14±0.712.54±0.17∗#△22.74±1.44∗#△F值0.38476.95474.19P值0.82<0.01<0.01
注:*:与单纯超声组比较,P<0.05;#:与超声+生理盐水组比较,P<0.05;△:与单纯尿激酶组比较,P<0.05
2.2 大体标本及扫描电镜所见 大体标本中,相比单纯超声组和单纯尿激酶组,超声+尿激酶组和超声+尿激酶+微泡组内部溶解区域显著增加,且后者更显著,见图2。扫描电镜下,未经干预的血凝块内见清晰的纤维蛋白网包裹红细胞;单纯超声组见被破坏的纤维蛋白及红细胞碎片覆盖在血凝块表面;单纯尿激酶组纤维蛋白丝呈模糊溶解状态贴附于红细胞表面;超声+尿激酶组及超声+尿激酶+微泡组纤维蛋白数量较单纯尿激酶组明显减少;相比超声+尿激酶组,超声+尿激酶+微泡组表面出现凹陷,且红细胞形变更严重。
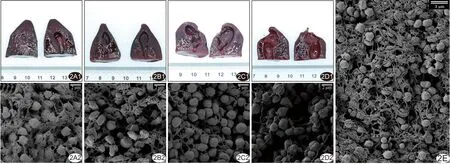
图2 各组大体标本图及扫描电镜观察图(×2 000) A1~D1.分别为单纯超声组、单纯尿激酶组、超声+尿激酶组和超声+尿激酶+微泡组大体标本图; A2~D2.分别为单纯超声组、单纯尿激酶组、超声+尿激酶组和超声+尿激酶+微泡组扫描电镜图; E.未经干预血凝块扫描电镜图
2.3 DiI渗透试验 荧光显微镜下,对照组针道表面光滑平整,可见荧光,血凝块内未见破坏及荧光;超声组及超声+微泡组均见血凝块组织疏松,DiI渗透深远,满视野荧光,针道扩大,表面破坏,以超声+微泡组缺损面积更大、DiI渗透更深。见图3。
3 讨论
脑血肿体积较大时占位效应明显,需要快速清除排出;不具备开颅手术条件时,可采用微创钻孔引流,以迅速缓解病情,争取救治时间[16]。超声针可通过微创穿刺方式抵达脑血肿,联合尿激酶快速溶解血栓,以清除血肿。
为观察超声针联合尿激酶的溶栓效果,本研究首先制备牛血凝块,而后将超声针置于其中,发现超声+尿激酶+微泡组和超声+尿激酶组对于血块的溶解率均高于单纯尿激酶组、超声+生理盐水组及单纯尿激酶组,且大体标本可见超声+尿激酶+微泡组、超声+尿激酶组内部溶解区域均比单纯超声组、单纯尿激酶组显著增大,提示超声针联合尿激酶可协同促进血凝块溶解。
本研究发现超声+生理盐水组的W0及溶解率均高于单纯超声组。超声空化效应可机械破坏血栓组织,但单纯超声针的机械破坏作用有限;液体经针鞘输入时,被高速振动的针尖击破为小液滴,为声空化提供了空化核,增强空化效应对血凝块的破坏作用[14,17-18];且给予额外空化核,即联合用于微泡,可进一步加强超声的空化作用。
DiI的分子量为尿激酶的2倍以上。本研究荧光显微镜观察结果显示,经超声针作用后,DiI可明显渗入血凝块内部。经超声空化破坏后的血凝块组织间隙增大,尿激酶可充分渗透,溶解更迅速。镜下微观结果提示,联合应用超声针、尿激酶及微泡能增强对血凝块的机械破坏作用,但超声+尿激酶组与超声+尿激酶+微泡组称重结果差异无统计学意义。既往研究[19]显示,微泡可明显增加微射流、自由基及剪切力,使尿激酶变性甚至失活,或可解释上述结果;而干预后孵育溶解时间及加入微泡浓度亦可能为其影响因素。
综上,超声针联合尿激酶可协同促进体外牛血凝块溶解,但联合微泡未见溶解率显著提高,有待进一步观察。
