电离辐射对人脑胶质瘤细胞NF-κB信号通路的作用及其机制
2016-11-27许瑞雪吴春明赵永顺徐英辉
许瑞雪 吴春明 赵永顺 徐英辉
(大连医科大学附属第一医院神经外科,辽宁 大连 116011)
·论著·
电离辐射对人脑胶质瘤细胞NF-κB信号通路的作用及其机制
许瑞雪 吴春明 赵永顺 徐英辉*
(大连医科大学附属第一医院神经外科,辽宁 大连 116011)
目的探讨电离辐射对人脑胶质瘤细胞核转录因子κB(NF-κB)通路的作用及机制。方法电离辐射(ionizing radiation,IR)诱导人胶质母细胞瘤 T98G细胞(T98G细胞)DNA损伤;划痕、甲基噻唑蓝(MTT)比色实验及流式细胞仪检测细胞增殖及凋亡;Bay-11处理抑制NF-κB活性;双荧光素酶报告系统检测NF-κB的活性;免疫荧光检测p65的亚细胞定位。结果电离辐射不抑制T98G细胞增殖,不诱导其凋亡;抑制NF-κB的活性增强T98G细胞对电离辐射的敏感性;电离辐射能激活T98G细胞中NF-κB信号通路。结论电离辐射能激活T98G细胞的NF-κB信号通路。抑制NF-κB可增强T98G细胞对电离辐射的敏感性。
胶质瘤; 电离辐射; DNA损伤; 核转录因子-κB
脑胶质瘤是最常见的中枢神经系统恶性肿瘤,占颅内肿瘤的50%~60%,5年存活率仅为20%~30%,具有高发病率、高侵袭性、高死亡率的特点。放疗是除了手术之外的重要治疗方法,但胶质瘤常表现为较强的放疗抵抗,故临床上治疗十分棘手[1]。
研究表明肿瘤细胞对放疗不敏感与NF-κB活性增高有关[2]。NF-κB在很多实体肿瘤中表达升高或者呈现持续激活状态,例如乳腺癌、食管癌、伯基特淋巴瘤、宫颈癌、胶质瘤等[3,4],而这些肿瘤普遍存在放疗抵抗现象,预后较差。
本研究采用电离辐射(ionizing radiation,IR)模拟胶质瘤放疗内环境,探讨DNA损伤后,人胶质瘤细胞中NF-κB的活性变化及其对细胞增殖及凋亡作用的影响,为阐明胶质瘤放疗抵抗的分子机制提供实验依据。
材料与方法
一、细胞系、质粒、抗体和试剂
人乳腺癌细胞系(Michigan cancer foundation-7,MCF-7)培养于含10%胎牛血清的MEM培养基(minimum essential medium,MEM),人脑胶质瘤细胞系T98G培养于含10%胎牛血清的改良的Eagle培养基(Dullbecco's modified Eagle medium,DMEM)。报告基因质粒(pNF-κB-Luc):带有NF-κB结合位点的荧光素酶报告质粒(Clontech公司)。p65、Bcl-xL、p50及p-IκBα抗体(Santa Cruz公司);H2AX-γ抗体(美国CST公司);双荧光素酶检测试剂盒(Promega公司);Annexin V-FITC/PI双染细胞凋亡检测试剂盒(南京凯基生物有限公司)。
二、划痕试验
MCF7及T98G细胞接种于24孔板中,细胞融合度为95%时给予电离辐射。用 Tip头划痕后,于0 h、20 h或30 h后记录细胞情况。划痕未愈合率(%)=100%-相对迁移距离(%)。
三、细胞凋亡检测
MCF7及T98G给予电离辐射(10 Gy)处理后6 h,收细胞,膜连蛋白V-FITC/碘化丙啶(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒染色。
四、甲基噻唑蓝(methy thiazolyl tetrazolium,MTT)检测细胞增殖
细胞以103/孔接种于96孔板。在37℃,5% CO2孵育24 h,加入NF-κB抑制剂Bay11(5 μ mol/L)并给予电离辐射处理。加药后4 h,换新鲜培养基继续培养12 h,24 h,48 h后进行MTT检测。存活率=(实验组-空白组)/(对照组-空白组)×100。
五、实时PCR
用Trizol提取总RNA,用Quant cDNA第一链合成试剂盒进行反转录,采用SBRY Premix Ex Taq PCR试剂盒配制反应体系。采用2-△△CT计算目的基因表达量。
六、双荧光素酶检测
细胞转染pNF-κB报告质粒及pRL-TK内参质粒28 h后给予电离辐射处理,处理后8 h收细胞,用双荧光素酶检测试剂盒进行检测。
七、Western blot
经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离提取蛋白后转移到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF) 膜上。脱脂奶粉封闭,一抗孵育4℃过夜,二抗室温孵育2 h。TBST缓冲液(tris buffer solution tween,TBST)洗3次后用ECL发光试剂盒(ECL Western Blotting KIT)显色。
八、免疫荧光检测
将T98G细胞用细胞辐照仪进行辐照处理(10 Gy)后,置于37℃培养30~60 min。4%多聚甲醛固定,0.2% Trixton X-100透化,5% BSA封闭液室温封闭,一抗37℃孵育45 min,荧光标记的二抗37℃孵育35 min,封片后用荧光显微镜观察。
九、统计学分析

结 果
一、IR能诱导T98G细胞DNA损伤
磷酸化H2AX(H2AX-γ)是DNA损伤的标志。实验以未照射组为阴性对照,以喜树碱(Camptothecin,CPT)处理组为阳性对照。结果所示,IR处理后30 min,H2AX-γ特异性增强,表明实验所用的辐照方法造成了DNA损伤(图1)。
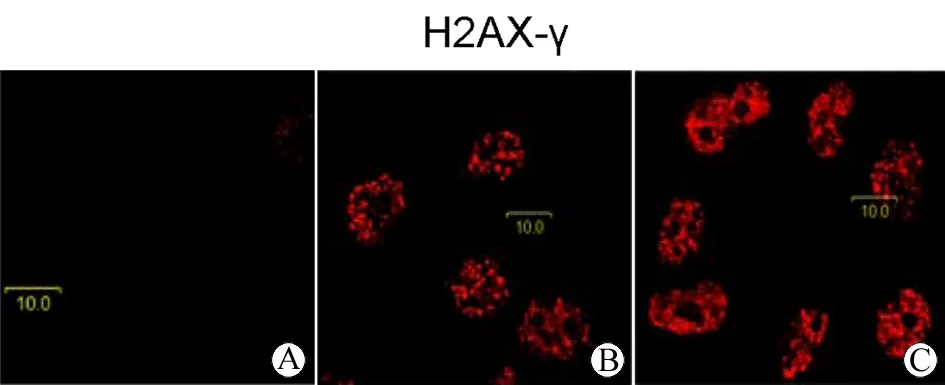
图1 免疫荧光检测H2AX-γ
Fig 1 Immunostaining analysis for H2AX-γ
A:Control group; B:CPT group; C:IR group.
二、T98G细胞对IR诱导的凋亡不敏感
放疗敏感细胞株人乳腺癌细胞MCF7在给予辐照处理后,划痕愈合能力被明显抑制,而辐照对T98G细胞的划痕愈合能力无明显影响(图2)。
IR能促使MCF7细胞发生凋亡(bPlt;0.01),但对T98G细胞则无明显影响(图3)。综上所述,人胶质瘤细胞株T98G对IR处理不敏感。
三、抑制NF-κB活性增强T98G细胞对IR的敏感性
T98G细胞给予IR处理同时添加NF-κB抑制剂Bay11后,T98G细胞的划痕愈合能力(图4 A,B)及增殖能力都显著下降(图4 C),表明抑制NF-κB的活性可增强T98G细胞对IR的敏感性。
四、IR能激活T98G细胞中NF-κB信号通路
荧光素酶报告基因结果显示T98G细胞给予IR处理后,NF-κB的活性显著增强,且与IR呈现剂量依赖关系(图5A)。Western Blot结果显示IR处理明显增强了IκBα的磷酸化水平,而IκBα的总量则随着IR剂量的增加而降低(图5B)。IR处理并不改变p50及p65的表达量(图5C),但能促进p65入核(图5D)。上述结果表明IR处理能激活胶质瘤细胞中NF-κB信号通路,诱导IκBα的磷酸化及降解,从而释放NF-κB(p50,p65)进入细胞核启动靶基因表达。

图2 IR处理后不同细胞株的划痕愈合能力
Fig 2 Would-healing analysis after IR treatment
A:The migrated distance of MCF7 cells after exposure to IR at 0 h and 30 h; B:The migrated distance of T98G cells after exposure to IR at 0 h and 30 h; C:Quantitative analysis of the migrated distance
aPlt;0.05,vsIR untreated group at 30 h.

图3 IR处理后细胞凋亡检测
Fig 3 Annexin V/PI double-staining assays after IR treatment
A:IR-untreated MCF7 cells; B:IR-treated MCF7 cells; C:IR-untreated T98G cells; D:IR-treated T98G cells; E:The percentage of Annexin V+ cells from three independent experiments
bPlt;0.01,vsIR-untreated MCF7 cells.
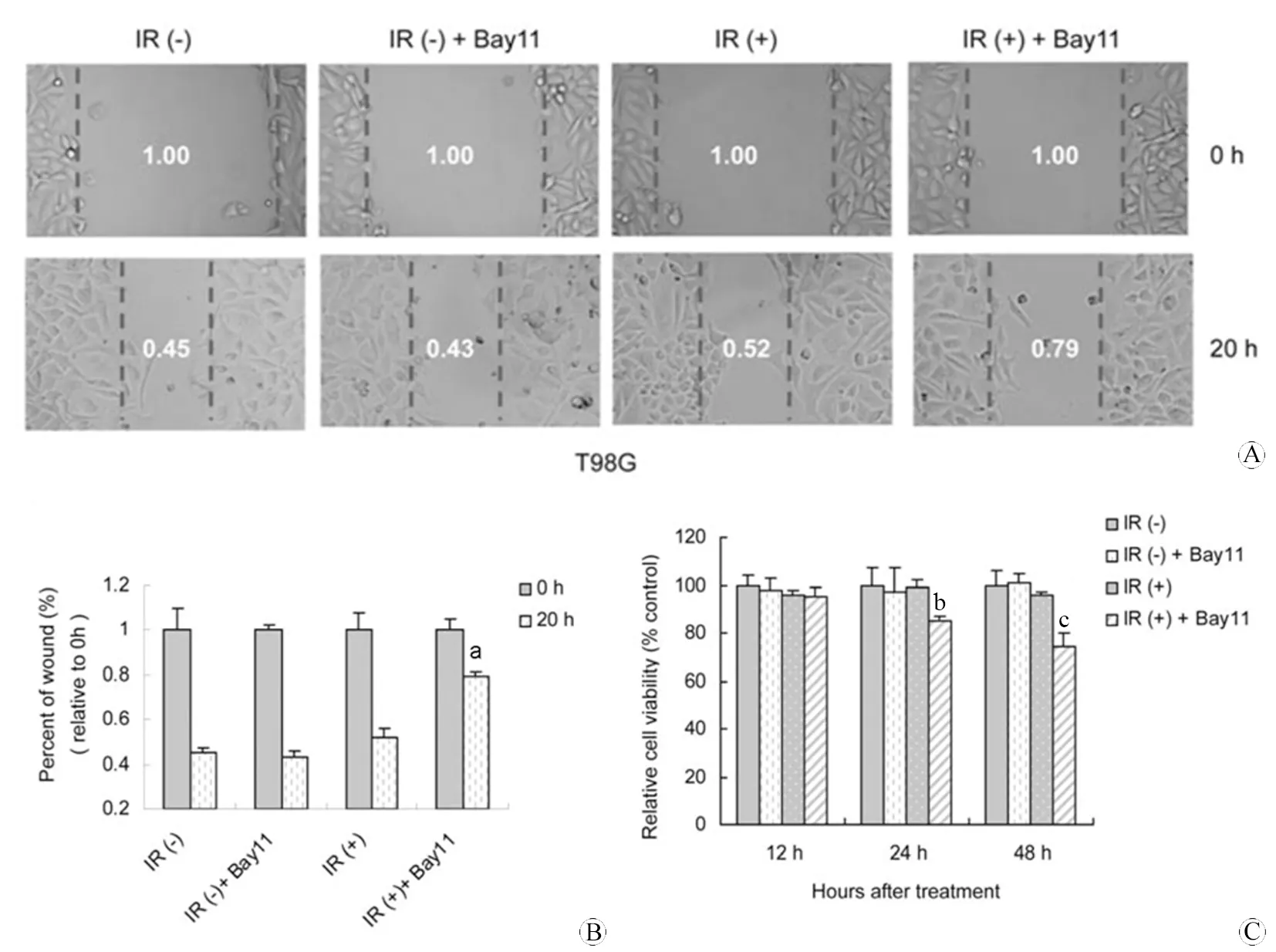
图4 抑制NF-κB活性增强T98G细胞对DNA损伤的敏感性
Fig 4 Inhibition of NF-κB activity decreases migration and proliferation of T98G cells
A:Wound-healing analysis for T98G cells after IR and Bay-11 treatment; B:Quantitation of the migrated distance (aPlt;0.05,vsIR-treated and Bay11-untreated group at 20 h ); C:MTT assays for T98G cells after IR and Bay-11 treatment (aPlt;0.05,vsIR-treated and Bay11-untreated group at 24 h;bPlt;0.01,vsIR-treated and Bay11-untreated group at 48 h).

图5 IR处理增强胶质瘤细胞中NF-κB的活性
Fig 5 IR induced NF-κB activation in T98G cells
A:NF-κB luciferase activity analysis after IR treatment; B:Western blot analysis for p-IκBα and IκBα in T98G cells; C:Western blot analysis for p65 and p50 in T98G cells; D:Immunostain analysis for p65 with or without IR treatment.
bPlt;0.01,vs0 Gy group;cPlt;0.001,vs0 Gy group.
讨 论
核转录因子kappaB(nuclear factor-kappa B,NF-κB)是一种核转录因子,静息状态下,与核因子kappaB抑制蛋白(NF-kappaB inhibitor alpha,IκBα)结合而滞留在细胞质。当细胞受到外界刺激或应激状态时,会启动相应的信号传导通路,磷酸化IκBα并使其发生泛素化降解,释放出的NF-κB得以入核行使其转录因子功能,诱导靶基因表达[5]。经典NF-κB信号通路的传导是发生在细胞质中的级联反应。其调控的基因种类多样,包括免疫和炎症相关的细胞因子,细胞增殖和凋亡相关基因,细胞粘附因子等。因此,NF-κB与多种正常或疾病状态,如免疫、炎症、肿瘤等相关[5~7]。持续活化的NF-κB通过刺激细胞增殖,抑制细胞凋亡,促进肿瘤细胞侵袭与转移等途径促使肿瘤产生放化疗抵抗[8,9]。
本实验结果说明DNA损伤能激活人胶质瘤细胞系中NF-κB信号通路,抑制NF-κB活性能增强胶质瘤细胞对DNA损伤的敏感性。提示NF-κB信号通路在胶质瘤放疗抵抗中发挥重要作用,特异性抑制NF-κB的活性有望增强胶质瘤的放疗敏感性,为有效治疗胶质瘤提出新的思路。
1Sturm D,Bender S,Jones DT,et al. Paediatric and adult glioblastoma:multiform (epi) genomic culprits emerge [J]. Nat Rev Cancer,2014,14(2):92-107.
2Chung AS,Wu X,Zhuang G,et al. An interleukin-17-mediated paracrine network promotes tumor resistance to anti-angiogenic therapy [J]. Nat Med,2013,19(9):1114-1123.
3陶胜忠,牛光明,尹先印,等. 不同放射敏感性胶质瘤中ATM蛋白、NF-κB表达及相关性研究 [J]. 中国实用神经疾病杂志,2008,11(8):7-10.
4李宝重,陈照丽,周芳,等. 核因子κB向细胞核移位降低食管癌放疗的疗效 [J]. 中华肿瘤杂志,2014,36(7):485-488.
5Chen ZJ. Ubiquitination in signaling to and activation of IKK [J]. Immunol Rev,2012,246(1):95-106.
6Bertrand MJ,Milutinovic S,Dickson KM,et al. cIAP1 and cIAP2 facilitate cancer cell survival by functioning as E3 ligases that promote RIP1 ubiquitination [J]. Mol Cell,2008,30(6):689-700.
7Tada K,Okazaki T,Sakon S,et al. Critical roles of TRAF2 and TRAF5 in tumor necrosis factor-induced NF-kappa B activation and protection from cell death [J]. J Biol Chem,2001,276(39):36530-36534.
8Baud V,Karin M. Is NF-kappaB a good target for cancer therapy? Hopes and pitfalls [J]. Nat Rev Drug Discov,2009,8(1):33-40.
9Salminen A,Ojala J,Kaarniranta K. Apoptosis and aging:increased resistance to apoptosis enhances the aging process [J]. Cell Mol Life Sci,2011,68(6):1021-1031.
IonizingradiationinducesNF-κBactivationinhumanglioblastomacells
XURuixue,WUChunming,ZHAOYongshun,XUYinghui
DepartmentofNeurosurgery,TheFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China
ObjectiveThe effects of ionizing radiation-induced nuclear factor-kappa B(NF-κB) activation in human glioblastoma cells are discussed.MethodsIonizing radiation (IR) was performed to induce DNA damage. Wound healing,methy thiazolyl tetrazolium (MTT) and annexin V and PI double-staining assays were used to detect cell migration,proliferation and apoptosis,respectively. Bay-11 treatment was performed to inhibit NF-κB activity. Dual-luciferase assays were performed to detect NF-κB activity. The nuclear translocation of p65 was detected by immunofluorescence.ResultsIR treatment had no significant effect on cell migration,proliferation or apoptosis in T98G cells. However,incubation with a NF-κB inhibitor Bay11 attenuated migration and proliferation in T98G cells upon IR exposure.ConclusionIR-induced NF-κB activation contributes to radioresistance in human glioblastoma cells T98G.
Glioblastoma; Lonizing radiation; DNA damage; NF-κB
1671-2897(2016)15-313-04
R 739
A
许瑞雪,副主任医师,E-mail:xrx1976@163.com
*通讯作者:徐英辉,教授,E-mail:yinghuixu2013@126.com
2015-04-20;
2015-07-20)
