靶向Survivin siRNA对乳腺癌MCF-7细胞雌激素受体表达的影响*
2016-11-26张永臣
黄 菁, 虞 玲,隋 俊, 张永臣
南京市第二医院检验科,南京 210003
靶向Survivin siRNA对乳腺癌MCF-7细胞雌激素受体表达的影响*
黄 菁, 虞 玲△,隋 俊, 张永臣
南京市第二医院检验科,南京 210003
目的 探讨靶向Survivin siRNA对乳腺癌MCF-7细胞雌激素受体表达的影响。方法 构建靶向Survivin siRNA载体,按照质粒类型分为空白对照组、阴性对照组和阳性实验组,空白对照组仅加入Lipofectamine 2000,阴性对照组加入空载质粒,阳性实验组加入靶向Survivin siRNA质粒,采用RT-PCR检测Survivin、ER mRNA表达水平,采用Western blot检测细胞Survivin、ER蛋白表达水平,并采用MTT法检测各组对MCF-7细胞增殖抑制率。结果 以β-actin作为内参照,空白对照组Survivin、ER mRNA表达量分别为(1.17±0.14)和(0.79±0.11),阴性对照组分别为(1.15±0.12)和(0.80±0.09),阳性实验组分别为(0.43±0.03)和(1.94±0.41),阳性实验组Survivin mRNA表达显著低于空白对照组、阴性对照组,ER mRNA表达显著高于空白对照组、阴性对照组(均P<0.05);空白对照组、阴性对照组Survivin、ER mRNA表达量比较差异无统计学意义(均P>0.05)。Western blot结果显示,阳性实验组Survivin蛋白表达显著低于空白对照组和阴性对照组,ER蛋白表达显著高于空白对照组和阴性对照组。细胞增殖实验结果显示,阳性实验组接种12、24、48 h后MCF-7细胞增殖的抑制率逐渐升高,并显著高于同时段空白对照组和阴性对照组(均P<0.05)。结论 通过siRNA技术干扰Survivin表达能够显著提高MCF-7细胞雌激素受体表达水平,靶向Survivin siRNA在ER阳性乳腺癌的基因治疗中具有潜在的临床价值。
雌激素受体; 小干扰RNA; 乳腺癌; 细胞增殖; Survivin
Survivin属于凋亡蛋白抑制因子(inhibitor of apoptosis protein,IAP)家族成员之一[1-2],在调节细胞凋亡和有丝分裂中扮演着重要角色。国外研究[3]证实Survivin高表达与肿瘤细胞凋亡、放化疗敏感性等生物学行为密切相关。Survivin特异性较高,在正常组织中不表达或仅少量表达,而在肿瘤细胞中呈高表达,因此被认为是肿瘤基因治疗的理想靶点[4-5]。小干扰RNA[6](small interfering RNA,siRNA)能够介导双链RNA转录后基因沉默,因其具有高度特异性和靶向性,而成为基因功能研究的主要工具。在本研究中,我们构建了靶向Survivin siRNA真核表达载体,并转染至乳腺癌MCF-7细胞株,观察其对MCF-7细胞雌激素受体(estrogen receptors,ER)的影响,旨在为扩展乳腺癌的治疗思路提供依据,现将研究结果总结如下。
1 材料与方法
1.1 试剂与材料
乳腺癌细胞株MCF-7购自东南大学医学实验动物中心,Pgenesil-1质粒载体、质粒提取试剂盒购自武汉淼灵生物科技有限公司,Survivin、ER、GAPDH单克隆抗体、BamHⅠ、SacⅠ、EcoRⅠ购自Sigma公司,转染试剂Lipofectamine 2000、Trizol试剂盒购自Invitrogen公司,荧光标记的羊抗兔IgG抗体、β-肌动蛋白(β-actin)抗体、PVDF膜、胰蛋白酶、磷酸缓冲盐溶液(PBS)、RPMI 1640培养液购自武汉博士德生物工程有限公司,细胞转染试剂METAFECTEN购自德国Biontex公司,培养液、胎牛血清购自美国Gibco公司,SuperSignal West Pico化学发光底物购自美国PIERCE公司。
1.2 实验方法
1.2.1 MCF-7细胞培养 将购买的MCF-7细胞株置于RPMI 1640(含0.1 g/L链霉素、105U/L青霉素和100 mL/L的小牛血清)培养液中,37℃,5%CO2饱和湿度条件下传代培养。
1.2.2 靶向Survivin siRNA载体构建 Survivin目的基因的序列:5′-GCAGCACCGGATGTGTAGA-3′,按照基因序列设计2条DNA链:5′-GATGCGGAGCAGGCGATGTGTAGATTGAAGAG-GTCTACAGATGGCGTGGTGGTTTTTTGAA-TTCA-3′和5′-GCGTGCTGGCCTACGAATCTAACTTGTGCAGATGTGTACGGGAGCAACAG-GAAAAAACTTAAGT-3′;引物结构:正义链+BamHⅠ+反义链+环状结构+终止信号+SacⅠ,上述设计的2条链磷酸化后与Pgenesil-1质粒载体相连,EcoRⅠ酶切使Pgenesil-1质粒载体线性化,琼脂凝胶将大片段回收。取连接产物并转化为感受态细胞,均匀涂布于含30 μg/mL卡那霉素的LB平板上,37℃恒温孵育过夜。用无内毒素的质粒提取试剂盒将质粒载体提取,SacⅠ酶切鉴定、测序,-20℃冰箱保存。
1.2.3 MCF-7细胞转染 取生长旺盛期MCF-7细胞系,接种于24孔培养板中,加入胎牛血清培养,倒置显微镜下观察,待细胞密度为80%~90%时,开始进行转染。分别将1.0 μg质粒、2.5 μL Lipofectamine 2000相互混匀,并用PBS稀释至50 μL,再加入至24孔培养板中进行转染,转染24 h后倒置荧光显微镜下观察细胞荧光表达情况。
1.2.4 Survivin、ER mRNA检测 将细胞接种于培养皿中,分为空白对照组、阴性对照组和阳性实验组,每组为3个培养皿;空白对照组仅加入Lipofectamine 2000,阴性对照组加入空载质粒,阳性实验组加入靶向Survivin siRNA质粒,分别转染MCF-7细胞。转染24 h后加入胰蛋白酶消化,收集106个细胞,按照Trizol试剂盒提取总RNA。采用RT-PCR检测Survivin、ER mRNA表达水平。按照RNA提取试剂盒说明书提取细胞总RNA,并逆转录成cDNA。按照预先设计好的引物:Survivin上游引物为5′-GGATCGCTCGGCGCAGCTTG-3′,下游引物为5′-CGTGGGCGGAGAGGGGTGA-A-3′;ER上游引物为5′-GACGTTGGCGGTGTTCAGTCTGCC-3′,下游引物为5′-TGGCTGCGA-CGTACGATTAGAGAC-3′;β-actin上游引物为5′-GTGCATGCTCGGCTGCGTCT-3′,下游引物为5′-GGTCTGAGGTTCAGCGTTGC-3′。Survivin扩增条件:95℃预变性5 min,95℃变性30 s,65℃退火45 s,72℃延伸1 min,40个循环后72℃ 5 min;ER扩增条件:95℃预变性5 min,95℃变性15 s,65℃退火30 s,72℃延伸30 s,45个循环后72℃ 5 min。记录检测指标的Ct值,每组测量3次,取平均值,以β-actin为内参照,计算Survivin、ER mRNA相对表达量(2-ΔΔCt)。
1.2.5 Survivin、ER蛋白检测 采用Western blot检测细胞Survivin、ER蛋白表达水平。培养板细胞融合度>80%时,将培养液吸出,PBS冲洗3次;再向每孔中加入100 μL含1%PMSF的细胞裂解液,待细胞完全裂解后,15 000 r/min离心5 min,留取上清液。将上清液移至EP管中,加入等量上样液,100℃煮沸5 min,使蛋白完全变性。SDS-PAGE电泳分离蛋白,并转移至PVDF膜上,100 mA、40 min电转后将PVDF膜取出。5%脱脂牛奶封闭2 h,加入Survivin、ER单克隆抗体,4℃孵育过夜;PBS冲洗3次,再分别加入羊抗兔IgG抗体(二抗),室温下振摇3 h,PBS冲洗3次。荧光图像扫描及条带灰度值分析,Survivin、ER蛋白相对表达量为样本条带与GAPDH条带灰度值之比。
1.2.6 MCF-7细胞增殖抑制率检测 将空白对照组、阴性对照组和阳性实验组细胞接种于96孔培养板中,每组设8孔,每孔150 μL,分别于接种后12、24、48 h采用MTT法检测MCF-7细胞增殖,计算增殖抑制率,增殖抑制率=(1-观察组吸光度值/空白对照组吸光度值)×100%。
1.3 统计学方法
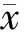
2 结果
2.1 质粒的鉴定
正确的克隆将酶切出1条400 bp的小带,由图1可见,M1、M2在400 bp无印迹,质粒阳性在400 bp的印迹较质粒阴性更明显,由此可知目的克隆正确,且整个条带无明显杂带,证实目的基因未被污染,转染目的基因成功。

M1:Marker 1;M2:Marker 2;①:质粒阴性;②:质粒阳性图1 质粒酶切鉴定凝胶电泳图Fig.1 Gel electrophoresis of the plasmids identification by enzyme digestion
2.2 Survivin siRNA转染MCF-7细胞结果验证
由图2可见,将质粒转染至MCF-7细胞24 h后,在倒置荧光显微镜下可见绿色荧光蛋白的表达,说明质粒已经成功转染至MCF-7细胞,MCF-7靶向Survivin siRNA模型构建成功。
2.3 三组Survivin、ER mRNA表达水平
以β-actin作为内参照,空白对照组Survivin、ER mRNA表达量分别为(1.17±0.14)和(0.79±0.11),阴性对照组分别为(1.15±0.12)和(0.80±0.09),阳性实验组分别为(0.43±0.03)和(1.94±0.41),阳性实验组Survivin mRNA表达显著低于空白对照组、阴性对照组,ER mRNA表达显著高于空白对照组、阴性对照组(均P<0.05);空白对照组、阴性对照组Survivin、ER mRNA表达量差异无统计学意义(均P>0.05),见图3。
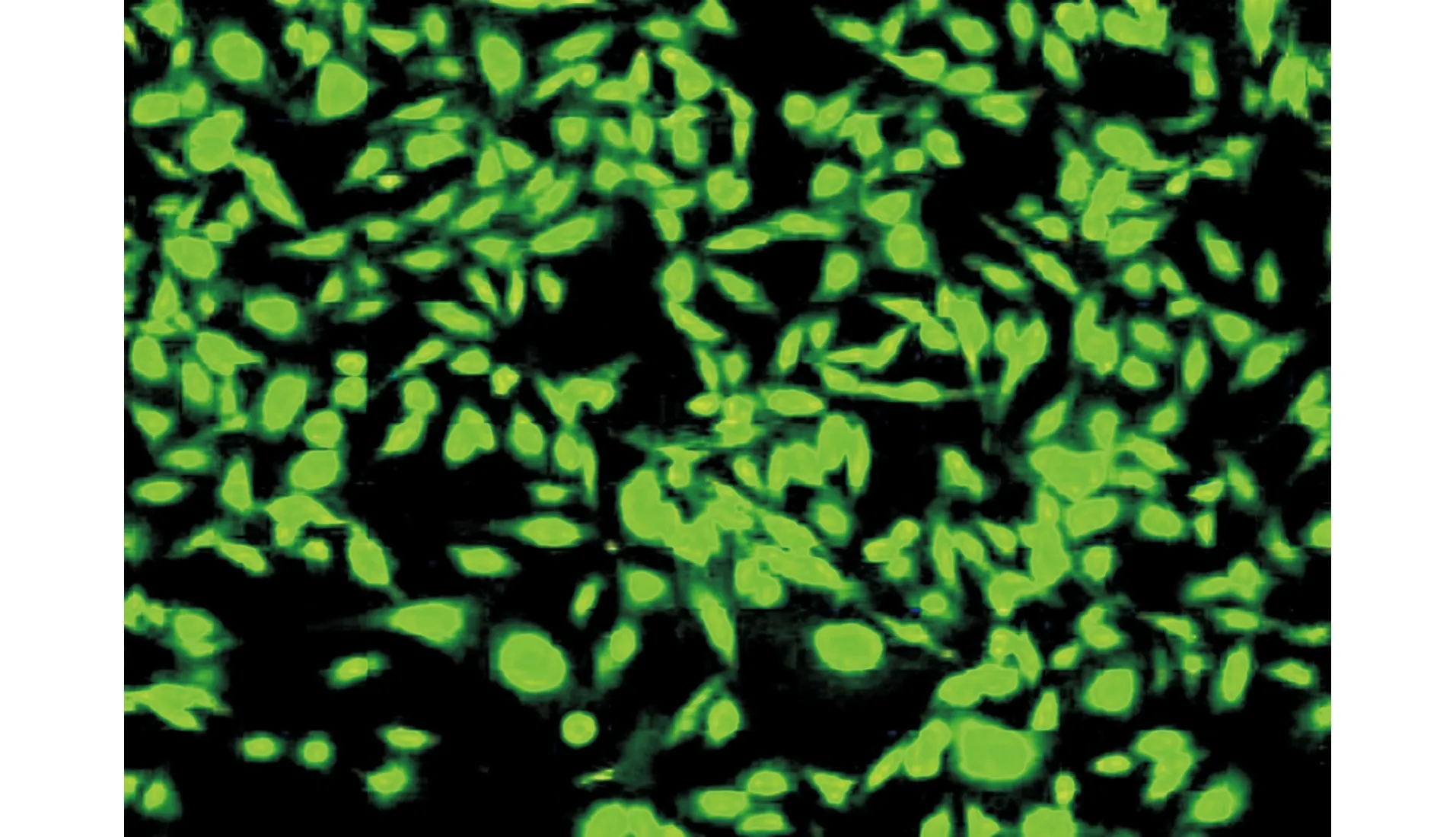
图2 Survivin siRNA转染MCF-7细胞24 h后绿色荧光蛋白表达情况(×400)Fig.2 Expression of green fluorescent protein in MCF-7 cells 24 h after transfection with survivin siRNA (×400)

与阳性实验组比较,#P<0.05图3 空白对照组、阴性对照组、阳性实验组Survivin、ER mRNA表达水平Fig.3 mRNA expression levels of survivin and ER in the blank control group,negative control group,and positive experimental group
2.4 三组Survivin、ER蛋白表达水平
阳性实验组Survivin蛋白表达强度显著低于空白对照组和阴性对照组,ER蛋白表达强度显著高于空白对照组和阴性对照组,见图4、5。
2.5 各组对MCF-7细胞增殖抑制率
阳性实验组接种12、24、48 h后MCF-7细胞增殖率逐渐升高,并显著高于同时段空白对照组和阴性对照组(均P<0.05),见表1。

M:Marker;①:阳性实验组;②:阴性对照组;③:空白对照组图4 各组Survivin蛋白表达水平Fig.4 Protein expression levels of Survivin in each group
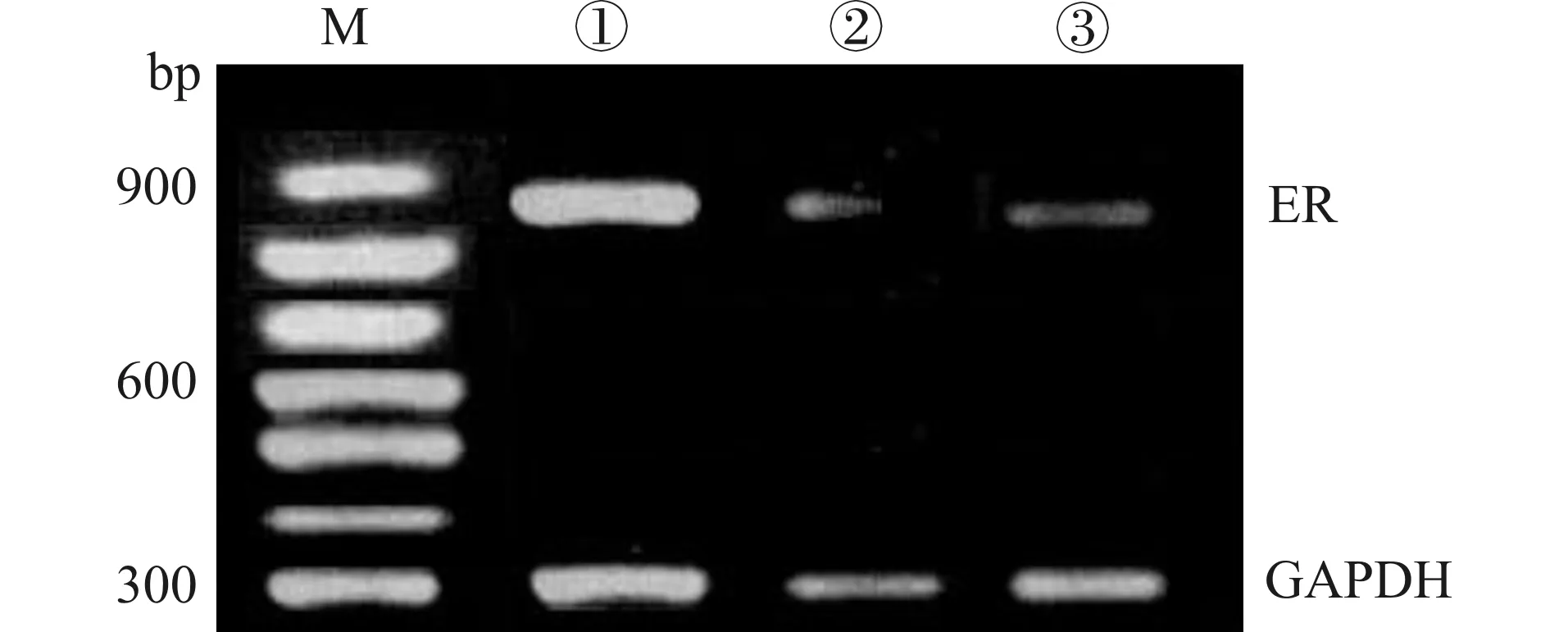
M:Marker;①:阳性实验组;②:阴性对照组;③:空白对照组图5 各组ER蛋白表达水平Fig.5 ER protein expression levels in each group

组别12h24h48h空白对照组841±058#834±037#871±068#阴性对照组826±047#868±053#832±038#阳性实验组1827±1482736±4433683±578
与阳性实验组比较,#P<0.05
3 讨论
Survivin基因同时具有调节细胞周期和凋亡的作用,国外研究[7-8]证实Survivin能够抑制Caspases,并能与CDK4/p21结合,阻断细胞凋亡途径,从而发挥凋亡抑制作用。宰红艳等[9]也证实Survivin与Cyclin、CDK等一起参与了细胞周期、细胞分裂等过程,在细胞增殖、分化、凋亡中发挥重要作用。胡梦泽等[10]通过miRNA阻断细胞内Survivin的表达,结果显示细胞微管被破坏,导致多倍体形成,细胞分裂受阻。近年来大量研究[11-13]也证实了Survivin与恶性肿瘤的发生密切相关。Survivin特异性高,在正常组织表达较低,但是在恶性肿瘤组织中呈过表达,且与肿瘤血管的形成、放化疗的敏感性以及远期预后密切相关。抑制了Survivin基因,能够降低肿瘤的恶性表型,诱导肿瘤细胞发生凋亡,因此Survivin是恶性肿瘤诊断、治疗的一个理想靶点。然而Survivin在各种肿瘤中分布并不均衡,有研究显示Survivin在乳腺癌组织中表达最高,在肾癌、结直肠癌中表达最低[14]。李庆霞等[15]也证实雌二醇能促进Survivin表达,并诱导ER阳性乳腺癌细胞增生。Yakirevich等[16]对170例乳腺癌患者采用免疫组化法进行研究,结果显示91.2%患者Survivin蛋白阳性,而在癌旁和正常组织中均表达阴性,该作者认为Survivin基因对乳腺癌的靶向特异性较好。
RNA干扰是生物体普遍存在的一种现象,其通过参与双链RNA所介导的特定序列发生转录后而发生的基因沉默过程。Ambardekar等[17]报道称外源性双链RNA整合到细胞内,会被Dicer酶识别,并切割成短小RNA,即siRNA。siRNA会与RNA沉默复合体结合并特定降解同源mRNA,从而抑制目的基因的表达。钟兴等[18]采用腺病毒构建了Survivin siRNA表达载体,结果显示Survivin siRNA转染效率更高,并能特定抑制乳腺癌细胞的增殖、分裂。本研究参考李莉萍等[19]的报道,设计了靶向Survivin siRNA真核表达载体,由于其载体含有增强绿色荧光蛋白,因此可以通过荧光显微镜更清晰地观察转染效率。本研究结果显示阳性实验组Survivin mRNA表达显著低于空白对照组、阴性对照组,ER mRNA表达显著高于空白对照组、阴性对照组,Western blot检测Survivin、ER蛋白也得到相同结果,说明Survivin基因能够抑制MCF-7细胞Survivin表达和上调ER表达。Sarti等[20]报道称雌二醇能够诱导Survivin表达,而高浓度孕激素又可以下调Survivin表达,提示Survivin与ER之间可能存在相互调节的关系。管海涛等[21]也证实抑制Survivin可以上调ER的表达,并提高乳腺癌细胞的活性,抑制肿瘤细胞的增殖。本研究亦显示阳性实验组接种12、24、48 h后MCF-7细胞增殖抑制率逐渐升高,并显著高于同时段空白对照组和阴性对照组,提示Survivin基因有抑制肿瘤细胞增殖的作用。然而Survivin与ER相互调控机制依然不清楚,推测可能是抑制Survivin的表达会诱导雌二醇与ER结合,并促进MCF-7细胞对雌二醇和ER依赖性,从而加速细胞的凋亡。
综上所述,通过siRNA技术干扰Survivin表达能够显著提高雌激素受体的表达,并增强MCF-7细胞的增殖抑制率,靶向Survivin siRNA在ER阳性乳腺癌的基因治疗中具有潜在的临床价值。
[2] Coothankandaswamy V,Elangovan S,Singh N,et al.The plasma membrane transporter SLC5A8 suppresses tumour progression through depletion of survivin without involving its transport function[J].Biochem J,2013,450(1):169-178.
[3] Donahue J M,Chang E T,Xiao L,et al.The RNA-binding protein HuR stabilizes survivin mRNA in human oesophageal epithelial cells[J].Biochem J,2011,437(1):89-96.
[4] Wadegaonkar V P,Wadegaonkar P A.Withanone as an inhibitor of survivin:A potential drug candidate for cancer therapy[J].J Biotechnol,2013,168(2):229-233.[5] Ortiz J,Chou L L.Calcium upregulated survivin expression and associated osteogenesis of normal human osteoblasts[J].J Biomed Mater Res A,2012,100(7):1770-1776.
[6] Juffermans L J,Meijering B D,Henning R H,et al.Ultrasound and microbubble-targeted delivery of small interfering RNA into primary endothelial cells is more effective than delivery of plasmid DNA[J].Ultrasound Med Biol,2014,40(3):532-540.
[7] Gaca S,Reichert S,Multhoff G,et al.Targeting by cmHsp70.1-antibody coated and survivin miRNA plasmid loaded nanoparticles to radiosensitize glioblastoma cells[J].J Control Release,2013,172(1):201-206.
[8] Pavlyukov M S,Antipova N V,Balashova M V,et al.Survivin monomer plays an essential role in apoptosis regulation[J].J Biol Chem,2011,286(26):23296-23307.
[9] 宰红艳,易小平,李宜雄,等.抑制X染色体连锁的凋亡抑制蛋白(XIAP)和Survivin表达对胰腺癌Panc-1细胞增殖及化疗敏感性的影响[J].北京大学学报:医学版,2013,45(2):242-249.
[10] 胡梦泽,师晓东,王天有,等.小干扰RNA沉默survivin基因表达对肿瘤细胞A549、Hela S3和K562的影响及小干扰RNA序列的筛选[J].中华实用儿科临床杂志,2014,29(3):194-198.
[11] 王春毅,傅仲学.高选择性RNA干扰抑制survivin基因对在体结肠癌的治疗作用[J].重庆医学,2013,42(28):3339-3341.
[12] 夏荣耀,张冉冉,孙亚娇,等.Survivin基因与肿瘤相关研究进展[J].现代肿瘤医学,2013,21(3):662-665.
[13] Riolo M T,Cooper Z A,Holloway M P,et al.Histone deacetylase 6(HDAC6)deacetylates survivin for its nuclear export in breast cancer[J].J Biol Chem,2012,287(14):10885-10893.
[14] 魏晓丽,张玉,刘敏丽,等.乳腺癌组织中Survivin、Ki67的表达变化及意义[J].山东医药,2013,53(3):12-14.
[15] 李庆霞,邢雅军,闫晓路,等.乳腺浸润性导管癌Survivin和AIB-1表达及其相关性研究[J].中华肿瘤防治杂志,2013,20(12):935-938.
[16] Yakirevich E,Samkari A,Holloway M P,et al.Total Survivin and acetylated Survivin correlate with distinct molecular subtypes of breast cancer[J].Hum Pathol,2012,43(6):865-873.
[17] Ambardekar V V,Wakaskar R R,Sharma B,et al.The efficacy of nuclease-resistant Chol-siRNA in primary breast tumors following complexation with PLL-PEG(5K)[J].Biomaterials,2013,34(20):4839-4848.
[18] 钟兴,弓健,郭斌,等.siRNA沉默survivin增强hNIS转染的鼻咽癌细胞株对131碘的敏感性[J].暨南大学学报:自然科学与医学版,2015,36(3):246-250.
[19] 李莉萍,梁念慈,罗超权,等.存活素siRNA表达质粒的构建及其对MCF-7细胞细胞周期和增殖的调控[J].癌症,2004,23(7):742-748.
[20] Sarti M,Pinton S,Limoni C,et al.Differential expression of testin and survivin in breast cancer subtypes[J].Oncol Rep,2013,30(2):824-832.
[21] 管海涛,代志军,王中卫,等.腺病毒介导的靶向survivin的siRNA上调乳腺癌MCF-7细胞雌激素受体表达[J].国际外科学杂志,2015,42(3):164-167.
(2016-05-30 收稿)
Effect of siRNA-targeted Survivin on the Expression of Estrogen Receptor of Breast Cancer MCF-7 Cells
Huang Jing,Yu Ling△,Sui Jun et al
Clinical Laboratory,the Second Hospital of Nanjing City,Nanjing 210003,China
Objective To explore the effect of siRNA-targeted survivin on the estrogen receptor(ER) of breast cancer MCF-7 cells.Methods The siRNA vectors that could target survivin were constructed. Three groups were set up according to different plasmids added: blank control group, in which lipofectamine 2000 was added; negative control group, in which the empty plasmids were given; positive experimental group, in which survivin siRNA was transfected into the cells. mRNA expression levels of survivin and ER were detected by RT-PCR and their protein levels by Western blotting. The inhibition rate of MCF-7 cells proliferation was detected by MTT assay. Results With β-actin as an internal reference, the mRNA expression levels of survivin and ER were(1.17±0.14) and(0.79±0.11) in blank control group,(1.15±0.12) and(0.80±0.09) in negative control group, and(0.43±0.03) and(1.94±0.41) in positive experimental group. The mRNA expression levels of survivin were significantly decreased and those of ER increased in positive experimental group as compared with blank control and negative control groups(P<0.05). There was no significance in the mRNA expression levels of survivin and ER between the blank control group and the negative control group(P>0.05). Similar findings were also observed in the expression of survivin and ER at the protein level. The proliferation inhibition rate was gradually increased from 12, 24 to 48 h in the positive experimental group, which was significantly higher than that in blank control and negative control groups at the same time point(P<0.05).Conclusion Interfering survivin expression by siRNA technology can significantly enhance the ER levels in MCF-7 cells, suggesting survivin siRNA has potential clinical value in the gene therapy of ER-positive breast cancer.
estrogen receptor; small interfering RNA; breast cancer; cell proliferation; survivin
*国家自然科学基金资助项目(No.81101999)
R737.9
10.3870/j.issn.1672-0741.2016.05.004
黄 菁,女,1974年生,主管技师,E-mail:360354891@qq.com
△通讯作者,Corresponding author,E-mail:weijunnanjin@163.com
