青虾精(卵)母细胞特有因子Gtsf1基因的克隆及其时空表达分析
2016-11-24梁国霞傅洪拓慧白鸿坤张文宜李法君蒋速飞熊贻伟龚永生金舒博吴
梁国霞傅洪拓,乔 慧白鸿坤张文宜李法君,蒋速飞熊贻伟龚永生金舒博吴 滟
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081; 3. 潍坊科技学院, 寿光 262700)
青虾精(卵)母细胞特有因子Gtsf1基因的克隆及其时空表达分析
梁国霞1傅洪拓1,2乔 慧2白鸿坤2张文宜2李法君1,3蒋速飞2熊贻伟2龚永生2金舒博2吴 滟2
(1. 南京农业大学无锡渔业学院, 无锡 214081; 2. 中国水产科学研究院淡水渔业研究中心, 农业部淡水渔业和种质资源利用重点实验室, 无锡 214081; 3. 潍坊科技学院, 寿光 262700)
为了研究青虾性早熟现象, 在实验室构建的青虾精卵巢表达谱中发现一个Gtsf1同源EST序列, 采用RACE技术克隆获得青虾Gtsf1基因cDNA序列长349 bp (GenBank登录号: KR349325), 开放阅读框(Open reading frame, ORF)为240 bp, 编码79个氨基酸。生物信息学分析预测青虾Gtsf1蛋白包含1个zf-U11-48K结构域,并发现该蛋白无信号肽, 属于非分泌蛋白。系统进化树分析表明青虾Gtsf1蛋白与昆虫纲的蝽类(Lygus hesperus)亲缘关系最近。组织表达分析结果显示, Gtsf1基因在性腺中表达很高, 特别是在卵巢中表达最高(为精巢的6倍), 其他组织中表达极低。卵巢不同发育时期表达结果发现, 发育初期Gtsf1基因表达水平较低, 随着卵巢的发育, 该基因的表达水平呈现显著上升趋势(P<0.05), 在成熟期达到最高峰, 在消退期显著下降并恢复到较低水平(P<0.05)。胚胎和胚后不同发育时期结果显示, Gtsf1基因在胚胎发育早期表达水平较高, 囊胚期时显著升高并达到峰值(P<0.05), 从原肠期显著下降直至变态后第10天该基因表达水平维持较低水平(P<0.05)。以上研究结果表明Gtsf1基因与生殖密切相关, 特别是在卵巢发育过程中有关, 且呈正相关趋势。同时, Gstf1基因可能主要参与青虾胚胎早期发育的调控。研究首次在甲壳动物中克隆获得Gtsf1基因, 并分析Gtsf1基因在青虾中的时空表达模式, 研究结果将为进一步研究青虾Gtsf1基因功能和青虾性腺发育调控规律奠定基础, 也为其他甲壳动物的生殖相关研究提供参考。
青虾; Gtsf1; 卵巢发育; 性腺; 时空表达
Gametocyte-specific factor 1 (Gtsf1)基因是UPF224基因家族中的重要一员[1], 在哺乳动物的小鼠(Mus musculus)、昆虫中的果蝇(Drosophila melanogaster)中研究发现, 该基因与性腺和生殖细胞的生成密切相关[2,3]。Gtsf1基因具有U11-48K锌指结构域, 在进化中具有高保守性[4,5]。最新研究报道发现Gtsf1是PIWI蛋白复合物的重要组成部分[3,6], PIWI蛋白是动物生殖细胞发育分化所必需的[7—9], 该蛋白形成的复合物可通过控制转座子元件的活动, 维持生殖细胞基因组稳定性及完整性,从而调控性腺的正常发育。目前有关该基因的研究报道较少, 主要集中在小鼠和果蝇的生殖细胞的生长发育的研究, 以及介导Piwi蛋白参与抑制反转录转座子的功能研究[1—3], 在其他物种未见相关报道。
青虾, 学名日本沼虾(Macrobrachium nipponense), 隶属于十足目(Decapoda), 长臂虾科(Palaemonidae), 沼虾属 (Macrobrachium), 是我国重要的淡水养殖经济虾类[10]。但青虾大规模的养殖中普遍出现了性早熟现象, 养殖过程中多代同堂, 严重制约了青虾养殖业的健康发展。目前有关青虾性腺发育相关基因研究较多, 如gonad-inhibiting hormone[11]、gonadotropin-releasing hormone[12]、SUMO-conjugating enzyme[13]、MnvWD-Kazal[14]等。本课题组先后构建了青虾精巢文库和精卵巢表达谱, 筛选了大量生殖相关基因并对部分基因进行了深入研究[15,16]。作者在本实验室构建的青虾精卵巢表达谱中发现一个Gtsf1同源EST序列, 并发现其在精卵巢中的表达存在极显著差异, 因此本文拟采用基因克隆和荧光定量表达方法研究Gtsf1基因在青虾不同组织、卵巢不同发育时期以及胚胎和胚后发育过程中的作用, 以期为进一步研究青虾Gtsf1基因功能和青虾性腺发育调控规律奠定基础,也为其他甲壳动物的生殖相关研究提供参考。
1 材料与方法
1.1 实验用虾
本实验青虾取自太湖湖区(120°13′44″E,31°28′22″N), 挑选规格齐整青虾约(4.0±0.5) g在室内聚乙烯塑料白色桶(500 L)充气暂养, 每天早晚定时投喂螺蛳及配合饲料, 投喂量约占体重的3%—5%, 每两天换水一次, 换水量为40%—50%,暂养一周。
1.2 实验试剂
RNA提取试剂有DNA I Rnase Free和RNAiso Plus; 反转录试剂盒、5′-Full RACE 及3′-Full RACE试剂盒; PCR所用试剂: DL-2000 DNA Marker、LA TaqDNA聚合酶、dNTP 等。以上试剂(盒)均购自宝生物(TaKaRa Bio Inc. Japan)。所用到的试剂还有DH5α感受态细胞、pMD18-T载体, 购自全式金公司。实验中用到的引物均由铂尚生物技术(上海)有限公司合成; 自配试剂按照张文宜[17]的方法配制。
1.3 样品采集
雌雄不同组织表达试验用虾为健康的成体青虾, 将其置于冰上3—5min, 使其麻醉。活体解剖雌雄各取精巢、卵巢, 再分取肌肉、鳃、心脏、脑、肝脏、眼柄、腹神经等7个组织, 每个组织取5个个体作为混合样本。取样后将其保存于RNA保存液中, 置于-20℃保存, 用于RNA提取。
挑选健康的成体雌虾, 根据Qiao[11]分期标准判断卵巢发育不同时期, 分别为: 卵巢增殖期、初级卵黄发生期、次级卵黄发生期、成熟期、消退期等5个不同发育时期。将虾置于冰上3—5min, 使其麻醉, 活体解剖各时期卵巢, 每期取5个个体作为混合样本。取样后将其保存于RNA保存液中, 置于-20℃保存, 用于RNA提取。
发育表达实验用虾的养殖条件同上, 待雌虾和雄虾交配抱卵后, 按陈瑛[10]发育分期标准, 取胚胎发育过程中的卵裂期、囊胚期、原肠期、无节幼体期、膜内溞状幼体期的虾卵。幼体发育过程中取出膜后第1天、第4天、第7天、第10天幼体、第13天以及第16天幼体。幼体经变态后发育到幼虾阶段, 取该阶段第1天、第5天、第10天幼虾的幼虾个体的头部组织。取样后将其保存于RNA保存液中, 置于-20℃保存, 用于RNA提取。
1.4 青虾Gsf1基因的引物
根据从本实验室构建的青虾卵巢文库中Gtsf1的EST序列, 遵循引物设计原则, 使用 Primer 5软件设计特异性引物, 采用快速扩增cDNA末端技术(RACE技术)从青虾卵巢中分别克隆出Gstf1基因的3′端和5′端, 并拼接成全长序列。在cDNA全长序列的基因上, 采用同样的方法设计一对荧光定量引物。荧光定量引物已验证其是有效的。荧光定量中所用到的β-actin 引物参考Zhang[18]设计, 并且广泛应用在青虾中[19,20]。引物列表见表 1。
1.5 青虾Gtsf1基因的克隆

表 1 实验所用引物列表Tab. 1 List of primers used in the current study
将青虾卵巢的混合样, 按Trizol reagent试剂的说明方法提取总RNA。所使用的RNA样品A260/280值为1.9—2.1。按Takara RACE试剂盒的说明, 采用套式PCR对青虾Gtsf1基因的3′, 5′端进行扩增。第一、二轮反应条件均如下: 94℃预变性1min, 随后95℃ 30s, 55℃ 30s, 72℃ 1min进行30个循环, 最后72℃ 10min。
分别取PCR产物经1.2%琼脂糖凝胶电泳20min后, 切取特异性目的条带, 用生工胶回收试剂盒切胶回收纯化。将纯化的纯化产物与pMD18-T载体进行连接, 反应体系为: 4 μL DNA, 1 μL pMD18-T,5 μL Solution I。混匀后PCR仪上16℃连接过夜。将连接产物转化到Trans DH5α大肠杆菌感受态细胞。在37℃过夜培养后, 将含有目的片段重组质粒的菌液送往上海铂尚生物工程技术服务有限公司进行测序。
1.6 青虾Gtsf1基因时空表达分析
首先用不同发育时期样品的总RNA作为cDNA第一链的合成模板, 严格按照BIO-RAD iScript cDNA Synthesis Kit试剂盒的说明进行cDNA第一链的合成。首先根据分光光度计所测量出样品RNA的浓度, 分别取1 µg总RNA为模板, 分别进行独立的反转录反应, 所有操作均在冰上进行, 产物-20℃保存备用。使用 BIO-RAD iQ5 荧光定量PCR仪进行PCR反应, 所用引物见表1, 反应过程如下: 首先95℃预变性1min, 然后进入40个循环, 每个循环中包括95℃变性10s, 55℃延伸30s两个步骤,循环结束后, 从55℃缓慢升温到95℃, 绘制熔解曲线。
每个样本设置3个重复, 每次反应都以β-actin基因作为阴性对照, 最后由系统自动记录荧光曲线和数据, 用于后期数据分析。PCR产物均须用1.2%的琼脂糖凝胶电泳检测其是否为单一特异性扩增条带, 以确保实验结果的可靠性。
1.7 青虾生物学信息分析和数据统计分析
在NCBI中用BLASTN对测序结果进行比对分析, ORF Finder软件(http://www.ncbi.nlm.nih.gov/ gorf)分析开放阅读框, 采用DNAMAN 5.0 软件将中间序列、3′端序列、5′端序列进行拼接得到青虾Gtsf1基因cDNA序列。用在线DNA和蛋白序列处理工具(http://www.91bio.com/SMS2/rev_comp. html)推导蛋白质分子量。用SignalP3.0 Server*(http:// www.cbs.dtu.dk/services)进行信号肽预测。
数值计算参考2-ΔΔCt方法进行[21]。数据用平均值±标准差(X±SE)表示, 运用SPSS 17.0进行统计分析, 运用One-Way ANOVA进行显著性检验及多重比较(P<0.05)。用Excel绘制青虾Gtsf1基因的相对表达量直方图。
2 结果
2.1 青虾Gtsf1基因序列特征
青虾卵巢总RNA经第一链cDNA合成试剂盒反转录为第一链cDNA, 以此为模板依据文库中Gtsf1基因cDNA的部分序列, 设计3′端、5′端进行PCR扩增。PCR产物经切胶回收、纯化、克隆和测序, 用DNAMAN 5.0拼接后获得了349 bp的DNA片段, 序列已提交至GenBank上, 登录号为KR349325。其中开放阅读框ORF (Open Reading Frame, ORF)为240 bp, 共编码79个氨基酸, 从第16个氨基酸到第42个氨基酸为zf-U11-48K保守结构域。BLAST分析显示与鱼虱(Caligus rogercresseyi)Gtsf1基因(ACO10875.1)最为相似, 相似度达48%。用在线DNA和蛋白序列处理工具推导蛋白质分子量为9.49 kD, 等电点pI为9.86; 信号肽预测结果表明此蛋白无信号肽。利用DNAMAN对轮虫和昆虫类的动物等十个物种的Gstf1基因进行氨基酸序列比对发现青虾zf-U11-48K保守结构域中的谷氨酰胺变异成了丙氨酸。
2.2 青虾Gtsf1基因系统进化分析
利用MEGA 5.0软件对青虾Gtsf1基因的氨基酸序列和昆虫类等其他物种Gtsf1基因的氨基酸序列进行系统进化分析, 计算方法采用Bootstrap法重复计算1000次。从图 1可以看出, 与青虾的亲缘关系最近的是昆虫纲的一种蝽类(Lygus hesperus)。
2.3 青虾Gtsf1基因的组织分布
使用实时荧光定量PCR分别检测Gtsf1基因在雌性青虾和雄性青虾9个成体不同组织中的表达模式和分布情况如图 2所示。Gtsf1基因在性腺中表达很高, 特别是在卵巢中表达最高, 为精巢的6倍,在其他组织中的表达极低, 与性腺中相比存在显著差异(P<0.05)。Gtsf1基因在雄性青虾各个组织中与在雌性青虾各个组织中的表达情况类似。
2.4 不同卵巢发育时期Gtsf1基因的表达规律
为了研究Gtsf1基因在性腺中的作用, 本研究使用实时荧光定量PCR检测Gtsf1基因在青虾不同卵巢发育时期的表达模式和分布情况(图 3)。Gtsf1基因在卵巢发育过程中有先升高后降低的表达趋势。在卵巢发育初期该基因的表达水平较低, 随着卵巢的发育该基因的表达水平显著升高(P<0.05),在成熟期其表达量达到最高值。在卵巢消退期其表达水平显著降低(P<0.05), 恢复到较低水平。
2.5 青虾Gtsf1基因在胚胎和胚后发育过程中的表达规律
使用实时荧光定量PCR检测Gtsf1基因在青虾胚胎发育和胚后发育不同发育时期的表达模式和分布情况如图 4所示。从卵子到受精卵发育的第一天, Gtsf1基因的表达量显著增加。在胚胎发育早期该基因的表达水平较高, 在囊胚期显著升高, 出现了表达高峰, 接着在原肠胚期其表达水平显著下降,此后维持在较低表达水平直到整个胚胎发育的完成。在胚胎后发育过程中Gtsf1基因的表达水平持续较低。

图 1 Gtsf1的系统进化树Fig. 1 Phylogenetic tree of Gtsf1 among different species
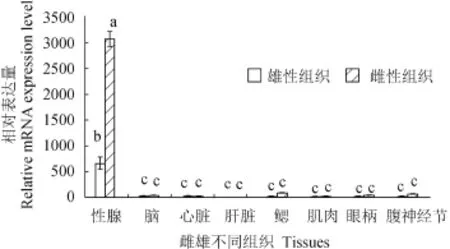
图 2 荧光定量PCR检测青虾各组织中Gtsf1 mRNA的转录水平(n≥3, P<0.05)Fig. 2 Gtsf1 mRNA level in various tissues of M. nipponense by real-time qPCR (n≥3, P<0.05)

图 3 荧光定量PCR检测青虾卵巢不同发育时期的Gtsf1 mRNA转录水平(n≥3, P<0.05)Fig. 3 Gtsf1 mRNA level in the different ovary development stages of M. nipponense by real-time qPCR (n≥3, P<0.05)
3 讨论
在小鼠Gtsf1基因中发现了两个串联的zf-U11-48K保守结构域, 有研究报道该结构域可能与RNA的识别有关, 从而发挥其相应的作用[5]。本研究也在青虾Gtsf1基因中发现了zf-U11-48K这个保守结构域, 但数量是一个。推测是因为小鼠比青虾具有较长的Gtsf1基因序列, 它具有167个氨基酸, 而在青虾中只有79个氨基酸。此外, 所推断的氨基酸序列不含信号肽, 具有分子作为非分泌型蛋白在细胞中行使功能特征。所构建的Gtsf1基因分子系统进化树显示, 青虾Gtsf1基因与昆虫纲的蝽类(Lygus hesperus)互为姐妹群, 这对于在分子进化水平上研究Gtsf1基因提供了一些背景材料。本文结果也为研究甲壳动物Gtsf1基因提供了背景材料。
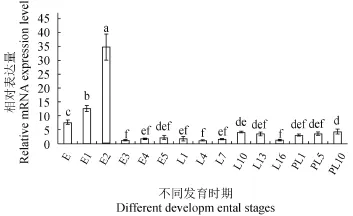
图 4 荧光定量PCR检测青虾不同发育时期Gtsf1 mRNA的转录水平(n≥3, P<0.05)Fig. 4 Gtsf1 mRNA level in different developmental stages of M. nipponense by real-time qPCR (n≥3, P<0.05)
有研究表明, 果蝇Gtsf1基因能在转录后水平抑制转座元件活性, 从而维持生殖细胞的正常发育分化, 促进性腺正常发育[6]。Krotz等[4]将Gtsf1蛋白定位在小鼠卵泡细胞的细胞质和精原细胞中, 均表明Gtsf1与生殖细胞的形成密切相关。本研究在青虾中也发现Gtsf1基因承担类似功能, 在各组织表达模式中发现在卵巢和精巢中表达很高, 在其他组织中基本不表达, 且在卵巢中的表达量远高于精巢, 由此可推测青虾Gtsf1基因与生殖密切相关, 特别与卵巢发育相关。
卵巢的直接关系着动物的生长发育、繁殖性能等重要生命活动。本研究在青虾卵巢不同发育时期研究发现, 随着卵巢的发育, Gtsf1基因的表达水平显著升高(P<0.05), 在卵巢的消退期又恢复到较低水平, 由此可说明Gtsf1基因与卵巢发育呈正相关。卵巢成熟的过程同时也是卵子发生的过程[22,23]。Bai等[24]报道卵黄蛋白原基因参与青虾卵子的发生过程, 随着卵巢的发育, 该基因的表达规律与Gtsf1基因一致, 也出现了上升趋势。由此可推测Gtsf1基因与青虾卵子的生成关系密切。
本文进一步从转录水平上具体分析Gtsf1基因
[1]Yoshimura T, Toyoda S, Kuramochi-Miyagawa S, et al. Gtsf1/Cue110, a gene encoding a protein with two copies of a CHHC Zn-finger motif, is involved in spermatogenesis and retrotransposon suppression in murine testes [J]. Developmental Biology, 2009, 335(1): 216—227
[2]Yoshimura T, Miyazaki T, Toyoda S, et al. Gene expression pattern of Cue110: a member of the uncharacterized UPF0224 gene family preferentially expressed in germ cells [J]. Gene Expression Patterns, 2007, 8(1): 27—35
[3]Ohtani H, Iwasaki Y W, Shibuya A, et al. DmGTSF1 is necessary for Piwi piRISC-mediated transcriptional transposon silencing in the Drosophila ovary [J]. Genes & Development, 2013, 27(15): 1656—1661
[4]Krotz S P, Ballow D J, Choi Y, et al. Expression and localization of the novel and highly conserved gametocytespecific factor 1 during oogenesis and spermatogenesis[J]. Fertility and Sterility, 2009, 91(5): 2020—2024
[5]Andreeva A, Tidow H. A novel CHHC Zn-finger domain found in spliceosomal proteins and tRNA modifying enzymes [J]. Bioinformatics, 2008, 24(20): 2277—2280
[6]Dönertas D, Sienski G, Brennecke J. Drosophila Gtsf1 is an essential component of the Piwi-mediated transcrip-在青虾胚胎发育及胚后发育表达规律, 在其他物种未见相关报道。研究结果表明在青虾中从卵子到受精卵发育的第一天, Gtsf1基因的表达量显著增加(P<0.05), 当受精卵不断增殖发育到囊胚期多细胞结构的时候, Gtsf1基因出现了表达最高峰, 但在接下来的原肠胚期Gtsf1基因的表达水平显著下降(P<0.05), 从原肠期显著下降直至变态后第十天该基因表达水平维持较低水平(P<0.05), 推测青虾Gstf1基因也可能参与青虾胚胎发育的启动和囊胚的形成。
本研究首次在甲壳动物中克隆获得青虾Gtsf1基因cDNA序列, 该基因长349 bp, 其中开放阅读框为240 bp, 共编码79个氨基酸。该蛋白进行信号肽预测, 发现无信号肽, 可推测其为非分泌蛋白。系统进化树分析结果显示与青虾的亲缘关系最近的是昆虫纲的一种蝽类(Lygus hesperus)。实时荧光定量PCR结果显示Gtsf1基因在各组织表达水平中, 在性腺中表达显著较高(P<0.05), 其他组织基本不表达, 其中在卵巢中的表达量最高, 且与卵巢发育呈现正相关的规律, 这预示着Gtsf1基因在青虾性腺发育过程中发挥重要作用, 具体作用机理还有待进一步研究。由此本研究为进一步研究青虾Gtsf1基因功能和青虾性腺发育调控规律奠定基础, 也为其他甲壳动物的生殖相关研究提供参考。tional silencing complex [J]. Genes & Development,2013, 27(15): 1693—1705
[7]Dai P, Gou L T, Liu M F. PIWI/piRNA machinery in spermatogenesis [J]. Chemistry of Life, 2014, 34(4): 456—465 [戴鹏, 苟兰涛, 刘默芳. PIWI/piRNA “机器”与雄性生殖细胞发育. 生命的化学, 2014, 34(4): 456—465]
[8]Cox D N, Chao A, Baker J, et al. A novel class of evolutionarily conserved genes defined by piwi are essential for stem cell self-renewal [J]. Genes & Development, 1998,12(23): 3715—3727
[9]Harris A N, Macdonald P M. Aubergine encodes a Drosophila polar granule component required for pole cell formation and related to eIF2C [J]. Development, 2001,128(14): 2823—2832
[10]Fu H T, Wan S Q, Fu C P, et al. Screening of microsatellite markers associated with growth traits in Macrobrachium nipponense [J]. Acta Hydrobiologica Sinica, 2010,34(5): 1043—1048 [傅洪拓, 万山青, 付春鹏, 等. 青虾生长性状相关的微卫星标记筛选. 水生物学报, 2010,34(5): 1043—1048]
[11]Qiao H, Xiong Y, Zhang W, et al. Characterization, expression, and function analysis of gonad-inhibiting hormone in Oriental River prawn, Macrobrachium nipponense and its induced expression by temperature [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2015, 185: 1—8
[12]Du Y X, Ma K Y, Qiu G F. Discovery of the genes in putative GnRH signaling pathway with focus on characterization of GnRH-like receptor transcripts in the brain and ovary of the oriental river prawn Macrobrachium nipponense [J]. Aquaculture, 2015, 442: 1—11
[13]Zhang F, Chen L, Wu P, et al. cDNA cloning and expression of Ubc9 in the developing embryo and ovary of oriental river prawn, Macrobrachium nipponense [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 155(3): 288—293
[14]Zhang F, Chen L, Qin J, et al. A novel gene with a vWD domain and three Kazal-type domains: molecular cloning and expression in the ovary of the oriental river prawn,Macrobrachium nipponense [J]. Russian Journal of Genetics, 2011, 47(9): 1052—1057
[15]Qiao H, Fu H, Jin S, et al. Constructing and random sequencing analysis of normalized cDNA library of testis tissue from oriental river prawn (Macrobrachium nipponense) [J]. Comparative Biochemistry and Physiology Part D: Genomics and Proteomics, 2012, 7(3): 268—276
[16]Qiao H, Xiong Y W, Jiang S F, et al. Gene expression profile analysis of testis and ovary of oriental river prawn,Macrobrachium nipponense, reveals candidate reproduction-related genes [J]. Genetics and Molecular Research: GMR, 2014, 14(1): 2041—2054
[17]Zhang W Y. Cloning and spatial-temporal expression of female sterile homeotic gene (fsh) in Macrobrachium nipponense [D]. Thesis for Master of Science. Nanjing Agricultural University, Nanjing. 2012 [张文宜. 青虾雌性不育同源异型基因(fsh)全长cDNA克隆及时空表达分析.硕士学位论文, 南京农业大学, 南京. 2012]
[18]Zhang Y, Jiang S, Xiong Y, et al. Molecular cloning and expression analysis of extra sex combs gene during development in Macrobrachium nipponense [J]. Turkish Journal of Fisheries and Aquatic Sciences, 2013, 13(2): 331—340
[19]Ma K Y, Lin J Y, Guo S Z, et al. Molecular characterization and expression analysis of an insulin-like gene from the androgenic gland of the oriental river prawn, Macrobrachium nipponense [J]. General and Comparative Endocrinology, 2013, 185: 90—96
[20]Wang Y T, Mao H, Hou C C, et al. Characterization and expression pattern of KIFC1-like kinesin gene in the testis of the Macrobrachium nipponense with discussion of its relationship with structure lamellar complex (LCx) and acroframosome (AFS) [J]. Molecular Biology Reports,2012, 39(7): 7591—7598
[21]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod [J]. Methods, 2001, 25(4): 402—408
[22]Zhang F Y. cDNA cloning and expression of the genes involving in oogenesis and embryo development in Macrobrachium nipponense [D]. Thesis for Doctorate of Science. East China Normal University, Shanghai. 2011 [张凤英. 日本沼虾 (Macrobrachium nipponense) 卵子和胚胎发育相关基因的克隆与表达研究. 博士学位论文, 华东师范大学, 上海. 2011]
[23]Du Y X, Qiu G F. Histological and histochemical observation on ovary development in oriental river prawn Macrobrachium nipponense [J]. Guangdong Agricultural Sciences, 41(13): 119—123 [杜玉昕, 邱高峰. 日本沼虾卵巢发育的组织学与组织化学观察. 广东农业科学, 2014,41(13): 119—123]
[24]Bai H, Qiao H, Li F, et al. Molecular characterization and developmental expression of vitellogenin in the oriental river prawn Macrobrachium nipponense and the effects of RNA interference and eyestalk ablation on ova- rian maturation [J]. Gene, 2015, 562(1): 22—31
MOLECULAR CHARACTERIZATION AND EXPRESSION ANALYSIS OF GTSF1 IN THE ORIENTAL RIVER PRAWN MACROBRACHIUM NIPPONENSE
LIANG Guo-Xia1, FU Hong-Tuo1,2, QIAO Hui2, BAI Hong-Kun2, ZHANG Wen-YI2, LI Fa-Jun1,3, JIANG Su-Fei2,XIONG Yi-Wei2, GONG Yong-Sheng2, JIN Shu-Bo2and WU Yan2
(1. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China; 3. Weifang University of Science and Technology, Shouguang 262700, China)
Gametocyte-specific factor 1(Gtsf1) is involved in gonadal development and plays an important role in maintaining normal proliferation of germ cells in Mus musculus and Drosophila melanogaste. In order to study sexual precocity in Macrobrachium nipponense, the homologous cDNA sequence of Gtsf1 was screened from the ovary and testis differentially gene expression profile, and the full-length cDNA sequence was cloned by RACE technique (KR349325). The length of its cDNA sequence was 349 bp, containing a 240 bp open reading frame (ORF), encoded a 79-amino acid protein. MnGtsf1 protein contained a zf-U11-48K domain that shared highly with its homologues in other vertebrates. The sequence did not contain signal peptide, indicating it is a non-secreted protein. According to the phylogenetic tree analysis, MnGtsf1 has the closest evolutionary relationship with its homologous in Lygus hesperus. MnGtsf1 was exclusively expressed in the gonads, especially in ovary, which is 6 times higher than that in testis. The MnGtsf1 expression showed an increased trend with the ovarian development. MnGtsf1 expression in the early embryonic development was higher than that in the late embryonic development. The MnGtsf1 expression showed the highest in blastula stage,and its expression stayed at a low level from gastrula stage to the 10thday after metamorphosis. These results indicate that MnGtsf1 might be involved in gonadal development and early embryonic development.
Macrobrachium nipponense; Gtsf1; Development of ovary; Gonad; Expression profiles
10.7541/2016.36
Q344+.1
A
1000-3207(2016)02-0261-07
2015-06-09;
2015-12-01
国家“十二五”科技支撑计划(2012BAD2604-05); 中央级基本科研业务费专项(2015JBFM05); 江苏省水产三新工程(D2013-6, D2015-16); 江苏省科技支撑计划-农业部分; 江苏省基础研究计划(自然科学基金)青年基金资助 [Supported by the National Science & Technology Supporting Program of the 12th Five Year Plan of China (2012BAD2604-05); China Central Governmental Research Institutional Basic Special Research Project from the Public Welfare Fund (2015JBFM05); the Three Aquatic Projects of Jiangsu Province (D2013-6, D2015-16); the Science & Technology Supporting Program of Jiangsu Province (BE2012334); the Natural Science Foundation of Jiangsu Province (BK2012091)]
梁国霞(1990—), 女, 湖南耒阳人; 硕士研究生; 研究方向为水产动物遗传育种。E-mail: liangguoxia_2009@126.com
傅洪拓(1964—), 男, 湖南长沙人; 研究员, 博士; 主要研究方向为水产动物遗传育种。E-mail: fuht@ffrc.cn
