人工细胞制备的研究进展
2016-11-24李培森
刘 巍,李培森,李 可,武 鑫
(1.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津 300387;2.天津工业大学环境与化学工程学院,天津 300387)
人工细胞制备的研究进展
刘 巍1,2,李培森1,2,李 可2,武 鑫2
(1.天津工业大学省部共建分离膜与膜过程国家重点实验室,天津 300387;2.天津工业大学环境与化学工程学院,天津 300387)
人工细胞即是模拟细胞精巧结构制备出与生物细胞功能相近的细胞微囊,如将一些生物大分子包埋在其中用以实现特定功能或寻找新型材料制备具有良好通透性细胞膜的人工细胞等.从人工细胞化学法和生物法制备的角度对近几十年来人工细胞的发展以及应用进行简要概述,并探讨了目前人工细胞发展面临的困难和未来研究的方向.
人工细胞;制备方法;微囊;固定化酶;多酶固定化;载体
生命体内的细胞因功能不同而分化为多种细胞,各种生物大分子的协同作用使得细胞的各种功能得以顺利进行.科学家通过研究各种细胞的优势功能,模拟其精巧结构合成人工细胞,不仅进一步了解了生命体的本质,同时也发明出相应的智能材料,促进了各领域的技术进步.
1964年加拿大McGill大学Chang[1]首次提出了人工细胞的概念,即用具有生物相容性的半透膜包裹组织细胞,该半透膜仅允许小分子的营养物质、代谢产物和分泌物通过,而阻止大分子物质包括免疫活性细胞和抗体通过.20世纪80年代初期,加拿大多伦多大学的Lim和Sun[2]成功制成了能够包裹胰岛细胞的海藻酸钠-聚赖氨酸-聚乙烯亚胺膜,并将其植入到患有糖尿病的实验鼠体内,实验鼠维持了3周的正常血糖,但最终由于聚乙烯亚胺会引发炎症而导致实验失败. 1986年,O′Shea等[3]用海藻酸钠代替聚乙烯亚胺,制成了海藻酸钠-聚赖氨酸-海藻酸钠膜,这种膜具有较好的生物相容性,成功地构建了较为理想的人工细胞.
目前的人工细胞大多是以双亲聚合物为细胞膜,这种膜在选择透过性和稳定性上都存在问题,为了改善这个问题,人工细胞上往往需要复杂的通道蛋白和离子泵来调节细胞和外界环境的物质交换.Mansy等[4]证明了这种细胞膜能使膜外的活性核苷酸自发地穿过细胞膜参与信息复制.
东京大学的Kurihara等[5]研制出了一种可以实现DNA扩增(PCR)、能自我复制的人工细胞.南开大学史林启课题组[6]将醇氧化酶和过氧化氢酶的酶纳米复合物进行包埋,制备出一种能够降解血液中酒精含量的人工细胞.除了直接在细胞中包埋生物大分子或改善细胞膜用以合成具有某一特定功能的人工细胞外,各界学者在人工细胞的制备方法上也不断推陈出新,使人工细胞可以实现分区.
层层自组装法(LbL)可以制备得到力学、热学相对稳定的微囊结构[7-8].利用LbL法制备出不同粒径且大小均一的细胞微囊,还可以控制囊壁的机械强度和通透性.目前应用最多的是静电层层自组装,它是利用聚合物阴阳离子间的静电作用力来制备细胞微囊,最后在去除核之后的中空结构中包埋酶分子,可使酶分子保持生物活性[9].利用LbL法制备有机/无机杂化的细胞微囊在多酶固定化研究和药物传递中将具有很强的指导意义.
目前,人工细胞作为一种组织工程、药物负载及催化化学领域的新兴技术已成为科学家们研究的热点.本文将从制备的角度对人工细胞的发展现状进行综述.
1 人工细胞制备方法的分类
人工细胞制备方法一般可分为2类:一类是利用生物方法构建自然界中本不存在的所谓的minimal cell[10],它是一种自上而下的方法[11-12],即移除自然界中生物真实生命体细胞的一些不必要的基因、细胞器等,直至得到可以存活的最小单元[12-13];另一类则是利用化学方法合成的,称为synthetic cell、artificial cell、primitive cells、organelle、protocell等[4-5,14-19],它是一种自下而上的方法,即利用化学方法将基本的化学分子组装起来获得具有一定功能的模拟细胞的微囊[4,12,19].
生物法合成人工细胞一般是生物学家常用的方法,他们不断寻找能够维持细胞生存、复制的最小基因组,将该最小基因组转入另一个细胞后可使另一个细胞的种类完全发生改变.如生殖支原体由于其代谢量小、基因组冗余少且是可以在纯培养物中生长的最小基因组,被认为是能够维持细菌生存的最小单元.使用全局转位子诱变,从482个生殖支原体蛋白编码基因中去除100非必需基因后,将剩余的由382个生殖支原体蛋白编码基因,3个磷酸盐转运蛋白基因和43个RNA编码基因构成最小基因组转入另一种细胞体内,另一种细胞表现出了生殖支原体的特性[11].
将一种细菌细胞中的全基因组移植入另一物种的基因组中,通过合成基因组的繁殖,可使子代细胞的物种发生改变.如Carole等[12]以四环素抗性细胞完整的基因组作为供体,由丝状支原体LC染色体携带,利用聚乙二醇介导法将其移植到山羊支原体细胞中,合成基因组繁殖后,子代细胞的性状与丝状支原体LC供体菌株几乎相同.
化学法合成人工细胞的材料通常有脂质体、双亲聚合物等,合成方法一般有层层自组装法、溶胶-凝胶法、乳液法等.目前人们制备的大多数人工细胞都是基于如DNA和RNA这样复杂的天然分子,但对于人工细胞同生物之间的信息交流的研究却很少.Grardner等[14]利用简单的原料合成复杂的碳水化合物,该碳水化合物可以构建一种脂质结合体(protometabolism).这种糖类能够引起海洋菌Vibrio harveyi的群体效应,产生荧光现象,实现了人工细胞与生物之间的信息传递.如图1所示,脂质体(L)囊泡(顶部)内发生自催化甲醛聚糖反应.囊泡外pH升高启动碳水化合物的合成.形成的碳水化合物-硼酸盐复合物(右上)通过媒介与Vibrio harveyi(右下)相互作用,成功与Vibrio harveyi发出的的信号结合,产生荧光蛋白(左下角).

图1 人工细胞的代谢产物引起海洋菌Vibrio harveyi的群体效应Fig.1 Metabolic products are capable of engaging natural quorum sensing mechanism of marine bacterium Vibrio harveyi
目前,在生物医学领域已有大量文献报道了生物法合成人工细胞的发展现状,本文不再赘述,仅从化学法的角度对人工细胞作出阐述.化学法合成人工细胞容易制得具有特异性功能的细胞微囊且发挥性能较稳定,所以在目前的研究中很受重视.本文将主要从制备原料和制备方法两个方面介绍化学法合成人工细胞.
2 人工细胞的制备原料
制备人工细胞的材料决定了细胞的性能和应用.如磷脂双层膜由于是生命体细胞膜的主要组成成分最先引起人们的重视[20-21],但是这种膜极易被破坏,所以在实际应用中很少使用.在人工细胞中包埋酶时,人工细胞材料的开发和酶的包埋方法已然成为研究重点,找到一种性能优良、价格合理的材料用于包埋酶分子,不仅可以大大提高酶的利用率,同时也使得人工细胞大规模应用到实际生产中成为可能.因此,在制备人工细胞时一般都要求材料应具有良好的渗透性、生物相容性、一定的机械强度和稳定性.目前常被用来合成人工细胞的材料有天然高分子材料和人工合成材料两大类.
2.1 天然高分子材料
常见的天然高分子材料有壳聚糖及其衍生物类、葡聚糖类、纤维素类、脂质体等.
2.1.1 壳聚糖
壳聚糖又被称为脱乙酰几丁质,它是由N—乙酰糖胺和糖胺组成的多聚体,主要通过甲壳素脱乙酰化制备.它是自然界中存在的唯一一种带正电的碱性多糖类物质,廉价易得且制备简单,经改性后衍生物具有机械性能良好、生物相容性好、耐热、耐酸碱、化学性能稳定等优点.由于壳聚糖分子链上有大量的伯氨基,海藻酸钠的分子链上有大量的羧基,二者可以通正、负电荷吸引形成聚电解质膜,具有较好的成膜特性[22],所以它是代替多聚赖氨酸制备细胞微囊的理想材料[23].
用壳聚糖制备人工细胞微囊应用最为广泛的是在其中固定酶分子.目前,利用壳聚糖为材料的微囊已成功地固定了脂肪酶、α-淀粉酶、木瓜蛋白酶、牛胰蛋白酶等一百多种酶.如李红等[24]用醋酸、壳聚糖溶液、戊二酸溶液制成壳聚糖细胞微囊,经干燥后用磷酸缓冲液浸泡抽干,加入木瓜蛋白酶搅拌后,然后滴入戊二醛溶液进行交联反应,从而得到包埋木瓜蛋白酶的人工细胞.陈金日等[25]利用离子凝胶化原理在磁力搅拌下将三聚磷酸钠溶液缓慢加入到壳聚糖醋酸溶液中,而后再将α-淀粉酶滴加到混合液中,在室温下进行吸附15 min后得到包埋α-淀粉酶的人工细胞.
2.1.2 葡聚糖
葡聚糖也常常被用作制备人工细胞的材料.近年来,各种葡聚糖改性载体材料也层出不穷.如陈秀琳等[26]用CM-葡聚糖凝胶作为细胞微囊并向其中固定脂肪酶:先将载体分别用盐酸和NaOH反复浸泡冲洗至中性后,再用缓冲液平衡,取其上清液,加入脂肪酶溶液进行反应,真空干燥后制得包含有脂肪酶的人工细胞.这种方法得到的人工细胞微囊对脂肪酶具有良好的保护作用,使脂肪酶在耐热、耐碱和热稳定性上都有了明显的改善.曹国民等[27]用“油包水”反相悬浮聚合法,将烯丙基葡聚糖与N,N′-亚甲基双丙烯酰胺聚合交联,直接包埋脂肪酶,获得的固定化脂肪酶具有较高活性.
2.1.3 脂质体
近年来,脂质体因其主要由卵磷脂、生育酚等天然成分构成,对生物体无毒无害而备受人们关注.脂质体是制备人工细胞的良好材料,脂质体微囊比其他材料微囊小,且细胞微囊对酶的包容量大,从而使人工细胞可以更好地发挥作用.如Picon A等[28]用脂质体微囊包埋洋蓟酶制备得到人工细胞,将其用于生产奶酪,可加速奶酪的形成,大大缩短熟化时间,制成的奶酪与对照实验并无明显区别.
2.2 人工合成材料
无机类吸附材料一般都有稳定性好、对生物体无毒无害、机械强度高、成本低廉等优点,常用的无机吸附剂有硅藻土、硅凝胶、玻璃、高岭土、氧化铝、二氧化钛等.有研究显示[29],无机类吸附材料在作为人工细胞合成原料包埋酶时,包埋酶的量、酶在细胞中的牢固程度以及包埋成功后酶的活性等取决于材料本身的特性.例如,用纯二氧化硅包埋α-淀粉酶形成的人工细胞要比氧化硅、硅藻土等材料与酶结合的更加牢固,且细胞中酶的活性更高,在连续使用一段时间后酶仍然保持着较高的活性.
2.2.2 有机类合成高分子材料
人工合成的高分子材料具有抗机械强度大、抗微生物性能良好、价格便宜等优点,所以在合成人工细胞的材料的研究中一直倍受青睐.
(1)海藻酸钠-聚赖氨酸-海藻酸钠.目前,应用最早且技术最为成熟的微囊是海藻酸钠-聚赖氨酸-海藻酸钠微囊.海藻酸钠是一种从褐藻中提取的水溶性聚醛酸盐,也是聚阴离子聚合物,其中的主要成分是1-4-β-D-甘露糖醛酸和α-L-古罗糖醛酸[30].研究表明,海藻酸钠对细胞具有无毒、生物相容性好且免疫原性低等优点.聚赖氨酸作为一种聚阳离子聚合物,具有良好的成膜特性,但是,由于其生产工艺复杂,主要依赖进口,故而价格昂贵.对海藻酸钠-聚赖氨酸-海藻酸钠微囊进行改善,使其优点更加突出,如Sun等[31]在海藻酸钠-聚赖氨酸-海藻酸钠微囊内部添加一层纤维蛋白的网状结构后,能够明显改善细胞微囊的生物相容性及稳定性,如图2所示.
(2)无机烷化物前体.用无机烷化物前体制备细胞微囊不仅可以封装对热敏感且比较脆弱的生物分子(如酶,蛋白质,抗体和全细胞植物,动物以及微生物),而且它还具有较好的生物相容性、化学惰性、物理刚性、热稳定性.这种细胞微囊通常是用溶胶—凝胶法来制备的.如在制备二氧化硅基质时,溶胶—凝胶过程一般包括醇盐前体的水解,羟基化单元的缩合、缩聚反应形成多孔凝胶.通常由烷化物正硅酸甲酯、TEOS或TMOS水解启动在活性生物分子的存在下进行的.Si单体在酸性催化剂下引发水解和缩合的交联反应熟化干燥后形成无定形SiO2基体,它是围绕生物分子形成的一种立体多孔无机基体,具体制备过程如图3所示.这种基体可以应用于医疗,环境和工业领域.目前,用溶胶—凝胶法制备的基体封装细胞器制成的人工细胞已经移植到生命系统中,用于实现植物/动物/微生物细胞重要代谢产物的商业化生产[32].但是,用这种材料制备的微囊在应用中有一个缺点,那就是容易形成裂痕[32-33].

图2 微囊中纤维蛋白凝块作用原理图Fig.2 Schematic diagram of role of fibrin clot formation in microcapsule
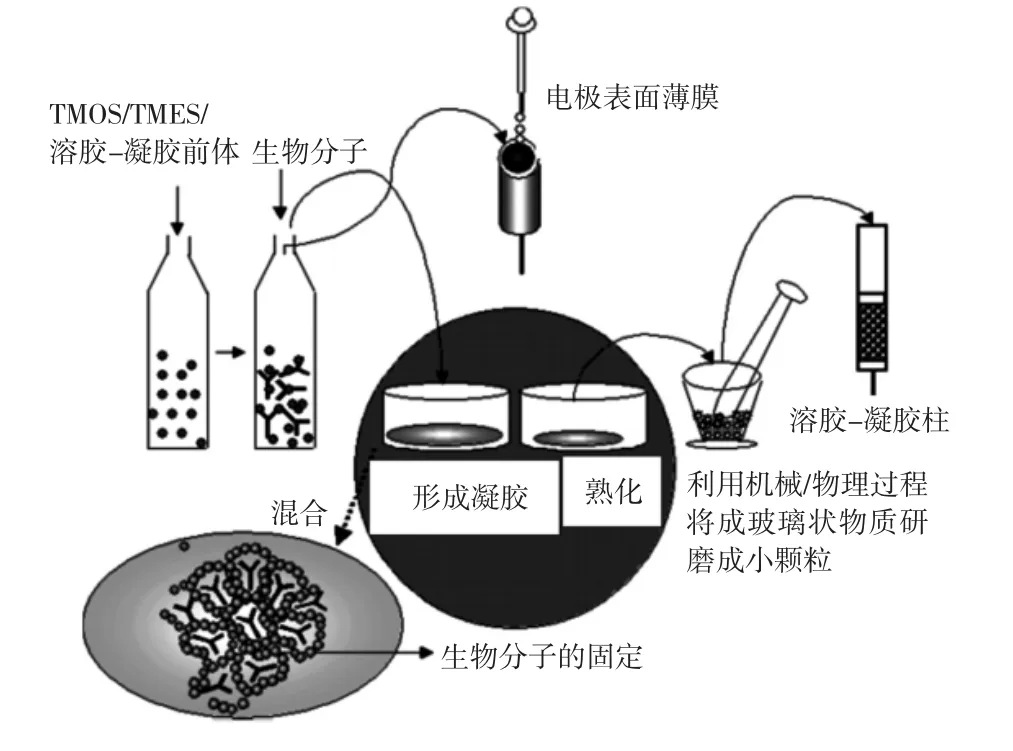
图3 溶胶-凝胶法制备SiO2基体原理图Fig.3 Schematic diagram of sol-gel process to prepare SiO2matrix
人工合成有机高分子材料用于人工细胞的可行性研究已成为目前研究的热点.如用戊二醛为交联剂,阳离子交换树脂D151制备乳糖酶人工细胞,以及聚苯乙烯阴离子交换树脂吸附交联法合成α-淀粉酶人工细胞等.俞宏峰等[34]采用树脂吸附—海藻酸钙包埋—戊二醛交联法制备乳糖酶人工细胞,分11批次反应后,乳糖水解率保持在85%,连续反应62天水解率仍然保持在80%,这种方法制成的乳糖酶人工细胞具有优越的操作性能.
3 人工细胞的制备方法
人工细胞的划分除了以上按制备原料分类外,还可以按照人工细胞的制备方法进行划分.目前,大致可以将其分为3类:固定化酶法,用于制备具有某种特定功能的人工细胞;遗传信息表达法,构建能够进行自我复制的人工细胞;构造通透性膜法,通过改进膜材料改善膜的通透性.以下将对这3种人工细胞进行简单的介绍.
当“共享型人力资源”与“创业型企业”实现结合,如何实现“可持续发展”就成为企业发展的关键。可持续发展是一种注重长远发展的经济增长模式,最初于1972年提出,指既满足当代人的需求,又不损害后代人满足其需求的发展,是科学发展观的基本要求之一。而企业的可持续发展,其主体关注的是企业是否能一直延续发展下去,而且要符合企业自身、企业外部乃至整个社会的发展要求。“共享型人力资源”为企业发展提供了前进的不竭动力,“创业型企业”目标为企业发展提供了前进的方向,而“可持续发展”则为企业的前进提供了先进的理念。
3.1 固定化酶法
酶是生命体生命活动不可或缺的生物催化剂,细胞中各种酶的协同催化作用使得细胞的各种功能得以顺利进行.因此,制备负载有酶的人工细胞微囊具有重要研究意义.人工细胞在固定化酶方面的应用最为广泛.在这里,我们首先对固定化酶进行介绍.
3.1.1 固定化酶的提出
游离酶的稳定性较差,活性受pH值及温度的影响比较明显,且在水溶液中,反应物及产物较难分离,从而使酶的使用成本增加,限制了酶的广泛应用.
为解决上述问题,从20世纪60年代开始,酶的固定化技术渐渐发展起来,酶的固定化既能保持酶的催化活性又能克服游离酶的一些不足,使酶分子结构的稳定性增加,耐酸、耐碱性增强,重复使用性增加,且反应后易与产物分离.不仅有效地控制了生产过程,又简化了生产工艺.因此固定化酶技术成为了酶工程中的研究热点[35].如2004年,Luckarift等[36]用仿生硅化法固定化酶取得了良好的成果.他们将一定比例的R5多肽、TMOS水解液和丁酰胆碱酯酶进行混合,在多肽的催化作用下成功包埋了丁酰胆碱酯酶的R5/氧化硅纳米颗粒,在纳米颗粒中丁酰胆碱酯酶的活性维持率几乎达到100%.
3.1.2 固定化酶的方法
酶的固定化方法大致可以分为4类,即吸附法、共价结合法、交联法和包埋法[37-38],如图4所示.

图4 固定化酶方法Fig.4 Enzyme immobilisation strategies
(1)包埋法:将酶分子截留在具有特定网状结构载体中的一种固定化方法.可分为凝胶包埋法、纤维包埋法、半透膜包埋法和辐射包埋法.常用的包埋载体有天然高分子,如海藻酸钠、琼脂糖等,以及合成高分子,如聚乙烯醇(PVA)、聚丙烯酰胺凝胶等.包埋法具有广泛的适用性,因为它仅仅只是将酶分子进行包埋,未进行化学修饰,所以酶活性较高,且避免了酶和外界环境的直接接触.但此方法不适用于作用大分子底物或产物的酶的固定化[38].
(2)微囊封装法:用半透性的聚合物膜封装酶分子,从而形成一种微胶囊型的固定化酶.
(3)吸附法:酶分子通过氢键、离子键等吸附于不溶于水的载体表面的方法.可以分为物理吸附和离子吸附.常用的载体有纤维素、硅藻土、多孔陶瓷、多孔玻璃等.吸附法操作简便,但实际应用中易受到pH、盐离子浓度的影响而脱落.
(4)交联法:在酶分子之间或酶分子与载体间利用双功能或多功能试剂形成凝集的网状结构的固定化方法.这种方法成本低,操作简便且形成的孔径较大,容易实现多种催化剂的共交联;但固定化过程中条件难以控制,酶的回收率较低,机械强度较差.
共价结合法:酶分子与载体通过共价键形成不可逆的连接.常用的载体有纤维素、壳聚糖、葡聚糖等.这种方法固定化的酶与载体结合稳定,但制备过程较为复杂,且酶活性可能不高.
3.1.3 多酶共固定
在生物细胞中,往往需要多种酶的协同作用来维持生命体的正常功能.同样,在工业应用中,常常也需要多种酶的一系列作用生产某种产品.多酶共固定化就是将多种酶固定在同一载体上,各种酶的特点充分发挥且相互联系,使细胞微囊具备特定功能的固定化酶的方法.南开大学史林启课题组[6]研制出一种可以降解血液中酒精含量的人工细胞,他们将醇氧化酶和过氧化氢酶形成的酶纳米复合物封装在一个薄的聚合物壳内形成细胞微囊,两种酶的协同作用避免了有毒代谢产物的积累,将这种人工细胞可以明显降低酒精中毒小鼠体内血液中酒精的含量.Brigitte等[39]研究了用层层自组装法构造的人工细胞和细胞器的结构,这种合成单元为新一代治疗运载工具的发展提供了强大的生物医药平台.如图5所示,即是层层自组装及其去核过程.图5中:(i)结构骨架为具有半透性的聚合物水凝胶膜,实现膜内与外部环境之间营养物质的交换;(ii)包埋酶分子后LbL模仿溶酶体引发DNA的降解;(iii)用一层合并的脂质体骨架与囊泡内部隔开.
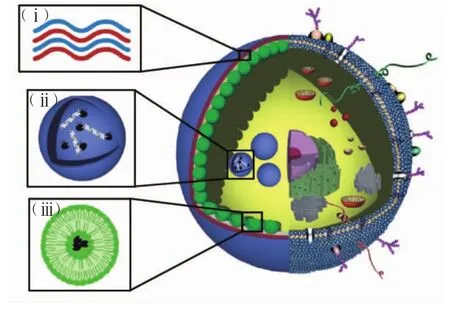
图5 源于LBL微囊的模拟细胞和细胞器的结构示意图Fig.5 Schematic diagram of simulated cell and organelle derived from LBL microcapsules
通常,要在微囊中进行空间的划分来有顺序的放置不同的酶(即所谓的分区).例如,按照酶的反应次序进行分区.通过分区可以实现对化学反应的控制,使细胞在反应中不被破坏,或者利用空间组合实现多步的串联反应,从而使一系列的反应可以有序进行.一般在双层膜微囊的3个不同位置包埋不同的酶.如在嵌段共聚物(isocyanopeptides)和苯乙烯形成的多孔共聚物囊泡的内腔、双层膜上和表面分别包埋葡萄糖氧化酶(glucose oxidase),脂肪酶(Candida antarctica lipase B)和辣根过氧化酶(horseradish peroxidase)3种酶[40].如图6所示,PS-PIAT和anchor 1的混合物与CalB酶冷冻干燥后溶解于THF中,而后将其注入到含GOx酶的缓冲液中,共聚物膜上封装诱捕的CalB酶,在膜表面通过共价键固定HRP酶.目前,对于这种复杂酶系统模拟的工作重点主要集中在酶的包埋和组装[34-35,41-43].
天津大学Jiang等[44-45]利用仿生钛化方法制备出一种新型Alg-Pro-Ti杂化微囊,在其中固定多种酶作为微工厂厂房,利用LbL微囊作为工作车间,实现了多酶体系内部的功能分割.建立形成的这种“仿生微工厂”具备6种机制,分别为:结构外壳或支架,生物分子与环境之间的交流运输,感应机制,酶的封装,靶向和细胞做出响应[46],具体结构如图7所示.

图6 共聚物囊泡中HRP,CalB,GOx的包埋位置Fig.6 Self-Assembly of HRP,CalB,Gox in a polymersome

图7 “仿生微工厂”结构示意图Fig.7 Schematic diagram of Bionic microfactory
3.2 遗传信息表达法
生命体细胞无时无刻不在进行着遗传信息的表达过程,通过细胞的分裂实现遗传信息的传递.近年来,学者们致力于研究可以实现遗传物质自我复制的人工细胞.
东京大学的Kurihara等[5]研制出了一种可以实现DNA扩增(PCR)、能自我复制的人工细胞.通过聚阴离子的DNA和阳离子细胞膜的相互作用,将信息物质的自我复制与人工细胞的自我复制连接起来,扩增后的DNA能平均分配到子代细胞内且DNA的扩增加速了人工细胞的分裂.具体过程如图8所示,
DNA的扩增过程中,在含有模板DNA、引物、荧光标记的SYBR GreenⅠ、脱氧核苷三磷酸、DNA聚合酶和Mg2+的缓冲溶液中用薄膜溶胀法制备含有PCR试剂的GVS水分散液;微囊的自我复制过程中,膜前体物质的加入诱导微囊进行自我复制,扩增DNA的附着加速了囊泡的生长和分裂.但是,细胞的自我复制是有限度的.因为随着细胞分离,磷脂质所占百分比的降低,阳离子人工膜含量不断增加.

图8 DNA的扩增及人工细胞自我复制图Fig.8 Schematic diagram of amplification of DNA and self-reproduction of GVs
Pierre-Alain等[16]将T7 RNA聚合酶和DNA模板包裹在脂质囊泡(脂质体)中,发现包埋后脂质体膜有足够的渗透性,可以允许和三磷酸腺苷(NTPs)一样大的离子化底物分子通过并与酶接触.包埋的聚合酶利用碱基序列转录特定的DNA模板合成核糖核酸RNA,其原理如图9所示.图中:a(i)23.3℃时,NTPs通过被动运输的方式透过脂质体膜;a(ii)37℃时,酶的活性最佳但NTPs的扩散能力较差;b脂质体内NTPs(虚线)的浓度和RNA的形成(实线)遵循温度变化形成循环:温度为23.3℃时,NTPs大量积聚;37℃时,NTPs用于转录模板RNA被迅速耗尽.他们的研究表明了在单个隔室中遗传信息单元可以与功能催化剂相关联,基因大小的DNA片段的转录可以仅仅靠被动扩散供给的NTPs基质来实现.

图9 T7 RNA聚合酶脂质体系统原理图Fig.9 Schematic diagram of T7 RNApolymerase liposomal system
将脱细胞的大肠杆菌封装在磷脂囊泡中建立一个类细胞的生物反应器表达系统.用乳液法将大肠杆菌提取物、绿色荧光蛋白基因包埋在大的单层脂质体中,而后将形成的双层微囊放置于含有核苷酸和氨基酸的溶液里进行培养(基因的转录和翻译是分开进行的),检测到绿色荧光蛋白基因的表达在2 h后停止,但若同时将α-溶血素包埋在囊泡里,绿色荧光蛋白的表达时间可以持续4 d[18].
3.3 构造通透性细胞膜法
生命体中的磷脂细胞膜对穿过细胞膜的极性带电分子具有很强的阻碍作用,这种作用使得人们很难了解细胞生命的起源.因此,制备人工细胞时,就需要细胞膜能够具有复杂的蛋白通道和离子泵来调解细胞与外界环境之间的物质交换.
在生命体细胞中,存在着一种光驱动离子泵BR(Bacteriorhodopsin),它能够维持细胞膜内外物质的浓度差,这种浓度差可以驱动F0F1-ATP合成酶合成ATP.将BR及F0F1-ATP合成酶包埋于脂质体中,光照条件下,人工细胞也可以合成ATP[47],合成过程如图10所示.

图10 包含BR和F0F1-ATP合成酶的脂质体合成ATP示意图Fig.10 Schematic diagram of synthesis of ATP that liposomes containing BR and F0F1-ATP synthase
二肉豆蔻酰磷脂酰胆碱(DMPC)细胞膜在凝胶—液体的转变温度下会存在缺陷,核苷酸可以利用这种缺陷穿过细胞膜,但是这种膜本身不具备膜生长的动态特性,所以在应用中受到限制.Mansy等[4]提出用脂肪酸及其醇类和甘油单酯来制备人工细胞膜,因为它们是形成细胞双分子层的简单两亲化合物,可以使封装在其中的寡核苷酸保持生长和分裂的能力.他们已经证实了这种人工细胞膜可允许带电分子的通过,如将激活的核苷酸加入到细胞膜外,它可以自发的穿过细胞膜并在细胞内部参与遗传信息的复制且完整遗传物质的分裂促进了子代人工细胞的形成.如图11所示为其理论模型.

图11 核苷酸自发通过人工细胞膜并参与复制的概念模型Fig.11 Conceptual model of nucleotides spontaneously permeate across the artificial cell membrane and act as substrates in replication
4 结语
目前,学者们对人工细胞在组织工程、药物负载甚至催化化学领域的应用都已展开研究.例如,微囊化胰岛细胞应用于治疗糖尿病,改善糖代谢异常问题,且能降低免疫排斥反应;微囊化人工细胞负载抗癌药物移植入小鼠体内取得较好的治疗效果;在催化化学领域,利用在人工细胞中固定酸脱氢酶、醛脱氢酶和醇脱氢酶三种酶做为催化剂,将二氧化碳转化为甲醇[48].
但是,种种制约因素导致人工细胞的应用目前大多还只是在实验阶段.例如,固定化酶法制备人工细胞时微囊材料就是首要影响因素.酶固定化要求载体材料要有良好的机械强度、热稳定性、化学稳定性、抗微生物特性及酶的结合能力等.由于寻找理想人工细胞材料困难,酶在固定化过程中不可避免地会损失部分活力,甚至当固定方法不得当时会损失绝大部分活力等原因,到目前为止也只有十几种固定化酶被应用于生产中.此外,制备材料的价格也是直接影响人工细胞能否广泛应用的重要因素.
人工细胞的制备涉及医学、生物学、化学、高分子材料学等多种学科的交叉结合.所以,要想制备出具有特定功能且性能优良的人工细胞必然需要多种学科的共同协作.近年来,人们利用接枝改性等方法创造着不同种类人工细胞,但要真正达到向生命体细胞那样能自我复制、自我修复和进化、选择透过性好的人工细胞,还需要各界学者的进一步研究.
[1]CHANG T M.Semipermeable microcapsules[J].Science,1964,146(3643):524-525.
[2]LIM F A,SUN A M.Microencapsulated islets as bioartificial endocrine pancreas[J].Science,1980,210(4472):908-910.
[3]O′SHEA G M,SUN A M.Encapsulation of rat islets of Langerhans prolongs xenograft survival in diabetic mice[J].Diabetes,1986,35(8):943-946.
[4]MANSY S S,SCHRUM J P,MATHANGI K,et al.Templatedirected synthesis of a genetic polymer in a model protocell[J]. Nature,2008,454(7200):122-125.
[5]KURIHARA K,TAMURA M,SHOHDA K I,et al.Self-reproduction of supramolecular giant vesicles combined with the amplification of encapsulated DNA[J].Nature Chemistry,2011,3(10):775-781.
[6]LIU Y,DU J J,YAN M,et al.Biomimetic enzyme nanocomplexes and their use as antidotes and preventive measures for alcohol intoxication[J].Nature Nanotechnology,2013,8(3):187-192.
[7]KREFT O,SKIRTACH A G,SUKHORUKOV G,et al.Remote control of bioreactions in multicompartment capsules[J]. Advanced Materials,2007,19(20):3142-3145.
[8]CARUSO F,TRAU D,MOEHWALD H,et al.Enzyme encapsulation in layer-by-layer engineered polymer multilayer capsules[J].Langmuir,2000,16(4):1485-1488.
[9]KATSUHIKO A,HILL J P,QINGMIN J.Layer-by-layer assembly as a versatile bottom-up nanofabrication technique for exploratory research and realistic application[J].Phys chem chem phys,2007,9(19):2319-2340.
[10]LUISI P L.The Emergence of Life:From Chemical Origins to Synthetic Biology[M].Cambridge:Cambridge Univ Press,2010.
[11]GLASS J I,NACYRA A G,NINA A,et al.Essential genes of a minimal bacterium[J].Proceedings of the National Academy of Sciences,2006,103(2):425-430.
[12]CAROLE L,GLASS J I,NINA A,et al.Genome transplantation in bacteria:changing one species to another[J].Science,2007,317(5838):632-638.
[13]MILLER D M,GULBIS J M.Engineering protocells:Prospects for self-assembly and nanoscale production-lines[J].Life,2015,5(2):1019-1053.
[14]GARDNER P M,WINZER K,DAVIS B G.Sugar synthesis in a protocellular model leads to a cell signalling response in bacteria[J].Nature Chemistry,2009,1(5):377-383.
[15]ZHANG Y,RUDER W C,LEDUC P R.Artificial cells:Building bioinspired systems using small-scale biology[J]. Trends in Biotechnology,2008,26(1):14-20.
[16]MDNNARD P A,DEAMER D W.Models of przmitive cellular life:Polymerases and templates in liposomes[J].Philospophical Transactions of the Rogal Society of London,2007,362:1741-1750.
[17]BLAIN J C,SZOSTAK J W.Progress toward synthetic cells[J]. Annu Rev Biochem,2014,83:615-640.
[18]NOIREAUX V,LIBCHABER A.A vesicle bioreactor as a step toward an artificial cell assembly[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(51):17669-17674.
[19]LI Mei,HUANG Xin,TANG T Y Dora,et al.Synthetic cellularity based on non-lipid micro-compartments and protocell models[J].Current Opinion in Chemical Biology,2014,22:1-11.
[20]MURTAS Giovanni.Early self-reproduction,the emergence of division mechanisms in protocells[J].Molecular BioSystems,2013,9(2):195-204.
[21]DENGLER E C,LIU J W,KERWIN A,et al.Mesoporous silica-supported lipid bilayers(protocells)for DNA cargo delivery to the spinal cord[J].2013,168(2):209-224.
[22]REACH G.Bioartificial pancreas[J].Diabetic Medicine,1993,10(2):105-109.
[23]BARTKOWIAK A,HUNKELER D.New microcapsules based on oligoelectrolyte complexation[J].Annals of the New York A-cademy of Sciences,1999,875:36-45.
[24]李红,王炜军,徐凤彩.壳聚糖微球固定化木瓜蛋白酶的特性研究[J].华南农业大学学报,2001,22(2):56-58. LI H,WANG W J,XU C F.Study on the characteristics of immobilized chitosan microspheres with chitosan microspheres[J].Journal of South China Agricultural University,2001,22(2):56-58(in Chinese).
[25]陈金日,冉旭,王利.壳聚糖纳米胶囊固定化α-淀粉酶及其特性的研究[J].中国酿造,2009(07):81-83. CHEN J R,RAN X,WANG L.Study on immobilization of aamylase and its characteristics of chitosan nanoparticles[J]. China Brewing,2009(07):81-83(in Chinese).
[26]陈秀琳,郑毅.CM—葡聚糖凝胶固定化脂肪酶的研究[J].药物生物技术,1999(1):20-23. CHEN X L,ZHENG Y.Study on immobilization of lipase by CM-dextran gel[J].Pharmaceutical Biotechnology,1999(1):20-23(in Chinese).
[27]曹国民,王钒.交联烯丙基葡聚糖凝胶固定化脂肪酶的研究[J].离子交换与吸附,1997(5):515-518. CAO G M,WANG F.Study on the immobilization of lipase by cross linked gel[J].Ion exchange and adsorption,1997(5):515-518(in Chinese).
[28]PICON A,SERRANO C,GAYA P,et al.The effect of liposome-encapsulated cyprosins on manchego cheese ripening[J]. Journal of Dairy Science,1996,79(10):1699-1705.
[29]IVANOVA V.Catalytic properties of immobilized purified thermostable α-amylase from Bacillus licheniformis 44MB82-A[J]. Process Biochemistry,1994,29(7):607-612.
[30]PRAKASH S,JONES M L.Artificial cell therapy:New strategies for the therapeutic delivery of live bacteria[J].Journal of Biomedicine&Biotechnology,2005,2005(1):44-56.
[31]SUN T,CHAN M L H,QUEK C H,et al.Improving mechanical stability and density distribution of hepatocyte microcap-sules by fibrin clot and gold nano-particles[J].Journal of Biotechnology,2004,111(2):169-177.
[32]KANDIMALLA V B,TRIPATHI V S,JU H X.Immobilization of biomolecules in sol-gels:Biological and analytical applications[J].Critical Reviews in Analytical Chemistry,2006,36(2):73-106.
[33]AVNIR D,CORADIN T,LEV O,et al.Recent bio-applications of sol-gel materials[J].J mater chem,2006,16(11):1013-1030.
[34]俞宏峰,孙志浩,郑璞,等.树脂吸附法制备固定化乳糖酶及其操作稳定性的研究[J].离子交换与吸附,2006,22(5):423-428. YU H F,SUN Z H,ZHENG P,et al.Study on adsorption resin prepared by immobilized lactase and its operational stability[J].Ion Exchange and Adsorption,2006,22(5):423-428(in Chinese).
[35]陈守文.酶工程[M].北京:科学出版社,2008,1-200. CHEN S W.Enzyme Engineering[M].Beijing:Science Press,2008,1-200(in Chinese).
[36]LUCKARIFT H R,SPAIN J C,NAIK R R,et al.Enzyme immobilization in a biomimetic silica support[J].Nature Biotechnology,2004,22(2):211-213.
[37]SHELDON Roger A.Enzyme immobilization:the quest for optimum performance[J].Adv Synth Catal,2007,349:1289-1307.
[38]BRADY D,JORDAAN J.Advances in enzyme immobilization[J].Biotechnol Lett,2009,31:1639-1650.
[39]BRIGITTE S,PRICE A D,RONA C,et al.Polymer hydrogel capsules:en route toward synthetic cellular systems[J].Nanoscale,2009,1(1):68-73.
[40]STIJN F M D,MADHAVAN N D.A three-enzyme cascade reaction through positional assembly of enzymes in a polymersome nanoreactor[J].Chemistry,2009,15(5):1107-1114.
[41]WALDE Z P,ICHIKAWA S.Enzymes inside lipid vesicles:preparation,reactivity and applications[J].Biomolecular Engineering,2001,18(4):143-77.
[42]LI Mei,GREEN D C.ANDERSON J L Ross,et al.In vitro gene expression and enzyme catalysis in bio-inorganic protocells[J].Chemical Science,2011,2(9):1739-1745.
[43]MURTAS G,KURUMA Y,BIANCHINI P,et al.Protein synthesis in liposomes with a minimal set of enzymes[J].Biochemical&Biophysical Research Communications,2007,363(1):12-17.
[44]JIANG Z Y,YANG D,ZHANG L,et al.Preparation of protamine-titania microcapsules through synergy between layerby-layer assembly and biomimetic mineralization[J].Advanced Functional Materials,2009,19(1):150-156.
[45]JIANG Z Y,ZHANG L,YANG D,et al.Fabrication of polysaccharide-inorganic hybrid biocapsules with improved catalytic activity and stability[J].Industrial&Engineering Chemistry Research,2008,47(8):2495-2501.
[46]LEDUC P R,WONG M S,FERREIRA P M,et al.Towards an in vivo biologically inspired nanofactory[J].Nature Nanotechnology,2007,2(1):3-7.
[47]STEINBERG-YFRACH G,RIGAUD J L,DURANTINI E N,et al.Light-driven production of ATP catalysed by F0F1-ATP synthase in an artificial photosynthetic membrane[J].Nature,1998,392(6675):479-482.
[48]孙倩芸.仿生硅化与自组装固定化酶用于二氧化碳转化的研究[D].天津:天津大学,2009. SUN Q Y.Study on the transformation of carbon dioxide by biomimetic and self-assembled immobilized enzymes[D].Tianjin:Tianjin University,2009(in Chinese).
Review on research process of artificial cells preparation
LIU Wei1,2,LI Pei-sen1,2,LI Ke2,WU Xin2
(1.State Key Laboratory of Separation Membranes and Membrane Process,Tianjin Polytechnic University,Tianjin 300387,China;2.School of Environmental and Chemical Engineering,Tianjin Polytechnic University,Tianjin 300387,China)
Artificial cells are cell-like microcapsules with functions similar to the living cells,mimicking the dedicated structures of biological cells,such as encapsulate biological macromolecules in microcapsules to achieve specific functions or to find new materials for the preparation of the cell membrane with felicitous permeability,etc.The development and application of artificial cells in recent decades are briefly overviewed from the point of view of chemical and biological prospective.The current difficulties and future research directions for the development of artificial cells are also discussed.
artificial cell;preparation method;microcapsule;immobilized enzyme;multienzyme immobilization;carriers
O631;R318
A
1671-024X(2016)05-0011-09
10.3969/j.issn.1671-024x.2016.05.003
2016-03-14
国家自然科学基金资助项目(21504063);天津市自然科学基金一般项目(12JCYBJC32000);天津市科技计划项目(15PTSYJC00230)
刘 巍(1981—),女,博士,讲师,主要研究方向为高分子材料.E-mail:liuhuiwen217@yahoo.com
