香蕉炭疽病拮抗菌Bs6602的诱变选育及防病作用研究
2016-11-24杜婵娟潘连富叶云峰晏卫红
杜婵娟, 付 岗*, 潘连富, 叶云峰, 晏卫红
(1. 广西农业科学院微生物研究所, 南宁 530007; 2. 广西农业科学院园艺研究所, 南宁 530007)
香蕉炭疽病拮抗菌Bs6602的诱变选育及防病作用研究
杜婵娟1, 付 岗1*, 潘连富1, 叶云峰2, 晏卫红1
(1. 广西农业科学院微生物研究所, 南宁 530007; 2. 广西农业科学院园艺研究所, 南宁 530007)
为了提高拮抗菌对香蕉炭疽病的抑菌活性,本研究采用紫外线-亚硝酸钠复合诱变的方法对枯草芽胞杆菌Bs6602菌株进行诱变。结果表明,该菌株的最佳诱变条件为在距离20 W紫外灯50 cm下照射15 s,然后经300 mmol/L NaNO2诱变处理60 min。经过2次复合诱变,最终得到1株抑菌活性最强的6B8-5菌株,其抑菌活性比出发菌株提高83.80%。咪鲜胺对突变株6B8-5的最低抑菌浓度(MIC)为20.83 μg/mL。连续转接7代,突变株6B8-5的抑菌活性无明显降低。6B8-5菌株的抑菌谱测试结果表明,其对13种植物病原真菌具有较强的抑菌活性,其中对多主棒孢霉的抑菌活性最强,抑菌圈直径达66.39 mm。对香蕉炭疽病防治的试验结果表明,香蕉贮藏15 d后,6B8-5菌株的防效明显高于出发菌株,为63.94%;6B8-5菌株与43 200倍咪鲜胺稀释液混用后,其防效最高达70.27%,与咪鲜胺1 350倍稀释液防效相当。
枯草芽胞杆菌; 香蕉炭疽病; 复合诱变; 防治效果
香蕉炭疽病由芭蕉炭疽菌(Colletotrichummusae)侵染引起,在香蕉大田生长期间就潜伏在果皮内,在香蕉采后贮运期间随着果实成熟逐渐显现症状,造成蕉果严重腐烂,是香蕉采后贮藏、运输过程中发生的主要病害之一。目前对该病的防治主要还是采用化学药剂[1]。然而长期大量使用化学药剂,会使病原菌产生抗药性,也会造成农药残留,污染环境,危害人类健康。因此,采用无污染、无公害的采后处理方法防治香蕉炭疽病, 已引起研究人员的广泛关注和重视。
枯草芽胞杆菌(Bacillussubtilis)是一种大量存在于自然界的重要细菌,其生长快、营养简单、并形成抗逆能力较强的芽胞,对多种植物病原真菌具有较好的拮抗作用,因此被广泛应用到农业、环保等领域。自1945年Johnson[2]发现枯草芽胞杆菌产生抗菌物质以后,便开始有大量的利用枯草芽胞杆菌防治植物病害的研究报道。Papavizas等[3]曾用枯草芽胞杆菌防治水稻的土传病害。Hwang等[4]报道枯草芽胞杆菌可防治由Rhizoctonia引起的豌豆根腐病。王雅平等[5]从丝瓜根际土壤分离的枯草芽胞杆菌TG26菌株对小麦赤霉病和西瓜枯萎病有较强的抑制作用。顾真荣等[6]用枯草芽胞杆菌G3防治菜豆和茄子苗期炭疽病和菌核病。尹华群等[7]从烟草青枯病流行区分离到1株内生枯草芽胞杆菌,该菌株的田间防效为82.5%。然而,目前利用枯草芽胞杆菌对香蕉炭疽病进行防治的报道仍不多见[8-10]。本研究拟以前期筛选获得的1株野生优良枯草芽胞杆菌Bs6602菌株作为出发菌株,采用紫外线-亚硝酸钠复合诱变法对其进行诱变处理,筛选出对香蕉炭疽病抑菌活性更强、传代稳定的正突变菌株,并探讨其与化学药剂复配后的抗病效果,以提高其对香蕉炭疽病的防效,旨在为香蕉炭疽病的无害化防治和香蕉病害微生物农药的研制提供可以利用的资源。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
拮抗菌:枯草芽胞杆菌Bs6602菌株,从香蕉根围分离筛选得到。
病原菌:芭蕉炭疽菌(Colletotrichummusae)、新月弯孢(Curvularialunata)、喙突脐蠕孢(Exserohilumrostratum)、簇生小窦氏霉(Deightoniellatorulosa)、香蕉链格孢(Alternariamusae)、弥泽那拟盘多毛孢(Pestalotiopsismenezesiana)、多主棒孢(Corynesporacassiicola)、香蕉大茎点霉(Macrophomamusae)、串珠镰孢(Fusariummoniliforme)、尖镰孢西瓜专化型(F.oxysporumf.sp.niveum)、尖镰孢古巴专化型(F.oxysporumf.sp.cubense)、细链格孢(Alternariaalternata)、胶孢炭疽菌(Colletotrichumgloeosporioides)。 以上菌株均由广西农业科学院微生物研究所生物防治研究室分离保存。
1.1.2 培养基
NA培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,水1 000 mL,pH 7.0;以不加琼脂作为液体培养基。
PSA培养基:马铃薯去皮后,取200 g切成小块煮沸30 min,用纱布过滤,滤汁加入蔗糖20 g,琼脂15 g,充分溶解后,补水至1 000 mL。
1.1.3 供试香蕉
试验香蕉品种为‘威廉斯B6’,采自广西南宁市武鸣县香蕉园,采收前3个月内未喷施杀菌剂。
1.2 方法
1.2.1 拮抗菌种子液的制备
将拮抗菌株接入NA液体培养基中,置28℃,120 r/min振荡培养16 h后,5 000 r/min离心3 min,弃上清液,沉淀用无菌水洗涤3次,制成108cfu/mL的菌悬液,4℃保存备用。
1.2.2 拮抗菌发酵液的制备
将拮抗菌株的种子液按1%(V/V)接种量移入NA液体培养基中,于28℃,120 r/min振荡培养72 h,即得发酵液,此时菌液浓度约为109cfu/mL。
1.2.3 拮抗菌株抑菌活性的测定
将香蕉炭疽病菌接入PSA试管斜面上,于28℃下恒温培养10 d,每管加入5 mL无菌水,轻微振荡将孢子洗下,收集得到香蕉炭疽病菌的孢子悬浮液(孢子浓度约为106cfu/mL),4℃保存备用。
在9 cm培养皿中加入5 mL熔化的2%水琼脂,冷凝后在平板上距中央2.5 cm处对称放置3个灭菌牛津杯。将熔化的PSA培养基冷却至45℃,加入1%(V/V)香蕉炭疽病菌孢子液,振荡摇匀,迅速加入到琼脂平板上,待凝固后取出牛津杯,形成直径7 mm的小孔,置28℃培养6 h。将待测拮抗菌株的发酵液于5 000 r/min离心3 min,上清液用细菌过滤器过滤后,分别取20 μL加入每个小孔,以无菌水为对照,每处理重复3次,每重复3个平板。然后置28℃下恒温培养,48 h后测量抑菌圈直径d(mm)。计算突变菌株的抑菌活性提高率:
抑菌活性提高率(%)=(d突变菌株-d出发菌株)/(d出发菌株-7)×100。
1.2.4 Bs6602菌株紫外诱变条件的确定
20 W紫外灯预热20 min后,取15 mL Bs6602菌株的种子液至灭菌的培养皿中(内置一灭菌磁力搅拌子),并放置在磁力搅拌器上,调整照射距离为50 cm,打开皿盖后,分别搅拌照射5、10、15、20、25、30和35 s;以未经紫外照射的菌液为对照,每个处理3个重复。用无菌水将照射后的菌液进行适当稀释,分别取100 μL涂布至NA平板上,置28℃下避光培养,诱变后所有操作均在红灯下进行。24 h后,对平皿上的单菌落进行计数,计算致死率。选择致死率90%左右的条件为紫外诱变的最适条件。
致死率(%)=(对照活菌数-诱变后活菌数)/对照活菌数×100。
1.2.5 Bs6602菌株亚硝酸钠诱变条件的确定
分别取5 mL Bs6602菌株的种子液,测定亚硝酸钠诱变的最适浓度时,加入灭菌的3 mol/L NaNO2溶液,使NaNO2浓度分别为25、50、100、150、200、250、300和350 mmol/L,充分混匀后反应30 min;而测定亚硝酸钠诱变的最适时间时,则加入600 μL灭菌的3 mol/L NaNO2溶液和400 μL无菌水,充分混匀后反应10、20、30、40、50、60和70 min。最后分别加入300 μL 5.6 mol/L 的Na2HPO4缓冲液(pH 8.6)终止反应,以未经NaNO2处理的菌液为对照,每个处理3个重复。用无菌水将处理后的菌液进行适当稀释,各取100 μL涂布至NA平板上,于28℃下培养24 h后,对平皿上的单菌落进行计数,计算致死率。致死率计算同1.2.4。选择致死率90%左右的条件为亚硝酸钠诱变的最适条件。
1.2.6 Bs6602菌株的紫外线-亚硝酸钠复合诱变
将Bs6602菌株的种子液以紫外诱变的最适条件进行诱变反应,对诱变后平皿上的单菌落进行抑菌活性的测定。然后选取抑菌活性最高的5株突变菌株以亚硝酸钠诱变的最适条件进行诱变反应,对诱变后平皿上的单菌落进行抑菌活性的测定,保存抑菌活性最高的5株突变菌株。Bs6602菌株的紫外线-亚硝酸钠复合诱变共进行2次。
1.2.7 诱变菌株的遗传稳定性测定
将经紫外线-亚硝酸钠复合诱变得到的抑菌活性最高的诱变菌株,转接到NA试管斜面上,28℃下培养24 h,置4℃冰箱保存,每隔7 d转接1次,连续转接10代后,参照1.2.3的方法测定各代菌株的抑菌活性。
1.2.8 Bs6602野生菌株和诱变菌株的抑菌谱测试
以Bs6602菌株和抑菌活性最高的诱变菌株作为测试菌株,分别测定其对供试的13种植物病原真菌的抑菌活性。方法参照1.2.7。
1.2.9 咪鲜胺对Bs6602野生菌株和诱变菌株最低抑菌浓度(MIC)的测定
采用试管二倍稀释法,用NA液体培养基(1 mL/管)将450 g/L咪鲜胺对倍稀释成系列浓度,使咪鲜胺的稀释浓度分别为675、1 350、2 700、5 400、10 800、21 600、43 200、86 400、172 800、345 600和691 200倍液,每个浓度3次重复,然后加入0.1 mL供试菌株的种子液。以加菌液但不加咪鲜胺的试管为阳性对照,以不加菌液和咪鲜胺的试管为空白对照。置28℃,120 r/min振荡培养24 h,以浑浊度为指标检查管中是否有细菌生长。管内无细菌生长而咪鲜胺浓度最低者,即为咪鲜胺对该试验菌株的MIC。
1.2.10 香蕉炭疽病的防治试验
田间采收八成熟的蕉果,洗净晾干,并除去伤病的蕉果,落梭后分成每梭5~6个蕉果。共设置6个处理:处理Ⅰ,Bs6602菌株发酵液的10倍稀释液;处理Ⅱ,6B8-5菌株发酵液的10倍稀释液;处理Ⅲ,咪鲜胺1 350倍液;处理Ⅳ,咪鲜胺43 200倍液;处理Ⅴ:Bs6602菌株发酵液的10倍稀释液(含43 200倍咪鲜胺);处理Ⅵ:6B8-5菌株发酵液的10倍稀释液(含43 200倍咪鲜胺);处理Ⅶ:清水对照。将蕉果在以上各处理中浸泡2 min后取出,室温下晾干,用塑料袋封装后,放入纸箱,置25℃下,RH 78%放置贮藏。每个处理设3次重复,每重复5 kg蕉果。
在蕉果开始发病时进行第1次病情调查,蕉果完全成熟后进行第2次调查;香蕉炭疽病的病情分级参照Fu等[11]的标准进行。
病情指数=∑(各级病果数×相对级数值)/(调查总果数×9)×100;
防治效果(%)=(对照区病情指数-处理区病情指数)/对照区病情指数×100。
1.3 数据统计与分析
研究所得数据用Excel进行汇总、平均值计算和作图,差异显著性采用DPS7.05软件的LSD法进行分析。
2 结果与分析
2.1 紫外诱变时间对Bs6602菌株致死率的影响
由图1可知,紫外线对Bs6602菌株的致死率随着其照射时间的增加而提高。当照射时间为15 s时,Bs6602菌株的致死率为91.49%;当照射时间大于25 s时,Bs6602菌株的致死率均趋于平缓并接近100%。
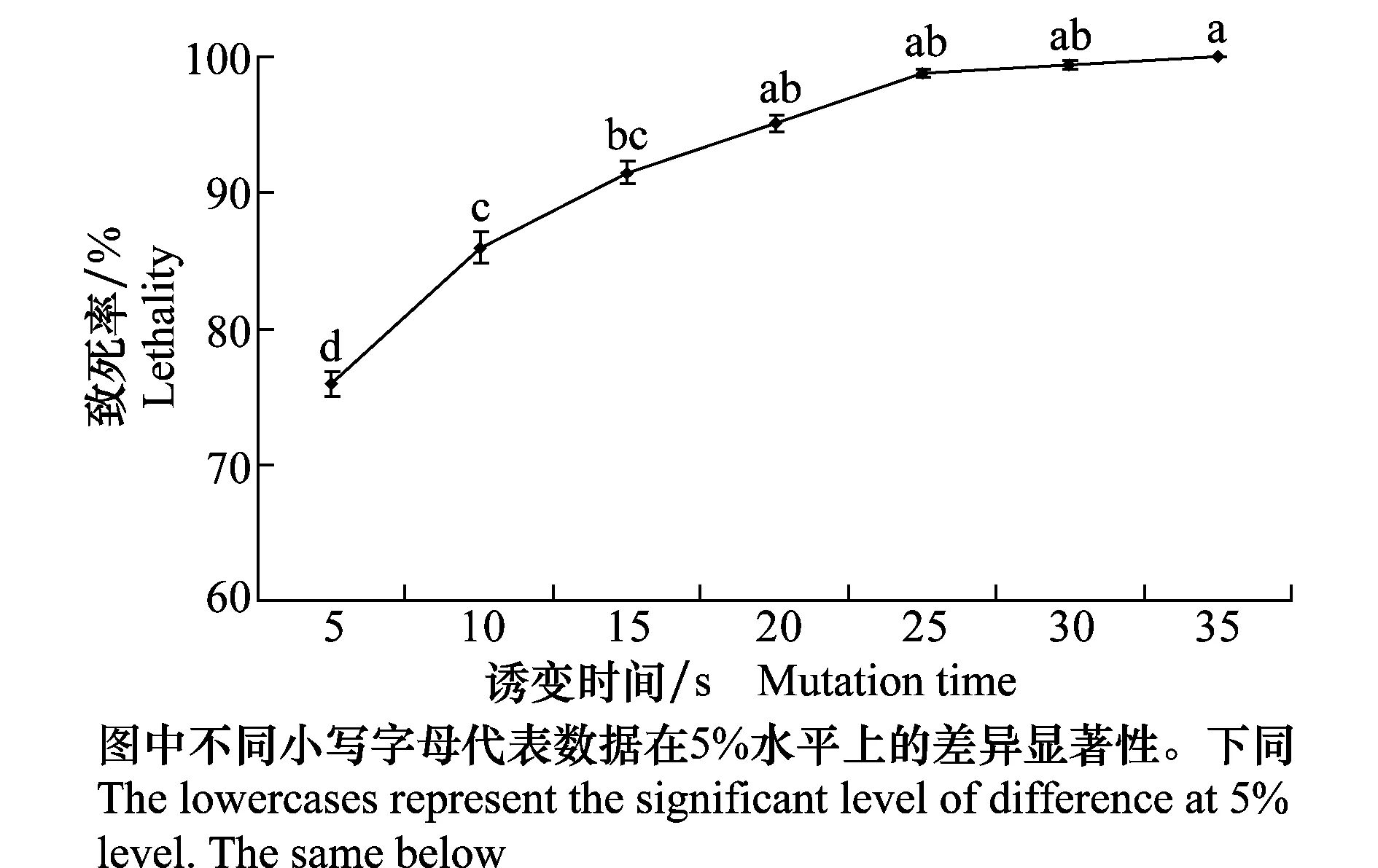
图1 紫外诱变时间对Bs6602菌株致死率的影响Fig.1 Effects of UV mutation time on the lethality of strain Bs6602
2.2 亚硝酸钠浓度对Bs6602菌株致死率的影响
由图2可知,NaNO2对Bs6602菌株的致死率随着其浓度的增加而提高。当NaNO2的浓度为300 mmol/L时,其对Bs6602菌株的致死率为87.86%。

图2 NaNO2浓度对Bs6602菌株致死率的影响Fig.2 Effects of NaNO2 concentration on the lethality of strain Bs6602
2.3 亚硝酸钠诱变时间对Bs6602菌株致死率的影响
由图3可知,NaNO2对Bs6602菌株的致死率随着其诱变时间的增加而提高。当NaNO2诱变的时间为60 min时,其对Bs6602菌株的致死率为90.78%。
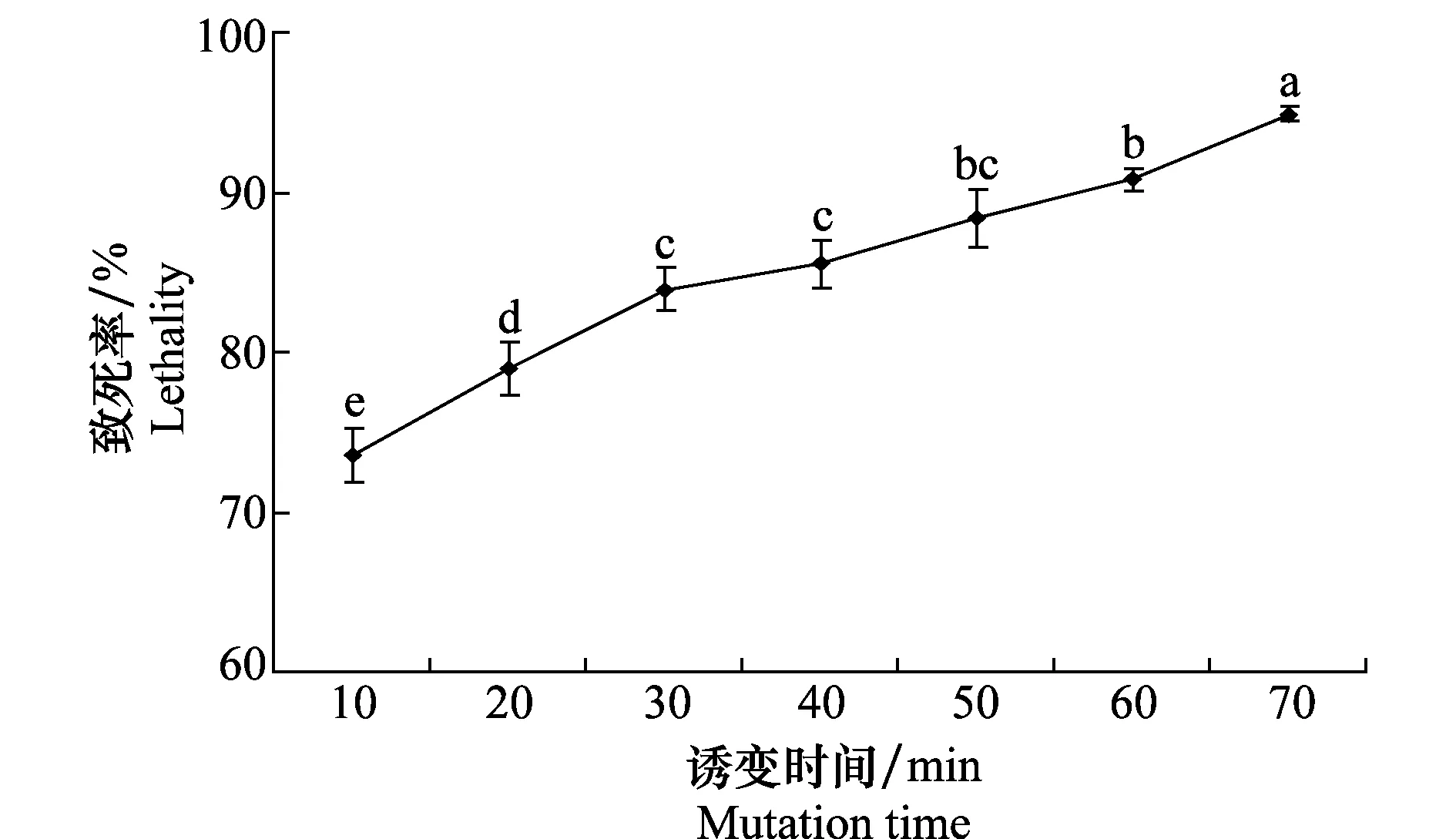
图3 NaNO2诱变时间对Bs6602菌株致死率的影响Fig.3 Effects of NaNO2 mutation time on the lethality of strain Bs6602
2.4 Bs6602菌株的紫外线-亚硝酸钠复合诱变
通过两次紫外线-亚硝酸钠复合诱变,以Bs6602菌株为出发菌株共得到143株正突变菌株。经过抑菌活性的测定,最终得到5株对香蕉炭疽病抑菌活性最高的突变菌株(图4)。由表1可知,5株突变菌株的抑菌圈直径为41.01~ 44.18 mm,其抑菌活性均比Bs6602菌株提高了70.03%以上。其中,6B8-5菌株的抑菌活性最高,提高了83.80%。
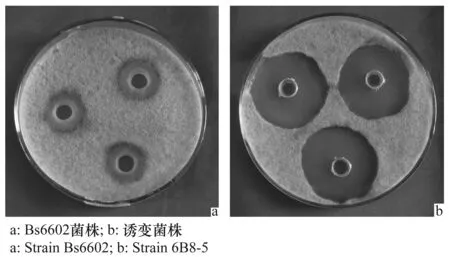
图4 拮抗菌株对香蕉炭疽病菌的抑菌作用Fig.4 Inhibition of antagonistic strains against Colletotrichum musae
此外本研究还发现,紫外线或亚硝酸钠的单一诱变和紫外-亚硝酸钠复合诱变均能提高Bs6602菌株的抑菌活性。与紫外线诱变相比,进行复合诱变后Bs6602菌株的抑菌活性提高了30.91%;而与亚硝酸钠诱变相比,则提高了18.35%。由此可知,复合诱变比单一诱变更能提高Bs6602菌株的抑菌活性。
2.5 突变株6B8-5菌株的遗传稳定性
将突变株6B8-5菌株每隔7 d传代1次,连续传代10次,由图5可知,随着传代次数的增加,该菌株的抑菌活性逐渐降低,但7代内其抑菌活性无明显变化,表明6B8-5菌株在7代内具有较好的遗传稳定性。

表1 诱变菌株的抑菌活性Table 1 Antifungal activity of mutant strains

图5 6B8-5菌株的遗传稳定性Fig.5 Genetic stability of strain 6B8-5
2.6 原始菌株Bs6602及诱变菌株6B8-5抑菌谱的测试
由图6可知,Bs6602及其突变株6B8-5菌株对13种植物病原真菌均有较强的抑菌活性。Bs6602菌株的抑菌圈直径在8.44~ 42.14 mm之间,而6B8-5菌株的则在11.93~ 66.39 mm之间。突变株6B8-5菌株的抑菌活性均比出发菌株Bs6602菌株有所提高,其提高率在6.65%~242.92%之间。其中,6B8-5菌株对多主棒孢霉(Corynesporacassiicola)、簇生小窦氏霉(Deightoniellatorulosa)和喙突脐蠕孢(Exserohilumrostratum)的抑菌作用最强,其抑菌圈直径分别为66.39、53.69和45.18 mm。

图6 拮抗菌株对植物病原真菌的抑菌作用Fig.6 Inhibition of antagonistic strains against plant pathogenic fungi
2.7 咪鲜胺对Bs6602菌株及其突变株6B8-5菌株的MIC
最低抑菌浓度的测试结果表明,咪鲜胺对Bs6602菌株及其突变株6B8-5菌株的MIC值相同,均为20.83 μg/mL。当咪鲜胺的稀释倍数大于43 200倍,即咪鲜胺浓度小于10.42 μg/mL时,其对2株菌株的生长无影响。
2.8 拮抗菌株对香蕉炭疽病的防治效果
由表2可知,香蕉贮藏15 d开始发病,各处理病情指数在13.78~55.15之间;突变株6B8-5菌株的防效为63.94%,显著高于出发菌Bs6602菌株(51.83%);6B8-5菌株与43 200倍咪鲜胺稀释液混用后,其防效为70.27%,与咪鲜胺1 350倍稀释液(75.01%)相当。贮藏至17 d 香蕉完全成熟,各处理区的病情指数均有增长,在28.48~ 95.71之间;6B8-5菌株与43 200倍咪鲜胺稀释液混用的处理,其防效(58.85%)与咪鲜胺43 200倍稀释液(55.59%)差异不显著。两次调查结果显示,6B8-5菌株与43 200倍咪鲜胺稀释液液混用后的防效均高于单独使用6B8-5菌株。

表2 拮抗菌株对香蕉炭疽病的防治效果Table 2 Control effect of antagonistic strains against Colletotrichum musae
3 讨论
野生型微生物大都存在生长缓慢、代谢物生产能力差、效价低等缺点,可采用适宜的诱变技术对其进行菌种改良。复合诱变是目前微生物育种的重要手段之一。卢燕回等[12]、游玟娟等[13]、司贺龙等[14]采用紫外线-亚硝酸盐复合诱变法对枯草芽胞杆菌进行诱变,均得到抑菌活性或产酶能力提高的正突变菌株。与他们的研究结果相似,本研究以野生枯草芽胞杆菌Bs6602菌株作为出发菌株,经过紫外线-亚硝酸钠复合诱变,得到1株对香蕉炭疽病菌抑菌活性较高的突变株6B8-5菌株,其抑菌活性比出发菌株提高了83.80%。
而在诱变剂量的选择上,通常对野生菌株的筛选趋向于采取较高的致死率,以90%左右的效果较好,虽然负突变株多,但变异幅度大,高产菌株的出现率较高,更有利于获得正突变株;对于经过长期诱变的微生物,则以70%~ 80%或更低的致死率较好,不会导致太多的负突变株和形态突变株,更利于高产菌株的稳定。因此本研究对Bs6602菌株进行诱变时,选择致死率为90%左右的诱变条件,提高该菌株的诱变效率,以筛选高抑菌活性的突变菌株。
此外,由于不同诱变因子的作用机理及特异性作用位点不同,如紫外线主要作用于DNA的嘧啶碱基,而亚硝酸则主要作用于DNA分子的嘌呤碱基,因此与单一诱变相比,采用复合诱变可以得到更多的突变类型,从而提高诱变效率。梁亮等[15]利用紫外线-亚硝酸钠对谷氨酸棒杆菌(Corynebacteriumglutamicum)进行复合诱变,发现经复合诱变处理的菌株产L-组氨酸的产量高于单因子诱变。与其研究结果类似,本研究结果表明,经过复合诱变后Bs6602菌株的抑菌活性比紫外线诱变提高了30.91%,比亚硝酸钠诱变提高了18.35%。
本研究中6B8-5菌株对香蕉炭疽病的防治效果显示,贮藏15 d后,该菌株的防效为63.94%,高于柳凤等[16]用解淀粉芽胞杆菌防治香蕉炭疽病处理10 d后的结果(56.67%)。而何红等[8]用枯草芽胞杆菌BS-2菌株防治香蕉炭疽病,当先接种病原菌,24 h后再接种BS-2菌株,15 d后防效为51.16%,低于本研究的结果;当先接种BS-2菌株,24 h再接种病原菌,15 d后防效为100%,高于本研究的结果。引起这一现象的原因,可能是由于先接种拮抗菌,使其在蕉果表面占领生态位,并快速繁殖,产生大量的抗菌物质,因此表现出较高的防治效果。然而,香蕉炭疽病的病菌在香蕉生长期内就潜伏在果皮上,在香蕉成熟后才表现症状。因此,本研究选用3个月内未喷施杀菌剂的蕉果进行试验,使试验结果能客观地反映6B8-5菌株对香蕉炭疽病的防治效果。
本研究结果表明,突变株6B8-5菌株对香蕉炭疽病的防效高于出发菌Bs6602菌株,但与生产上所使用的咪鲜胺1 350倍稀释液相比则存在一定的差距。究其原因,可能是因为发酵液中起主要作用的活性抗菌物质浓度较低,因此可以考虑优化发酵条件,并提取活性物质,以提高拮抗菌株对香蕉炭疽病的防治效果。此外,6B8-5菌株与咪鲜胺43 200倍稀释液混用后表现出较好的防治效果,香蕉贮藏15 d后其防效与咪鲜胺1 350倍稀释液差异不显著;至17 d,其防效仍与咪鲜胺43 200倍稀释液相当。表明该菌株与低浓度咪鲜胺混用,对香蕉炭疽病的防治具有增效作用,应用时可达到减少农药使用量的目的。而6B8-5菌株对香蕉生产上重要的病原真菌都具有较强的抑制作用,因此利用该菌株开发高效、对环境友好的生物农药,对香蕉产业的发展具有重要的意义。
[1] Korsten L.Advances in control of postharvest diseases in tropical fresh produce[J]. International Journal of Postharvest Technology and Innovation, 2006, 1(1): 48-61.
[2] Johnson A B.A new antibiotic produced by a member of theB.subtilisgroup [J]. Science, 1945, 102: 453-471.
[3] Papavizas G C, Lumsden R D.Biological control of soilborne fungal propagules[J]. Annual Review of Phytopathology, 1980, 18: 389-413.
[4] Hwang S F, Chakravarty P.Potential for the integrated control ofRhizoctoniaroot-rot ofPisumsativumusingBacillussubtilisand a fungicide[J]. Journal of Plant Diseases and Protection, 1992, 99(6): 626-636.
[5] 王雅平, 刘伊强, 潘乃, 等. 枯草芽孢杆菌TG26防病增产效应的研究[J]. 生物防治通报, 1993, 9(2): 63-68.
[6] 顾真荣, 马承铸, 韩长安. 枯草芽孢杆菌G3 防治植病盆栽试验[J]. 上海农业学报, 2002, 18(1): 77-80.
[7] 尹华群,易有金,罗宽,等.烟草青枯病内生拮抗细菌的鉴定及小区防效的初步测定[J].中国生物防治,2004,20(3):219-220.
[8] 何红, 蔡学清, 陈玉森, 等. 辣椒内生枯草芽孢杆菌BS-2和BS-1防治香蕉炭疽病[J]. 福建农林大学学报(自然科学版), 2002, 31(4): 442-444.[9] 谭志琼, 淦国英, 张荣意, 等. 枯草芽孢杆菌B68对香蕉果实潜伏炭疽菌的抑制作用[J]. 广西热带农业, 2006(5): 1-4.
[10]付岗, 叶云峰, 吴永官, 等. 香蕉采后炭疽病生防菌的多重筛选研究[J]. 云南农业大学学报, 2015, 30(4): 554-559.
[11]Fu Gang, Huang Siliang, Ye Yunfeng, et al. Characterization of a bacterial biocontrol strain B106 and its efficacy in controlling banana leaf spot and post-harvest anthracnose diseases [J]. Biological Control, 2010, 5(1): 1-10.
[12]卢燕回, 黎起秦, 林纬, 等. 西瓜枯萎病生防菌枯草芽孢杆菌B11菌株高产拮抗物质的诱变选育[J]. 广西农业生物科学, 2006, 25(4): 300-304.
[13]游玟娟, 冯刚利. 紫外线与亚硝酸复合诱变选育中性蛋白酶高产菌株[J]. 食品科技, 2010, 35(10): 23-26.
[14]司贺龙,张靖,赵巍,等.一株拮抗腐霉病菌的枯草芽孢杆菌的分离鉴定及诱变选育[J].湖北农业科学,2014,53(16):3805-3809.
[15]梁亮, 邱雁临, 许进涛. 紫外线与亚硝酸钠复合诱变选育L-组氨酸产生菌[J]. 微生物学杂志, 2008, 28(2): 27-29.
[16]柳凤, 陈振明, 何红. CⅢ-1菌株胞外抗菌蛋白防治香蕉炭疽病研究[J]. 果树学报, 2010, 27(4): 580-584.
(责任编辑:田 喆)
Mutation breeding and control effect of banana anthracnose antagonistic strain Bs6602
Du Chanjuan1, Fu Gang1, Pan Lianfu1, Ye Yunfeng2, Yan Weihong1
(1. Research Institute of Microbiology, Guangxi Academy of Agricultural Sciences, Nanning 530007, China;2. Horticulture Research Institute, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
In order to improve the antifungal activity of antagonistic bacteria on banana anthracnose,Bacillussubtilisstrain Bs6602 was mutated by UV-NaNO2compound. The results showed that the best mutation condition was irradiated by 20 W UV for 15 s when the irradiation distance was 50 cm, and then treated with 300 mmol/L NaNO2for 60 min. After mutated twice, the strain 6B8-5 was screened for the strongest antifungal activity. Its antifungal activity was increased by 83.80% compared with the original strain. Minimal inhibitory concentration (MIC) of prochloraz against strain 6B8-5 was 20.83 μg/mL.The antifungal activity of strain 6B8-5 was not reduced significantly after transferred for 7 generations continuously. The results of inhibition spectrum test showed that strain 6B8-5 had strong antifungal activity against 13 plant pathogenic fungi. Its antifungal activity againstCorynesporacassiicolawas the strongest, and the diameter of antifungal circle was 66.39 mm. The results of banana anthracnose control test showed that the control effect of strain 6B8-5 was 63.94%, significantly higher than that of the original strain, after stored for 15 days. When the strain 6B8-5 was mixed with the 43 200 times dilution of prochloraz, the control effect on banana anthracnose was 70.27%, similar to that with 1 350 times dilution of prochloraz.
Bacillussubtilis; banana anthracnose; compound mutation; control effect
2015-10-08
2016-01-08
广西自然科学基金项目(2013GXNSFBB053008);广西农业科学院基本科研业务费专项(2015YT79, 2015JZ61)
S 436.681
A
10.3969/j.issn.0529-1542.2016.05.011
* 通信作者 E-mail:fug110@gxaas.net
