不同产地烟草花蕾精油的抑菌和抗氧化能力比较研究
2016-11-23许春平李萌姗谭兰兰戴亚
许春平,李萌姗,谭兰兰, 戴亚
1 郑州轻工业学院 食品与生物工程学院 郑州高新区科学大道166号 450002;2 四川中烟工业有限责任公司技术中心 成都市成龙大道1段56号610066;3 重庆中烟工业有限责任公司技术中心 重庆市南岸区南坪城大道197号 400060
不同产地烟草花蕾精油的抑菌和抗氧化能力比较研究
许春平1,李萌姗1,谭兰兰2, 戴亚3
1 郑州轻工业学院 食品与生物工程学院 郑州高新区科学大道166号 450002;2 四川中烟工业有限责任公司技术中心 成都市成龙大道1段56号610066;3 重庆中烟工业有限责任公司技术中心 重庆市南岸区南坪城大道197号 400060
为研究不同产地云烟87烟草花蕾精油的抑菌和抗氧化活性,从而为烟草废弃物资源的综合利用提供理论支持。本试验采用水蒸汽蒸馏法制备烟草花蕾精油,并采用滤纸片法和最小抑菌浓度(MIC)、最小杀细菌浓度(MBC)和最小杀真菌浓度(MFC)方法测定精油的抑菌能力,采用清除DPPH、OH自由基和O2-以及还原能力测定其抗氧化能力。抑菌试验结果表明,4种产地的烟草花蕾精油均能够抑制细菌的生长,抑菌能力大小依次为云南文山>广西贺州>重庆奉节>贵州正安,但对于真菌的抑菌效果较差。抗氧化能力试验结果表明:4种产地的烟草花蕾精油均具有一定的抗氧化能力,基本上呈现出抗氧化能力随着浓度的升高而增强的趋势。其中,贵州正安烟草花蕾精油清除DPPH和还原能力测定的试验效果最好,重庆奉节烟草花蕾精油清除OH自由基的效果最好,广西贺州烟草花蕾精油清除O2-的效果最好。
烟草花蕾;精油;抑菌;抗氧化
植物精油是一类植物次生代谢物质,分子量较小,可随水蒸汽蒸出,具有一定的挥发性的油状液体物质[1],具有广谱的抑菌、抗癌、抗氧化等生理功能[2]。刘玉民等研究发现水蒸汽蒸馏法制备的枫香叶精油对革兰氏阳性菌和霉菌的抑制作用较强,对革兰氏阴性菌的抑制作用较弱,其抗氧化活性随着浓度的增大而增强[3]。El-Shazly等[4]研究了唇形科植物 Teucrium leucocladum Boiss 精油的抑菌活性, 试验表明精油对铜绿假单孢菌、白色念珠菌等呈现显著的抑菌活性。Chanjirakul等[5]研究发现采用茉莉酸甲酯、茶树油等涂抹处理可提高草莓和黑莓果实中的抗氧化能力,有效的清除过量的超氧阴离子自由基、羟基自由基、H2O2和单线态氧,延长果实保鲜期。为了剔除生长过程中的顶端优势,烟草生产中必须进行打顶处理,弃去花蕾部分[6]。但烟草花蕾是天然植物香源之一,含有丰富的香味物质,因而可以利用废弃的烟草花蕾进行精油的提取。许春平等通过CO2超临界萃取法制备烤烟烟草花蕾挥发油,并通过GC/MS分析了不同添加比例的烟草花蕾挥发油对烟草薄片烟气化学组成的影响[7]。国内对烟草花蕾精油的抑菌、抗氧化活性等进一步的研究鲜有报道。本试验研究了不同产地烟草花蕾精油的抑菌和抗氧化活性,旨在为烟草废弃物资源的综合利用提供理论支持。
1 材料与仪器
1.1 材料
广西中烟工业有限责任公司提供的2014年云烟87烟草花蕾(产地:贵州正安、云南文山、广西贺州、重庆奉节)
1.2 供试菌种
1.3 试剂
氯化钠、无水硫酸钠(天津市凯通化学试剂有限公司)、二氯甲烷、无水乙醇(天津市富宇精细化工有限公司)、BHT、吐温80、三氯化铁、硫酸亚铁、蔗糖、葡萄糖(天津市风船化学试剂科技有限公司)、DPPH(梯希爱(上海)化成工业发展有限公司)、PBS缓冲溶液(Solarbio北京索莱宝科技有限公司)、铁氰化钾(天津市光复精细化工研究所)、30%双氧水(天津市华东试剂厂)、邻二氮菲、EDTA(天津市科密欧化学试剂有限公司)、邻苯三酚(天津市瑞金特化学品有限公司)、Tris(GEN-VIEW SCIENTIFIC INC)、HCL(开封市芳晶化学试剂有限公司),以上试剂均为分析纯。青霉素钠(华北制药股份有限公司),头孢噻肟钠(华北制药河北华民药业有限责任公司),琼脂(北京索莱宝科技有限公司),肉汤培养基(北京奥博星生物技术有限责任公司)。
1.4 仪器与设备
水蒸汽蒸馏装置(郑州科技玻璃仪器厂)、电加热套、HS-4恒温水浴锅(上海医疗器械五厂)、Q-100A3旗箭粉碎机(上海冰都电器有限公司)、DGX-9143电热恒温鼓风干燥箱、恒温培养箱(上海福玛设备有限公司)、PL203电子分析天平(梅特勒-托利多仪器(上海)有限公司)、UV-17001C紫外分光光度计(上海凤凰光学科仪有限公司)、MicroCen16台式离心机(德国Herolab公司)、移液枪(大龙兴创实验仪器(北京)有限公司)、苏净安泰超净工作台(广州市深华生物技术有限公司)、SHINVA-2540型台式灭菌器(山东新华医疗器械股份有限公司)。
2 试验方法
2.1 原料的预处理
将云烟87烟草花蕾采集后,立即置于45℃烘箱中烘干,粉碎,过60目筛,密封保存,备用。
2.2 烟草花蕾精油的制备
采用水蒸汽蒸馏法制备烟草花蕾精油[8]。称取30g烟草花蕾置于烧瓶中,加入600mL蒸馏水和72g氯化钠,混合均匀后,静置2h后,加入玻璃珠数颗。将烧瓶置于电加热套内,然后连接挥发油提取器与冷凝回流管,并向挥发油提取器中加入蒸馏水,使其溢流回烧瓶中为止。打开电加热套,使其缓慢加热至沸腾。从有馏出液滴出开始计时,蒸馏4h后停止加热,冷却。将油水分离器下端的活塞打开,使水缓慢流出,待快到油层时,关闭活塞。使用二氯甲烷冲洗提取器,反复冲洗至油水分离器中无残留精油为止,合并冲洗液。向冲洗液中加入无水硫酸钠过夜,除去水分后,低温旋转蒸发,除去二氯甲烷,得到烟草花蕾精油。将制备好的烟草花蕾精油置于4℃冷藏室中冷藏,备用。
2.3 抑菌性能研究
2.3.1 培养基的制备
肉汤固体培养基:称取25g肉汤培养基,18g琼脂,加入1000mL蒸馏水,加热溶解后,分装,121℃高压灭菌15min,备用。用于大肠杆菌、枯草芽孢杆菌和多粘性芽孢杆菌的培养和抑菌试验。
PDA固体培养基(马铃薯葡萄糖琼脂培养基):称取200g马铃薯,洗净去皮,切碎,加入1000mL蒸馏水,煮沸,30min后,用8层纱布过滤。然后再加入20g蔗糖,18g琼脂,充分溶解后,分装,121℃高压灭菌15min,备用。用于黑曲霉、毛霉、青霉和毕赤酵母的培养和抑菌试验。其中,制作液体培养基时,不加入琼脂。
2.3.2 菌悬液的制备
将待试菌种活化后,用生理盐水配制成菌悬液。采用平板计数法测定细菌菌悬液的菌体个数,选用含菌体浓度为106~107cfu /mL的菌悬液,真菌采用显微镜直接计数法测定菌体个数,选用含孢子浓度为106~107个 /mL的菌悬液,备用。
其次,工作与生活的压力,是产后抑郁的重要原因。部分女性因为怀孕与分娩,可能会错失职场上升的机会,甚至会丢掉工作,加之因为宝宝的诞生,经济支出增加,会无形中给年轻妈妈增加焦虑。
2.3.3 抑菌圈的测定
采用滤纸片法[9]测定精油的抑菌性能。将滤纸用打孔器切割成直径为6mm的小圆型纸片,然后置于干燥的试管中,121℃灭菌30min后,在无菌操作台上将其放入浓度为140mg/mL的精油-乙醇溶液中。用无菌移液枪吸取0.2mL含菌体浓度为106~107cfu /mL的菌悬液,滴加到新鲜无菌的固体培养基上,涂布均匀。用无菌镊子将浸有精油的滤纸片贴在固体培养基中心,每个菌种平行测定3次。恒温培养(细菌:37℃/24h;真菌:28℃/48h),测定抑菌圈直径,比较抑菌效果。采用3mg/mL的青霉素钠和10mg/mL的头孢噻肟钠作为阳性对照,以经高压灭菌但未浸泡精油的无菌滤纸片作空白对照。测定抑菌圈直径,比较抑菌效果。
2.3.4 最小抑菌浓度(MIC),最小杀细菌浓度(MBC)和最小杀真菌浓度(MFC)
采用倍比稀释法在96孔板中测定最小抑菌浓度(MIC)[10]。首先第1列8个孔分别加入200μL液体培养基做空白对照,第2列加入180μL液体培养基和20μL浓度为30mg/mL的烟草花蕾精油,从第3列到第11列均加入100μL的液体培养基。从第2列中分别吸取相应的100μL精油到对应的第3列各孔,依次稀释到第11列,最后从第11列中吸出100μL废弃。各列精油的浓度为(14、7、3.5、1.75、0.875、0.4375、0.2188、0.1094、0.0547、0.0273mg/mL)。最后向2到11列各孔加入100μL菌悬液,其中第4行加100μL培养液做对照,第12列各孔加200μL菌液做阴性对照,细菌的第4行以3mg/mL的青霉素钠的倍比稀释做阳性对照,真菌不做阳性对照。
在MIC和MFC测定试验中,将无菌生长的液体培养基中取出20μL涂布平板,继续培养(细菌37℃/24h;真菌30℃/48h)。观察有无菌落生长。无菌落生长的最小浓度即为MBC或MFC。MIC和MBC的试验中,为了保证精油与培养液的互溶性,需在培养液中加入1%(v/v)的吐温80做乳化剂。
2.4 抗氧化能力研究
2.4.1 DPPH(1,1-二苯基-2-三硝基苯肼)清除能力测定
用50%的无水乙醇分别配置浓度为0.5、1.0、1.5、2.0mg/mL的烟草花蕾精油、BHT溶液(2,6-二叔丁基-4-甲基苯酚溶液)作为样品溶液。取样品溶液1mL,分别加入50μL吐温80溶解,然后再加入2mL浓度为1mmol/L的DPPH溶液(50%乙醇溶解),暗处放置0.5h后在517nm处测吸光值,记为A。对照组用蒸馏水代替各个样品,重复上述操作,在517nm处测吸光度,记为A1。空白组用50%乙醇代替DPPH溶液,重复上述操作,在517nm处测吸光度,记为A0。每组试验设3组平行试验[11]。DPPH清除率(%)=[1-(A-A0)/A1]×100
2.4.2 还原能力测定
用50%的无水乙醇分别配置浓度为0.5、1.0、1.5、2.0mg/mL的烟草花蕾精油、BHT溶液作为样品溶液。取样品溶液0.5mL,分别加入50μL吐温80溶解,然后再加入2.5mL的PBS缓冲溶液(磷酸盐缓冲液)(pH=6.6),2.5mL浓度为 1%的铁氰化钾(w/w),50℃恒温水浴30min,后快速冷却。然后再分别加入2.5mL蒸馏水和0.5mL浓度为 0.1%的三氯化铁溶液(w/w),3000 r/min离心后静置10 min,在700nm处测吸光度记为A。空白组用蒸馏水代替铁氰化钾和三氯化铁溶液,重复上述操作,在700nm处测吸光度记为A0。每组试验设3组平行试验[12]。还原能力的大小用吸光度(A-A0)表示。
2.4.3 清除OH自由基
用50%的无水乙醇分别配置浓度为0.5、1.0、1.5、2.0mg/mL的烟草花蕾精油、BHT溶液作为样品溶液。取样品溶液0.5mL,分别加入50μL吐温80溶解,然后加入1mL PBS缓冲溶液(pH=7.4),1mL浓度为7.5mmol/L的邻二氮菲溶液,1mL浓度为3.25mmol/L的硫酸亚铁溶液,2mL浓度为1.5%的双氧水,充分混合后于37℃下放置1h,在536nm处测吸光度记为A。对照组用蒸馏水代替各个样品,重复上述操作,在536nm处测吸光度记为A1,空白组用蒸馏水代替邻二氮菲、硫酸亚铁溶液和双氧水,重复上述操作,在536nm处测吸光度记为A0。每组试验设3组平行试验[13]。
OH自由基清除率(%)=[(A-A0)/(A1- A0)]×100
2.4.4 清除O2-自由基
用50%的无水乙醇分别配置浓度为0.5、1.0、1.5、2.0mg/mL的烟草花蕾精油、BHT溶液作为样品溶液。取样品溶液1mL,分别加入50μL吐温80溶解,然后加入4.5mL浓度为0.05mol/L的Tris-HCL 缓冲液(三羟甲基氨基甲烷-盐酸缓冲液)(pH=8.2),1mL浓度为1mmol/L的EDTA(乙二胺四乙酸)溶液,0.4mL浓度为25mmol/L的邻苯三酚溶液,置于25℃水浴锅中恒温4min后,迅速用1mL浓度为12mol/L的HCL终止反应。在320nm处测吸光度,记为A。对照组用蒸馏水代替各个样品,重复上述操作,在320nm处测吸光度,记为A1。空白组用蒸馏水代替EDTA、邻苯三酚和HCL溶液,重复上述操作,在320nm处测吸光度,记为A0。每组试验设3组平行试验[14]。
超氧阴离子清除率(%)=[1-(A-A0)/A1]×100
3 结果与分析
3.1 抑菌试验结果
不同产地烟草花蕾精油以及青霉素钠、头孢噻肟钠对不同微生物的抑菌圈测定见表1。

表1 不同产地烟草花蕾精油的抑菌圈直径Tab. 1 Diameter of inhibition zone of tobacco essential oils of flower bud from different growing areas mm
抗菌素抑菌圈实验结果的判定标准为: 抑菌圈直径>15mm为最敏感,10~15mm 为中度敏感,7~9mm 时为低度敏感, 无抑菌圈者为不敏感。因此,从表1中可以看出4种产地的精油对细菌均有一定的抑菌性。重庆奉节烟草花蕾精油对大肠杆菌、枯草芽孢杆菌和多粘类芽孢杆菌的抑菌圈直径处于21.34~31.52之间,均属最敏感,且对枯草芽孢杆菌的抑制最强。贵州正安烟草花蕾精油对多粘类芽孢杆菌的抑菌圈直径为12.755±3.30,属中度敏感,对枯草芽孢杆菌的抑菌圈直径为19.75±8.13,属中高度敏感,而对枯草芽孢杆菌的抑菌圈直径为26.25±6.01,属最敏感。广西贺州烟草花蕾精油对3种细菌的抑菌圈直径处于22.19~50.06之间,均属最敏感,且对大肠杆菌的抑菌能力最强。云南文山烟草花蕾精油对3种细菌的抑菌圈直径处于30.30~60.92之间,均属最敏感,且对大肠杆菌的抑菌能力最强。4种产地的烟草花蕾精油对黑曲霉、青霉和毕赤酵母的抑菌圈直径处于6.47~9.62之间,属于低度敏感,而对毛霉的抑菌圈直径均为0,没有抑菌性,因而对毛霉不敏感。
综合比较来看,云南文山烟草花蕾精油的抑菌性能最好,其次广西贺州烟草花蕾精油。抑菌效果最差的是贵州正安烟草花蕾精油。同时,由表1中还可以看出,4种产地的烟草花蕾精油对真菌的抑菌效果无明显差异,抑菌效果较差。尤其是对毛霉没有抑菌效果。
3.2 最小抑菌浓度(MIC),最小杀细菌浓度(MBC)和最小杀真菌浓度(MFC)
不同产地烟草花蕾精油以及青霉素钠对不同微生物的最小抑菌浓度(MIC)以及最小杀菌浓度(MBC)测定见表2和表3。

表2 不同产地烟草花蕾精油的最小抑菌浓度(MIC)Tab.2 Minimum inhibitory concentration (MIC) of tobacco essential oils of flower bud from different growing areas mg/mL

表3 不同产地烟草花蕾精油的最小杀细菌浓度(MBC)和最小杀真菌浓Tab.3 Minimum bactericidal concentration (MBC) and minimum fungicide concentration of tobacco essential oils of flower bud from different growing areas mg/mL
由表2和表3可知,不同产地烟草花蕾精油对细菌和真菌都具有一定的抑菌能力。其中云南文山烟草花蕾精油对大肠杆菌的抑菌效果最好,其最小抑菌浓度(MIC)为1.75mg/mL,最小杀菌浓度为3.5mg/mL。另外,重庆奉节烟草花蕾精油对枯草芽孢杆菌的抑菌效果较好,而广西贺州烟草花蕾精油对多粘类芽孢杆菌的抑菌效果较好,两者的MIC和MBC均为3.5mg/mL。4种不同产地的烟草花蕾精油对真菌的抑菌效果均较差,尤其是对于青霉的抑菌效果最差,其最小杀菌浓度均大于或等于14mg/mL。
3.3 DPPH清除能力测定
如图1所示,4种产地的烟草花蕾精油与BHT均具有一定的清除DPPH能力且DPPH清除能力随着浓度的增加均有所变化。其中BHT随着浓度的增加,DPPH清除率也呈上升趋势。贵州正安烟草花蕾精油在浓度0.5~1.0mg/mL范围内快速增长,其后基本保持不变。重庆奉节烟草花蕾精油和广西贺州烟草花蕾精油随着浓度的增大,DPPH清除率缓慢增加。而云南文山烟草花蕾精油的DPPH清除率随着浓度的增加,在1.5mg/mL处略有回落,随后又继续增长。从图1中还可以看出,在浓度高于1mg/mL时,贵州正安烟草花蕾精油的DPPH清除能力高于其他3种烟草花蕾精油。当浓度达到2.0mg/mL时,4种烟草花蕾精油清除DPPH的能力相差不大,均可以达到BHT的一半左右。整体上在浓度为0.5~2.0mg/mL范围内,4种烟草花蕾精油清除DPPH的能力大小为:贵州正安>重庆奉节>广西贺州>云南文山。

图1 不同产地烟草花蕾精油的DPPH清除率Fig.1 Radical scavenging rate of DPPH of tobacco essential oils of flower bud from different growing areas
3.4 还原能力测定
图2可以看出,4种烟草花蕾精油与BHT均有一定的还原能力,且均随着浓度的升高,还原能力增强,但增加速率不同。其中BHT>贵州正安>重庆奉节>云南文山>广西贺州,4种烟草花蕾精油的还原能力在0.5mg/mL时,最接近BHT。在浓度为2.0mg/mL时,4种烟草花蕾精油的还原能力达到最大,BHT的吸光度为0.453±0.005,贵州正安的吸光度达到BHT的一半,为0.235±0.004,重庆奉节的吸光度为0.149±0.018,云南文山的吸光度为0.110±0.002,广西贺州的还原能力最低,吸光度为0.101±0.001。

图2 不同产地烟草花蕾精油的还原能力Fig.2 Reduction ability of tobacco essential oils of flower bud from different growing areas
3.5 清除OH自由基
如图3所示,4种产地的烟草花蕾精油与BHT均有一定的OH自由基清除能力。BHT的OH自由基清除能力在浓度1.5mg/mL时,略有升高,随后基本保持不变。由图3中可以看出,重庆奉节烟草花蕾的OH自由基清除能力在浓度低于1.5mg/mL时,均高于BHT,在浓度为2.0mg/mL时,与BHT无明显差异。广西贺州和云南文山的烟草花蕾精油在浓度为0.5和1.0mg/mL时的OH自由基清除能力高于BHT,在浓度为1.5和2.0mg/mL时,与BHT无明显差异。贵州正安烟草花蕾精油的OH自由基清除能力,除在1.0mg/mL时,与BHT无明显差异外,均低于BHT。4种烟草花蕾精油的OH自由基清除能力大小为:重庆奉节>云南文山>广西贺州>贵州正安。

图3 不同产地烟草花蕾精油的OH自由基清除率Fig.3 Radical scavenging rate of OH of tobacco essential oils of flower bud from different growing areas
3.6 清除O2-自由基
由图4可以看出,4种烟草花蕾精油均具有一定的O2-自由基清除能力,且随着浓度的升高而增大。其中广西贺州烟草花蕾精油的O2-清除能力最好,在1.0mg/mL时接近BHT,在2.0mg/mL时达到最大,为(38.57±0.27)%。重庆奉节烟草花蕾精油的O2
-清除能力较其他几种精油差,尤其是在浓度为0.5mg/mL时,清除率仅有(17.20±0.19)%,但是随着浓度的增大,清除能力逐渐增大,在浓度为2.0mg/mL时,达到(35.37±1.27)%。
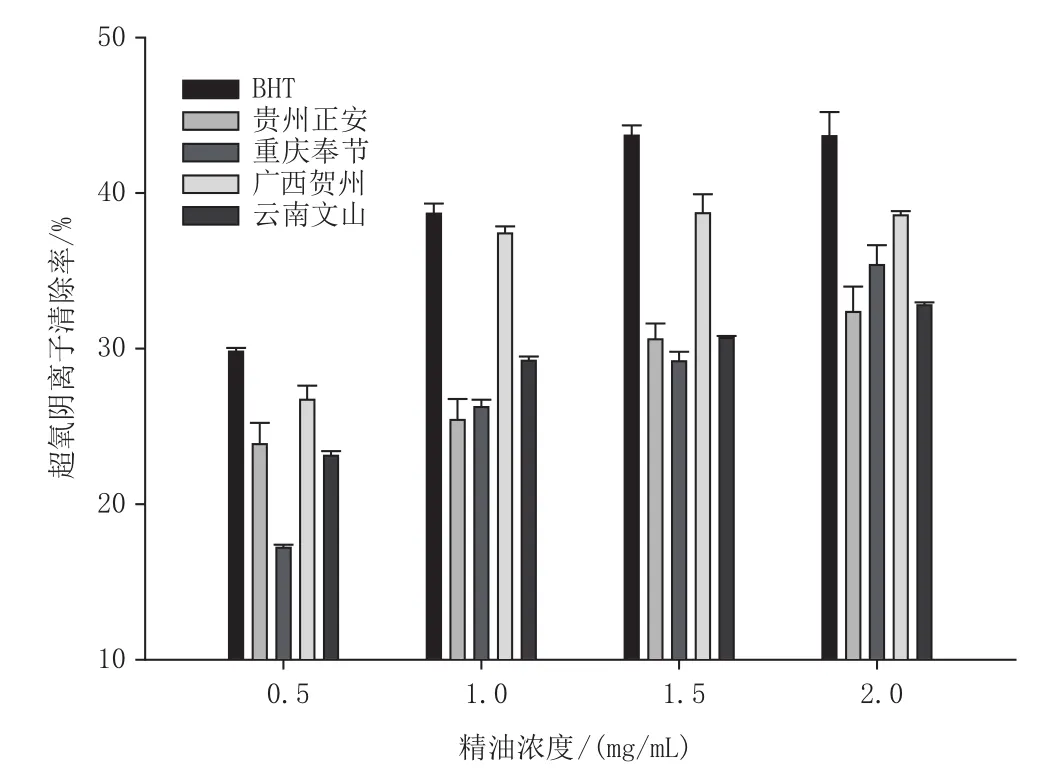
图4 不同产地烟草花蕾精油的O2-自由基清除率Fig.4 Radical scavenging rate of O2- of tobacco essential oils of flower bud from different growing areas
4 结论
本试验结果表明,不同产地的烟草花蕾精油具有一定的抑菌和抗氧化能力,因此可以作为天然抑菌剂和抗氧化剂进行开发利用。但不同产地烟草花蕾精油的抑菌和抗氧化能力有所不同,可能是由于烟草生长环境不同,如温度、水分、土壤结构、日照时间等不同,造成所提出的烟草花蕾精油的成分有所不同,从而导致其生物活性有所差异,后期可以进一步对不同产地的烟草花蕾精油的成分进行分析,从而确定影响其抑菌和抗氧化能力的成分,进而有针对性的对其生物活性进行开发利用。
本试验所采用的烟草花蕾均为云烟87品种花蕾,未来可进一步研究不同品种烟草花蕾精油的成分、抑菌、抗氧化等能力的不同,进而为烟草花蕾精油的研究及综合开发利用提供理论支持。
[1] 周晓薇, 王静, 顾镍,等. 植物精油对果蔬防腐保鲜作用研究进展[J]. 食品科学, 2010, 31(21):427-430.Zhou Xiaowei,Wang Jing,Gu Nie,et al. Research progress in preservative effect of plant essential oil on fruits and vegetables[J]. Food Science, 2010, 31(21):427-430. (in Chinese)
[2] Guenther E.The essential oils[M].Now York: REK Publishing Company,1950.
[3] 刘玉民, 刘亚敏, 李鹏霞. 枫香叶精油抑菌活性及抗氧化活性研究[J]. 食品科学, 2009, 30(11):134-137.Liu Yumin, Liu Yamin, Li Pengxia. Study on antimicrobial activities of essential oil from leaves of Liquidambar formosana Hance as well as its antioxidant activity[J]. Food Science, 2009,30(11):134-137. (in Chinese)
[4] El-Shazly A M, Hussein K T. Chemical analysis and biological activities of the essential oil of Teucrium leucocladum Boiss.(Lamiaceae)[J]. Biochemical Systematics & Ecology, 2004,32:665–674.
[5] Chanjirakul K, Wang S Y, Wang C Y, et al. Natural volatile treatments increase free-radical scavenging capacity of strawberries and blackberries [J]. Journal of the Science of Food & Agriculture, 2007, 87(8):1463-1472(10).
[6] 林中麟, 石健林, 周益. 烟草打顶研究进展[J]. 江西农业学报, 2009, 21(6):32-36.Lin Zhonglin, Shi Jianlin, Zhou Yi. Research developments on tobacco topping[J]. Acta Agriculture Jiangxi, 2009, 21(6):32-36. (in Chinese)
[7] 许春平, 肖源, 孙斯文,等. 烤烟花挥发性成分的萃取及分析[J]. 中国烟草学报, 2014(4):23-27.Xu Chunping, Xiao Yuan, Sun siwen, et al. Extraction and analysis of volatile components from flue-cured tobacco flower[J]. Acta Tabacaria Sinica, 2014(4):23-27. (in Chinese)
[8] 吉礼, 车振明, 黄伟,等. 水蒸汽蒸馏法提取橙皮精油的研究[J]. 食品研究与开发, 2008, 29(4):92-94.JI Li, Che Zhenming, Huang Wei, et al. Research of extraction orange peel oil by steam distillation[J]. Food Research and Development, 2008, 29(4):92-94.
[9] Parvathamma S, Shanthamma C. Antimicrobial Activity of Mollugo cerviana ser. (Molluginaceae)[J]. Anc Sci Life, 2000,20(20): 11–13.
[10] Eloff J N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria[J]. Planta Med, 1999, 64(8):711-3.
[11] Bondet V, Brand-Williams W, Berset C. Kinetics and Mechanisms of Antioxidant Activity using the DPPH Free Radical Method[J]. LWT - Food Science and Technology, 1997,30(6):609–615.
[12] 李慎新, 曹新志, 钟俊波,等. 几种中草药抗氧化性成分的还原能力及总酚含量比较研究[J]. 安徽农业科学, 2008,36(29):12755-12756.Li Shenxin, Cao Xinzhi, Zhong Junbo, et al. Comparative study on reducing power of anti-oxidative of constituents several Chinese herbal medicines and their total phenols content[J].Anhui Agricultural Science, 2008, 36(29):12755-12756. (in Chinese)
[13] 许纲, 张虹, 董建红. 竹叶提取物清除O2-和OH自由基的研究[J]. 营养学报, 2001, 23(1):79-81.Xu Gang, Zhang Hong, Dong Jianhong. Studies on superoxide and hydroxyl radicals scavenging capacity of bamboo leave extracts. Acta Nutrimenta Sinica, 2001, 23(1):79-81. (in Chinese)
[14] 郝桂霞. 罗汉果提取液对自由基的清除作用[J]. 江西化工,2005(4):89-90.Hao Guixia. The scavenging effect of Siraitia grosvenorii extracts on free radical[J]. Jiangxi Chemical Engineering, 2005,4:89-90. (in Chinese)
Comparative study on antimicrobial and antioxidant capacity of essential oils of tobacco flower bud from different growing areas
XU Chunping1, LI Mengshan1, TAN Lanlan2, DAI Ya3
1 College of Food and Biological Engineering, Zhengzhou University of Light Industry, Zhengzhou 450002, China;2 Technology Center, China Tobacco Sichuan Industrial Co. Ltd, Chengdu 610066, China;3 Technology Center, China Tobacco Chongqing Industrial Co. Ltd, Chongqing 400060, China
Experiments were conducted to investigate antimicrobial and antioxidant activity of essential oils of tobacco flower bud from different growing areas and to provide theoretical basis for comprehensive utilization of tobacco waste. Essential oils were prepared by water vapor distillation and antimicrobial activity of essential oil was determined by disc diffusion method, minimum inhibitory concentration (MIC), minimum of bactericidal concentration (MBC), and minimal fungicide concentration (MFC). Antioxidant capacity was measured by radical scavenging of DPPH, OH and O2-and reduction abilities were determination. Antimicrobial test results showed that tobacco flower bud essential oils from four different growing areas could inhibit bacterial growth with antimicrobial capacity in the order of Yunnan Wenshan > Guangxi Hezhou > Chongqing Fengjie > Guizhou Zhengan. However, antifungal effects of the four oils were poor. Antioxidant activity test results showed that: all four essential oils of tobacco flower bud had certain antioxidant capacity, and antioxidant capacity increased with the increase of oil concentration. Among them, tobacco flower bud essential oil from Zhengan, Guizhou province had the best results in DPPH scavenging and reduction ability, while essential oil from Fengjie, Chongqing municipality had the best effect on OH radical scavenging, and essential oil from Hezhou, Guangxi Autonomous Region featured the best in O2-clearance.
tobacco flower bud, essential oil, antimicrobial, antioxidant
许春平,李萌姗,谭兰兰,等. 不同产地烟草花蕾精油的抑菌和抗氧化能力比较研究[J]. 中国烟草学报,2016,22(3)
重庆中烟合作项目“以低次烟叶为原料制备烟用香料的研究(20151011)”
许春平(1977—),教授,博士,研究方向:烟草工程领域的研究;Email:xuchunping05@163.com
戴 亚(1946—),教授,研究方向:烟草化学、原料学,Email: dycy@263.net
2015-09-01
:XU Chunping, LI Mengshan, TAN Lanlan, et al. Comparative study on antimicrobial and antioxidant capacity of essential oils of tobacco flower bud from different growing areas[J]. Acta Tabacaria Sinica, 2016,22(3)
