小儿肠道外感染性疾病应用抗生素后肠道菌群失调的临床分析
2016-11-23王玉瑛张孝兴汤淑斌焦爱萍高怡玢庞伟斌
王玉瑛,张孝兴,汤淑斌,焦爱萍,高怡玢,庞伟斌,刘 莹
(1.宝鸡市妇幼保健院儿童医院儿科,2.检验科,3.细菌室,陕西 宝鸡 721000)
小儿肠道外感染性疾病应用抗生素后肠道菌群失调的临床分析
王玉瑛1,张孝兴1,汤淑斌1,焦爱萍1,高怡玢2,庞伟斌3,刘 莹2
(1.宝鸡市妇幼保健院儿童医院儿科,2.检验科,3.细菌室,陕西 宝鸡 721000)
目的 探讨小儿肠道外感染性疾病应用抗生素对肠道菌群的影响。方法 回顾性分析2013年1月至2014年8月期间在宝鸡市妇幼保健院治疗的非肠道性感染患儿149例,对患儿应用抗生素治疗前及治疗第1天、3天、7天、14天的粪便进行细菌学分析,对比同期健康体检患儿的粪便细菌学情况,分析肠道菌群差异及肠道菌群失调比例。结果 小儿非肠道感染性疾病应用抗生素后发生肠道菌群失调的比例为64.43%,均为Ⅰ度、Ⅱ度肠道菌群失调,无Ⅲ度菌群失调发生;婴儿组应用抗生素后发生肠道菌群失调的比例最高,差异均具有统计学意义(χ2=8.89,P<0.05)。相较于健康小儿肠道菌群,肠道菌群失调患儿主要组成菌群比例与健康小儿比较变化明显,差异具有统计学意义(χ2=102.73,均P<0.01)。结论 对小儿,尤其是婴儿应尽可能使用窄谱抗生素,缩短抗生素使用时间,保护小儿正常肠道菌群。
小儿;非肠道感染性疾病;抗生素;肠道菌群失调
肠道病原菌在人群中的分布有地域性,它与人们的生活环境有着密切的关系,在不同的阶段、不同的季节其菌型分布规律不同,广泛分布于世界各地的肠道病原菌多种多样[1-2]。通过大量临床积累发现,肠微生物菌群比率、定居环境、位置的变化不但可以影响儿童健康,而且影响疾病的转归[3-5]。本研究分析了小儿肠道菌群的组成,探索非肠道感染性疾病应用抗生素对肠道菌群的影响,以期能够提升临床抗生素使用合理性,避免小儿因肠道外感染应用抗生素而诱发肠道菌群失调。
1资料与方法
1.1一般资料
选取2013年1月至2014年8月期间在宝鸡市妇幼保健院儿童医院治疗的肠道外感染患儿149例,其中男性74例,女性75例,年龄30天~10岁,平均年龄(3.25±0.29)岁。按年龄分为婴儿组(30天~1岁)、幼儿组(1~3岁)以及儿童组(>3岁)。选取同时期在本院检查的健康小儿49例为对照组,其中男性24例,女性25例,年龄30天~10岁,平均年龄(3.10±0.35)岁。体重平均(12.5±1.0)kg。两组一般资料比较差异均无统计学意义,均P>0.05),具有可比性。
1.2纳入与排除标准
纳入标准:①所有参与患者家属均了解研究的整个过程,并自愿参与;②研究前7d无抗生素使用情况;③纳入病例均符合抗生素使用指征,如:鼻窦炎出现流脓性鼻涕,急性化脓性中耳炎出现外耳道流脓,确诊为急性化脓性扁桃体炎,确诊为细菌性肺炎;血常规白细胞超过12×109/L,嗜中性粒细胞超过80%[6-7];细菌性感冒合并高烧(体温超过39.5°C,且持续增长1~2天不退或发生高热惊厥)。排除标准:不适宜用抗菌药物的病毒感染疾病,心肝肾严重疾病及对药物过敏用抗生素有禁忌证者。
1.3方法
所有患儿均依据病情合理使用抗生素,具体包括青霉素类(青霉素、阿莫西林舒巴坦、苯唑青霉素等)、头孢菌素类(头孢呋辛、头孢曲松、头孢哌酮舒巴坦、头孢硫咪、头孢唑林等)、大环内酯类(红霉素、阿奇霉素、罗红霉素等)、头霉素类(头孢米诺等、亚胺培南、美罗培南等),均为口服用药或静脉给药。
1.3.1检测方法
①收集患儿应用抗生素后(用药结束后)第3、7、10、15天粪便,用无菌盒密封送检,由资深检验师采用粪便涂片法分析肠道菌群,并将肠道菌群失调者选出;②收集健康小儿及肠道菌群失调患儿粪便进行培养,分析其菌群变化;③本研究所用的主要试剂如下:哥伦比亚琼脂(购自生物梅里埃公司)、M-H琼脂(购自生物梅里埃公司)、绵羊血(购自浙江泰康生物科技有限公司)、革兰氏染液(购自浙江泰康生物科技有限公司)。
1.3.2评价指标
本研究依据肠道菌群粪便涂片检查图谱[6]判定患儿是否发生肠道菌群失调,具体标准如下:①正常菌群:各类细菌和细菌的总数比例均正常,包括双歧杆菌、乳酸杆菌、肠球菌、大肠杆菌、产气杆菌、变形杆菌、葡萄球菌、厌氧性细菌等,杆菌/球菌>3:1[8-10];②Ⅰ度菌群失调:细菌总数的值较正常值略少、正常范围或正常低值,革兰阴性杆菌略有增加,革兰阳性杆菌在正常低值,革兰阳性球菌在正常高值或增多,类酵母菌、梭菌有所增加,杆球菌比例常为l:1~2:1[11-12];③Ⅱ度菌群失调:细菌总数明显减少或无明显改变,革兰阳性杆菌明显减少,革兰阴性杆菌明显增多,有的高达90%以上,杆球菌比例倒置。类酵母菌或梭菌明显增多;④Ⅲ度菌群失调:细菌总数明显减少,菌群受到抑制,只有一种细菌或真菌占绝对优势[13-14]。
1.4统计学方法
使用SPSS 19.0软件进行统计学分析,计数资料用率表示,组间比较采用χ2检验。检验水准α取值为0.05,以P<0.05为差异有统计学意义。
2结果
2.1小儿非肠道感染性疾病应用抗生素后肠道菌群失调比例
小儿非肠道感染性疾病应用抗生素3天后,59.73%(89/149)患儿肠道菌群出现改变;应用抗生素7天后,73.15%(109/149)患儿肠道菌群出现改变;应用抗生素10天后,84.56%(126/149)患儿肠道菌群出现改变;应用抗生素15天后,100%(149/149)患儿肠道菌群出现改变。
小儿非肠道感染性疾病应用抗生素后发生肠道菌群失调的比例为64.43%,且均为Ⅰ度、Ⅱ度肠道菌群失调,无Ⅲ度菌群失调发生。其中婴儿组应用抗生素后发生肠道菌群失调的比例最高,差异均具有统计学意义(χ2=8.89,P<0.05),见表1。
2.2肠道菌群失调患儿与健康小儿肠道菌群组成比例分析
相较于健康小儿肠道菌群,肠道菌群失调患儿主要组成菌群比例与健康小儿比较变化明显,差异具有统计学意义(χ2=102.73,均P<0.01),见表2。
表1 小儿非肠道感染性疾病应用抗生素后肠道菌群失调比例[n(%)]
Table 1 The proportion of cases suffering enteric flora imbalance after using antibiotics because of parenteral infection diseases in infants [n(%)]
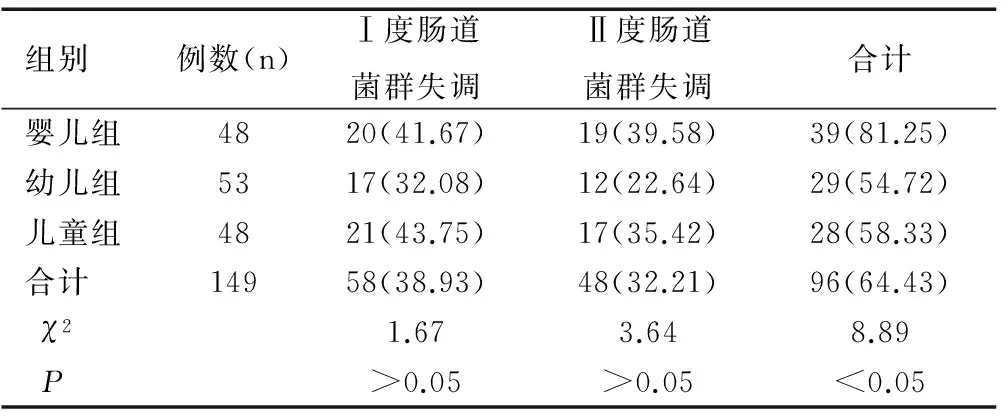
表2 肠道菌群失调患儿与健康小儿肠道菌群组成比例分析[n(%)]
Table 2 Analysis of intestinal microflora composition of children with enteric flora imbalance and healthy children[n(%)]

菌群种类肠道菌群失调(n=149)健康小儿(n=49)χ2P革兰氏阳性杆菌(%)7(4.70)35(71.43)92.85<0.01革兰氏阴性杆菌(%)97(65.10)9(18.37)32.37<0.01革兰氏阳性球菌(%)45(30.20)4(8.16)9.62<0.01革兰氏阴性球菌(%)01(2.04)-<0.01χ2102.73P<0.01
3讨论
3.1小儿非肠道感染性疾病应用抗生素后肠道菌群失调分析
小儿相较于成年人,生理功能不完善,免疫力低下,肠道菌群更易被破坏,应用抗生素时更易于发生肠道菌群失调,乃至抗生素相关性腹泻,影响患儿健康水平[15]。因肠道内感染性疾病应用抗生素对肠道菌群的影响更直接,且已研究得比较全面[16],故本文旨在探讨小儿非肠道感染性疾病应用抗生素对肠道菌群的影响。本研究发现,小儿非肠道感染性疾病应用抗生素3天后,59.73%患儿肠道菌群出现改变;应用抗生素7天后,73.15%患儿肠道菌群出现改变;应用抗生素10天后,84.56%患儿肠道菌群出现改变;应用抗生素15天后,100%患儿肠道菌群出现改变;并有64.43%患儿出现肠道菌群失调,且婴儿组肠道菌群失调发生率明显高于幼儿组、儿童组以及平均值(P<0.05)。本研究提示,儿科医师应慎重使用抗生素,包括:①降低抗生素使用剂量,避免盲目大剂量使用抗生素[17];②谨慎选择使用方式,尽量口服等给药方式,尽量减小非肠道感染性疾病应用抗生素对肠道菌群的影响;③避免联合用药,避免使用抗菌效力强,上市时间较近的抗生素;④尽量使用抗菌谱较窄的抗生素,避免使用广谱抗生素[18];⑤在切实需要持续或者大剂量使用抗生素时,联合应用微生物生态制剂维持和调整肠道菌群正常。
3.2肠道菌群失调患儿与健康小儿肠道菌群组成比例分析
正常菌群在一定条件下能够保持相对平衡,但当人体生理变化或因药物作用导致正常菌群中某些成员受到打击,或被消灭时,就会破坏正常菌群的分布状态,转化为异常组合,称为“菌群失调”[19]。菌群失调对人体的免疫、消化、营养供给等造成了不良的影响,对疾病的转归、患者的康复等均有负性影响[20]。对粪便菌群的分析发现,相较于健康小儿肠道菌群,肠道菌群失调患儿主要组成菌群比例明显下降,主要组成菌群中优势菌属比例也明显下降[21]。
综上所述,对小儿尤其是婴儿应尽可能使用窄谱抗生素,缩短抗生素使用时间,保护小儿肠道菌群。
[1]Tomasello G, Bellavia M, Palumbo V D,etal. From gut microflora imbalance to mycobacteria infection: is there a relationship with chronic intestinal inflammatory disease?[J]. Ann Ital Chir,2011,82(5):361-368.
[2]Bellot P, Frances R, Such J. Pathological bacterial translocation in cirrhosis: pathophysiology, diagnosis and clinical implications[J]. Liver Int,2013,33(1):31-39.
[3]Wang X M, Lu Y, Wu L Y,etal. Moxibustion inhibits interleukin-12 and tumor necrosis factor alpha and modulates intestinal flora in rat with ulcerative colitis[J]. World J Gastroenterol,2012,18(46):6819-6828.
[4]吴水英.婴幼儿轮状病毒腹泻并发肠道菌群失调状态的探讨[J].中华医院感染学杂志,2012,22(23):5299-5301.
[5]张良娟,虎崇康,林燕,等.早产儿喂养不耐受肠道菌群多样性研究[J].中国妇幼健康研究,2015,26(2):171-174.
[6]吴楚璇.复合乳酸菌胶囊在小儿肠道菌群失调性腹泻中的应用[J].医学理论与实践,2014,27(1): 60-61.
[7]黄晓雅,阮旦青,张钦碧,等.乐清地区小儿轮状病毒肠炎的临床分析[J].中国小儿急救医学,2014,21(7):433-435,439.
[8]Guarino A, Lo Vecchio A, Canani R B. Probiotics as prevention and treatment for diarrhea[J]. Curr Opin Gastroenterol,2009, 25(1): 18-23.
[9]王金梅.非肠道感染性疾病患儿应用抗生素后肠道菌群失调分析[J].中国实用医刊,2013,40(13): 117.
[10]Inaba H, Gaur A H, Cao X,etal. Feasibility, efficacy, and adverse effects of outpatient antibacterial prophylaxis in children with acute myeloid leukemia[J]. Cancer,2014,120(13):1985-1992.
[11]赵洪波.小儿腹泻病临床新观点与研究进展[J].现代中西医结合杂志,2013,22(23):2620-2622.
[12]董立静,李滟.小儿腹泻病的临床治疗研究进展[J].内蒙古中医药,2013,32(34):118-119.
[13]张华,黄海涛.双歧杆菌预防重症胰腺炎患者肠道菌群失调的临床研究[J].中国微生态学杂志,2012,24(4):339-340.
[14]陈咏丽,严晓娟.小儿肺炎支原体感染肺外消化系统损害及其相关因素分析[J].重庆医学,2014,43(7):863-866.
[15]邓仲元,谭小青,贺德行,等.补充微生态制剂对腰椎后路手术患者肠道菌群失调的影响[J].中国综合临床,2014,30(1):10-14.
[16]Yan L, Zhang S, Pace L,etal. Combination of reverse transcription real-time polymerase chain reaction and antigen capture enzyme-linked immunosorbent assay for the detection of animals persistently infected with Bovine viral diarrhea virus[J]. J Vet Diagn Invest,2011,23(1):16-25.
[17]魏莉平,黄艳春,刘诚明.结直肠癌患者血清降钙素原水平变化及其与肠道菌群失调的关系[J].山东医药,2015,55(12):78-79.
[18]王生,黄晓星,余鹏飞,等.肠道菌群失调与结肠癌发生发展之间关系的研究进展[J].中国药理学通报,2014,30(8):1045-1049.
[19]Aguirre I M, Quezada M P, Celedón M O. Antigenic variability in bovine viral diarrhea virus (BVDV) isolates from alpaca ( Vicugna pacos ), llama ( Lama glama ) and bovines in Chile[J]. Vet Microbiol, 2014, 168(2-4):324-330.
[20]林小碧,陆海燕,何时军.16例肠道病毒71型感染手足口病死亡病例临床分析[J].中国小儿急救医学,2012,19(1):50-52.
[21]董开忠,高永盛,秦宁恩加,等.参苓白术散对抗生素引起肠道菌群失调小鼠的影响[J].中国实验方剂学杂志,2015,21(1):154-157.
[专业责任编辑:黄燕萍]
Clinical analysis of enteric flora imbalance after antibiotics use for parenteral infection diseases among infants
WANG Yu-ying1, ZHANG Xiao-xing1, TANG Shu-bin1, JIAO Ai-ping1, GAO Yi-bin2, PANG Wei-bin3, LIU Ying2
(1.Department of Pediatrics; 2.Department of Laboratory; 3.Bacteriology Room,Baoji Maternity and Child Health Hospital, Shaanxi Baoji 721000, China)
Objective To investigate the influence of antibiotics application for parenteral infection on intestinal flora. Methods A retrospective analysis was conducted on 149 cases of children treated in Baoji Maternity and Child Health Hospital for parenteral infection during the period of January 2013 to August 2014. The bacteriological analysis was carried out on feces of children before using antibiotics and 1d, 3d, 7d and 14d after using them, and they were compared to those of healthy children selected in the same period. The difference in intestinal flora and the proportion of enteric flora imbalance were analyzed. Results The proportion of children suffering enteric flora imbalance after use of antibiotics for parenteral infection was 64.43%, and they were Ⅰand Ⅱ degree of enteric flora imbalance. No case was found with dysbacteriosis of Ⅲ degree. The proportion of cases with enteric flora imbalance was highest in infant group, and the difference was statistically significant (χ2=8.89,P<0.05). The differences in main composition of flora between cases of enteric flora imbalance and healthy cases were statistically significant (χ2=102.73, bothP<0.01). Conclusion For children, especially infants, narrow spectrum antibiotics should be given as far as possible, and the duration of antibiotics use should be shortened to protect the normal intestinal flora.
infants; parenteral infection diseases; antibiotics; enteric flora imbalance
2015-12-06
宝鸡市卫生局科研立项资助项目(2012-42)
王玉瑛(1964-),女,副主任医师,主要从事儿科临床工作。
汤淑斌,主任医师。
10.3969/j.issn.1673-5293.2016.09.028
R725.7
A
1673-5293(2016)09-1114-03
