胰腺癌淋巴结转移MSCT影像特征与病理对照研究
2016-11-23方旭边云李骁盛彧陈海虎王莉
方旭 边云 李骁 盛彧 陈海虎 王莉
·论著·
胰腺癌淋巴结转移MSCT影像特征与病理对照研究
方旭 边云 李骁 盛彧 陈海虎 王莉
目的 探讨胰腺癌(PC)淋巴结转移的多层螺旋CT(MSCT)影像学特征。方法 选取经病理确诊为PC且有淋巴结转移的患者30例,术前均进行MSCT胰腺增强扫描。以日本胰腺病学会2002年制定的第5版TNM分期为淋巴结分组标准,分析转移淋巴结的部位、最大短轴径(MSAD)、淋巴结密度、强化、内部坏死及融合情况。结果 病理诊断转移淋巴结63枚,影像诊断转移淋巴结53枚。胰头癌以第13组、第17组淋巴结转移率较高,胰体尾癌以第18组转移率较高。转移淋巴结MSAD为2~17 mm,平均(7.2±4.0)mm。按淋巴结大小分为MSAD<5 mm组、5 mm~<10 mm组和≥10 mm组,每组转移淋巴结分别为10枚、18枚和25枚。3组转移淋巴结的强化枚数随淋巴结的增大而减少,而内部坏死、融合枚数随淋巴结的增大而增加,差异均有统计学意义(P值均<0.05)。两两组间比较,MSAD<5 mm组、5 mm~<10 mm组强化淋巴结枚数显著多于≥10 mm组(7/10、11/18比2/25),融合淋巴结枚数显著少于≥10 mm组(0、2/18比22/25);<5 mm组边缘清晰淋巴结枚数显著多于≥10 mm组(6/10比5/25),内部坏死枚数显著少于≥10 mm组(2/10比18/25),差异均有统计学意义(P值均<0.05)。其余两两组间差异均无统计学意义。结论 淋巴结不明显强化、内部坏死及融合是PC淋巴结转移的主要影像学特征,结合淋巴结密度不均匀、边缘模糊的特征更有助于诊断转移淋巴结。
胰腺肿瘤; 淋巴转移; 体层摄影术,螺旋线计算机
Fund program:Clinical Science and Technology Innovation Project of Shanghai Shenkang Hospital Development Center(SHDC22015035)
胰腺癌(pancreatic cancer,PC)是一种起病隐匿、恶性程度高、预后差、生存率低的消化系统恶性肿瘤。近年来胰腺肿瘤外科迅速发展,手术治疗成为PC唯一有效的治疗手段,但术后复发率仍高达80%,根治性手术后5年生存率<5%,预后仍未明显改善[1]。文献报道[2-4],54%的PC患者存在淋巴结转移,有淋巴结转移者术后5年生存率为0~7.7%,而无淋巴结转移者术后5年生存率为15%~40%。由此可见,淋巴结转移是影响PC预后的重要因素之一。术前通过影像学准确评估淋巴结有无转移,从而明确术中淋巴结清扫范围,进而改善患者术后生存率至关重要。本研究分析PC患者多层螺旋CT(multi-slice spiral computed tomography,MSCT)图像的淋巴结表现,为提高阳性转移淋巴结的检出率提供依据。
资料与方法
一、一般资料
收集2014年3月至2016年1月经长海医院手术及病理确诊的伴有淋巴结转移的30例PC患者,所有患者均有完整的影像学资料。本研究获得长海医院伦理委员会批准,所有患者检查前均签署知情同意书。
二、MSCT扫描
扫描设备为东芝640层容积CT。患者检查前20~30 min均行碘对比剂过敏试验。扫描条件:120 kV,300 mA。扫描参数:准直2.5 mm,层厚0.5 mm,重建间隔3.0 mm,螺距5.3,矩阵512×512,视野348 mm×348 mm。扫描时间为15~20 s,扫描延迟时间根据小剂量试验确定,阈值为180 HU。对比剂为非离子型普碘胺,355 mgI/ml,总量90~95 ml,由高压注射器经前臂静脉团注,注射流率3.0~4.0 ml/s,继之注射98 ml生理盐水以同样流率冲洗。分别于注射对比剂后20~25 s、60~70 s、110~130s行动脉期、静脉期和延迟期扫描。扫描范围包括整个上腹部。
三、图像分析
由2名有10年以上影像经验的高年资医师将影像图像和手术病理一一对照,共同完成分析,当意见不一致时通过协商讨论达成一致意见。所有图像均在东芝Vital工作站使用多平面重建技术(multi-planner reformation, MPR)进行图像处理。以日本胰腺病学会(JPS)2002年制定的第5版TNM分期为标准[5],将胰周淋巴结分成18组:1为贲门右组;2为贲门左组;3为胃小弯组;4为胃大弯组;5为胃网膜左、右动脉周围和幽门上组;6为幽门下组;7为胃左动脉周围组;8为肝固有动脉周围组;9为腹腔干周围组;10为脾门组;11为脾动脉周围组;12为肝十二指肠韧带组;13为胰十二指肠后组;14为肠系膜上动脉周围组;15为结肠中动脉周围组;16为主动脉旁组;17为胰十二指肠前组;18为胰体下缘组。观察并记录阳性淋巴结的部位、形态、密度、强化情况,测量其横断面最大短轴直径(maximum short axis diameter, MSAD)。
四、统计学处理

结果
一、患者基本资料
30例PC患者中男性23例,年龄40~72岁,平均(60±9)岁;女性7例,年龄56~80岁,平均(66±9)岁。肿瘤部位:胰头癌21例,胰体尾癌9例;肿瘤类型:导管腺癌27例,腺鳞癌2例,腺泡细胞癌1例;分化程度:高分化1例,中分化19例,低分化8例,未分化2例;28例伴有胰周神经浸润。21例胰头癌行胰十二指肠扩大切除术,9例胰体尾癌均行胰体尾扩大切除术。
二、MSCT影像学特征
30例PC患者病理诊断转移淋巴结的数目为63枚,影像学诊断的阳性淋巴结数目为53枚,漏诊10枚。胰头癌转移淋巴结的位置以第13组、第17组多见,其中1例胰头癌的第13组、第14组、第16组淋巴结均转移(图1);胰体尾癌淋巴结转移以第18组多见(表1)。

图1 胰头癌伴多组淋巴结转移,胰腺头部见低密度肿块影(箭头,1A);第13组、第14组、第16组多发肿大的转移淋巴结(箭头,1B~1E),表现为密度不均匀、强化不明显、内部坏死、相互融合;第13组淋巴结大体标本(1F)
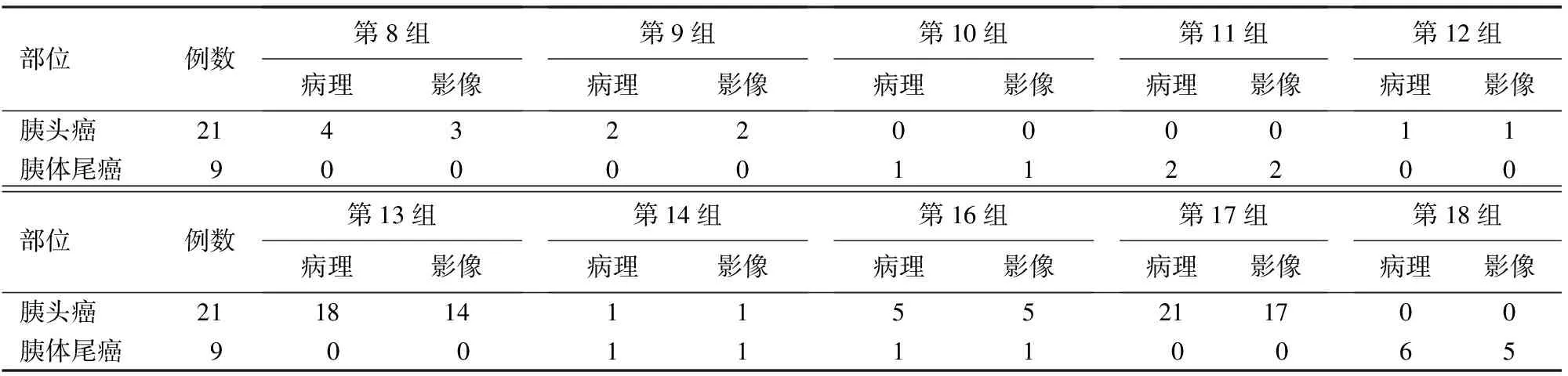
部位例数第8组病理影像第9组病理影像第10组病理影像第11组病理影像第12组病理影像胰头癌214322000011胰体尾癌90000112200部位例数第13组病理影像第14组病理影像第16组病理影像第17组病理影像第18组病理影像胰头癌2118141155211700胰体尾癌90011110065
转移淋巴结的MSAD为2~17 mm,平均(7.2±4.0)mm。10枚转移淋巴结的MSAD<5 mm,18枚为5 mm~<10 mm,25枚≥10 mm。不同MSAD组间的淋巴结强化程度、坏死及融合趋势的差异均有统计学意义,而淋巴结密度及边缘是否清晰的差异无统计学意义(表2)。两两组间比较,MSAD<5 mm组强化淋巴结枚数(7/10)显著多于≥10 mm组(2/25,χ2=14.37,P=0.0001),5 mm~<10 mm组强化淋巴结枚数(11/18)显著多于≥10 mm组(2/25,χ2=14.00,P=0.0001);<5 mm组边缘清晰淋巴结(6/10)显著多于≥10 mm组(5/25,χ2=5.30,P=0.021);<5 mm组内部坏死枚数(2/10)显著少于≥10 mm组(18/25,χ2=7.89,P=0.005);<5 mm组融合淋巴结枚数(0/10)显著少于≥10 mm组(22/25,χ2=23.69,P=0.0001),5 mm~<10 mm组融合淋巴结枚数(2/18)显著少于≥10 mm组(22/25,χ2=25.09,P=0.0001),差异均有统计学意义,余两组间的差异均无统计学意义。
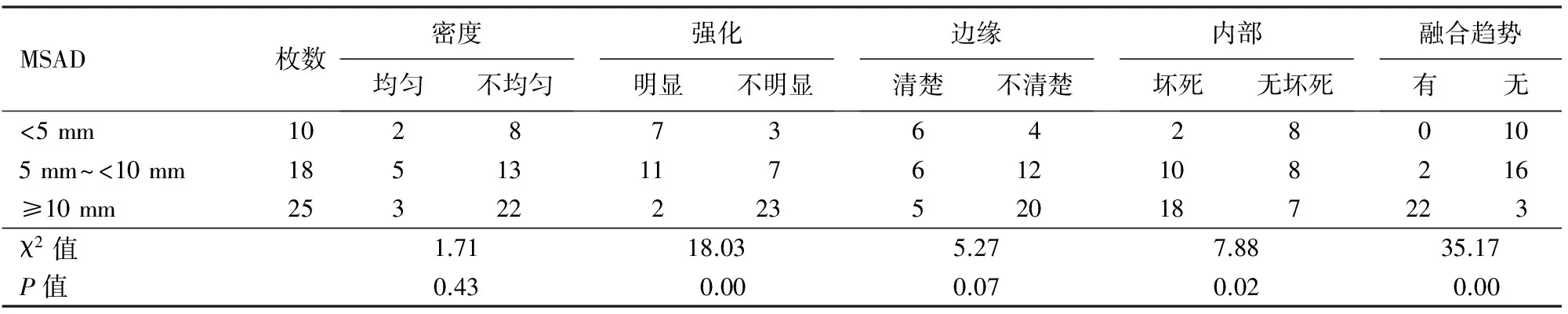
表2 胰腺癌转移淋巴结的MSCT表现
讨论
一般认为,在胰腺小叶内及小叶间结缔组织内存在相通的毛细淋巴管网,小叶间结缔组织内的毛细淋巴管汇合到小叶间淋巴管丛,由丛发出集合淋巴管,伴随血管走行汇合至器官外局部淋巴结。但有研究认为,胰腺小叶内不存在毛细淋巴管,仅在胰腺小叶间的结缔组织内见到毛细淋巴管[6]。
胰腺各部位的集合淋巴管呈放射状分别汇入胰腺周围的淋巴结:(1)胰头的集合淋巴管均注入胰十二指肠上、下淋巴结,然后向下至肠系膜上淋巴结,或向上经幽门下淋巴结汇入腹腔淋巴结。(2)胰体右上部的集合淋巴管注入肝淋巴结,然后入腹腔淋巴结;左上部的集合淋巴管注入胰脾淋巴结。胰体左下部的集合淋巴管入横结肠淋巴结,然后注入肠系膜上淋巴结;右下部的集合淋巴管可直接汇入肠系膜上淋巴结。(3)胰尾上部的集合淋巴管向右注入胰脾淋巴结;下部的集合淋巴管注入横结肠淋巴结,然后入肠系膜上淋巴结。根据JPS制定[5]的PC各组淋巴结转移的顺序,可将PC淋巴结转移分为3站式转移。Nagakawa等[7]提出,第13组淋巴结可视为胰头癌的前哨淋巴结,其淋巴结转移途径主要是从第13组经第14组转移至第16组淋巴结。Nakao等[8]报道,胰体尾癌转移至第16组淋巴结的途径有3条:通过第14组淋巴结转移,通过第11组至第9组淋巴结转移,直接由原发灶转移。本研究结果显示,胰头癌以第13组、第17组淋巴结转移居多,其中1例胰头癌的第13组、第14组、第16组淋巴结均转移,符合Nagakawa等[7]提出的淋巴引流路径。
以往PC患者常采用16排或者64排CT扫描。由于其分辨率低,对小淋巴结转移漏诊较大,而且无法进行三维后处理,难以在术前对淋巴结进行精准定位,从而与术中定位淋巴结有较大的差异。目前MSCT已成为PC最常用的影像学检查方法[9],MSCT的能量采集避免了对比剂伪影和容积效应的干扰,增加了图像的噪声比,可以对胰腺进行薄层高分辨率容积扫描,提高了PC淋巴结转移的检出率;结合多种三维后处理技术更可以清晰显示胰周淋巴结的大小、形态和走行,甚至可以评价胰周淋巴网络[10-11]。但影像学对阳性淋巴结诊断仍较困难,主要是因为淋巴结大小与转移无较多相关性,PC肿块的大小也与淋巴结转移无太大相关性。MSAD≥10 mm是目前采用最多的诊断转移淋巴结的标准[12]。淋巴结密度不均匀、边缘模糊、强化不明显、内部坏死、相互融合都是转移淋巴结的主要特征[13]。本研究结果显示,随着淋巴结体积的增大,转移淋巴结更趋向于不强化、内部出现坏死并有融合趋势。此外,也会出现密度不均匀、边缘不清晰。造成该现象的病理学机制可能因为PC本身是乏血供肿瘤,淋巴结体积逐渐增大加重其内部缺血,导致淋巴结在影像学中易出现密度不均匀、强化不明显;转移淋巴结越大,边缘模糊越明显可能与胰周神经和脂肪浸润有一定的相关性。
在临床工作中,PC患者的MSCT图像中胰周可见较多淋巴结,从而在影像诊断结论中写到“淋巴结转移可能”,但术后病理结果大多数是阴性淋巴结,即炎性增生性淋巴结。这是由于对淋巴结转移的临床特点和MSCT影像特征表现缺乏认识。首先,当胰头癌发生胰管截断阻塞时,远段胰腺发生阻塞性胰腺炎,周围即可见多发炎性增生性淋巴结,而非转移性淋巴结。其次,PC本身是乏血供的恶性肿瘤,增强扫描后呈弱强化,其转移性淋巴结也和原发肿瘤强化方式相同,而炎性增生性淋巴结的MSCT影像特征多表现为密度均匀、强化明显、边缘清晰、无互相融合,与转移性淋巴结的MSCT影像特征差异较大。最后,对胰腺淋巴结引流路径特点及胰周淋巴结解剖位置认识不够,尤其是PC中的前哨淋巴结。前哨淋巴结发生转移是诊断PC淋巴结转移的前提,再根据胰头癌和胰体尾癌淋巴结转移路径特征的综合分析可大大降低误诊率,提高诊断水平。本组影像诊断有10枚转移淋巴结漏诊,原因可能是淋巴结太小,缺乏阳性淋巴结的影像学特征表现。
由于本研究的样本量不够大,每组淋巴结例数较少,可能未能显示某些转移淋巴结的特征。此外本研究不是前瞻性研究,未能得出MSCT对阳性淋巴结的诊断能力,因此还有待日后提高样本量进一步深入研究。
[1] 汪炳瑞, 邱伟华. 胰腺癌嗜神经侵袭的解剖和分子生物学研究进展[J]. 中华肝胆外科杂志, 2014, 20(4): 314-317. DOI: 10.3760/cma.j.issn.1007-8118.2014.04.021.
[2] Schwarz RE, Smith DD. Extent of lymph node retrieval and pancreatic cancer survival: information from a large US population database[J]. Ann Surg Oncol, 2006, 13(9): 1189-1200. DOI: 10.1245/s10434-006-9016-x.
[3] Gebhardt C, Meyer W, Reichel M, et al. Prognostic factors in the operative treatment of ductal pancreatic carcinoma[J]. Langenbecks Arch Surg, 2000, 385(1): 14-20.
[4] Benassai G, Mastrorilli M, Mosella F, et al. Significance of lymph node metastases in the surgical management of pancreatic head carcinoma[J]. J Exp Clin Cancer Res, 1999, 18(1): 23-28.
[5] Isaji S, Kawarada Y, Uemoto S. Classification of pancreatic cancer: comparison of Japanese and UICC classifications[J]. Pancreas, 2004, 28(3): 231-234.
[6] 王云祥, 张雅芳. 淋巴管结构与癌转移[M]. 北京: 人民卫生出版社, 2011: 238-242. ISBN: 978-7-117-15062-0.
[7] Nagakawa T, Nagamori M, Futakami F, et al. Results of extensive surgery for pancreatic carcinoma[J]. Cancer, 1996, 77(4): 640-645.
[8] Nakao A, Harada A, Nonami T, et al. Lymph node metastases in carcinoma of the head of the pancreas region[J]. Br J Surg, 1995, 82(3): 399-402.
[9] 张太平,曹喆,赵玉沛. 《2015年美国国立综合癌症网络胰腺癌临床实践指南(V2版)》外科相关部分解读[J]. 临床肝胆病杂志, 2015, 31(5): 654-656.
[10] Sai M, Mori H, Kiyonaga M, et al. Peripancreatic lymphatic invasion by pancreatic carcinoma: evaluation with multi-detector row CT[J]. Abdom Imaging, 2010, 35(2): 154-162. DOI: 10.1007/s00261-008-9461-z.
[11] Mori H. New insight of pancreatic imaging: from "unexplored" to "explored"[J]. Abdom Imaging, 2010, 35(2): 130-133. DOI: 10.1007/s00261-008-9471-x.
[12] Dorfman RE, Alpern MB, Gross BH, et al. Upper abdominal lymph nodes: criteria for normal size determined with CT[J]. Radiology, 1991, 180(2): 319-322. DOI: 10.1148/radiology.180.2.2068292.
[13] Efremidis SC, Vougiouklis N, Zafiriadou E, et al. Pathways of lymph node involvement in upper abdominal malignancies: evaluation with high-resolution CT[J]. European Radiology, 1999, 9(5): 868-874. DOI: 10.1007/s 003300050757.
(本文编辑:屠振兴)
Comparison on MSCT and pathological findings of metastatic lymph nodes in pancreatic cancer patients
FangXu,BianYun,LiXiao,ShengYu,ChenHaihu,WangLi.
DepartmentofMedicalImaging,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,ChinaCorrespondingauthor:WangLi,Email:wangli_changhai@163.com
Objective To discuss the MSCT imaging characteristics of metastatic lymph nodes in pancreatic cancer. Methods The MSCT images of 30 pancreatic cancer patients with metastatic lymph node confirmed by pathology were selected and all the patients underwent enhanced MSCT before surgery. The location, maximum short axis diameter (MSAD), sizes, density, enhancement, necrosis and fusion of the metastatic lymph nodes were analyzed using the 5th edition of TNM stage of Japan Pancreatic Society in 2002 as the standard. Results Sixty-three metastatic lymph nodes was pathologically diagnosed, while 53 were diagnosed by MSCT. The metastatic lymph nodes most commonly occurred in group 13 and 17 in pancreatic head cancer, while group 18 lymph node metastasis was more common in pancreatic body and tail cancer. The MSAD of metastatic lymph nodes was 2~17 mm with the average of (7.2±4.0)mm. All of metastatic lymph nodes were divided into MSAD<5 mm group, 5 mm~<10 mm group and ≥10 mm group based on their size. The number of metastatic lymph nodes of the three groups were 10, 18 and 25, respectively. The number of enhanced metastatic lymph nodes was decreased as the size increased, while the number of necrotic and fused lymph nodes was increased, which were statistically different (allP<0.05). Comparison between the
Pancreatic neoplasms; Lymphatic, metastasis; Tomography,spiral computed
上海申康医院发展中心临床科技创新项目(SHDC22015035)
10.3760/cma.j.issn.1674-1935.2016.05.004
200433 上海,第二军医大学长海医院影像医学科
王莉,Email:wangli_changhai@163.com
two groups showed that the number of enhancement metastatic lymph nodes in MSAD<5 mm group and 5 mm~<10 mm group were more than that in ≥10 mm group(7/10 and 11/18vs2/25). The number of fused lymph nodes in MSAD<5 mm group and 5 mm~<10 mm group were less than that in ≥10 mm group (0 and 2/18vs22/25).Clear edge metastatic lymph nodes were more in MSAD<5 mm group than that in ≥10 mm group (6/10vs5/25). The number of necrotic metastatic lymph nodes in MSAD<5 mm group was less than that in ≥10 mm group(2/10vs18/25). All the differences above were statistically significant ( allP<0.05), but no other significant differences were found between two groups. Conclusions The main imaging findings of metastatic lymph nodes in pancreatic cancer were unobvious enhancement, intratumoral necrosis and fusion. Heterogeneous density and unclear edge could benefit the diagnosis of metastatic lymph node.
2016-02-03)
