高血压相关miRNAs及其单核苷酸多态性研究进展
2016-11-23齐涵刘峥刘彬曹寒张玲
齐涵,刘峥,刘彬,曹寒,张玲
· 综述 ·
高血压相关miRNAs及其单核苷酸多态性研究进展
齐涵1,刘峥1,刘彬1,曹寒1,张玲1
在精准医学的时代背景下,有关慢性病的精准诊断和个体化精准治疗得到了飞速发展,其中以miRNAs为代表的表观遗传学和转录组学研究更是成为慢性病病因学研究的基石。miRNAs参与转录后调控的机制以及与miRNAs相关的单核苷酸多态性(SNPs)位点是近20年研究的热点。高血压作为最常见的慢性病是亟待解决的重大公共卫生问题,其表观遗传组学水平的研究自从第一个miRNAs被发现以来就未曾停歇,也取得了一定突破。本文主要整理了近些年报道的与高血压相关的miRNAs及其SNPs,从研究对象、表达水平变化和可能的致病通路等角度进行总结,旨在为实现高血压的精准诊断和精准治疗提供理论依据。
1 高血压与miRNAs概述
高血压是一种常见的慢性非传染性疾病,以体循环动脉血压增高为主要特征(收缩压≥140 mmHg和(或)舒张压≥90 mmHg,1 mmHg=0.133kPa)。其病因复杂,涉及环境、遗传等多个方面。高血压发病机制主要包括交感神经系统活性亢进、肾性水钠潴留、肾素-血管紧张素-醛固酮系统(RAAS)激活和细胞膜离子转运异常等[1]。由于高血压病因复杂多样,会导致全身性多器官损害且临床上尚无可治愈的药物,不仅严重影响患者的生活质量,也给整个家庭带来沉重的经济负担。因此,阐明高血压的致病机制,针对不同患者开展个性化的精准治疗是攻克高血压这一重大公共卫生问题的关键研究思路,而表观遗传学概念的提出也为研究复杂的多基因疾病提供了一个契机。表观遗传现象指的是DNA序列不发生变化但是基因表达却发生了可遗传的改变,包括转录表达的调控和基因转录后的调控。本文主要从转录后调控的表观遗传学角度以及遗传学中的单核苷酸多态性角度总结与高血压相关的国内外研究进展。
MicroRNA(miRNAs)为16至22个核苷酸组成的内源性非编码RNA,属于小RNA(smallRNA)家族中的一员[2]。它主要作用于靶基因 3'端非编码区(3'UTR),在转录后水平调控基因的表达[3]。虽然第一个miRNA lin-4在1993年就被发现[4],但miRNAs领域真正的发展是伴随着2000年let-7的发现而为人们所熟知[5]。根据权威miRNAs数据库miRBase的统计,截止至2014年6月,该数据库已收录miRNAs条目28 645个,说明miRNAs已引起众多学者的广泛关注。虽然miRNAs不直接编码蛋白质,但其参与基因的缄默和基因组防御的过程同样可以影响疾病的发展。目前已知的miRNAs的功能包括调控细胞生长周期[6],参与信号转导通路[7],参与细胞凋亡和代谢过程[8]以及在脑组织中发挥重要作用[9]。与miRNAs相关的疾病主要包括肿瘤、心脑血管疾病(高血压、脑卒中和动脉粥样硬化)以及代谢性疾病。本文主要概括总结不同种类的miRNAs及其SNPs对于高血压的影响。
2 研究方法
利用检索词“microRNAs”和“hypertension”及其近义词检索Pubmed、中国知网和万方数据库。文献纳入标准为:①病例对照研究;②利用miRNAs芯片或测序技术;③包含miRNAs表达水平的变化情况;④miRNAs与高血压的关联性研究。
3 高血压与miRNAs的相关性
血管紧张素Ⅱ(AngⅡ)是RAAS系统中的主要活性物质,通过与特定受体结合发挥作用(AT1R),例如收缩血管、增强心肌收缩力以及促进醛固酮的分泌等。这些作用的直接结果是导致血压的升高[10]。现有大量实验已证明一些miRNAs可以作用于生成AngⅡ的基因,从而导致高血压的发生。徐婵婵等利用自发性高血压(SHR)大鼠和正常血压对照的WKY大鼠的主动脉和心脏来探讨miRNAs与高血压发生的关系。结果表明miR-155在雄性成年SHR大鼠主动脉中的表达量低于WKY大鼠,并且通过靶基因的预测发现血管紧张素Ⅱ1型受体(AGTR1a)为miR-155作用的靶基因之一,由此可推断miR-155表达异常可能为血压升高的原因[11]。在另一篇文献中,Donato Santovito等[12]按照有无高血压将22例患有颈动脉硬化的患者分为两组(高血压组15例、血压正常组7例),分别取动脉粥样硬化斑块检测miRNAs的表达,利用实时定量PCR来验证其差异性。结果显示高血压组中的miR-145表达量明显高于血压正常组,此外,用血管紧张素受体拮抗剂进行治疗会导致miR-145表达的大幅度升高,提示miR-145与高血压有一定相关性。由于样本量的限制,该研究未得到有意义的结果,还需要进一步的探索。除了与AngⅡ有一定关联性,高血压相关的miRNAs还与血管平滑肌的收缩、调节血管紧张度和脂质代谢等有关,使得miRNAs可以从不同角度对高血压的发生产生影响。表1汇总了目前发表的与高血压相关的miRNAs的研究结果。
4 miRNAs靶基因单核苷酸多态性对高血压的影响
SNP指的是在基因组水平上由于单个碱基的突变导致DNA序列的多态性变化,其突变频率>1%[24]。2007在英国人群中进行的大规模全基因组关联性研究(GWAS)表明SNPs与许多人类常见疾病之间存在关联[25]。
发生在基因3'端非编码区的SNP可能会通过影响miRNAs和靶基因的结合从而干扰正常生理代谢。miRNAs有一特定的种子区,一般位于5'端2-7碱基之间[26],如果该区域发生多态性变化将会对miRNAs的功能产生更大的影响。Praveen Sethupathy等[24]通过检索dsSNP数据库总结了9个人类靶基因位点中包含的12个SNPs。其中,AGTR1靶位点存在3个SNPs,而re5186(1166A/C)正好位于与miR-155种子区相结合区域,因而假设该SNP会对miR-155的功能产生影响。随后他们进行了体外实验,用3种不同的荧光素酶报告基因的含量来检测不同等位基因与miR-155结合的情况。结果显示:在miR-155存在的情况下,1166A等位基因的含量明显降低而1166C等位基因的含量无变化,这说明1166C会干扰miR-155与靶基因的结合从而对血压产生影响。该文又总结了40篇不同人种中AGTR1 1166C和血压相关性的研究,其中有18篇认为1166C是发生高血压的危险因素。尽管由于种族的原因使得不同的文章之间的可比性不强且犯I型错误的几率较高,但这些文章也充分说明1166C等位基因在不同种族中与高血压密切相关。表2中总结了一部分和高血压相关的miRNAs靶基因SNPs情况,其中包括实验证实的SNPs和通过计算预测的SNPs。
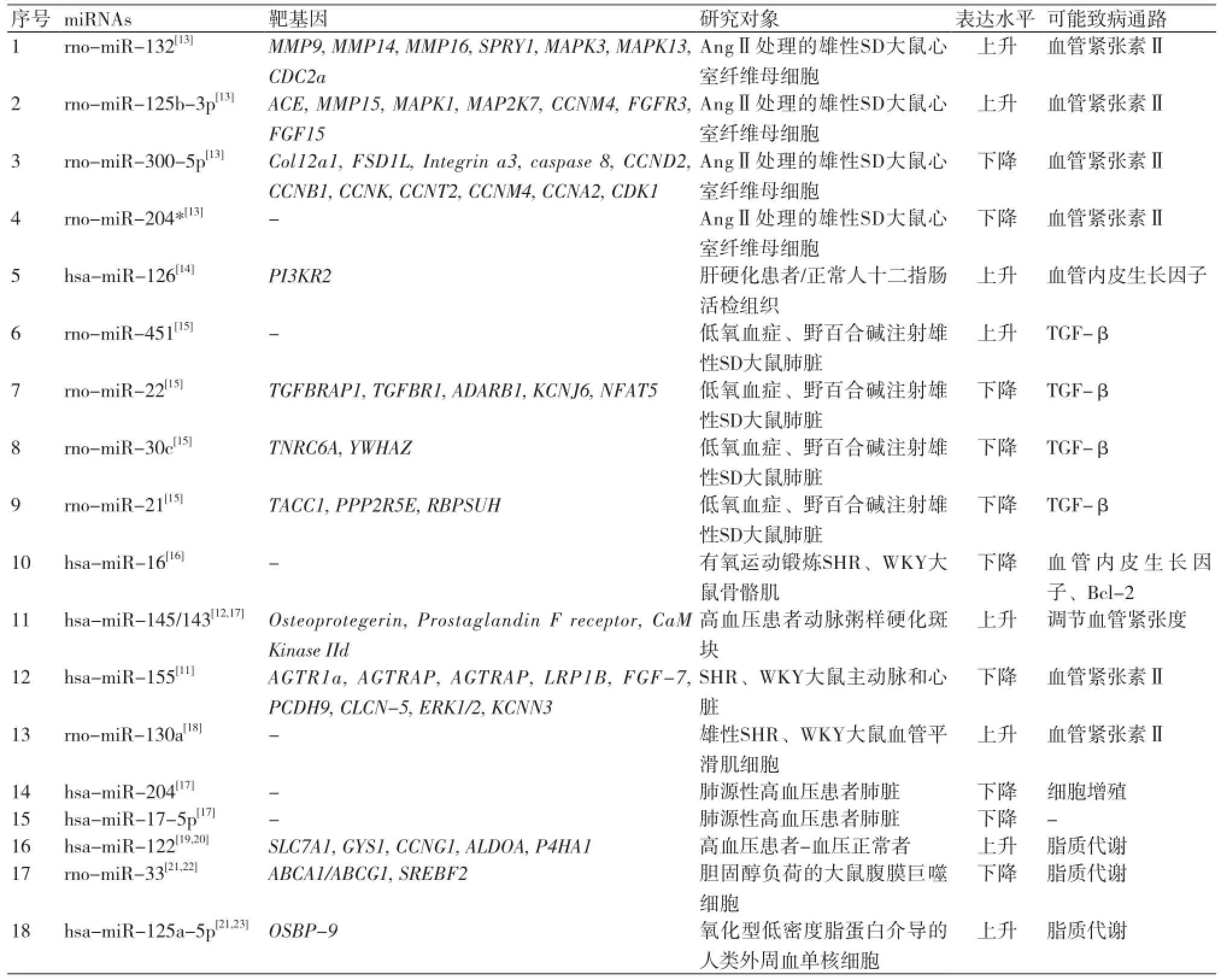
表1 高血压相关miRNAs研究结果汇总
靶基因的单核苷酸多态性可能只是miRNAs致病通路上的一环,而miRNAs本身的SNPs也会影响疾病的发生。有关这一方面的文献较少,还需要我们继续探索。
5 展望
随着科技的不断发展,人们把目光聚焦到了以前所未达到的微观世界,更多的只有几个碱基长度的小分子被人们发现,例如microRNA、circRNA等。它们可能是疾病致病机制中的关键物质,是以前黑匣子里不为人知的部分。探索基因水平和分子水平的目的是更好的预防疾病和促进健康,所以其应用价值应得到重视。我们寻找和高血压相关的miRNAs是为了找到一种能有效代表疾病发生的遗传标志物,从而在疾病早期进行干预而延缓或阻止疾病进展,这是我们进行研究的最终目的。就目前来说,有关miRNAs的实验多选择大鼠为研究对象,因此外推到人时的不确定性很大,所以我们需要进行大样本的人群实验来证明动物实验的假设。现在有关从外泌体中提取miRNAs的研究引起了人们的重视[29],因为相对从白细胞中提取来说,外泌体的获得更加方便,很多体液都含有外泌体,例如尿液、血液和唾液。如果在进行大样本的人群实验时采用收集比较好获得的尿液的方法来提取miRNAs,将会降低工作难度,而受试者的依从性也会提高。但由于其提取技术还不成熟,将外泌体和其他膜性结构相区别还有难度。通过外泌体来研究miRNAs的生物功能,甚至作为生物标志物来预测疾病是日后发展的趋势[30]。
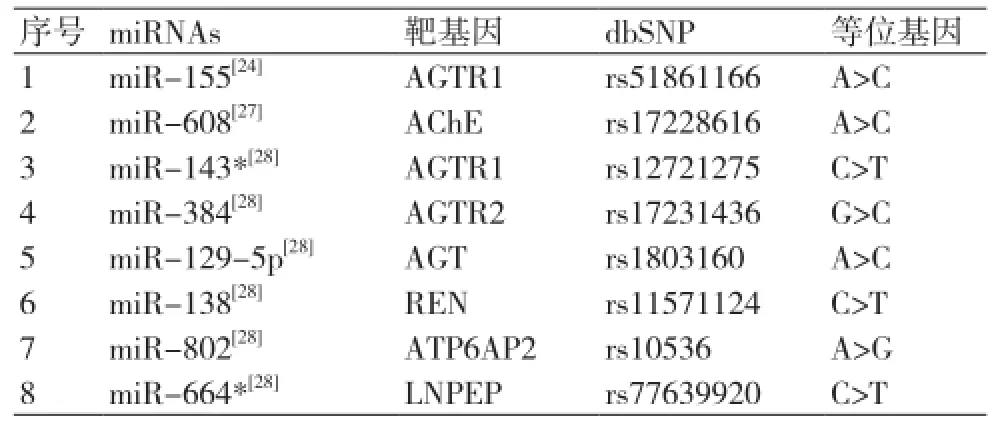
表2 高血压相关miRNAs靶基因SNP
[1] 陆再英,钟南山. 内科学[M]. 北京:人民卫生出版社,2008:252.
[2] Moazed D. Small RNAs in transcriptional gene silencing and genome defence[J]. Nature,2009,457(7228):413-20.
[3] Bartel DP. MicroRNAs: target recognition and regulatory functions[J]. Cell,2009, 136(2):215-33.
[4] Lee RC,Feinbaum RL,Ambros V,et al. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell,1993,75(5):843-54.
[5] Reinhart BJ,Slack FJ,Basson M,et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans[J]. Nature, 2000,403(6772):901-6.
[6] Abrahante JE,Daul AL,Li M,et al. The Caenorhabditis elegans hunchback-like gene lin-57/hbl-1 controls developmental time and is regulated by microRNAs[J]. Dev Cell,2003,4(5):625-37.
[7] Boehm M,Slack F. A developmental timing microRNA and its target regulate life span in C. elegans[J]. Science,2005,310(5756):1954-7.
[8] Xu P,Vernooy SY,Guo M,et al. The Drosophila microRNA Mir-14 suppresses cell death and is required for normal fat metabolism[J]. Curr Biol,2003,13(9):790-5.
[9] Wienholds E,Kloosterman WP,Miska E,et al. MicroRNA expression in zebrafish embryonic development[J]. Science,2005,309(5732):310-1.
[10] 刘治全. 盐敏感性高血压[M]. 北京:人民卫生出版社,2011:160.
[11] 徐婵婵,韩卫青,肖冰,等. 微小RNA在自发性高血压大鼠主动脉的差异表达[J]. 生理学报,2008,60(4):553-60.
[12] Santovito D,Mandolini C,Marcantonio P,et al. Overexpression of microRNA-145 in atherosclerotic plaques from hypertensive patients[J]. Expert Opin Ther Targets,2013,17(3):217-23.
[13] Jiang X,Ning Q,Wang J. Angiotensin II induced differentially expressed microRNAs in adult rat cardiac fibroblasts[J]. J Physiol Sci,2013,63(1):31-8.
[14] Kobus K,Kopycinska J,Kozlowska-Wiechowska A,et al. Angiogenesis within the duodenum of patients with cirrhosis is modulated by mechanosensitive Kruppel-like factor 2 and microRNA-126[J]. Liver Int,2012,32(8):1222-32.
[15] Caruso P,MacLean MR,Khanin R,et al. Dynamic changes in lung microRNA profiles during the development of pulmonary hypertension due to chronic hypoxia and monocrotaline[J]. Arterioscler Thromb Vasc Biol,2010,30(4):716-23.
[16] Fernandes T,Magalhaes FC,Roque FR,et al. Exercise training prevents the microvascular rarefaction in hypertension balancing angiogenic and apoptotic factors: role of microRNAs-16, -21, and -126[J]. Hypertension, 2012,59(2):513-20.
[17] Bockmeyer CL,Maegel L,Janciauskiene S,et al. Plexiform vasculopathy of severe pulmonary arterial hypertension and microRNA expression[J]. J Heart Lung Transplant,2012,31(7):764-72.
[18] Wu WH,Hu CP,Chen XP,et al. MicroRNA-130a mediates proliferation of vascular smooth muscle cells in hypertension[J]. Am J Hypertens,2011,24(10):1087-93.
[19] Yang Z,Kaye DM. Mechanistic insights into the link between a polymorphism of the 3'UTR of the SLC7A1 gene and hypertension[J]. Hum Mutat,2009,30(3):328-33.
[20] Esau C,Davis S,Murray SF,et al. miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting[J]. Cell Metab,2006,3(2):87-98.
[21] Rink C,Khanna S. MicroRNA in ischemic stroke etiology and pathology[J]. Physiol Genomics,2011,43(10):521-8.
[22] Rayner KJ,Suarez Y,Davalos A,et al. MiR-33 contributes to the regulation of cholesterol homeostasis[J]. Science,2010,328(5985):1570-3.
[23] Chen T,Huang Z,Wang L,et al. MicroRNA-125a-5p partly regulates the inflammatory response, lipid uptake, and ORP9 expression in oxLDL-stimulated monocyte/macrophages[J]. Cardiovasc Res,2009,83(1):131-9.
[24] Sethupathy P,Borel C,Gagnebin M,et al. Human microRNA-155 on chromosome 21 differentially interacts with its polymorphic target in the AGTR1 3' untranslated region: a mechanism for functional single-nucleotide polymorphisms related to phenotypes[J]. Am J Hum Genet,2007,81(2):405-13.
[25] Wellcome Trust Case Control Consortium. Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls[J]. Nature,2007,447(7145):661-78.
[26] Lewis BP,Burge CB,Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets[J]. Cell,2005,120(1):15-20.
[27] Hanin G,Shenhar-Tsarfaty S,Yayon N,et al. Competing targets of microRNA-608 affect anxiety and hypertension[J]. Hum Mol Genet, 2014,23(17):4569-80.
[28] Elton TS,Sansom SE,Martin MM. Cardiovascular Disease, Single Nucleotide Polymorphisms; and the Renin Angiotensin System: Is There a MicroRNA Connection?[J]. Int J Hypertens,2010,2010:291692.
[29] Valadi H,Ekstrom K,Bossios A,et al. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol,2007,9(6):654-9.
[30] Kourembanas S. Exosomes: vehicles of intercellular signaling, biomarkers, and vectors of cell therapy[J]. Annu Rev Physiol,2015,77:13-27.
本文编辑:杨新颖,姚雪莉
R544.1
A
1674-4055(2016)10-1262-03
国家自然科学基金资助项目(81373076);北京市属高等学校高层次人才引进与培养计划项目青年拔尖人才培育计划(CIT&TCD201504088)
1100069 北京,首都医科大学公共卫生学院流行病与卫生统计学系
张玲,E-mail:zlilyepi@ccmu.edu.cn
10.3969/j.issn.1674-4055.2016.10.35
