血管内超声在冠心病介入诊断和治疗中的应用进展
2016-11-23王树鹏王悦喜
王树鹏,王悦喜
血管内超声在冠心病介入诊断和治疗中的应用进展
王树鹏1,王悦喜2
目前,我国心血管疾病的发病率和死亡率仍处于升高趋势,且发病趋于年轻化。冠状动脉造影(CAG)长期以来被公认为冠心病诊断的金标准,但近年来发现CAG在冠心病介入诊断和指导治疗上仍存在着如不能评价冠状动脉管壁结构、斑块形态、性质以及判断冠状动脉狭窄程度受术者主观因素影响等诸多的局限性;血管内超声(IVUS)、血流储备分数(FFR)、光学断层扫描(OCT)等辅助技术的出现弥补了其不足。其中已经历了20多年发展历程的IVUS技术,在评价斑块的形态、性质及斑块的稳定性、判断冠状动脉管壁结构及管腔狭窄程度,指导非保护性左主干、临界性病变、分叉及中重度钙化等复杂病变的诊治以及辅助介入治疗等方面具有重要价值[1],现已受到临床的重视并广泛应用于冠心病的临床诊治。本文着重对近些年IVUS在冠心病介入诊治中的应用作一综述。
1 IVUS在评价冠状动脉病变的应用
1.1IVUS评价斑块性质 临床中常用的CAG仅能通过对比剂充填的轮廓显示血管内腔长轴的二维图像,估算出管腔的相对狭窄程度,而并不能提供冠状动脉病变管壁性状特征有价值的信息。灰阶IVUS能够评价斑块的形态、判断冠状动脉管壁结构及管腔狭窄程度,并可通过斑块的回声强度判断斑块的性质,IVUS提供斑块灰度图像的分类:①软斑块,回声低于附近的外膜;②钙化斑块,回声高于附近的外膜;③纤维斑块,中等回声;④混合斑块,2种或2种以上回声信号[2]。然而不同斑块的回声会在灰阶IVUS图像上发生重叠,而虚拟组织血管内超声(VH-IVUS)综合利用了超声波的频率及振幅信息对斑块中的组织成分做出有效识别,弥补了灰阶IVUS的不足。纤维斑块(FI)、纤维脂肪斑块(FF)、坏死核心组织(NC)、钙化组织(DC)在VH-IVUS图像上分别显示为深绿色、浅绿色、红色、白色区域。VH-IVUS对这4种组织预测的准确度分别可达:FI 93.4%,FF 94.6%,NC 95.1%,DC96.8%[3],与病理组织学有着极高的一致性[4,5],被认为是“活体病理组织学”。
1.2IVUS评价斑块的稳定性 动脉粥样硬化易损斑块很容易破裂、血栓形成进而引起急性冠脉综合征等临床急症。冠状动脉成像技术的不断改进对早期辨别易损斑块是十分有必要的。具有高分辨率(10 μm×25 μm)的光学相干断层扫描技术(OCT)可以清晰识别纤维帽<65 μm大脂质核心的薄层纤维斑块(TCFA)、斑块内巨噬细胞为主的炎细胞浸润及新生血管形成等,这些指标均与斑块的不稳定性存在着较好相关性[6-8],然而OCT识别易损斑块的真阳性率很低(47%),而IVUS阴性预测及组织穿透力方面有明显优势,联合利用OCT和IVUS评价易损斑块可使真阳性率提高至80%[8]。鉴于IVUS的分辨率(100 μm×100 μm)有限,意味着IVUS不能识别覆盖于脂质核心上≤100~200 μm厚度的纤维帽。因此,目前IVUS研究大部分采用TCFA、简化定义,为局灶性丰富的坏死核心病变,坏死核心面积/斑块总面积≥10%且贴近管腔壁、斑块负荷≥40%、并且出现在3个以上连续的横断面上,均未提及纤维帽作为依据[9],同时也有新的研究[10]表明,IVUS图像显示斑块的回声衰减和回声透明分别提示大的及相对较小的坏死核心或脂质池的存在,而位置表浅的点状钙化,常提示伴钙盐沉积的坏死核心的存在。上述在IVUS显示的斑块特点对诊断斑块不稳定性有提示意义,但该结论目前并未达成共识,其诊断价值仍需临床研究进一步加以证实。
1.3IVUS在非左主干临界性病变中的应用 冠状动脉临界性病变的治疗目前仍然是介入心脏病学的一个难题,对非左主干临界性病变目前多定义为CAG显示冠状动脉狭窄40%~70%的病变。血流储备分数(FFR)被认为是评价冠状动脉缺血的具有功能意义最可靠的手段,当以FFR<0.75为标准时,预测心肌缺血的灵敏度88%、阴性预测值93%、特异度及阳性预测值可达100%[11],甚至被誉为目前判断心肌缺血、指导介入治疗的新“金标准”。鉴于此,目前国内外相关指南均建议对冠状动脉临界病变应常规行FFR检查以指导临床治疗决策。已有研究报告指出由IVUS提供的的解剖学信息与缺血的生理评估具有较好的相关性,FFR可通过建立等式被三维IVUS成像准确地预测[12]。早期研究表明IVUS所测得的最小管腔面积(MLA)≥4.0 mm2、MLA<4.0 mm2分别与FFR≥2(准确性可达89%)及FFR<0.75(灵敏度及特异度分别为92%、56%)有较好的相关性[13,14];Abizaid等[15]随机纳入300例冠心病患者(357处临界冠状动脉病变)行IVUS检查,并对其病变管腔面积、最大及最小管腔直径、斑块面积、斑块负荷等参数进行多变量分析,结果显示在MLA≥4 mm2的248处病变,心血管事件发生率仅为4.4%,靶病变血管重建率为2.8%,IVUS测定的最小管腔面积和直径是发生心血管事件及靶病变血管重建的独立预测因素。基于以上研究,目前IVUS对于冠状动脉临界病变进行定量分析多采用MLA≥4.0 mm2或者面积狭窄率即(血管外膜面积-最小管腔面积)/血管外膜面积)<60%,建议推迟介入干预治疗,MLA<4.0 mm2或者面积狭窄率≥60%的患者,积极给予介入治疗[16]。然而单纯IVUS指导治疗假阳性率较高,容易导致过度介入治疗[17]。有学者推荐IVUS与FFR联合指导临界性病变经皮冠状动脉介入治疗(PCI)[18](图1)。FFR只能评估病变区域血流动力学状态而不能提供血管狭窄程度及管壁性质等相关信息;冠状动脉临界病变有6%会在一年内发展为急性冠脉事件并需要介入治疗[19],而急性冠脉综合征的发生往往又与易损斑块息息相关。因此对于临界性病变行FFR检查≥0.75只能说明狭窄无血流动力学意义,也应建议行IVUS检查判断斑块的稳定性,对不稳定斑块应及时予以药物或介入干预,稳定斑块,防止急性心血管事件发生,联合利用FFR与IVUS能给冠状动脉临界病变带来最优化的治疗。
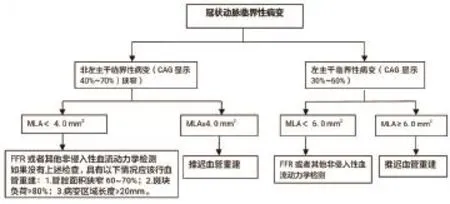
图1 临界性病变经皮冠状动脉介入治疗流程
1.4IVUS对左主干病变的评估及介入治疗的指导 左主干的解剖特点:较短,行CAG检查时无合适的血管参考段,为弥漫性病变时,CAG所显示的是整个左主干管腔直径弥漫性狭窄,影响术者判断;从主动脉窦发出时所形成的角度千变万化,且前降支和回旋支发出起始变异较大,决定了单纯CAG有时难以在常规体位准确判断左主干、前降支及回旋支开口病变情况;对于左主干的临界性病变的评估,单纯CAG所提供的信息更是不能满足对左主干诊断及介入治疗的临床需要。IVUS可准确地测得血管横截面积、管腔横截面积,并计算出斑块负荷,更精确的描述出左主干狭窄、斑块偏心及重构程度,并可精确判断前降支和回旋支开口受累情况,为左主干病变下一步的治疗提供更准确地指导信息。并且有研究发现IVUS对左主干狭窄的分析与FFR也有明显相关性(90%)[20],在对55例左主干临界性病变患者的研究显示,FFR<0.75与IVUS所测得的左主干MLA的临界值5.9 mm2(灵敏度:93%,特异度:95%)和最小管腔面积值2.8 mm2(灵敏度:93%,特异度:98%)有较好的相关性[21]。左主干MLA>6.0 mm2的患者引起心脏不良事件的发生率低,可推迟血管重建术[22]。目前临床只要IVUS检查左主干MLA<6.0 mm2,无论患者有无临床缺血症状;或者患者存在临床缺血症状并且左主干MLA<7.0 mm2,均建议PCI治疗;而左主干MLA>6.0 mm2或者管腔直径狭窄<50%时可推迟PCI治疗[21]。此外IVUS对指导无保护左主干PCI可明显改善预后,Gao XF等[23]将1016例无保护左主干狭窄行药物洗脱支架(DES)置入术的患者分为IVUS指导组(337例)及单纯CAG指导组(679例),术后一年随访结果IVUS指导组较CAG组明显降低了主要不良心血管事件(MACE)(包括心源性死亡、心肌梗死及靶血管血运重建)的发生率(14.8% vs. 27.7%,P<0.001)。
1.5IVUS对冠状动脉分叉区域的侧支闭塞情况的判断 分叉区域的介入治疗目前仍是难点,且介入治疗后最常见的并发症为侧支血管闭塞。曾有学者报道,通过血管造影判断冠状动脉分叉区域的侧支闭塞情况,例如通过CAG观察侧支开口狭窄程度[24]或者主支与侧支的角度判断[25]。Furukawa E等[26]在72个患者中选定81个分叉区域,通过IVUS在侧支开口处鉴别有无粥样斑块将侧支分为两组,两组侧支开口狭窄行CAG检查无明显统计学差异,但侧支开口带有粥样斑块的分叉区域在行PCI术后侧支发生闭塞的发生率较高(35% vs. 8%,P=0.003)。因此IVUS对分叉区域PCI术后的侧支闭塞情况有较好的预测能力。
2 IVUS在冠状动脉介入中的应用
2.1IVUS在冠状动脉中重度钙化病变介入治疗中的应用 中重度钙化病变可阻碍导丝通过病变部位、影响球囊扩张及支架安置等,容易导致支架扩张不完全、冠状动脉夹层等不良后果。因此对钙化病变部位、分布以及性状进行准确的分析,有助于治疗计划的制定。目前评价冠状动脉钙化病变的影像学技术包括:CAG、IVUS、多排螺旋CT及OCT等,其中又以CAG和IVUS在临床中的应用最为广泛[27]。在常规IVUS图像上钙化病变为白亮回声后方伴声影;对于高密度大的钙化病变,常规IVUS只能探测到边缘,而不能测量其厚度,故常用其弧度、纵向长度以及深度来对其进行描述;VH-IVUS进一步提高对钙化病变诊断的敏感性,其与组织学相比对钙化病变的预测准确度可达96.8%[3,4],故常被认为是诊断冠状动脉钙化病变的金标准[28]。目前,对中-重度钙化病变介入治疗的主要方法包括冠状动脉钙化斑块旋磨、球囊扩张及药物涂层支架置入[29]。已有研究已经证明了IVUS在钙化病变治疗上的潜在效用,IVUS指导钙化病变旋磨术可减少支架内血栓形成及支架植入术后血管再重建发生率,临床上钙化病变旋磨术中IVUS的应用较CAG更为常见[30];王鑫鑫等[31]研究同样证明,尽管IVUS指导中重度钙化病PCI对患者术后早期临床终点事件无显著影响,但术后1年随访IVUS指导组MACE的发生率显著降低;同时,IVUS对切割球囊处理钙化病变也有指导意义。
2.2IVUS对PCI器材的选择、术后效果的评价及指导作用单纯CAG缺乏对病变冠状动脉管壁的评价,其指导的PCI出现支架未完全扩张的发生率可高达15%~20%[32];改善支架贴壁情况、支架扩张程度对减少支架内血栓形成、支架内再狭窄等并发症有重要意义[22]。血管内成像技术可以评价支架置入术前、术后的最小血管腔直径及面积、测量支架的对称指数、评价即刻支架贴壁、展开程度、支架释放位置及对斑块病变的覆盖情况等,对支架贴壁、扩张情况不满意者可予高压球囊后扩张,并对介入器材的准确选择也有一定的指导意义[33,34]。目前最主要的两项血管内成像技术是IVUS 和OCT。IVUS对改善支架扩张、贴壁程度以及释放后即刻支架截面积较单纯CAG指导更为显著这已得到认可[32,33]。OCT因其极高的分辨率能更好地显示血管壁各层结构,对术后即刻支架贴壁状态、支架扩张程度及有无组织脱垂等情况可获得更清晰图像,故很多人会认为OCT指导PCI应较IVUS要好。但Habara等[35]将70例行PCI患者随机分为两组,术前、术后分别进行IVUS与OCT检查,根据两项检查测得的支架截面积和支架贴壁情况等参数判断是否进行球囊后扩张,球囊扩张术后重复两种技术检查,比较两组支架的扩张程度及支架截面积,结果发现IVUS指导组支架截面积及支架扩张程度大于OCT指导组,表明IVUS在指导PCI方面有其独特优势,对PCI的指导意义优于OCT。
2.3IVUS指导PCI治疗的预后评价 目前IVUS联合CAG对PCI的指导作用优于单纯CAG已被认可,但对于指导PCI治疗的预后,IVUS联合CAG是否优于单纯CAG一直未能达成一致结论。近年来这方面也进行了大量临床研究,在IVUS指导裸金属支架(BMS)置入预后方面,一项对来自7个随机试验的2193例患者进行分析,结果发现IVUS联合CAG指导下的BMS置入组与单纯CAG指导组相比,靶血管血运重建明显降低(13% vs. 18%,P<0.001),但两组死亡率(2.4% vs. 1.6%,P=0.18)和心肌梗死发生率(3.6% vs. 4.4%,P=0.51)无统计学差异[36]。另一项在800例患者中随机选择行IVUS联合CAG或单纯CAG指导下的BMS植入术,其临床终点为1年内靶血管血运重建情况,结果显示IVUS组靶病变血管重建发生率较CAG组无明显差异(8.1% vs. 12%,P=0.08),随后该研究再次报道:当选择直径≥2.5 mm的病变血管行PCI时,IVUS组靶病变血管重建发生率较CAG组明显减少,差异有统计学意义[37]。在IVUS指导药物洗脱支架置入预后方面,YoungJinYoun等[38]分别对216例冠心病患者行单纯CAG指导的PCI及125例冠心病患者行IVUS联合CAG指导的PCI,结果显示两组间的主要不良心脏事件发生率(死亡率、心肌梗死、血运重建和支架内血栓形成等)在30 d(0.5% vs. 1.6%,P=0.557)、1年(13.9% vs. 9.6%,P=0.306)、和3年随访(18.1% vs. 12.8%,P=0.224)无明显差异。然而Claessen等[39]研究表明IVUS联合CAG指导支架置入术较单纯CAG指导术后随访血栓形成及支架内狭窄发生明显减低。另一项研究报道称冠状动脉长的狭窄病变经IVUS指导的支架置入患者预后也优于CAG指导的支架置入者[40]。综上所述,IVUS指导PCI的预后是否优于单纯CAG指导不能一概而论,不同实验结果有所不同可能与接受介入治疗的靶血管病变部位、长度以及管腔直径等有关,需进一步临床研究加以证实。
3 IVUS在行CAG或PCI的慢性肾脏病(CKD)患者身上的应用价值
CAG或PCI时使用对比剂可导致急性肾损害(AKI),患有慢性肾脏病更容易因此导致病情进行性发展;在复杂的PCI手术中常常应用大量造影剂,大大增加了AKI的发生率。Ogata N等[41]回顾性调查了接受PCI治疗的CKD患者,分析手术时应用对比剂容量(CV)与AKI和1年临床结局的关系,结果显示明显减少对比剂应用组显著降低了AKI的发生率及1年内导致维持性血液透析、死亡的发生率;因此CV对CKD影响较大。IVUS指导PCI治疗与冠状动脉造影指导PCI治疗相比可显著降低造影剂用量,在之前的研究指出IVUS 指导下的PCI治疗在造影剂用量<10 ml的情况下安全完成[42]。更不可思议的是,一病例报道在无造影剂情况下单纯应用IVUS指导下对一位造影剂过敏患者行PCI治疗是可行的[43]。
4 结论
总之,常规的CAG是诊断冠心病的金标准,但其在冠心病诊治方面的不足需要新的辅助技术来填补。IVUS相关技术近年来得到了进一步发展并且得到了广泛应用,凭借其穿透力强、成像范围广等特点在观察冠状动脉管壁重构、侧支血管情况以及指导PCI球囊扩张等方面具有较大优势;FFR对冠状动脉病变区域的血流动力学评价也是当前任何一项技术无法比拟的;OCT的出现更以其较高的空间分辨率在评价易损斑块及PCI术后即刻并发症等方面有其独特优势。但每一种技术均有其两面性,有利也有弊,相信随着国家医疗制度的不断完善,几种技术的有机结合,势必会使冠状动脉疾病的诊治做到最优化。
[1] 刘青波,陈晖. 血管内超声在介入治疗中的应用[J]. 中国介人心脏病学杂志,2015,23(9):519-21.
[2] Garcìa-Garcìa HM,Gogas BD,Serruys PW,et al. IVUS-based imaging modalities for tissue characterization:similarities and differences[J]. Int J Cardiovasc Imaging,2011,27(2):215-24.
[3] Nakamura T,Kubo N,Funayama H,et al. Plaque characteristics of the coronary segment proximal to the culprit lesion in stable and unstable patients[J]. Clin Cardiol,2009,32(8):9-12.
[4] Garcia HM,Jang IK,Serruys PW. Imaging plaques to predict andbetter manage patients with acute coronary events[J]. Circ Res,2014,114 (12):1904-17.
[5] 王巍彬,程标. 血管内超声在冠心病诊断及治疗中的应用[J]. 实用医院临床杂志,2014,11(3):166-73.
[6] Fleiner M,Kummer M,Mirlacher M,et al. Arterial neovascularization and inflammation in vulnerable patients:early and latesigns of symptomatic atherosclerosis[J]. Circulation,2004,110(18):2843-50.
[7] Levine GN,Bates ER,Blankenship JC,et al. 2011 ACCF/AHA /SCAI guideline for percutaneous coronary intervention.A report of the american college of cardiology foundation/american heart association task force on practice guidelines and the society for cardiovascular angiography and interventions[J]. Circulation,2011,124(23):2574-609.
[8] Kataiwa H,Tanaka A,Kitabata H,et al. Head to head comparison between the conventional balloon occlusion method and the nonocclusion method for optical coherence tomography[J]. Int J Cardiol, 2011,146(2):186-90.
[9] GA Rodriguez-Granillo,HM García-García,EPM Fadden,et al. In vivo intravascular ultrasound-derived thin-cap fibroatheroma detection using ultrasound radiofrequency data analysis[J]. J Am Coll Cardiol,2005,46(11):2038-42.
[10] Takaoka N,Tsujita K,Kaikita K,et al. Comprehensive analysis of intravascular ultrasound and angiographic morphology of culprit lesions between ST-segment elevation myocardial infarction and non-ST-segment elevation acute coronary syndrome[J]. Int J Cardiol, 2014,171(3):423-30.
[11] Pijls NH,De Bruyne B,Peels K,et al. Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses[J]. N Engl J Med,1996,334(26):1703-8.
[12] Takayama T,Hodgson JM. Prediction of the physiologic severity of coronary lesions using 3D IVUS:validation by direct coronary pressure measurements[J]. Catheter Cardiovasc Interv 2001,53(1):48-55.
[13] Abizaid A,Mintz GS,Pichard AD,et al. Clinical,intravascular ultrasound,and quantitative angiographic determinants of the coronaryflow reserve before and after percutaneous transluminal coronary angioplasty[J]. Am J Cardiol,1998,82(4):423-8.
[14] Briguori C,Anzuini A,Airoldi F,et al. Intravascular ultrasound criteria for the assessment of the functional significance of intermediate coronary artery stenoses and comparison with fractional flow reserve[J]. Am J Cardiol,2001,87(2):136-41.
[15] AbizaidAS,Mintz GS,Mehran R,et al. Long-term follow-up after percutaneous transluminal coronary angioplasty was not performed based on intravascular ultrasound findings:importance of lumen dimensions[J]. Circulation,1999,100(3):256-61.
[16] Tyczynski P,Pregowski J,Mintz GS,et al. Intravascular ultrasound assessment of ruptured atherosclerotic plaques in left main coronary arteries[J]. Am J Cardiol,2005,96(6):794-8.
[17] Ben-Dor I,Torguson R,Deksissa T,et al. Intravascular ultrasound lumen area parameters for assessment of physiological ischemia by fractional flow reserve in intermediate coronary artery stenosis[J].Cardiovasc Revasc Med,2012,13(3):177-82.
[18] McDaniel MC,Eshtehardi P,Sawaya FJ,et al. Contemporary clinical applications of coronary intravascular ultrasound[J]. JACC Cardiovasc Interv,2011,4(11):1155-67.
[19] Latacz P,Rostoff P,Gackowski A,et al. Comparison of the efficacy and safety of pharmacological treatment versus percutaneous coronary angioplasty in patients with intermediate coronary artery lesions[J]. Kardiol Pol,2009,67(8A):1004-12.
[20] Kang SJ,Lee JY,Ahn JM,et al. Intravascular ultrasound-derived predictors for fractional flow reserve in intermediate left main disease[J]. JACC Cardiovasc Interv,2011,4(11):1168-74.
[21] Jasti V,Ivan E,Yalamanchili V,et al. Correlations between fractional flow reserve and intravascular ultrasound in patients with an ambiguous left main coronary artery stenosis[J]. Circulation,2004,110 (18):2831-6.
[22] de la Torre Hernandez JM,Hernandez Hernandez F,Alfonso F,et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions;results from the multicenter LITRO study[J]. J Am Coll Cardiol,2011,58(4):351-8.
[23] Gao XF,Kan J,Zhang YJ,et al. Comparison of one-year clinical outcomes between intravascular ultrasound-guided versus angiography-guided implantation of drug-eluting stents for left main lesions: a single-center analysis of a 1,016-patient cohort [J]. Patient Prefer Adherence,2014,8:1299-309.
[24] Fischman DL,Savage MP,Leon MB,et al. Fate of lesion-related side branches after coronary artery stenting[J]. J Am Coll Cardiol,1993,22 (6):1641-6.
[25] Gil RJ,Vassilev D,Formuszewicz R,et al. The carina angle-new geometrical parameter associated with periprocedural side branch compromise and the long-term results in coronary bifurcation lesions with main vessel stenting only[J]. J Interv Cardiol 2009,22(6):E1-E10.
[26] Furukawa E,Hibi K,Kosuge M,et al. Intravascular ultrasound predictors of side branch occlusion in bifurcation lesions after percutaneous coronary intervention[J]. Circ J,2005,69(3):325-30.
[27] 方哲,周玉杰,刘宇扬,等. 血管内超声与光学相干断层扫描在冠状动脉临界病变中的长期随访对比研究[J]. 心肺血管病杂志,2013,32(3):255-8.
[28] Maurovich-Horvat P,Christopher L,Alkadhi H,et al. Differentiation of Early from Advanced Coronary Atherosclerotic Lesions:Systematic Comparison of CT,Intravascular US,and Optical Frequency Domain Imaging with Histopathologic Examination in ex Vivo Human Hearts[J]. Radiology,2012,265(2):393-401.
[29] BangaloreS,Vlachos HA,Selzer F,et al. Percutaneous coronary intervention of moderate to severe calcified coronary lesions :insights from the National Heart,Lung,and Blood Institute DynamicRegistry[J]. Catheter Cardiovasc Interv,2011,77(1):22-8.
[30] Roy P,Steinberg DH,Sushinsky SJ,et al. The potential clinical utility of intravascular ultrasound guidance in patients undergoing percutaneous coronary intervention with drug-eluting stents[J]. Eur Heart J,2008,29(15):1851-7.
[31] 王鑫鑫,杜捷夫. 血管内超声指导冠状动脉中重度钙化病变介入治疗的效果[J]. 心脏杂志,2014,26(4):468-71,476.
[32] Witzenbichler B,Maehara A,Weisz G,et al. TCT-21use of IVUS reduces stent thrombosis: results from the prospective,multicenter ADAPT-DES study[J]. J Am Coll Cardiol,2012,60(17):B6-7.
[33] Nakamura S,Colombo A,Gaglione A,et al. Intracoronary ultrasound observations during stent implantation[J]. Circulation,1994,89(5):2026-34.
[34] Goldberg SL,Colombo A,Nakamura S,et al. Benefit of intracoronary ultrasound in the deployment of Palmaz-Schatz stents[J]. J Am Coll Cardiol,1994,24(4):996-1003.
[35] Habara M,Nasu K,Terashima M,et al. Impact of frequency-domain optical coherence tomography guidance for optimal coronary stent implantation in comparison with intravascular ultrasound guidance[J]. Circ Cardiovasc Interv,2012,5(2):193-201.
[36] Parise H,Maehara A,Stone GW,et al. Meta-analysis of randomized studies comparing intravascular ultrasound versus angiographic guidance of percutaneous coronary intervention in pre-drug-eluting stentera[J]. Am J Cardiol,2011,107(3):374-82.
[37] Russo RJ,Silva PD,Teirstein PS,et al. A randomized controlled trial of angiography versus intravascular ultrasound-directed baremetal coronary stent placement (the AVID trial)[J]. Circ Cardiovasc Interv,2009,2(2):113-23.
[38] Youn YJ,Yoon J,Lee JW,et al. Intravascular Ultrasound-Guided Primary Percutaneous Coronary Intervention With Drug-Eluting Stent Implantation in Patients With ST-Segment Elevation Myocardial Infarction[J]. Clin Cardiol,2011,34(11):706-13.
[39] Claessen BE,Mehran R,Mintz GS,et al. Impact of intravascular ultrasound imaging on early and late clinical outcomes following percutaneous coronary intervention with drug-eluting stents[J]. JACC Cardiovasc Interv,2011,4(9):974-81.
[40] Oemrawsingh PV,Mintz GS,Schalij MJ,et al. Intravascular Ultrasound Guidance Improves Angiographic and Clinical Outcome of Stent Implantation for Long Coronary Artery Stenoses:final results of a randomized comparison with angiographic guidance (TULIP Study)[J]. Circulation,2003,107(1):62-7.
[41] Ogata N,Ikari Y,Nanasato M,et al. Safety margin of minimized contrast volume during percutaneous coronary intervention in patients with chronic kidney disease[J]. Cardiovasc Interv Ther,2014,29(3):209-15.
[42] Ogata N,Matsukage T,Toda E,et al. Intravascular ultrasound-guided percutaneous coronary interventions with minimum contrast volume for prevention of the radiocontrast-induced nephropathy:Report of two cases[J]. Cardiovasc Interv Ther,2011,26(1):83-8.
[43] Okura H,Nezuo S,Yoshida K. Successful stent implantation guided by intravascular ultrasound and a Doppler guidewire without contrast injection in a patient with allergy to iodinated contrast media[J]. J Invasive Cardiol,2011,23(7):297-9.
本文编辑:阮燕萍
R541.4
A
1674-4055(2016)10-1269-04
1010050 呼和浩特,内蒙古医科大学研究生学院;2010050 呼和浩特,内蒙古医科大学附属医院心血管内科
王悦喜,E-mail:wangyuexi2@163.com
10.3969/j.issn.1674-4055.2016.10.38
