水浸法提取银杏叶总黄酮工艺的研究
2016-11-22闫高颖张必荣郭倩茹
闫高颖,张必荣,张 敏,周 阳,郭倩茹,杨 妍,张 勇
(陕西天谷生物科技集团有限公司,西安 710065)
水浸法提取银杏叶总黄酮工艺的研究
闫高颖,张必荣*,张 敏,周 阳,郭倩茹,杨 妍,张 勇
(陕西天谷生物科技集团有限公司,西安 710065)
目的 优选水浸法提取银杏黄酮工艺的最佳条件。方法 采用正交实验以及高效液相色谱法,对水提银杏总黄酮的条件进行了优选。结果 浸提温度、浸提时间、提取次数和料液比对银杏叶总黄酮的提取率均有影响;最佳提取工艺为:100 ℃条件下水浸法提取3次,每次1 h,料液比为1∶26。结论 该提取工艺简单可行,稳定,适合大生产。
黄酮;银杏提取物;水浸提取;正交实验
A.stract:Objective To study the optimal water extraction conditions of total flavones fromGinkgoleaves. Methods Using orthogonal test and HPLC, the water extraction conditions was optimized for total flavones fromGinkgoleaves. Results Extraction rate of total flavones was affected by the extraction temperature,extraction time, extraction times and material-liquid ratio.The optimal extraction conditions were concluded as follows:water as the extractant, material-liquid ratio 1∶26,extraction 3 times (each time 1 h)and extraction temperature 100 ℃.Conclusion The proposed procedure is simple,feasible, stable and suitable for mass production.
银杏(GinkgobilobaL.)为银杏科银杏属植物,现仅存1科1属1种,素有裸子植物“活化石”之称,作为中草药在民间使用,最早见于14世纪的《日用本草》,主要用于咳嗽、气喘及炎症[1-2]。其树皮、果实和叶子均有很高的药用价值和食用价值,叶的药用价值最高;银杏叶中含有的主要有效物质为银杏黄酮,具有抗氧化、预防心脑血管疾病等作用,因此引起了研究者的广泛关注,具有广阔的市场前景[3-7]。
目前,国内银杏叶提取物厂家很多,对于银杏叶的提取工艺主要集中于采用有机溶剂进行提取,但提取成本高,导致很多厂家纷纷停止生产,因此银杏工艺的开发成为一个难点[8-10]。为了降低生产成本,本实验从提取环节进行优化,采用了水作为提取溶剂,优选提取银杏黄酮的最佳条件,对银杏黄酮的大生产具有一定的指导意义。
1 仪器与试药
1.1 仪器 高效液相色谱仪(thermo ultimate 3000型四元泵、二极管阵列检测器、自动进样器);101型电热恒温鼓风干燥箱(北京科伟永兴仪器有限公司);BP25S 型电子天平(德国赛多利斯公司);KQ型数控超声波清洗器(昆山市超声仪器有限公司);Maxima超纯水机(美国基因公司)。
1.2 试药 银杏叶(陕西昊源中药饮片有限公司);槲皮素对照品(供含量测定用,批号10081-201406),山柰素对照品(供含量测定用,批号110861-201403),异鼠李素对照品(供含量测定用,批号110860-201405),以上对照品均由中国食品药品检定研究院提供;甲醇为色谱纯;其他试剂均为分析纯。
2 方法与结果
2.1 含量测定 参照2010年版《中国药典》银杏叶提取物总黄酮醇苷的测定方法,对银杏叶黄酮的含量进行测定[1]。
2.1.1 色谱条件 色谱柱:Agilent TC-C18(250 mm ×4.6 mm,5 μm);流动相:甲醇:4 mL·L-1,磷酸溶液(50∶50);检测波长:360 nm;流速:1 mL·min-1;温度:30 ℃;色谱图见图1。
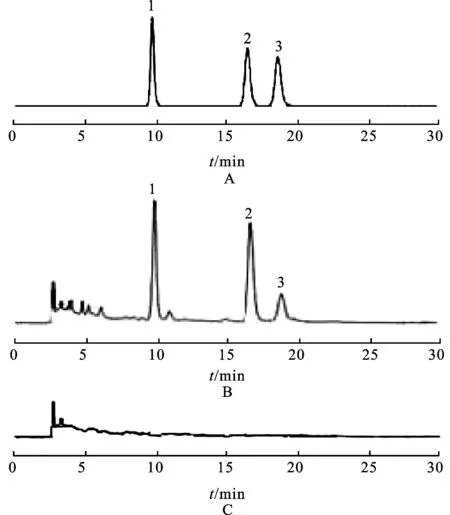
图1 HPLC图
A.对照品;B.供试品;C.阴性对照品;1.槲皮素;2.山柰素;3.异鼠李素
Fig.1 HPLC chromatograms
2.1.2 对照品溶液的制备 分别精密称取槲皮素对照品、山柰素对照品和异鼠李素对照品,加甲醇制成1 mL分别含各对照品30,30和20 μg的混合溶液,作为对照品溶液,在-4 ℃储存待用。
2.1.3 供试品溶液的制备 移取100 mL的提取液样品进行烘干,精密称取适量的银杏叶提取物干粉,加入甲醇∶ 250 mL·L-1盐酸溶液(4∶1)混合溶液25 mL,置于50 mL圆底烧瓶中,加热回流30 min,迅速冷却至室温,转移至50 mL量瓶中,用甲醇稀释至刻度,摇匀,用0.45 μm微孔滤膜滤过,取续滤液,即得供试品溶液。
2.1.4 阴性对照品溶液的制备 取空白样品,按照供试品溶液的制备方法进行制备。
2.1.5 样品测定 分别精密吸取对照品溶液与供试品溶液各10 μL,注入液相色谱仪,进行测定,分别按照外标法计算槲皮素、山柰素和异鼠李素的含量,按照下式换算成总黄酮醇苷的含量。总黄酮醇苷含量=(槲皮素含量+山柰素含量+异鼠李素含量)×2.51
2.2 正交实验设计 取银杏叶药材适量,采用正交实验法,选择料液比、提取温度、提取时间和提取次数为主要因素,每个因素各选取3个水平,按照L9(34) 正交实验表进行实验,分别以银杏总黄酮醇苷为指标进行考察,结果见表1~3。
表1 正交实验因素与水平
Tab.1 The factors and leves of orthogonal experiment

水平因素A,提取时间/hB,提取温度/℃C,料液比D,提取次数/次11801∶26122901∶282331001∶303
表2 正交实验结果
Tab.2 Results of orthogonal experiment

水平因素A,提取时间/hB,提取温度/℃C,料液比D,提取次数/次11801∶26122901∶282331001∶303
表3 方差分析结果
Tab.3 Results of variance analysis

方差来源离差平方和自由度FFα显著性A0.081214.067F0.1=9*B1.2512216.895F0.05=19**C0.00521D0.01923.457误差0.0002
注:*P<0.1,**P<0.05。
由表2可知,银杏叶提取工艺以总黄酮醇苷为考察指标,由极差R可知,各因素影响大小顺序为B>A>D>C。随着温度的逐步升高,总黄酮醇苷的提取量也逐步升高。由表3可知,因素B(提取温度)对总黄酮醇苷提取率有极显著性意义;其次是因素A;因素D和因素C对提取率无显著性意义,可根据生产条件任取一水平,从节约能源和提高生产效率方面考虑,提取时间为分别选择提取次数D3(3次) 和料液比C1(1∶26),得出较佳提取工艺。
2.3 验证实验 根据正交实验结果,以最终确定的提取工艺以及纯化工艺进行验证实验3批,总黄酮醇苷的平均含量大于24%。
3 讨论
关于银杏黄酮的提取,传统的提取工艺主要是有机溶剂法,以甲醇、丙酮以及乙醇为提取溶剂,前两者有一定的毒性,均有少量的残留,对最终的产品有一定的影响[11-14]。同时乙醇提取法存在蒸汽压高,易燃易爆,且成本较高的特点;本工艺利用黄酮类化合物在水中的溶解度较好,银杏总黄酮的提取率可达0.59%;同时以乙醇溶剂法为参照,银杏总黄酮的提取率为0.61%,本工艺的提取率略低于乙醇溶剂法的提取率,但本工艺的提取液不经水沉可直接进行层析。此工艺一方面降低了提取环节的成本,另一方面缩减了银杏纯化工艺的时间与成本,同时提高了大生产的安全性。
验证实验结果表明,浸提温度、浸提时间、浸提次数以及料液比对银杏叶黄酮的提取效果均产生不同程度的影响。其中浸提温度对银杏叶总黄酮浸出率的影响达极显著水平,随着浸提温度的升高,浸提效果越好。本实验银杏叶最佳提取工艺为26倍量的水(1∶10∶8∶8),100 ℃条件下提取3次,每次1 h。本工艺稳定可行,已应用于大生产。
[1] 国家药典委员会. 中国药典2010年版[S]. 一部. 北京: 中国医药科技出版社,2010:296-297.
[2] 徐艳芬,张丽娟,宋新波. 银杏叶提取物的研究进展[J]. 药物评价研究,2010,33(6):452-456.
[3] 安建平,王延璞,赵菲佚,等. 银杏化学成分及药理作用的研究和应用进展[J]. 天水师范学院学报,2003, 23(5):34-37.
[4] 陈素芹. 银杏叶总黄酮近期研究进展[J]. 中华今日医学杂志,2003,3(14):87-89.
[5] 谢纲,李冲. 银杏叶提取物的分离分析方法研究进展[J]. 西北药学杂志,2005,20(6):277-278.
[6] 耿秀芳,庞秀英,李桂芝. 银杏叶总黄酮近期研究进展[J]. 中国中药杂志,2003,28(6): 488-490.
[7] 袁龙. 高效液相色谱法测定银杏叶片剂中银杏黄酮含量[J]. 西北药学杂志,2004,19(6):246-248.
[8] 张岩,曹国杰,张燕,等. 黄酮类化合物的提取以及检测方法的研究进展[J]. 食品研究与开发, 2008, 29 (1): 154-158.
[10]张玉祥,李宗伟. 银杏叶有效成分的提取工艺进展[J]. 时珍国医国药,2006,17(6):1076-1077.
[11]赵华,张慧明,董银卯,等. 银杏叶黄酮类化合物水提工艺的响应面优化[J]. 北京工商大学学报:自然科学版,2010,28(3):27-31,43.
[12]陈富强. 银杏叶提取工艺研究[J]. 科技创新与应用,2012, (3):15.
[13]王晓,廖克俭,戴跃玲. 银杏叶有效成分提取工艺研究[J]. 东华理工学院学报,2007,30(2):181-184.
[14]朱平华. 银杏叶中黄酮类化合物的提取工艺研究[J]. 化工生产与技术,2006,13(6):25-27.
Study on the water extraction of total flavones from Ginkgo leaves
YAN Gaoying,ZHANG Birong*,ZHANG Min,ZHOU Yang,GUO Qianru,YANG Yan,ZHANG Yong
(Shaanxi Tiangu Biological Technology Group Limited Company, Xi′an 710065, China)
flavones;Ginkgobilobaextract; water extraction; orthogonal test
ubstances;B.test products;C.negative sample;1.quercetin;2.kaempferol;3.isorhamnetin
闫高颖,女,助理工程师
*通信作者:张必荣,男,高级工程师
10.3969/j.issn.1004-2407.2016.06.003
R284
A
1004-2407(2016)06-0560-03
2016-01-13)
