脑脊液中利奈唑胺质量浓度测定方法的建立及临床应用
2016-11-22李海燕马小亚张抗怀
蔡 艳,张 莉,李海燕,马小亚,张抗怀
(西安交通大学第二附属医院药学部,西安 710004)
脑脊液中利奈唑胺质量浓度测定方法的建立及临床应用
蔡 艳,张 莉,李海燕,马小亚,张抗怀
(西安交通大学第二附属医院药学部,西安 710004)
目的 建立人脑脊液中利奈唑胺质量浓度测定方法并开展临床检测。方法 使用高效液相色谱仪(HPLC),采用外标法。色谱条件为:色谱柱:Agilent5TC-C18(2),250mm×4.6mm;流动相:甲醇-水(40∶60);流速:1.0mL·min-1;柱温:25 ℃;紫外检测波长:250nm。结果 利奈唑胺质量浓度在0.31~40mg·L-1范围内线性关系良好(r=0.999 6),定量下限为0.31mg·L-1,方法回收率、提取回收率均大于85%,高、中、低3个质量浓度日内、日间精密度的RSD值均小于5%。药物干扰试验中美罗培南、头孢曲松及头孢他啶对利奈唑胺的测定无影响。对8例患者开展27例次脑脊液利奈唑胺质量浓度测定,平均质量浓度为2.67±1.11mg·L-1。结论 建立的利奈唑胺脑脊液质量浓度测定方法简单、方便、灵敏、准确,可用于临床检测;利奈唑胺在脑脊液中的质量浓度个体差异较大。
利奈唑胺;脑脊液;中枢神经系统感染;高效液相色谱法
中枢神经系统感染治疗难度大、死亡率高,目前指南推荐在经验治疗阶段均使用以万古霉素为基础的联合治疗方案。但万古霉素脑脊液穿透率低(脑脊液/血液的质量浓度比值为7%~14%),且有肾毒性,对于存在肾功能损害或前期使用万古霉素疗效不佳的患者,治疗更为棘手[1-2]。利奈唑胺是噁唑烷酮类衍生物,其组织分布广泛,耐药率低,是目前重症和多重耐药菌感染的主要治疗药物之一[3-4]。国外文献显示,利奈唑胺可作为化脓性脑膜炎的治疗选择,且安全性较万古霉素更高[5],可用于新生儿及老年患者。但是利奈唑胺的脑脊液质量浓度在不同患者间差异较大,建议使用利奈唑胺治疗中枢神经系统感染时监测其脑脊液中的药物质量浓度[6]。因此,本课题拟建立利奈唑胺脑脊液质量浓度测定方法,应用于中枢神经系统感染患者,初步探讨利奈唑胺在脑脊液中的分布情况,为该类患者治疗方案的调整提供依据。
1 仪器与材料
1.1 仪器 高效液相色谱仪(美国戴安公司生产,包括P680四元泵、PDA-100光电二极管序列检测器、自动脱气机、柱温箱、自动进样器、Chromeleon色谱工作站);超纯水机(Milli-Qplus,美国milipope公司);台式高速离心机(TG1650-WS,湖南赛特湘仪离心机仪器有限公司)。
1.2 试药 利奈唑胺对照品(加拿大多伦多研究化学品公司,批号5-ARP-79-1);注射用头孢他啶(葛兰素史克制药有限公司,批号15010026);注射用头孢曲松(上海罗氏制药有限公司,批号SH6069);注射用美罗培南(珠海联邦制药股份有限公司,批号150320902);甲醇(色谱纯,天津市科密欧化学试剂有限公司)。
1.3 脑脊液 空白脑脊液:入住神经外科、考虑为非感染性疾病、且近期在院外未使用药物的患者,经同意后行腰椎穿刺留取的脑脊液作为空白脑脊液,用于建立测定方法;已使用利奈唑胺的患者,在住院期间需开展脑脊液常规、生化检查时经患者同意后行腰椎穿刺后留取;或已行脑室引流的患者从引流管中缓慢抽取适量用于测定。
2 方法
2.1 色谱条件 色谱柱:Agilent5TC-C18(2),250mm×4.6mm;流动相:甲醇-水(40∶60);流速:1.0mL·min-1;柱温:25 ℃;紫外检测波长:250nm;进样量:10μL。
2.2 样品处理与测定 参照李淑娟等[7]建立的脑脊液样品处理方法,精密量取适量空白脑脊液,加入等量甲醇涡旋混匀1min,离心(25 ℃,10 000r·min-1,10min),吸取上清液测定,记录色谱峰面积。将其代入标准曲线方程,求出药物质量浓度。
2.3 方法专属性 分别取空白脑脊液、利奈唑胺标准液及含利奈唑胺的脑脊液样品,按照样品处理方法处理后进行测定。
2.4 标准曲线的制备 配制含利奈唑胺梯度质量浓度为40,20,10,5,2.5,1.25,0.63和0.31mg·L-1的脑脊液样品,编号为1~8,按照样品处理方法进行操作,记录峰面积。以样品的峰面积为纵坐标,以利奈唑胺质量浓度为横坐标作图,采用最小二乘法进行线性回归,得标准曲线方程及相关系数。
2.5 回收率试验 配制质量浓度为 1.25,5和20mg·L-1的脑脊液样品,按照2. 2项下方法处理后分析测定,每一质量浓度测定5个样品,记录峰面积,并带入标准曲线方程计算质量浓度,与实际质量浓度进行比较,计算方法回收率。同法配制并处理上述3种质量浓度的脑脊液各5份,另取与脑脊液样品相同质量浓度的利奈唑胺对照品溶液,将2组峰面积比进行比较,计算提取回收率。
2.6 精密度试验 取适量空白脑脊液,配制成质量浓度分别为20,5和1.25mg·L-1的样品溶液各5份,按照样品处理方法进行处理,分别在同日内测定5次,连续测定3d,计算脑脊液日内及日间精密度。
2.7 稳定性试验 取适量空白脑脊液,配制成质量浓度分别为20,5和1.25mg·L-1的样品溶液,分别考察室温放置稳定性(24h)、样品处理后稳定性(室温24h)、长期冷冻稳定性(-20 ℃保存20d)以及冻融稳定性(反复冻融3次),按照2.2项下方法处理后测定其质量浓度。
2.8 干扰性试验 由于中枢神经系统感染的经验治疗方案中往往会使用2种抗菌药物同时覆盖阳性菌和阴性菌,因此,将常用于中枢神经系统感染的抗革兰阴性菌药物头孢曲松、头孢他啶和美罗培南作为干扰药物。将美罗培南、头孢曲松和头孢他啶配制成适当质量浓度的脑脊液溶液,进样测定,记录保留时间;将上述干扰药品加入到含利奈唑胺的脑脊液溶液中,进样测定,观察其他抗菌药物对利奈唑胺质量浓度的测定有无影响。
2.9 患者脑脊液中利奈唑胺的质量浓度测定 收集8位神经外科诊断为颅内感染或肺部感染,且使用利奈唑胺的患者,在利奈唑胺第4次给药后,第5次或之后任何一次给药前测定谷质量浓度。对于多次行腰椎穿刺或行脑室引流的患者可多次测定。
3 结果
3.1 方法专属性 脑脊液中利奈唑胺的高效液相色谱图见图1。利奈唑胺的保留时间为12.25min,脑脊液中的内源性杂质峰在2~3min之间,不干扰利奈唑胺的测定。
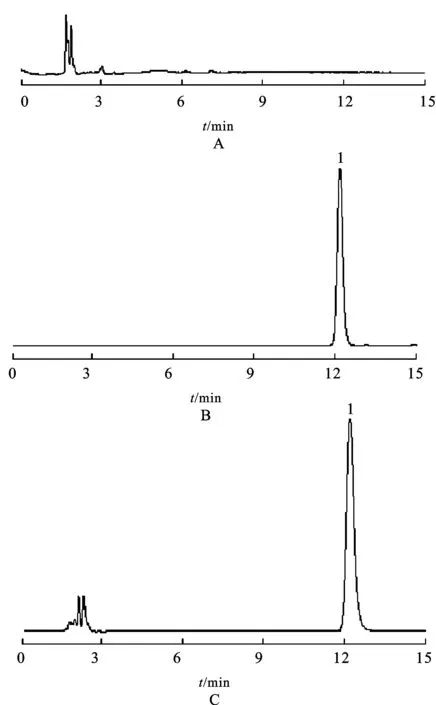
图1 脑脊液中利奈唑胺的HPLC图
A.空白脑脊液;B.利奈唑胺溶液;C.含利奈唑胺的脑脊液样品;1.利奈唑胺Fig.1HPLCchromatogramsoflinezolidincerebrospinalfluid
A.blankcerebrospinalfluid;B.linezolidsolution;C.cerebrospinalfluidsample;1.linezolid
3.2 标准曲线 线性回归方程为Y=2.438 9X+0.266 5,r=0.999 6,利奈唑胺质量浓度在0.31~40mg·L-1范围内线性关系良好,定量下限为0.31mg·L-1。
3.3 精密度与回收率 日内、日间精密度及提取回收率、方法回收率结果见表1。由表1可知,本方法的日内、日间的RSD值均小于5%,说明有良好的精密度;提取回收率和方法回收率也较高,达到试验要求。
表1 利奈唑胺测定方法的回收率和精密度
Tab.1Recoveryandprecisionoflinezoliddetermination
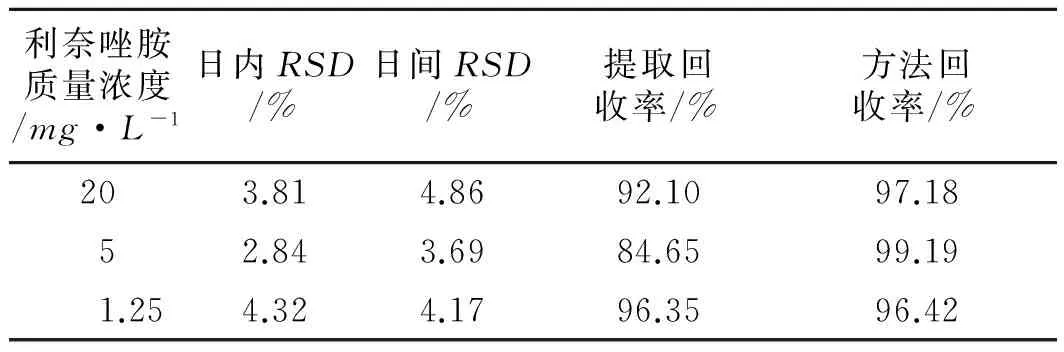
利奈唑胺质量浓度/mg·L-1日内RSD/%日间RSD/%提取回收率/%方法回收率/%203.814.8692.1097.1852.843.6984.6599.191.254.324.1796.3596.42
3.4 样品稳定性 见表2。由表2可知,利奈唑胺脑脊液样品放置24h、样品处理后室温放置24h和反复冻融3次的RSD值均小于5%,而长期冷冻20d的RSD值大于15%。
表2 样品稳定性
Tab.2Samplestability

利奈唑胺质量浓度/mg·L-1室温24hRSD/%处理后室温24hRSD/%冷冻20dRSD/%反复冻融3次RSD/%202.513.6710.132.7853.772.4819.014.211.254.084.2224.192.58
3.5 干扰性试验 测得的美罗培南、头孢曲松和头孢他啶3种药物的保留时间分别为3.47,2.84和3.13min,与利奈唑胺的保留时间相差较远,对利奈唑胺测定无影响。见图2。
3.6 治疗药物监测 8名神经外科患者诊断为颅内感染或肺部感染,已使用利奈唑胺(剂量均为600mg,ivgtt,q12h),因诊断或治疗需要行腰穿或脑室引流时抽取脑脊液测定,每位患者测定次数为1~5次。患者基本信息及脑脊液中利奈唑胺质量浓度测定结果见表3。其中6名患者细菌培养呈阳性,利奈唑胺对致病菌的最低抑菌质量浓度(MIC,纸片法测定,测定结果由我院微生物室提供)均为1或2mg·L-1。8例患者共测定27例次,测得脑脊液中利奈唑胺平均质量浓度为2.67±1.11mg·L-1,患者转归情况均为治愈或好转。
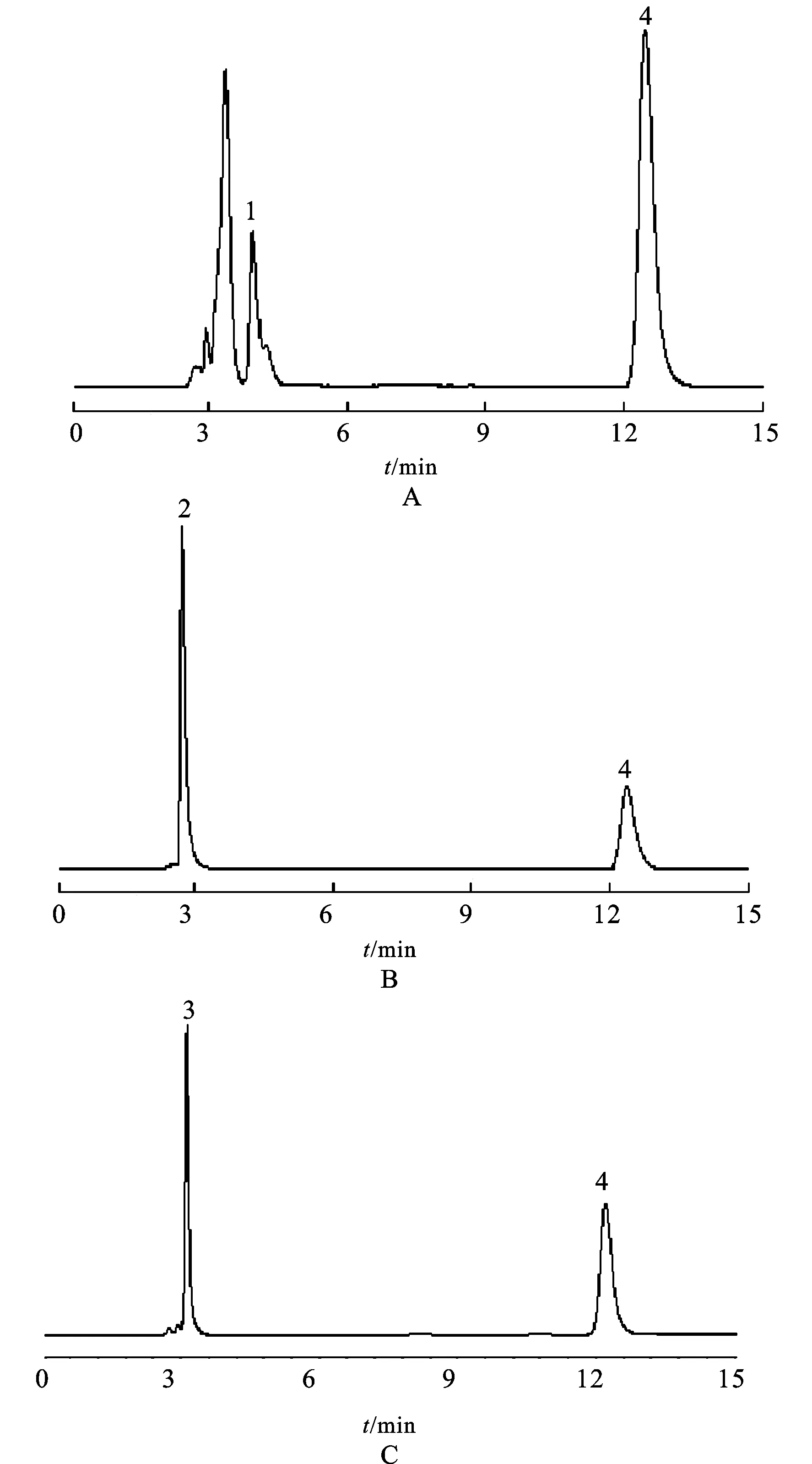
图2 药物干扰性试验
A.含美罗培南和利奈唑胺的脑脊液样品;B.含头孢曲松的和利奈唑胺的脑脊液样品;C.含头孢他啶和利奈唑胺的脑脊液样品;1.美罗培南;2.头孢曲松;3.头孢他啶;4.利奈唑胺
Fig.2Interferenceexperiments
A.cerebrospinalfluidcontainingmeropenemandlinezolid;B.cerebrospinalfluidcontainingceftriaxoneandlinezolid;C.cerebrospinalfluidcontainingceftazidimeandlinezolid;1.meropenem; 2.ceftriaxone; 3.ceftazidime; 4.linezolid
表3 患者基本信息及其脑脊液中利奈唑胺质量浓度
Tab.3Patientsinformationandmonitorresultsoflinezolidlevelincerebrospinalfluid

序号性别年龄体质量/kg诊断脑脊液质量浓度测定次数范围/mg·L-1与MIC值比较治疗转归1女5450面肌痉挛术后;颅内感染32.08~4.13>MIC治愈2男6758化脓性脑膜炎22.76~4.52>MIC治愈3男3875脑胶质瘤术后;颅内感染41.55~2.64>MIC好转4女7053脑出血术后;颅内感染52.07~4.45未测定好转5男2977开放性颅脑损伤;颅内感染50.82~1.98
4 讨论
本研究在李淑娟等[7]建立的利奈唑胺脑脊液质量浓度测定方法的基础上,对色谱条件进行了调整,结果显示,该方法所得利奈唑胺峰形好,与内源性物质分离完全,定量限、精密度和回收率等均能达到试验要求。同时,我们增加了干扰性试验,将常用于中枢神经系统感染的抗革兰阴性菌药物头孢曲松、头孢他啶和美罗培南加入到样品溶液中,结果发现上述3种药物对脑脊液中利奈唑胺质量浓度的测定均无影响。因此,该方法适用于监测中枢神经系统感染患者脑脊液中利奈唑胺的质量浓度。
本研究中8名中枢神经系统感染患者均使用了相同剂量的利奈唑胺(600mg,q12h)测定谷质量浓度。结果表明,8名患者的脑脊液谷质量浓度范围在0.82~4.52mg·L-1之间,个体差异较大,平均质量浓度为2.67±1.11mg·L-1,与文献[8-9]结果相似。对于产生个体差异的原因,YogevR等[8]认为与脑膜炎性程度、年龄关系均不大,可能与不同患者脑积水程度不同而导致与脑脊液容积差异有关,但由于他们并未测定脑脊液容积,所以对此相关性并未确立;同时他们的数据显示,不同患者利奈唑胺在血浆中药物质量浓度差异也非常大,因此推测其他影响利奈唑胺组织分布的因素可能影响了脑脊液中质量浓度。在国内,张雷[10]开展了利奈唑胺在中国人群的群体药代/药效动力学研究,结果表明,体质量可能是影响利奈唑胺血药质量浓度的重要因素。本研究中体质量较轻的女性患者脑脊液质量浓度较其他高,原因可能类似,但由于样本量小,暂不能得出上述结论。另外,8名患者治疗结果均较好,其中有5例患者利奈唑胺脑脊液中谷质量浓度均高于其对病原菌的MIC值,1名患者多次测定谷质量浓度仍低于MIC,但最终也达到了较好的效果,其原因可能是脑脊液中利奈唑胺消除时间较血浆中长,经多次给药后脑脊液中药物蓄积,质量浓度不断升高并最终达到有效治疗质量浓度[7]。因此,后续的研究中,有必要扩大检测例数,对于有脑脊液引流或行多次腰椎穿刺的患者,测定多个时间点的药物质量浓度,并与患者的性别、年龄、身高、体质量、血肌酐、肝功能分级、脑脊液体积、是否手术和治疗结局等做相关性分析,以获得利奈唑胺在脑脊液中的动力学数据并了解其影响因素,为利奈唑胺治疗中枢神经系统感染提供指导。
[1] 范洪伟,吴东,吕玮,等. 热病:桑福德抗微生物治疗指南[M].42版,北京:中国协和医科大学出版社,2012:86.
[2] 曾晓艳,张祎,仝晓宁,等. 2 743株革兰阳性菌的临床分离及耐药性分析[J]. 西北药学杂志,2014,29(5):519-521.
[3] 杨华,董海燕,刘青,等. 利奈唑胺的药物利用评价[J]. 西北药学杂志,2010,25(5): 374-376.
[4]DrydenMS.Linezolidpharmacokineticsandpharmacodynamicsinclinicaltreatment[J].JAntimicrobChemother,2011;66(Suppl4):iv7-iv15.
[5]NtzioraF,FalagasME.Linezolidforthetreatmentofpatientswithcentralnervoussysteminfection[J].AnnPharmacother,2007;41(2):296-308.
[6]RupprechtTA,PfisterHW.Clinicalexperiencewithlinezolidforthetreatmentofcentralnervoussysteminfections[J].EurJNeurol,2005,12(7):536-542.
[7] 李淑娟,马彦,张弋. 高效液相色谱法测定人脑脊液中利奈唑胺浓度[J]. 中国医院药学杂志,2012,32(10):785-788.
[8]YogevR,DamleB,LevyG,etal.Pharmacokineticsanddistributionoflinezolidincerebrospinalfluidinchildrenandadolescents[J].PediatrInfectDisJ,2010,29(9):827-830.
[9]ViaggiB,PaoloAD,DanesiR,etal.Linezolidinthecentralnervoussystem:comparisonbetweencerebrospinalfluidandplasmapharmacokinetics[J].ScandJInfectDis,2011,43(9):721-727.
[10]张雷.利奈唑胺在中国人群的群体药代/药效动力学研究[D]. 北京:军医进修学院解放军总医院,2011:50.
Establishment and clinical application of determination method of linezolid concentration in human cerebrospinal fluid
CAIYan,ZHANGLi,LIHaiyan,MAXiaoya,ZHANGKanghuai
(DepartmentofPharmacy,theSecondAffiliatedHospitalofXi′anJiaotongUniversity,Xi′an710004,China)
ObjectiveToestablishamethodforthedeterminationoflinezolidconcentrationinhumancerebrospinalfluidandapplythismethodtodeterminelinezolidconcentrationincerebrospinalfluidofintracranialinfectionpatients.MethodsReversedphasehigh-performanceliquidchromatographywasselectedandexternalstandardmethodwasused.TheseparationwasperformedonanAgilent5TC-C18(2) (250mm×4.6mm)chromatographiccolumn,mobilephasewasconsistedofmethanol-water(40∶60)withaflowrateof1.0mL·min-1.Thecolumntemperaturewas25 ℃andtheUVdetectionwavelengthwas250nm.Thelinezolidconcentrationwasdetectedinthecerebrospinalfluidofintracranialinfectionpatients.ResultsThecalibrationcurveoflinezolidshowedgoodlinearity(r=0.999 6)inthedruglevelrangefrom0.31mg·L-1to40mg·L-1andtheminimumquantitationlimitwas0.31mg·L-1.Theabsoluterecoveryandtherelativerecoveryratewereabove85%andtheintra-dayandinter-dayvariationwasbelow5%.Meropenem,ceftriaxoneandceftazidimehadnoinfluenceinthedeterminationoflinezolid.Thelinezolidconcentrationinthecerebrospinalfluidofintracranialinfectionpatientswas2.67±1.11mg·L-1.ConclusionThemethodwassimple,convenient,sensitiveandaccurate,itcanbeusedformonitoringlinezolidconcentrationofcerebrospinalfluid.Thelinezolidconcentrationinthecerebrospinalfluidvariedindifferentpatients.
linezolid;cerebrospinalfluid;centralnervoussysteminfection;HPLC
西安交通大学临床新技术项目(编号:XJLS-2015-313);西安交通大学第二附属医院科研基金青年项目(编号:YJ(QN)201309)
10.3969/j.issn.1004-2407.2016.06.009
R
A
2016-01-12)
