啶氧菌酯降解菌的分离鉴定及其降解特性
2016-11-21吴龙飞罗香文李梦晴张德咏
吴龙飞,罗香文,,刘 勇,,李梦晴,杜 娇,张德咏,,∗
(1.湖南农业大学植物保护学院,湖南长沙410128;2.湖南省植物保护研究所,湖南长沙410125)
啶氧菌酯降解菌的分离鉴定及其降解特性
吴龙飞1,罗香文1,2,刘 勇1,2,李梦晴1,杜 娇2,张德咏1,2,∗
(1.湖南农业大学植物保护学院,湖南长沙410128;2.湖南省植物保护研究所,湖南长沙410125)
通过富集培养法筛选分离到1株能以啶氧菌酯为唯一碳源的降解菌株PID-1,采用形态学、生理生化方法,并结合16S rDNA序列系统发育分析,将菌株PID-1初步鉴定为沼泽红假单胞菌(Rhodopseudomonas palustris)。菌株PID-1降解啶氧菌酯的最佳条件为pH 7和35℃。在该降解条件下,培养5 d,菌株PID-1对100 mg·L-1啶氧菌酯的降解率可达83.54%。将啶氧菌酯经PID-1降解后的物质经质谱扫描,通过谱库检索,发现其降解中间产物包括1-(1,5-dimethylhexyl-)-4-methyl-benzene、2,5-bis(1,1-dimethylethyl)-phenol、butyl 2-methyoxyethyl ester、bis(tert-butyldimethylsilyl)ester、1-(3-n-propoxyphenyl)-2-propanone oxime和2-nitro-4-(trifluoromethyl)phenol。
啶氧菌酯;沼泽红假单胞菌;降解途径
啶氧菌酯是一种甲氧基丙烯酸酯类广谱、内吸性杀菌剂,在我国2008年获得临时登记,主要用于防治麦类叶面病害,如座枝孢属(Ramulispora)导致的叶斑病等[1]。与现有甲氧基丙烯酸酯类杀菌剂,如嘧菌酯、肟菌酯等相比,啶氧菌酯对座枝孢属(Septoria)、丝核菌属(Rhizoctonia)等导致的小麦病害有更强的防治效果[2]。在我国,啶氧菌酯还用于水稻稻曲病等病害的防治[3]。啶氧菌酯的使用范围和使用量在我国正逐步上升。
推荐剂量的啶氧菌酯在香蕉和土壤中的半衰期分别为10.7~12.1和12.5~13.4 d,若按1.5倍推荐剂量施用,15 d后其在香蕉和土壤中的残留量为0.686和0.159 mg·kg-1,表明啶氧菌酯的残留期较长[4]。啶氧菌酯能够抑制啤酒酵母(Saccharomyces cerevisiae)的生长[5],对土壤微生物的呼吸作用及土壤微生物结构具有不可逆转的影响[6]。4倍推荐剂量的啶氧菌酯能够显著降低家蚕的全茧量和茧层量[7],且啶氧菌酯对斑马鱼的急性毒性为高毒,即使低浓度长时间暴露,对斑马鱼亦具有慢性毒性。可以推测,高浓度的啶氧菌酯对非靶标生物和环境具有潜在的毒性风险。
以生物修复(bioremediation)为理论支撑的农药残留物降解修复技术,为降低或清除农产品和农田生态环境中的化学农药残留污染物提供了新颖的技术措施,具有修复效率高、环境兼容性好、无二次污染等特点,且修复成本低,操作简易,目前是国内外去除农药残留污染研究的热点技术之一[8]。甲氧基丙烯酸酯类杀菌剂的微生物降解目前仅见少量报道[9],啶氧菌酯的微生物降解资源筛选及降解机理研究鲜见报道。为此,特采用富集培养、定向驯化的方法筛选啶氧菌酯降解菌资源,并研究其降解啶氧菌酯的机制,为啶氧菌酯潜在的残留污染提供有用微生物资源。
1 材料与方法
1.1 主要培养基
微生物筛选分离培养基(无碳源MM培养基):(NH4)2SO42.0 g·L-1,MgSO4·7H2O 0.2 g· L-1,CaCl2·2H2O 0.01 g·L-1,FeSO4·7H2O 0.001 g·L-1,Na2HPO4·12H2O 1.5 g·L-1,KH2PO41.5 g· L-1,pH 7.2[10];选择培养基:在MM培养基中加入一定浓度的啶氧菌酯;固体培养基:在相应液体培养基中添加1.5%琼脂。
1.2 主要仪器
JEXL-230扫描电子显微镜,日本电子公司;Tu-1901分光光度计,北京普析通用仪器有限责任公司;6890N/5975气质联用仪,Agilent;5810R冷冻高速离心机,Eppendorf;Mili QA-10纯水系统,Millipore;Alpha Imager凝胶成像系统,HP;PGX-150A光照培养箱,北京中联科仪科技有限公司。
1.3 降解菌的分离、筛选
将采自不同地区农田排水渠的污泥2.0 g加入120 mL以20 mg·L-1啶氧菌酯作为唯一碳源的选择培养基中,置于3 000 lx、35℃光照培养箱中,培养至浑浊(5~7 d)后,取5 mL菌液加入120 mL以40 mg·L-1啶氧菌酯作为唯一碳源的选择培养基中,同等条件下培养;重复该步骤,直至加入120 mL以100 mg·L-1啶氧菌酯作为唯一碳源的选择培养基中,培养至浑浊。然后,取200 μL培养液涂布到含100 mg·L-1啶氧菌酯的选择性固体培养基中。挑取菌落形态不同的菌,分别接种到含啶氧菌酯、甲氰菊酯100 mg·L-1的选择性液体培养基中,培养至浑浊(3~5 d)。采用分光光度计测定菌液浊度,计算菌液的菌落含量(colony forming unit,cfu),调整菌液的菌落总数达到109cfu·mL-1,作为后续试验接种液。
1.4 菌株鉴定
1.4.1 电镜样品制备及观察
将细菌溶液反复离心收集沉淀,2.5%戊二醛固定,经磷酸缓冲液洗涤,1%锇酸固定2 h,反复洗涤离心后梯度酒精脱水,树脂渗透包埋。经60℃烘箱加热聚合、切片后,扫描电子显微镜观察拍照。
1.4.2 生理生化指标测定
参照《伯杰氏细菌鉴定手册》[11]检测筛选细菌资源的各种生理生化指标。
1.4.3 菌体吸收光谱的测定
取1.5 mL培养浑浊的细菌培养液,8 000 r· min-1离心洗涤3次,用60%蔗醣溶液重悬浮,分光光度计上300~900 nm扫描。
1.4.4 菌体16S rDNA序列的测定
细菌基因组提取采用UNIQ-10柱式基因组DNA抽提试剂盒(上海生工生物工程技术服务有限公司),具体操作方法参见使用说明书。以所提的细菌总DNA为模板,采用细菌16S rDNA通用引物进行序列扩增[12],PCR反应体系(总体积50μL):10×PCR buffer 2.5μL;MgCl22μL;dNTP 1 μL;引物 (27F,agagtttgatcctggctcag;1492R,ggttaccttgttacgactt)各0.5μL;Taq酶(5 U·μL-1)0.5μL;双蒸水43μL。PCR扩增程序为:94℃,4 min;94℃,1 min,50℃,1 min,72℃,1 min,30个循环;72℃,10 min。PCR反应完成后,经1%琼脂糖凝胶电泳检测扩增片断。测序由上海生工生物工程技术服务有限公司进行。
测定的16S rDNA序列在GenBank中利用BLAST进行比对,比较其序列同源性。利用Mega 5软件进行多序列联配,构建系统发育树[13]。
1.5 降解特性测定
1.5.1 啶氧菌酯残留量
啶氧菌酯残留量采用 LE-HPLC方法测定[14]。
1.5.2 啶氧菌酯降解途径
啶氧菌酯降解中间代谢产物采用气相色谱-质谱(GC-MS)鉴定[15]。鉴定条件:全扫描,质量范围50~550 amu;电子轰击能70 eV;色谱柱HP-5MS(30 m×0.25 mm×0.25μm),进样口温度220℃,氦气流量1.0 mL·min-1。升温程序:初始温度120℃,保持3min,以10℃·min-1的速度升温至200℃,再以5℃·min-1的速度升温,终止温度250℃,保持5 min;离子源温度230℃;四极杆温度150℃。
2 结果与分析
2.1 啶氧菌酯降解菌筛选分离
以啶氧菌酯为唯一碳源的MM培养基,经过富集培养,培养液逐步浑浊,呈现不同的颜色,表明有不同的微生物能够利用啶氧菌酯作为唯一碳源进行生长。
将富集培养得到的菌液划线培养,进行单胞分离。在固体培养基平板上,得到了不同颜色、不同菌落直径的菌落。本研究选择菌落最大的一个红色菌落,命名为PID-1,进行后续的鉴定及降解特性研究。
2.2 啶氧菌酯降解菌株PID-1鉴定
啶氧菌酯降解菌株PID-1的扫描电镜结果(图1)表明,菌株PID-1的形状为短杆状,细胞大小为(0.3~0.6)μm×(2.5~3.4)μm,以二分裂方式繁殖。

图1 菌株PID-1扫描电镜图Fig.1 Morphology of strain PID-1 by scanning electron microscope
生理生化试验结果表明,菌株PID-1为革兰氏阴性(G-),H2S反应阳性,V.P反应阴性,吲哚试验阳性,甲基红反应阴性,不能利用淀粉,能液化明胶。碳源利用试验(表1)表明,菌株PID-1可以利用多种碳源,其中,酵母膏是最佳碳源;能利用部分醇类化合物如肌醇、丙三醇等进行生长,也可利用小分子有机酸如丙酮酸等生长。

表1 菌株PID-1碳源利用试验结果Table 1 Carbon utilization capacity of strain PID-1
菌体色素扫描结果(图2)表明,在880、820、580和360 nm处有典型的吸收峰,表明菌株PID-1菌体含有菌绿素和类胡萝卜素。化特点,并结合16S rDNA序列系统发育分析(图3),依据《伯杰氏细菌鉴定手册》[11],将菌株PID-1初步鉴定为沼泽红假单胞菌(Rhodopseudomonas palustris)。

图2 菌株PID-1菌体色素吸收光谱Fig.2 Absorption spectrum of pigments of strain PID-1
根据菌株PID-1形态特征、菌体色素、生理生
2.3 菌株啶氧菌酯降解特性
2.3.1 发酵培养基初始pH对菌株降解啶氧菌酯的影响
在pH分别为4、5、6、7、8、9的120 mL MM培养基中,加入100 mg·L-1的啶氧菌酯和0.5%的PID-1菌液,光照培养5 d后取样,样品经萃取后,采用LE-HPLC方法检测啶氧菌酯的残留量。图4结果表明,当pH值在6~8之间时,菌株PID-1降解啶氧菌酯的效能较好,降解啶氧菌酯的最适pH为7,降解效率可达76.56%。

图3 菌株PID-1 16S rDNA序列系统发育分析Fig.3 Phylogenetic analysis of 16S rDNA sequence of strain PID-1

图4 发酵培养基初始pH对菌株PID-1降解啶氧菌酯的影响Fig.4 Effects of initial pH of media on picoxystrobin degradation by strain PID-1
2.3.2 发酵温度对菌株降解啶氧菌酯的影响
在以100 mg·L-1的啶氧菌酯为碳源的120 mLMM培养基(pH 7)中,接种0.5%的PID-1菌液,不同温度下(15~55℃)光照培养5 d后,采用LE-HPLC方法测定啶氧菌酯残留量。图5表明,当温度为25~45℃时,菌株PID-1具有较好的啶氧菌酯降解能力;其中,降解啶氧菌酯的最适温度为35℃。温度过高(55℃)或过低(15℃)都会显著降低菌株PID-1降解啶氧菌酯的能力,特别是当温度低于15℃时,菌株PID-1降解100 mg·L-1啶氧菌酯的效率仅为19.52%。

图5 温度对菌株PID-1降解啶氧菌酯的影响Fig.5 Effects of temperature on picoxystrobin degradation by strain PID-1
2.3.3 降解动态
在以100 mg·L-1的啶氧菌酯为碳源的120 mL MM培养基中,接种0.5%的PID-1菌液,在35℃、初始pH值7条件下进行光照培养,定期取样,采用LE-HPLC方法测定啶氧菌酯残留量,获得菌株PID-1在最适条件下降解啶氧菌酯的动态结果(图6)。培养液中的啶氧菌酯含量在培养初期(2 d)降低较慢,随后,啶氧菌酯的含量快速降低,表明菌株对啶氧菌酯的降解率3 d后快速上升。菌株PID-1在最适降解条件下,培养5 d,对 100 mg·L-1啶氧菌酯的降解率可达83.54%。

图6 菌株PID-1降解啶氧菌酯的动态过程Fig.6 Degradation dynamics of picoxystrobin by strain PID-1
2.4 啶氧菌酯降解机制
2.4.1 啶氧菌酯降解中间产物
菌株PID-1降解啶氧菌酯的质谱(mass spectrum)扫描结果(图7)表明,随着培养时间的延长,啶氧菌酯的相对丰度逐步降低;在质谱图上,随着啶氧菌酯的逐步降解,质谱图上出现一系列的中间代谢产物的质谱峰(3 d),继续培养,一些中间代谢产物的质谱峰消失,表明这些中间代谢产物继续被降解,但仍有部分代谢产物没有被降解(5 d)。
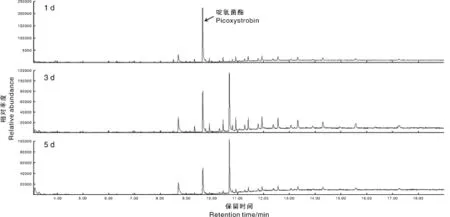
图7 菌株PID-1降解啶氧菌酯代谢产物质谱扫描图Fig.7 Mass scanning of degrading metabolics of picoxystrobin by strain PID-1
菌株PID-1降解啶氧菌酯的质谱(mass spectrum)扫描后,经过谱库检索,啶氧菌酯的降解中间产物(图8)包括:1-(1,5-dimethylhexyl-)-4-methyl-benzene,保留时间3.943 min;2,5-bis(1,1-dimethylethyl)-phenol,保留时间6.313 min;butyl 2-methyoxyethyl ester,保留时间8.720 min;bis(tert-butyldimethylsilyl) ester,保留时间 9.330 min;1-(3-n-propoxyphenyl)-2-propanone oxime,保留时间9.339 min;2-nitro-4-(trifluoromethyl)phenol,保留时间10.689 min。
2.4.2 啶氧菌酯降解途径
根据菌株PID-1降解啶氧菌酯中间代谢产物的质谱检测分析结果,推测啶氧菌酯可能的降解途径如图9所示,啶氧菌酯的—O—键先断裂,然后苯环上的侧链氧化,还包含有苯环开环反应等降解步骤。

图8 菌株PID-1降解啶氧菌酯代谢产物Fig.8 Degradation metabolics of picoxystrobin by strain PID-1
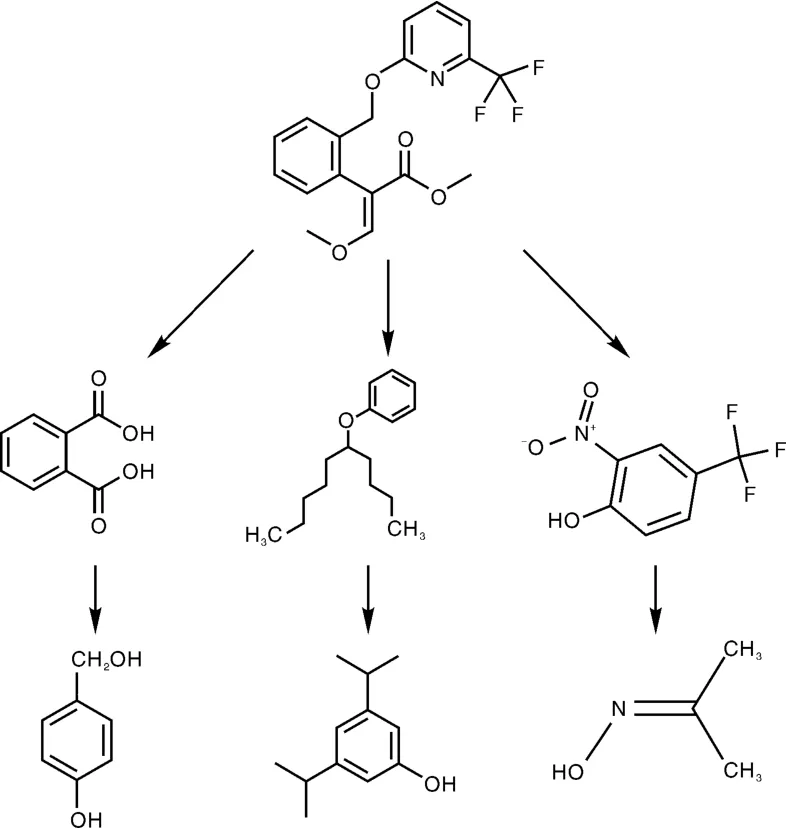
图9 菌株PID-1降解啶氧菌酯可能的降解途径Fig.9 Possible degradation pathway of picoxystrobin by strain PID-1
3 结论与讨论
通过富集培养法筛选分离获得一株能以啶氧菌酯为唯一碳源的降解菌株PID-1,经形态学、生理生化方法结合16S rDNA序列系统发育分析,将菌株 PID初步鉴定为沼泽红假单胞菌(Rhodopseudomonas palustris)。菌株 PID-1降解啶氧菌酯的最佳条件为pH 7和35℃,在该降解条件下,培养5 d,菌株PID-1对100 mg·L-1啶氧菌酯的降解率可达83.54%。
菌株 PID-1初步鉴定为沼泽红假单胞菌(Rhodopseudomonas palustris),是光合细菌中重要的细菌资源之一。在化学农药及有机污染物残留的生物修复研究中,光合细菌资源筛选分离及降解特性的研究报道较少,迄今为止,仅有光合细菌降解有机磷农药残留物[16]、硫代磷酸酯类农药残留物[17]、菊酯类农药残留物[18],以及磺酰脲类除草剂残留物[19]的报道。光合细菌已被大量研究证实是一种益生菌,具有良好的促进作物抗逆性和刺激作物生长的作用[20],因此,筛选光合细菌降解菌将具有较好的应用潜力。
甲氧基丙烯酸酯类杀菌剂残留物的微生物降解研究方面,目前仅见的醚菌酯残留物降解菌资源包括贪铜离菌(Cupriacidu sp.)和产黄杆菌(Rhodanobacter sp.),这2个菌株均能将嘧菌酯完全降解为CO2,同时具有较宽的降解谱,还能降解肟菌酯、唑胺菌酯和醚菌酯[9]。利用芽孢杆菌等多种菌株的复合微生物还能够降解多种甲氧基丙烯酸酯类杀菌剂[21]。但啶氧菌酯的微生物降解资源的分离、降解特性及降解机理等还需开展进一步的研究。降解机理研究表明,微生物降解甲氧基丙烯酸酯类杀菌剂的主要作用基因为甲氧基丙烯酸酯甲基酯酶基因[22]。根据菌株PID-1降解啶氧菌酯中间代谢产物的质谱检测和分析,推导啶氧菌酯的降解途径为:啶氧菌酯的—O—键先断裂,然后苯环上的侧链氧化,并包含有苯环开环反应等降解步骤。
(
):
[1] MALIN′SKI Z T.Studies on in vitro activity of picoxystrobin and its mixtures with other fungicides against Ramulispora herpotrichoides and Ramulispora acuformis[J].Pestycydy,2008(1/2):75-86.
[2] GAURILCˇIKIENE·I,RONISA.The effectof strobilurin fungicides on the development of foliar diseases of winter wheat[J].Agronomy Research,2006(Suppl.1):177-180.
[3] 阮宏椿,杨秀娟,石妞妞,等.不同杀菌剂对水稻稻曲病菌的室内毒力及田间药效[J].福建农业学报,2013,28(6):580-583.
RUAN H C,YANG X J,SHIN N,et al.Toxicity and field efficiency of several fungicides against Ustilaginoidea virens[J].Fujian Journal of Agricultural Sciences,2013,28(6):580-583.(in Chinese with English abstract)
[4] WANG Y,YANG Y,ZHOUQ,etal.Dissipation and residue of picoxystrobin in banana and soil under field conditions[J]. Polish Journal of Environmental Studies,2014,23(4):1361 -1365.
[5] FAIP B,GRANT A.A rapid resazurin bioassay for assessing the toxicity of fungicides[J].Chemosphere,2009,74(9):1165-1170.
[6] STENRØD M,KLEMSDAL SS,NORLIH R,et al.Effects of picoxystrobin and 4-n-nonylphenol on soil microbial community structure and respiration activity[J].PloSONE,2013,8(6):e66989.
[7] 谢道燕,杨振国,田梅金,等.7种杀菌剂对桑树及家蚕的安全性评价[J].中国农学通报,2014,30(22):310 -315.
XIE D Y,YANG Z G,TIAN M J,et al.Safety evaluation of seven fungicides to Morus alba and Bombyx mor[J].Chinese Agricultural Science Bulletin,2014,30(22):310-315.(inChinese with English abstract)
[8] MAJONE M,VERDINI R,AULENTA F,et al.In situ,groundwater and sediment bioremediation:barriers and perspectives at European contaminated sites[J].New Biotechnology,2015,32(1):133-146.
[9] HOWELL C C,SEMPLE K T,BENDING G D.Isolation and characterisation of azoxystrobin degrading bacteria from soil[J].Chemosphere,2013,95(1):370-378.
[10] CYCON′M,WÓJCIKM,PIOTROWSKA-SEGETZ.Biodegradation of the organophosphorus insecticide diazinon by Serratia,sp.and Pseudomonas,sp.and their use in bioremediation of contaminated soil[J].Chemosphere,2009,76(4):494-501.
[11] HOLT JG.Bergrey's manual of determinative bacteriology[M]. 9th eds.Baltimore:The Willianms&Wilkin s,1993.
[12] UEYAMA J,KIMATA A,KAMIJIMA M,etal.Urinary excretion of 3-phenoxybenzoic acid in middle-aged and elderly general population of Japan[J].Environmental Research,2009,109(2):175-180.
[13] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis usingmaximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology&Evolution,2011,28(10):2731 -2739.
[14] 张继伟,张博,冯文英,等.啶氧菌酯原药中主要杂质的制备、鉴定和定量分析[J].世界农药,2015(4):50 -54.
ZHANG JW,ZHANG B,FENGW Y,et al.Synthesis,identification and quantitative analysis of the main impurity of picoxystrobin[J].World Pesticides,2015(4):50-54.(in Chinese with English abstract)
[15] ZHANGS,YIN L,LIU Y,etal.Cometabolic biotransformation of fenpropathrin by Clostridium species strain ZP3[J]. Biodegradation,2011,22(5):869-875.
[16] 张德咏,谭新球,罗香文,等.一株能降解有机磷农药甲胺磷的光合细菌HP-1的分离及生物学特性的研究[J].生命科学研究,2005,9(3):247-253.
ZHANG D Y,TAN X Q,LUO XW,et al.Isolation of photosynthetic bacteria HP-1 with degradation of organic-phosphorus insecticides and studies on its biodegradation ability and capacity of increasing growth[J].Life Science Research,2005,9(3):247-253.(in Chinese with English abstract)
[17] 李乐,李兰生,孙涛,等.固定化光合细菌降解氧化乐果[J].农业环境科学学报,2006,25(增刊):721-724.
LIL,LILS,SUN T,etal.Degradation of omethoate by immobilized photosynthetic bacteria[J].Journal of Agro-Environment Science,2006,25(Suppl.):721-724.(in Chinese with English abstract)
[18] ZHANG S B,ZHANG D Y,YONG L,et al.Degradation characteristics and pathway of fenpropathrin by Rhodopseudomonas sp.strain PSB07-6.[J].Fresenius Environmental Bulletin,2009,18(11):2060-2065.
[19] YIN L B,LIU Y,ZHANG D Y,et al.Isolation and characterization of Rhodopseudomonas sp.S9-1 capable of degrading pyrazosulfuron-ethyl[J].Advanced Materials Research,2011,356-360:1152-1163.
[20] 揭晶,赵越.光合细菌应用的研究进展[J].广东药学院学报,2006,22(1):113-114.
JIE J,ZHAO Y.Research progress on application of photosynthetic bacteria[J].Journal of Guangdong College of Pharmacy,2006,22(1):113-114.(in Chinese)
[21] WOL/EJKO E,L/OZOWICKA B,KACZYN′SKIP,et al.The influence of effective microorganisms(EM)and yeast on the degradation of strobilurins and carboxamides in leafy vegetables monitored by LC-MS/MS and health risk assessment[J].Environmental Monitoring and Assessment,2016,188:64.
[22] CLINTON B,WARDEN A C,HABOURY S,etal.Bacterial degradation of strobilurin fungicides:a role for a promiscuous methyl esterase activity of the subtilisin proteases?[J]. Biocatalysis&Biotransformation,2011,29(4):119-129.
(责任编辑 高 峻)
Isolation and degrading characteristics of picoxystrobin degrading strain
WU Long-fei1,LUO Xiang-wen1,2,LIU Yong1,2,LIMeng-qing1,DU Jiao2,ZHANG De-yong1,2,∗
(1.College of Plant Protection,Hunan Agricultural University,Changsha 410128,China;2.Hunan Plant Protection Institute,Changsha 410125,China)
The strain PID-1 was screened and isolated by enrichment culture,and was primarily identified as Rhodopseudomonas palustris based on morphology,physiological and biochemical characteristics as well as phylogenetic analysis of 16S rDNA sequences.The optimal degrading conditions of PID-1 were pH 7 and 35℃.Under this condition,up to 83.54%of 100 mg·L-1picoxystrobin could be degraded by PID-1.Themetabolics of picoxystrobin degraed by PID-1 were identified bymass spectrum as 1-(1,5-dimethylhexyl-)-4-methyl-benzene,2,5-bis(1,1-dimethylethyl)-phenol,butyl2-methyoxyethyl ester,bis(tert-butyldimethylsilyl)ester,1-(3-n-propoxyphenyl)-2-propanone oxime and 2-nitro-4-(trifluoromethyl)phenol.
picoxystrobin;Rhodopseudomonas palustris;degrading pathway
X592
A
1004-1524(2016)09-1550-08
10.3969/j.issn.1004-1524.2016.09.14
2016-04-19
公益性行业(农业)科研专项(201203098);国家自然科学基金(31272067);现代农业产业技术体系专项资金(CARS-25-B-05)
吴龙飞(1990—),男,湖南郴州人,硕士研究生,主要研究方向为农田污染物生物修复。E-mail:wlf814@163.com
∗通信作者,张德咏,E-mail:dyzhang78@163.com
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(9):1550-1557 http://www.zjnyxb.cn吴龙飞,罗香文,刘勇,等.啶氧菌酯降解菌的分离鉴定及其降解特性[J].浙江农业学报,2016,28(9):1550-1557.
