西瓜根际土壤酶及微生物对小麦伴生的响应
2016-11-21徐伟慧吴凤芝2
徐伟慧,吴凤芝2,∗
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔161006;2.东北农业大学园艺学院,黑龙江哈尔滨150030)
西瓜根际土壤酶及微生物对小麦伴生的响应
徐伟慧1,2,吴凤芝2,∗
(1.齐齐哈尔大学生命科学与农林学院,黑龙江齐齐哈尔161006;2.东北农业大学园艺学院,黑龙江哈尔滨150030)
连作障碍是限制设施西瓜生产的重要因素,合理地运用地上部生物多样性是解决连作障碍的有效手段。为探讨连作西瓜根际土壤酶活性和微生物对小麦伴生的响应,采用连作西瓜土壤进行盆栽试验,设置D123小麦伴生西瓜、D125小麦伴生西瓜、西瓜单作和无苗对照4个处理,研究土壤酶活性、微生物区系和微生物生物量碳、氮、磷对小麦伴生的响应。结果表明,D123小麦伴生处理的根际土壤微生物总数和放线菌数量分别比西瓜单作增加了45.21%和130.20%,根际土壤放线菌的比例比西瓜单作增加了7.6%;D125小麦伴生处理的根际土壤细菌数量比西瓜单作增加了40.89%,根际细菌的比例比西瓜单作增加了10.81%。同时,两种小麦伴生处理均降低了西瓜根际土壤真菌的比例,提高了西瓜根际微生物生物量碳、氮、磷含量,降低了微生物生物量碳氮比,提高了多酚氧化酶和蔗糖酶活性。可见,连作西瓜根际对小麦伴生产生了积极的响应。
连作障碍;小麦伴生西瓜;根际;微生物生物量;微生物区系;土壤酶
近年来,西瓜[Citrullus lanatus(Thunb)Matsum&Nakai]设施栽培面积不断扩大,其连作障碍日益凸显,导致土壤养分失衡,土壤酶活性降低,土壤微生物种群失衡,致使土地可持续利用能力下降[1-2]。前人研究表明,合理的间、轮、套作、伴生能改善土壤酶活性与微生物区系,有效缓解连作障碍[3-5]。间作可以提高土壤酶活性,提高地力[6]。郭晓霞等[7]证实,土壤微生物生物量碳、氮、磷可直观地反映土壤微生物活性和土壤肥力状况。伴生栽培是指在主栽作物一侧种植经过特殊挑选的具有某种相生相克性状的植物,且不以其作为收获目的的栽培方式。小麦与黄瓜伴生能降低黄瓜病害,提高黄瓜产量[8]。研究发现,小麦根系分泌物能有效抑制西瓜专化型尖孢镰刀菌菌丝生长[9],促进西瓜根系生长[10],且小麦伴生能有效控制西瓜枯萎病。然而,连作西瓜根际土壤酶活性、微生物生物量、微生物区系能否对小麦伴生产生响应,目前尚未见报道。因此,本研究通过盆栽实验研究连作西瓜土壤环境下,西瓜根际土壤酶活性、微生物群落结构及微生物生物量对小麦伴生的响应,为小麦伴生西瓜栽培模式应用及阐释其缓解西瓜连作障碍机制提供理论依据。
1 材料与方法
1.1 供试材料
西瓜品种为京欣1号,种子购于北京多又奇科贸有限公司;小麦品种D125
[11]和 D123
[9],由东北农业大学园艺学院蔬菜生理生态研究室提供,D123小麦根系分泌物能有效抑制西瓜专化型尖孢镰刀菌菌丝生长[9],D125小麦根系分泌物能促进西瓜根系生长[10]。
供试土壤采自哈尔滨市香坊农场,西瓜连作3年且土壤已感染了大量的西瓜枯萎病菌。土壤的基本理化性质为:EC 1.27 mS·cm-1,pH 7.23,有效磷378.80 mg·kg-1,碱解氮357 mg·kg-1,有机质35.90 g·kg-1,速效钾107.5 mg·kg-1。
1.2 试验方法
试验设4个处理:D123小麦伴生西瓜(D123)、D125小麦伴生西瓜(D125)、西瓜单作(CK)和不栽种任何植物(CW)。西瓜采用常规育苗,待西瓜长至4叶1心时定植到盆(20 cm×17 cm)中,D125和D123小麦伴生处理每盆种植1株西瓜苗,同时在西瓜苗一侧5~7 cm处分别撒播30粒左右D125小麦和D123小麦种子,小麦长至20 cm左右时留5 cm茬口割掉,以不影响西瓜生长为准。另设不栽培任何植物的西瓜连作土为无苗对照(CW)。每个处理分3个重复,每个重复10盆,随机排列,试验期间不喷洒任何药剂,不施加任何肥料,人工除草,其余正常管理。小麦伴生处理和西瓜单作处理的西瓜植株均表现枯萎病症状时用抖根法取西瓜根际土,每个重复取5株,土壤过20目筛去除植物残体,土样4℃保存,用于土壤酶活性、可培养微生物数量和微生物生物量碳、氮、磷的测定。
1.3 测定项目
土壤脲酶采用靛酚蓝比色法测定,多酚氧化酶采用邻苯三酚比色法测定,转化酶采用硫代硫酸钠滴定法测定,过氧化氢酶采用高锰酸钾滴定法测定[12];细菌采用牛肉膏蛋白胨培养基,放线菌采用改良高氏1号培养基,真菌采用马丁氏培养基,均采用稀释平板法计数[13];土壤微生物生物量碳和微生物生物量氮采用改进的氯仿熏蒸—硫酸钾浸提法[14],土壤微生物生物量磷测定采用Brookes等[15]的方法。
1.4 数据处理
采用SAS 9.0进行方差分析,采用Origin 9.0作图,相关性分析采用Pearson相关系数评价不同因子间的相关系数。
2 结果与分析
2.1 西瓜根际土壤酶活性对小麦伴生的响应
土壤酶活性对小麦伴生的响应,如图1。西瓜根际土壤脲酶活性为D123>CK>D125和CW,D123显著高于CK(P<0.05),D123处理的西瓜根际土壤脲酶活性比CK提高了58.4%,而D125处理的土壤脲酶活性比CK降低了3.6%;土壤多酚氧化酶活性为D123>D125>CK和CW,D123和D125处理西瓜根际土壤多酚氧化酶活性分别比CK提高了129%和68.8% (P<0.05);土壤过氧化氢酶活性为D123和CK>CW>D125,D123处理与CK无显著差异,D125处理比 CK降低了5%;各处理蔗糖酶活性为 D123>D125>CK>CW,两种小麦伴生处理的西瓜根际土壤蔗糖酶活性显著高于西瓜单作(P<0.05),D123和D125处理的蔗糖酶活性分别比 CK增加了17%和10.4%。
2.2 西瓜根际土壤微生物区系对小麦伴生的响应
从两种小麦伴生模式对西瓜根际土壤微生物的变化分析中(表1)可以看出,与西瓜单作相比,在小麦伴生模式下西瓜根际土壤微生物总数、细菌、放线菌都有显著变化,微生物总数量的大小为D123>D125>CW>CK,细菌数量大小为D125>D123>CW >CK,放线菌数量为 D123>D125>CW>CK,其中D123小麦伴生西瓜的根际土壤微生物总数和放线菌分别比对照增加了45.21%和130.20%,D125小麦伴生西瓜的根际土壤细菌数比对照增加了40.89%。
对两种小麦伴生模式下西瓜根际土壤微生物种群结构分析(表1)表明,土壤微生物总数均以细菌最多(78.59% ~87.78%),放线菌次之(12.15% ~21.33%),真菌所占比例最小(0.07%~0.09%)。细菌所占微生物总数的比例大小依次为D125>CW>CK>D123;放线菌所占的比例与细菌所占比例大小顺序相反,其中D123小麦伴生模式放线菌占总菌数比例最大,达到21.33%,D125小麦伴生模式放线菌占总菌数比例最小,为12.15%;两种小麦伴生模式下的真菌数所占比例均小于西瓜单作(CK)。
2.3 西瓜根际土壤微生物生物量碳、氮、磷对小麦伴生的响应

图1 西瓜根际土壤脲酶(A)、多酚氧化酶(B)、过氧化氢酶(C)和蔗糖酶(D)活性对小麦伴生的响应Fig.1 Response of urease(A),polyhenol oxidase(B),catalase(C)and saccharase(D)activities in the watermelon rhizosphere soil to wheat as companion crop
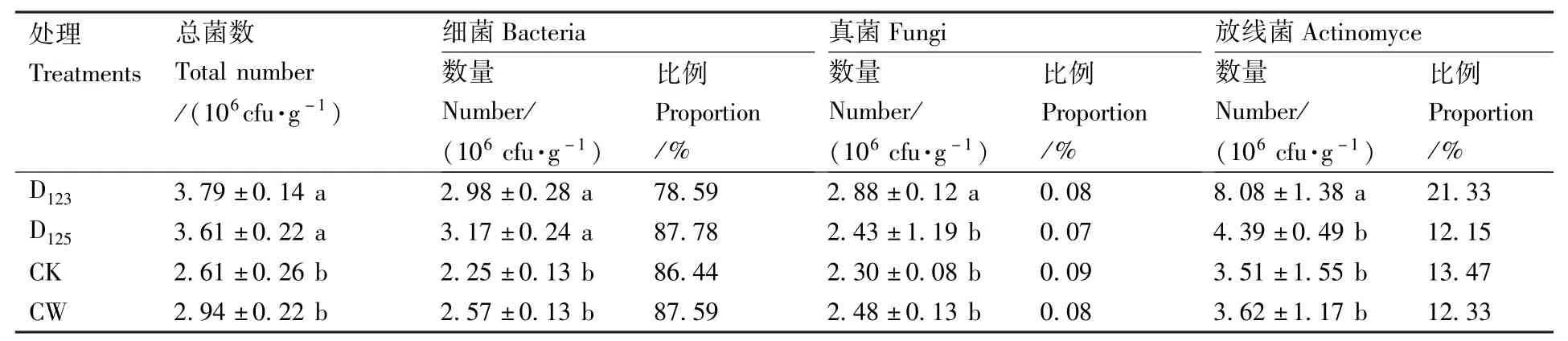
表1 小麦伴生模式下西瓜根际土壤微生物区系和种群组成结构的变化Table 1 Changes of soilmicrobial population and community structure in the rhizosphere of watermelon in the watermelon/wheat companion system
由表2可以看出,西瓜根际土壤微生物生物量碳为D125>CW>D123>CK,与西瓜单作相比,D125小麦伴生显著提高了西瓜根际土壤微生物生物量碳(P<0.05),较对照提高了38.71%;西瓜根际土壤微生物生物量氮含量为CW>D125>D123>CK,D125和D123小麦伴生模式西瓜根际土壤微生物生物量氮分别比西瓜单作高110.88%、107.58%;西瓜根际土壤微生物生物量磷含量为CW>D125>D123>CK,D125和 D123小麦伴生模式下西瓜根际土壤微生物生物量磷分别比西瓜单作增加了31.57%、26.08%,说明两种小麦伴生方式提高了西瓜根际土壤微生物生物量磷;在4种处理中,单作西瓜根际土壤微生物生物量碳氮比最高,两种小麦伴生模式间无显著差异。
2.4 西瓜根际土壤酶与微生物生物量碳、氮、磷和微生物数量的相关性
由表3可知,西瓜根际土壤总微生物数量与脲酶、多酚氧化酶、蔗糖酶均呈显著或极显著正相关;真菌与脲酶、多酚氧化酶呈显著或极显著正相关;细菌与多酚氧化酶、过氧化氢酶有显著相关关系;放线菌与脲酶、多酚氧化酶、蔗糖酶呈显著或极显著正相关关系;微生物生物量碳与过氧化氢酶呈极显著负相关。
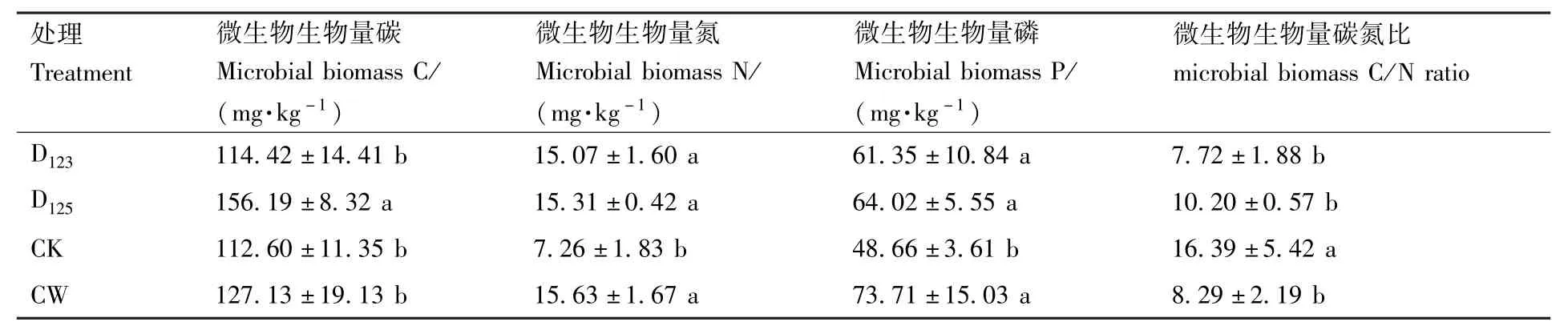
表2 西瓜根际微生物生物量碳、氮、磷和微生物生物量碳氮比对小麦作为伴生植物的响应Table 2 Response of the microbial biomass C,N,P and the microbial biomass C/N ratio in the rhizosphere of watermelon to wheat as companion crop

表3 西瓜根际土壤酶与微生物生物量碳、氮、磷和微生物数量的相关系数Table 3 Correlation coefficients among soil enzyme,microbial biomass C,N,P and microbial population in the rhizosphere of watermelon
3 讨论
伴生植物是指经过特殊挑选的具有某种相生相克性状的植物,其本身不以收获为目的[16]。本研究中小麦作为伴生植物,D123和D125小麦品种是从大量小麦种质资源中筛选而来,D125小麦根系分泌物能够促进西瓜根系生长[10],D123小麦根系分泌物能抑制西瓜枯萎病菌菌丝生长[9]。土壤酶活性不仅是土壤肥力、土壤微生物活性及土壤健康的重要指标,也是评价各种农业措施的主要因素[17-18]。本试验测定了4种土壤酶活性,结果表明,D123和D125小麦伴生提高了土壤多酚氧化酶和蔗糖酶的活性。土壤细菌和真菌分泌胞外酚类氧化酶减轻酚类物质的毒性并有助于植株的抗病防御[19],本研究表明,两种小麦作为伴生植物均提高了西瓜根际土壤多酚氧化酶的活性,说明小麦伴生西瓜有利于减轻西瓜根际酚酸物质的毒性,这可能是小麦伴生缓解西瓜连作障碍的原因之一。土壤中的蔗糖酶是土壤中的生物催化剂,反映了土壤中生物活性的强弱及物质转化的速度,Dai等[20]发现花生与苍术间作显著提高了土壤蔗糖酶的活性。辣椒与大蒜间作也有效提高了蔗糖酶的活性[21]。我们的研究结果与他们的结论一致。脲酶催化酰胺态有机氮化物水解为可以被植物直接吸收利用的无机氮化物,反映了土壤的供氮能力[22],D123小麦作为伴生植物显著提高了土壤脲酶活性,说明D123小麦伴生处理使西瓜根际土壤氮素代谢旺盛。过氧化氢酶活性与土壤微生物数量和活跃程度以及植物的根系均有关系,是一种重要的氧化还原酶,可以用来表征土壤的生化活性[2]。本研究表明,D123小麦伴生处理西瓜根际过氧化氢酶活性与西瓜单作相比无显著差异,而D125小麦伴生处理显著低于西瓜单作(P<0.05),可能与不同小麦品种根系分泌物的种类和数量有关,有待进一步研究。土壤酶活性增高归功于有机质的输入刺激了微生物的生长和酶合成[23],小麦伴生模式提高了西瓜根际土壤酶活性,可能与小麦伴生为西瓜根际土壤提供的有机物质较多,从而刺激了微生物的生长和土壤酶活性的提高。
土壤微生物区系对土壤质量有很大的影响,一般认为细菌型土壤是土壤肥力提高的一个生物学标志,真菌型土壤是地力衰退的标志。本研究结果表明,小麦伴生增加了西瓜根际细菌、放线菌、真菌数量和微生物总数,提高了细菌和放线菌的比例,降低了真菌的比例;黄瓜与番茄交替种植也得到了类似的结果[24]。小麦伴生使西瓜根际土壤微生物增加的原因,可能是小麦根系分泌物分泌了大量有机物质,为西瓜根际土壤微生物提供碳源与能源,影响着微生物代谢[25],从而有助于西瓜根际土壤微生物数量增加。土壤微生物生物量在土壤有机质的分解中起重要作用,为植物增加养分循环和养分有效性[26]。本研究结果表明,小麦伴生增加了西瓜根际土壤微生物生物量碳、氮、磷,降低了土壤微生物生物量碳氮比,原因可能是小麦伴生模式下土壤中的根系庞大,为土壤提供的有机物质较多,其土壤微生物生物量较西瓜单作的高。土壤微生物生物量碳氮比用来描述土壤微生物群落结构和状态,土壤微生物群落结构不同,土壤微生物生物量碳氮比不一样,细菌C/N比为5~7,真菌为7~25,碳氮比高说明微生物生物量中含有更高比例的真菌,意味着土壤健康状态不良,反之,微生物生物量碳氮比低,说明细菌占优势,土壤较健康[27-28]。本研究表明,小麦伴生模式下西瓜根际土壤微生物生物量碳氮比显著低于西瓜单作,说明小麦伴生模式使土壤健康状态好转。土壤细菌、真菌、放线菌等是土壤关键生态过程中土壤酶活性的重要来源[29]。特定的土壤酶活性与细菌和真菌类群密切相关[30]。本研究表明,真菌与脲酶、多酚氧化酶呈显著或极显著正相关,细菌与多酚氧化酶、过氧化氢酶呈显著或极显著正相关,微生物总数及放线菌与脲酶、多酚氧化酶、蔗糖酶均呈显著正相关。
综上所述,小麦伴生提高了西瓜根际土壤酶活性和微生物生物量碳、氮、磷含量,改善了西瓜根际微生物区系,说明小麦与西瓜伴生的栽培模式对连作土壤的改良效果较好,使根际土壤环境向着有益的方向发展,利于减缓西瓜连作障碍。
(
):
[1] 马云华,魏珉,王秀峰.日光温室连作黄瓜根区微生物区系及酶活性的变化[J].应用生态学报,2004,15(6):1005-1008.
MA Y H,WEIM,WANG X F.Variation of microflora and enzyme activity in continuous cropping cucumber soil in solar greenhouse[J].Chinese Journal of Applied Ecology,2004,15(6):1005-1008.(in Chinese with English abstract)
[2] 张翼,张长华,王振民,等.连作对烤烟生长和烟地土壤酶活性的影响[J].中国农学通报,2007,23(12):211 -215.
ZHANG Y,ZHANG C H,WANG ZM,et al.The effects on the yields of flue-cured tobacco and activities of main soil enzymes[J].Chinese Agricultural Science Bulletin,2007,23(12):211-215.(in Chinese with English abstract)
[3] 苏世鸣,任丽轩,霍振华,等.西瓜与旱作水稻间作改善西瓜连作障碍及对土壤微生物区系的影响[J].中国农业科学,2008,41(3):704-712.
SU SM,REN L X,HUO ZH,et al.Effects of intercropping watermelon with rain fed rice on fusarium wilt and the microflora in the rhizosphere soil[J].Scientia Agricultura Sinica,2008,41(3):704-712.(in Chinese with English abstract)
[4] 于高波,吴凤芝,周新刚.小麦、毛苕子与黄瓜轮作对土壤微生态环境及产量的影响[J].土壤学报,2011,48(1):175-184.
YUG B,WU F Z,ZHOU X G.Effects of rotations of cucumber with wheat and hairy vetch on soil micro-ecological environment and its yield[J].Acta Pedologica Sinica,2011,48(1):175-184.(in Chinese with English abstract)
[5] 吴凤芝,潘凯,刘守伟.设施土壤修复及连作障碍克服技术[J].中国蔬菜,2013(13):39.
WU F Z,PAN K,LIU SW.Remediation technologies of greenhouse soil and overcoming technologies of soil sickness[J].China Vegetables,2013(13):39.(in Chinese)
[6] 胡举伟,朱文旭,张会慧,等.桑树/大豆间作对植物生长及根际土壤微生物数量和酶活性的影响[J].应用生态学报,2013,24(5):1423-1427.
HU JW,ZHU W X,ZHANG H H,et al.Effects of mulberry/soybean inter cropping on the plant growth and rhizosphere soil microbial number and enzyme activities[J].Chinese Journal of Applied Ecology,2013,24(5):1423-1427.(in Chinese with English abstract)
[7] 郭晓霞,刘景辉,张星杰,等.免耕对旱作燕麦田耕层土壤微生物生物量碳、氮、磷的影响[J].土壤学报,2012,49(3):575-582.
GUO X X,LIU JH,ZHANGX J,etal.Effects of non-tillage on soilmicrobial C,N and P in plough layer of oat field[J]. Acta Pedologica Sinica,2012,49(3):575-582.(in Chinese with English abstract)
[8] 王东凯,杨威,吴凤芝.不同栽培模式对设施黄瓜生长发育及土壤微生物数量的影响[J].东北农业大学学报,2012,43(7):95-99.
WANG D K,YANGW,WU F Z.Effect of different cultivation modes on cucumber growth and the numbers of culturable rhizosphere soilmicroorganisms[J].Journal ofNortheast Agricultural University,2012,43(7):95-99.(in Chinese with English abstract)
[9] XUW H,LIU D,WU F Z,et al.Root exudates of wheat are involved in suppression of Fusarium wilt in watermelon in watermelon-wheat companion cropping[J].European Journal of Plant Pathology,2015,141(1):209-216.
[10] XUW H,WANG Z G,WU F Z.Companion cropping with wheat increases resistance to Fusarium wilt in watermelon and the roles of root exudates in watermelon root growth[J]. Physiology and Molecular Plant Pathology,2015,90:12 -20.
[11] 徐伟慧,吴凤芝,王志刚,等.连作西瓜光合特性及抗病性对小麦伴生的响应[J].中国生态农业学报,2014,22(6):655-660.
XUW H,WU F Z,WANG ZG,et al.Response of photosynthetic characteristics and disease resistance of watermelon to companion with wheat[J].Chinese Journal of Eco-Agriculture,2014,22(6):655-660.(in Chinese with English abstract)
[12] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1987.
[13] 吴宏亮,康建宏,陈阜,等.不同轮作模式对砂田土壤微生物区系及理化性状的影响[J].中国生态农业学报,2013,21(6):674-680.
WU H L,KANG JH,CHEN F,et al.Effect of different rotation patterns on soil microbial population and physiochemical properties under gravel-sand mulched field conditions[J].Chinese Journal of Eco-Agriculture,2013,21(6):674 -680.(in Chinese with English abstract)
[14] 杨玉莲,吴福忠,何振华,等.雪被去除对川西高山冷杉林冬季土壤微生物生物量碳氮和可培养微生物数量的影响[J].应用生态学报,2012,23(7):1809-1816.
YANG Y L,WU F Z,HE ZH,et al.Effects of snow pack removal on soilmicrobial biomass carbon and nitrogen and the number of soil culturable microorganisms during winter time in alpine Abies faxoniana forest of western Sichuan,Southwest China[J].Chinese Journal of Applied Ecology,2012,23(7):1809-1816.(in Chinese with English abstract)
[15] BROOKESPC,LANDMAN A,PRUDEN G,et al.Chloroform fumigation and the release of soil nitrogen:a rapid direct extraction method to measure microbial biomass nitrogen in soil[J].Soil Biology&Biochemistry,1985,17(6):837 -842.
[16] 阎飞,杨振明,韩丽梅.论农业持续发展中的化感作用[J].应用生态学报,2001,12(4):633-635.
YAN F,YANG ZM,HAN LM.Allelopathy in sustainable development of agriculture[J].Chinese Journal of Applied E-cology,2001,12(4):633-635.(in Chinese with English abstract)
[17] DICK WA,CHENG L,WANG P.Soil acid and alkaline phosphatase activity as pH adjustment indicators[J].Soil Biology&Biochemistry,2000,32(13):1915-1919.
[18] 张俊丽,高明博,温晓霞,等.不同施氮措施对旱作玉米地土壤酶活性及 CO2排放量的影响[J].生态学报,2012,32(19):6147-6154.
ZHANG JL,GAOM B,WEN X X,et al.Effects of different fertilizers on soil enzyme activities and CO2emission in dry-land of maize[J].Acta Ecologica Sinica,2012,32(19):6147-6154.(in Chinese with English abstract)
[19] SINSABAUGH R L.Phenol oxidase,peroxidase and organic matter dynamics of soil[J].Soil Biology&Biochemistry,2010,42(3):391-404.
[20] DAIC,CHEN Y,WANG X,et al.Effects of intercropping of peanut with the medicinal plant Atractylodes lancea on soil microecology and peanut yield in subtropical China[J]. Agroforestry Systems,2013,87(2):417-426.
[21] AHMAD I,CHENG Z,MENG H,et al.Effect of peppergarlic intercropping system on soil microbial and bio-chemical properties[J].Pakistan Journal of Botany,2013,45(2):695-702.
[22] QIN SP,HU C S,DONGW X.Nitrification results in underestimation of soil urease activity as determined by ammonium production rate[J].Pedobiologia,2010,53:401 -404 .
[23] DICK R P.A review:long-term effects of agricultural systems on soil biochemical and microbial parameters[J].Agriculture Ecosystems&Environment,1992,40(1/4):25 -36.
[24] 李刚,文景芝,吴凤芝,等.连作条件下设施黄瓜根际微生物种群结构及数量消长[J].东北农业大学学报,2006,37(4):444-448.
LIG,WEN JZ,WU F Z,et al.Microbial population structures and variation of microbial communities in rhizosphere of cucumber potted in the soil obtained from continuous cropping green house[J].Journal of Northeast Agricultural University,2006,37(4):444-448.(in Chinese with English abstract)
[25] 刘峰,温学森.根系分泌物与根际微生物关系的研究进展[J].食品与药品,2006,8(9):37-40.
LIU F,WEN X S.Progress in relationship between rootexudates and rhizospheric microorganism[J].Food and Drug,2006,8(9):37-40.(in Chinese with English abstract)
[26] MOORE JM,SUSANNE K,TABATABAIM A.Soil microbial biomass carbon and nitrogen as affected by cropping systems[J].Biology&Fertility ofSoils,2000,31(3):200-210.
[27] CAMPBELL C A,MOULIN A P,BOWREN K E,et al. Effect of crop rotations on microbial biomass,specific respiratory activity and mineralizable nitrogen in a black chernozemic soil[J].Canadian Journal of Soil Science,1992,72(4):417-427.
[28] 张四海,曹志平,胡婵娟.添加秸秆碳源对土壤微生物生物量和原生动物丰富度的影响[J].中国生态农业学报,2011,19(6):1283-1288.
ZHANG SH,CAO Z P,HU C J.Effect of added straw carbon on soil microbe and protozoa abundance[J].Chinese Journal of Eco-Agriculture,2011,19(6):1283-1288.(in Chinese with English abstract)
[29] DIAMANTIDISG,EOSSE A,POTIER P,et al.Purification and characterization of the first bacterial laccase in the rhizospheric bacterium Azosprillum lipoferum[J].Soil Biology and Biochemistry,2000,32(7):919-927.
[30] AON M A,COLANERIA C.Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil[J].Applied Soil Ecology,2001,18(3):255-270.
(责任编辑 张 韵)
Response of soil enzymes activities and microorganism in rhizosphere of watermelon to wheat as com panion crop
XUWei-hui1,2,WU Feng-zhi2,∗
(1.Department of Life Science and Agroforestry,Qiqihar University,Qiqihar161006,China;2.Department of Horticulture,Northeast Agricultural University,Harbin 150030,China)
Soil sickness is an important factor which limits production of watermelon.It has also been noted that using the biodiversity of the ground could reduce soil sickness.To explore the response of soil enzymes activities and microorganism in the rhizosphere of watermelon to wheat as companion crop,pot experiments were conducted to investigate the response of soil enzymes activities,microbial community structure and microbial biomass in the rhizosphere of watermelon to wheat as companion crop.The four treatments were D123wheat/watermelon companion system(D123),D125wheat/watermelon companion system(D125),watermelon monoculture(CK)and no plant(CW).Results showed that total microbial and actinomyce population in the rhizosphere of watermelon in the D123wheat/watermelon system were increased by 45.21%and 130.20%,respectively,and ratio of actinomyce was increased by 7.6%in the D123wheat/watermelon companion system compared with watermelon monoculture.Compared with watermelon monoculture,bacteria population was increased by 40.89%and ratio of bacteria was increased by 10.81% in the rhizosphere of watermelon in the D125wheat/watermelon companion system.Also,the microbial biomass carbon(MBC),microbial biomass nitrogen(MBN)and microbial biomass phosphorus(MBP)in the wheat/watermel-on companion systems were significantly higher than those in the watermelon monoculture system.The ratio of fungus and the value of MBC/MBN were decreased,and polyphenol oxidase and saccharase activities in the rhizosphere of watermelon were increased in the wheat/watermelon companion systems compared with watermelon monoculture.The results suggested that watermelon rhizosphere had a positive response to wheat as a companion crop.
soil sickness;wheat/watermelon companion system;rhizosphere;microbialbiomass;microbial community;soil enzymes
S651
A
1004-1524(2016)09-1588-07
10.3969/j.issn.1004-1524.2016.09.19
2016-01-06
黑龙江省自然科学基金项目(C2015048);齐齐哈尔大学青年教师科学技术类科研启动支持计划项目(2014k-Z14)
徐伟慧(1979—),女,内蒙古赤峰人,博士,副教授,从事蔬菜生理生态研究。E-mail:xwh800206@163.com
∗通信作者,吴凤芝,E-mail:fzwu2006@aliyun.com
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(9):1588-1594 http://www.zjnyxb.cn徐伟慧,吴凤芝.西瓜根际土壤酶及微生物对小麦伴生的响应[J].浙江农业学报,2016,28(9):1588-1594.
