广丰千金薯驯化移栽苗对PEG干旱胁迫的光合生理响应
2016-11-21柯维忠杨星鹏徐玉琴夏瑾华尹明华洪森荣
柯维忠,王 丽,杨星鹏,徐玉琴,吴 丹,江 霞,夏瑾华,尹明华,洪森荣
(上饶师范学院生命科学学院,江西上饶334001)
广丰千金薯驯化移栽苗对PEG干旱胁迫的光合生理响应
柯维忠,王 丽,杨星鹏,徐玉琴,吴 丹,江 霞,夏瑾华,尹明华,洪森荣∗
(上饶师范学院生命科学学院,江西上饶334001)
为了探究广丰千金薯驯化移栽苗的耐旱生理机制,测定了干旱胁迫下广丰千金薯驯化移栽苗的多项光合生理指标。结果表明,50和100 g·L-1PEG-6000可显著促进广丰千金薯移栽驯化苗的生物量和根冠比,而150和200 g·L-1PEG-6000则显著减少其生物量和根冠比。当PEG-6000浓度为50和100 g·L-1,其叶片相对含水量、气孔开度、T r、F o、F v/F m、ΦPSⅡ、NPQ和ZR含量无显著变化,叶绿素含量、气孔密度、P n、G s、L s、WUE、CUE、F m、F v/F o、F v′/F m′、qP、GA3和ABA含量显著增加,C i显著下降。当PEG-6000浓度达到150和200 g·L-1,其叶片相对含水量、叶绿素含量、气孔开度、P n、G s、L s、T r、WUE、CUE、F o、F m、F v/F o、ΦPSⅡ、F v′/ F m′、F v/F m、qP、GA3、ZR和IAA显著下降,气孔密度、C i、NPQ和ABA含量显著增加。在干旱胁迫下,广丰千金薯移栽驯化苗叶片ZR/ABA和ZR/IAA随着PEG-6000浓度的增大而显著下降,而ABA/(IAA+GA3+ZR)则随PEG-6000浓度的增大而显著提高。在干旱胁迫下广丰千金薯移栽驯化苗叶片倍性稳定,但当PEG-6000浓度达到200 g·L-1,电泳图谱上出现了明显的DNA ladder。因此,广丰千金薯驯化移栽苗能适应一定程度的干旱胁迫,但随着干旱胁迫的加剧,会影响其生长发育、光合作用和内源激素的调控机制,导致细胞程序性死亡。
广丰千金薯;驯化移栽苗;干旱胁迫;光合生理响应
广丰千金薯(Dioscorea opposite Thunb.cv. Guangfeng Qianjin)为薯蓣科薯蓣属多年生草本植物,是江西省上饶市广丰区传统名优地方山药品种[1]。广丰千金薯的薯块(块茎)药食兼优,肉质绵密粉嫩,软糯爽口,具有健脾养胃、滋肾益精、预防心血管病、增强免疫力、延缓衰老等功效[2],被誉为“广丰人参”。但广丰千金薯块茎繁殖用种量大,生产成本高,还易受季节限制,而且长期利用块茎繁殖易造成病毒积累,种性退化,产量和品质下降。利用组织培养技术可以获得基因型较为一致的优良种苗,有利于品种的更新复壮[3],是解决广丰千金薯产业化生产的有效途径,但广丰千金薯驯化移栽苗对水分的要求十分严格,水分不足、湿度不够易出现枯苗,对产量影响极大[1]。因此,干旱是广丰千金薯生产的主要非生物限制因素,试管苗的驯化移栽期干旱更是影响广丰千金薯品质和产量的重要因素。
近年来,有关广丰千金薯的研究主要集中在组培育苗[2]和高产栽培[1]等方面,而广丰千金薯试管苗干旱胁迫下的研究报道较少。干旱胁迫对植株的影响与叶片光合作用密切相关,光合特性是评价作物品种资源的重要参数。叶绿素荧光、光合碳同化作用、能量转换和热耗散均源于同一激发态,荧光监测技术可以探测光合机构的变化和光合作用受环境等的影响[4-5]。内源激素是植物体生命活动的调节者,在植物遭受逆境胁迫时,激素作为调控作物生长发育的物质,在干旱条件下起着重要的调节作用[6]。因此,研究干旱胁迫对广丰千金薯驯化移栽苗光合特性、叶绿素荧光参数及内源激素含量的影响具有重要的理论价值和实践意义。目前,植物耐旱性的评价方法主要有模拟渗透胁迫和土壤干旱,但土壤干旱研究中受土壤复杂组分等客观因素所限,常采用渗透调节剂模拟干旱[7]。PEG-6000能够很好地模拟自然干旱,是一种较为理想也最常用的渗透调节剂[8-9]。本研究以广丰千金薯驯化移栽苗为材料,用PEG-6000模拟干旱胁迫条件,探讨干旱胁迫对广丰千金薯驯化移栽苗光合特性、叶绿素荧光参数及内源激素含量的影响,阐明光合特性与内源激素含量变化间的关系,为广丰千金薯驯化移栽苗的大田种植提供理论依据和实践参考。
1 材料与方法
1.1 试验材料
广丰千金薯块茎由上饶市广丰区科技局潘翔鹤先生提供,材料来源于上饶市广丰区少阳乡少阳村。
1.2 试验方法
1.2.1 无菌体系的建立和移栽驯化苗的获得
2015年4月将广丰千金薯薯块切成长5~6 cm的小段块茎,切口涂上草木灰,暴晒3~4 d,待切口变干后种植于装有沙土(体积比1∶1)的大型花钵中。待新的植株长出后,选取带芽的稍木质化茎段,经70%乙醇消毒1 min、无菌水冲洗3次、0.1%氯化汞消毒12 min、无菌水冲洗3次,然后接种到MS+1mg·L-1KT+0.2 mg·L-1NAA固体培养基上,置于光周期14 h/10 h(L/D)、(25±2)℃,光强1 500~2 000 lx条件下培养。待到新芽长至2~3 cm,将其切下接种于MS+ 2mg·L-1KT+0.5 mg·L-1NAA液体培养基,继续置于光周期14 h/10 h(L/D)、(25±2)℃,光强1 500~2 000 lx条件下培养。培养90 d左右便可形成完整植株。移栽时将封口膜打开,仍置于光周期14 h/10 h(L/D)、(25±2)℃,光强1 500~2 000 lx条件下培养2~3 d,取出完整植株洗净培养基后放入盛有浅层MS基本培养液的容器中进行室内移栽驯化。待到新生叶长出并长至一定大小(叶长5.5~6.0 cm,叶宽3.0~3.5 cm)时,取出用于后续试验。
1.2.2 干旱胁迫处理
将广丰千金薯移栽驯化苗移入Hoagland营养液平衡培养3 d后,将其放于添加了不同浓度PEG-6000的1/2 Hoagland营养液(所有元素用量减半)中。PEG-6000浓度依据参考文献[9]设置为5个处理:0(CK)、50、100、150和200 g· L-1,根据Michel等[10]有关PEG-6000溶液浓度与其渗透势的关系计算可以得出与之对应的溶液水势,分别为0、-0.054、-0.177、-0.393和-0.735 MPa[11]。干旱胁迫所有处理均置于光照培养箱中培养,培养条件为:光照时间14 h· d-1,光照强度2 000 lx,温度(25±1)℃,湿度70%~80%。在干旱胁迫后10 d测定叶片相对含水量、单株生物量、根冠比、叶绿素质量分数、气孔密度、气孔开度、光合特性、叶绿素荧光参数和内源激素含量。
1.2.3 单株生物量和根冠比的测定
干旱胁迫后,每处理取8株幼苗,去离子水洗净Hoagland营养液,用滤纸吸去多余水分,然后分别取地上部和根系,105℃杀青10 min,75℃烘干至恒质量,称取其干质量[12]。最后计算5个PEG-6000处理下的单株生物量和根冠比。单株总生物量是每株地上部干质量和根系干质量的总和,根冠比是每株根系干质量与地上部干质量的比值。试验重复3次。
1.2.4 叶片相对含水量的测定
剪下叶片后立刻称鲜质量,然后将其放在室内暗处的盛水容器中,4 h后取出叶片,滤纸片吸干水分后称饱和重。然后将叶片在105℃杀青10 min,75℃烘干至恒质量,称干质量[13]。最后计算叶片相对含水量,叶片相对含水量(%)=(鲜质量-干质量)/(饱和重-干质量)×100。试验重复3次。
1.2.5 光合参数的测定
叶绿素质量分数测定。用英国Hanstech公司生产的CL-01叶绿素仪测定完全展开且大小相同的新生叶(叶长约6.0 cm,叶宽约3.5 cm)的叶绿素质量分数(μg·g-1)。试验重复3次。
气孔密度和气孔开度测定。采取透明胶带粘取法[14],并参照王春艳等[15]的方法计算每个干旱胁迫处理的气孔密度,测量每个干旱胁迫处理中每气孔开放口的长度和宽度。气孔长度为平行于气孔器的最长值,气孔宽度为垂直于气孔器的最宽值。气孔开度=πab,其中a表示1/2气孔开度的长度,b表示 1/2气孔开度的宽度[16-17]。试验重复3次。
光合特性测定。用LI-6400XT便携式光合仪(LI-COR,USA)于9:00—11:00测定完全展开且大小相同的新生叶(叶长约6.0 cm,叶宽约3.5 cm)的净光合速率(P n)、气孔导度(G s)、细胞间CO2浓度(C i)、蒸腾速率(T r)等参数,并计算气孔限制值(L s)、水分利用效率(WUE)和瞬时羧化速率(CUE),其公式分别为L s=1-C i/C a,WUE=P n/T r,CUE=P n/C i。测定时使用 LI-6400-02B LED红蓝光源,设置光合饱和光强为1 000μmol·m-1·s-1,CO2注入系统设定值C a为400μmol·mol-1,气体流量为500μmol·s-1,室内温度为22.5℃。测定5株,每株测3个叶片。
叶绿素荧光参数测定。在同一叶片上用上述LI-6400XT便携式光合仪的荧光叶室测定叶绿素荧光动力学参数。参照Genty等[18]方法,在叶片充分暗适应16 h后,打开弱测量光测定初始荧光(F o),再用饱和的脉冲闪光(6 000μmol· m-1·s-1,脉冲时间0.8 s)测定暗适应下最大荧光(F m);然后打开光化学活性光(PPFD=1 000 μmol·m-1·s-1)照射叶片30 min以上,测量光适应下稳态荧光(F s);再打开一个饱和脉冲闪光(6 000μmol·m-1·s-1,脉冲时间0.8 s)测定光适应后的最大荧光(F m′);最后,关闭光化学活性光,施加远红光照射3 s以测量光适应下的最小荧光(F o′)。计算暗适应下PSⅡ最大光化学效率F v/F m-(F m-F o)/F m,PSⅡ潜在光化学效率F v/F o=(F m-F o)/F o,光适应下PSⅡ实际光化学效率ΦPSⅡ=(F m′-F s)/F m′,光适应下PSⅡ最大光化学效率F v′/F m′=(F m′-F o′)/ F m′,光化学荧光猝灭系数 qP=(F m′-F s)/(F m′-F o′),非光化学猝灭系数NPQ=F m/F m′-1。测定5株,每株测3个叶片。
1.2.6 内源激素含量的测定
内源激素提取参照龙雯虹等[19]的方法获得各样品叶片的激素提取液,然后用酶联免疫吸附法(ELISA)测定内源激素吲哚乙酸(IAA)、玉米素核苷(ZR)、赤霉素(GA3)和脱落酸(ABA)的含量。所用试剂盒购于中国农业大学化控中心。试验重复3次。
1.2.7 DNA含量的测定
叶片DNA含量的测定采用细胞流式仪FCM(flow cytometry)分析[20]。
1.2.8 叶片的DNA ladder分析
叶片总DNA采用CTAB法进行提取,将纯化后的DNA用1.5%的琼脂糖凝胶进行电泳,在凝胶成像分析系统中观察和拍照。
1.3 数据处理
所有数据均表示为平均值±标准差,各组试验数据用SPSS 19.0软件进行One-Way ANOVA分析,再进行 LSD法检验,P<0.05为显著性水平。
2 结果与分析
2.1 PEG干旱胁迫对广丰千金薯移栽驯化苗每株生物量和根冠比的影响
由图1可知,适当的干旱胁迫(50和100 g· L-1)PEG-6000可显著促进广丰千金薯移栽驯化苗的地上部生物量、根系生物量、总生物量和根冠比,而较高浓度(150 g·L-1)的PEG-6000处理则显著减少移栽驯化苗的地上部生物量、根系生物量、总生物量和根冠比。当PEG-6000浓度达到200 g·L-1时,广丰千金薯移栽驯化苗的地上部生物量、根系生物量、总生物量继续显著下降,而根冠比与150 g·L-1PEG-6000处理组相比,无显著差异。
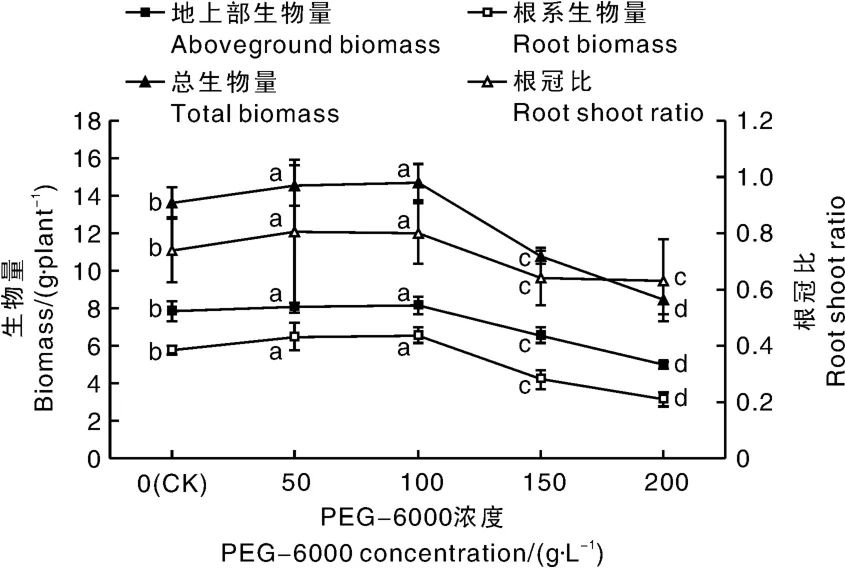
图1 PEG干旱胁迫对广丰千金薯移栽驯化苗每株生物量和根冠比的影响Fig.1 Effect of PEG drought stress on biomass and root shoot ratio per plant of Dioscorea opposite Thunb.cv. Guangfeng Qianjin acclimated and transplanted seedlings
2.2 PEG干旱胁迫对广丰千金薯移栽驯化苗叶片相对含水量和叶绿素含量的影响
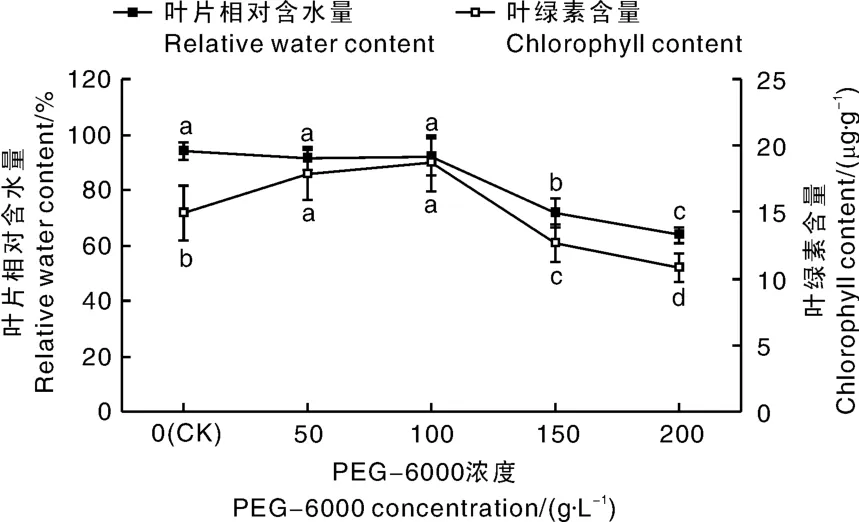
图2 PEG干旱胁迫对广丰千金薯移栽驯化苗叶片相对含水量和叶绿素含量的影响Fig.2 Effect of PEG drought stress on leaf relative water content and chlorophyll content of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
由图2可知,PEG干旱胁迫会造成广丰千金薯移栽驯化苗叶片相对含水量的显著下降。当PEG-6000浓度为50和100 g·L-1时,叶片相对含水量与对照组相比无显著差异,而且这2个处理之间也无显著差异;当PEG-6000浓度达到150和200 g·L-1,其叶片相对含水量与对照组、50和100 g·L-1处理组相比显著下降,而且这2个处理之间也有显著差异。干旱胁迫也会导致广丰千金薯移栽驯化苗叶绿素含量发生变化,与对照组相比,PEG-6000浓度为50和100 g·L-1,叶绿素含量显著增加,但两者之间无显著差异;当PEG-6000浓度达到150和200 g·L-1,其叶绿素含量与对照组、50和100 g·L-1PEG-6000处理组相比显著下降,两者之间也有显著差异。
2.3 PEG干旱胁迫对广丰千金薯移栽驯化苗气孔开度和气孔密度的影响
由图3和图4可知,干旱胁迫会在一定程度上影响广丰千金薯移栽驯化苗气孔开度和气孔密度的变化。PEG-6000浓度为50和100 g·L-1,叶片气孔开度与对照组相比无显著变化,气孔密度与对照组相比显著增加,但2处理之间无显著差异;PEG-6000浓度达到150和200 g·L-1,叶片气孔开度与对照组、50和100 g·L-1PEG-6000处理组相比显著下降,两者之间也有显著差异,气孔密度与对照组、50和100 g·L-1PEG-6000处理组相比显著增加,但两者之间无显著差异。
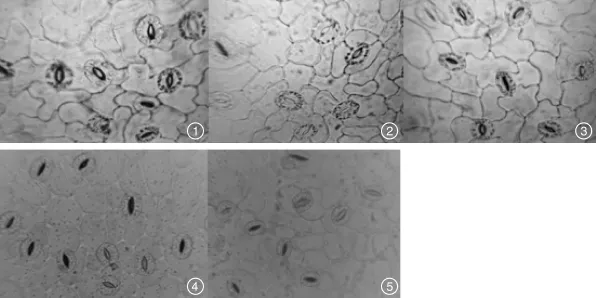
图3 PEG干旱胁迫下广丰千金薯移栽驯化苗气孔的观察Fig.3 Stomatal observation of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings under PEG drought stress

图4 PEG干旱胁迫对广丰千金薯移栽驯化苗气孔开度和气孔密度的影响Fig.4 Effect of PEG drought stress on stomatal aperture and stomatal density of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
2.4 PEG干旱胁迫对广丰千金薯移栽驯化苗光合特性的影响
从图5可知,PEG-6000干旱胁迫显著影响广丰千金薯移栽驯化苗的光合特性。PEG-6000浓度为50和100 g·L-1,移栽驯化苗的P n、G s、L s、WUE和CUE与对照组相比显著增加,C i与对照组相比显著下降,T r与对照相比无显著差异,但50和100 g·L-1PEG-6000处理之间的P n、G s、C i、T r、L s、WUE和CUE无显著差异。PEG-6000浓度为150和200 g·L-1,移栽驯化苗的P n、G s、L s、T r、WUE和CUE与对照组相比显著下降,C i与对照组相比显著增加,但150和200 g·L-1PEG-6000处理之间的P n、G s、T r、WUE和CUE也有显著差异。
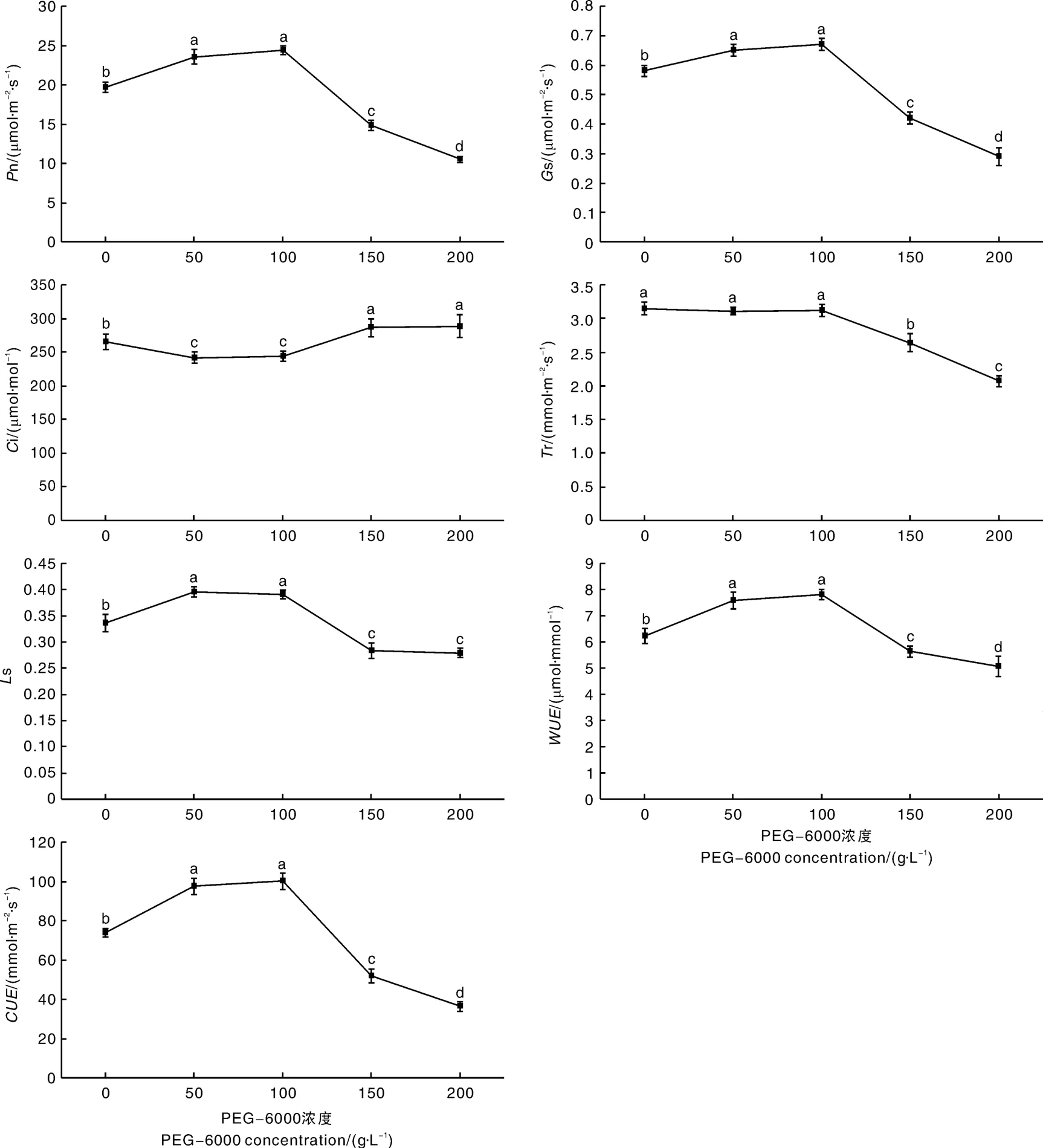
图5 PEG干旱胁迫对广丰千金薯移栽驯化苗光合特性的影响Fig.5 Effect of PEG drought stress on photosynthetic characteristics of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
2.5 PEG干旱胁迫对广丰千金薯移栽驯化苗叶绿素荧光参数的影响
从图6可知,PEG-6000浓度为50 g·L-1时,移栽驯化苗的F o、F v/F m、ΦPSⅡ、qP和NPQ与对照组相比无显著变化,而F m、F v/F o和F v′/F m′与对照组相比显著提高。
PEG-6000浓度为100 g·L-1,移栽驯化苗的F o、F v/F m、NPQ和 ΦPSⅡ与对照组、50 g·L-1PEG-6000处理组相比无显著变化,F m和F v′/ F m′与对照组相比显著提高,与50 g·L-1PEG-6000处理组相比无显著变化;F v/F o、qP与对照组和50 g·L-1PEG-6000处理组相比均显著提高。
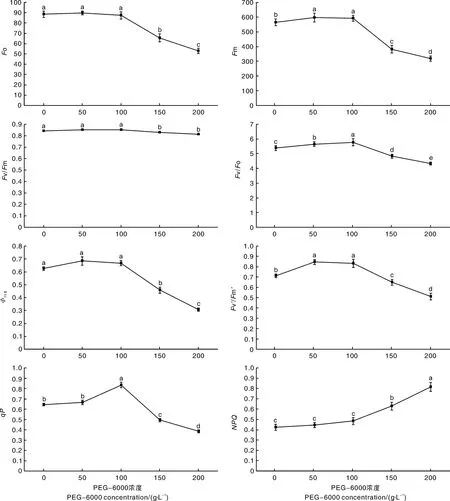
图6 PEG干旱胁迫对广丰千金薯移栽驯化苗叶绿素荧光参数的影响Fig.6 Effect of PEG drought stress on chlorophyll fluorescence parameters of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
PEG-6000浓度为150和200 g·L-1,移栽驯化苗的 F o、F m、F v/F o、ΦPSⅡ、F v′/F m′、qP与对照组、50和100 g/L PEG-6000处理组相比均显著下降,且150和200 g·L-1PEG-6000处理组的F o、F m、F v/F o、ΦPSⅡ、F v′/F m′和qP也有显著差异;F v/F m与对照组、50和100 g·L-1PEG-6000处理组相比显著下降,但150和200 g·L-1PEG-6000处理组的F v/F m无显著变化;NPQ与对照组、50和100 g·L-1PEG-6000处理组相比均显著增加。
2.6 PEG干旱胁迫对广丰千金薯移栽驯化苗叶片内源激素含量的影响
从图7可知,干旱胁迫下广丰千金薯移栽驯化苗叶片的内源激素含量会发生显著变化。随着PEG-6000浓度的增加,IAA含量先增后减,当PEG-6000浓度为50 g·L-1时,IAA含量最大;PEG-6000浓度超过50 g·L-1,IAA含量显著下降。PEG-6000浓度为0~100 g·L-1,ZR含量无显著变化;当PEG-6000浓度超过100 g·L-1,ZR含量显著下降。随着PEG-6000浓度增加,GA3含量也显著增加后下降,当PEG-6000浓度为50和100 g·L-1,GA3含量均可达到最高值,且两者之间无显著性差异;当PEG-6000浓度超过100 g·L-1,GA3含量则显著下降。随着PEG-6000浓度增加,ABA含量持续增加,各处理之间差异显著。
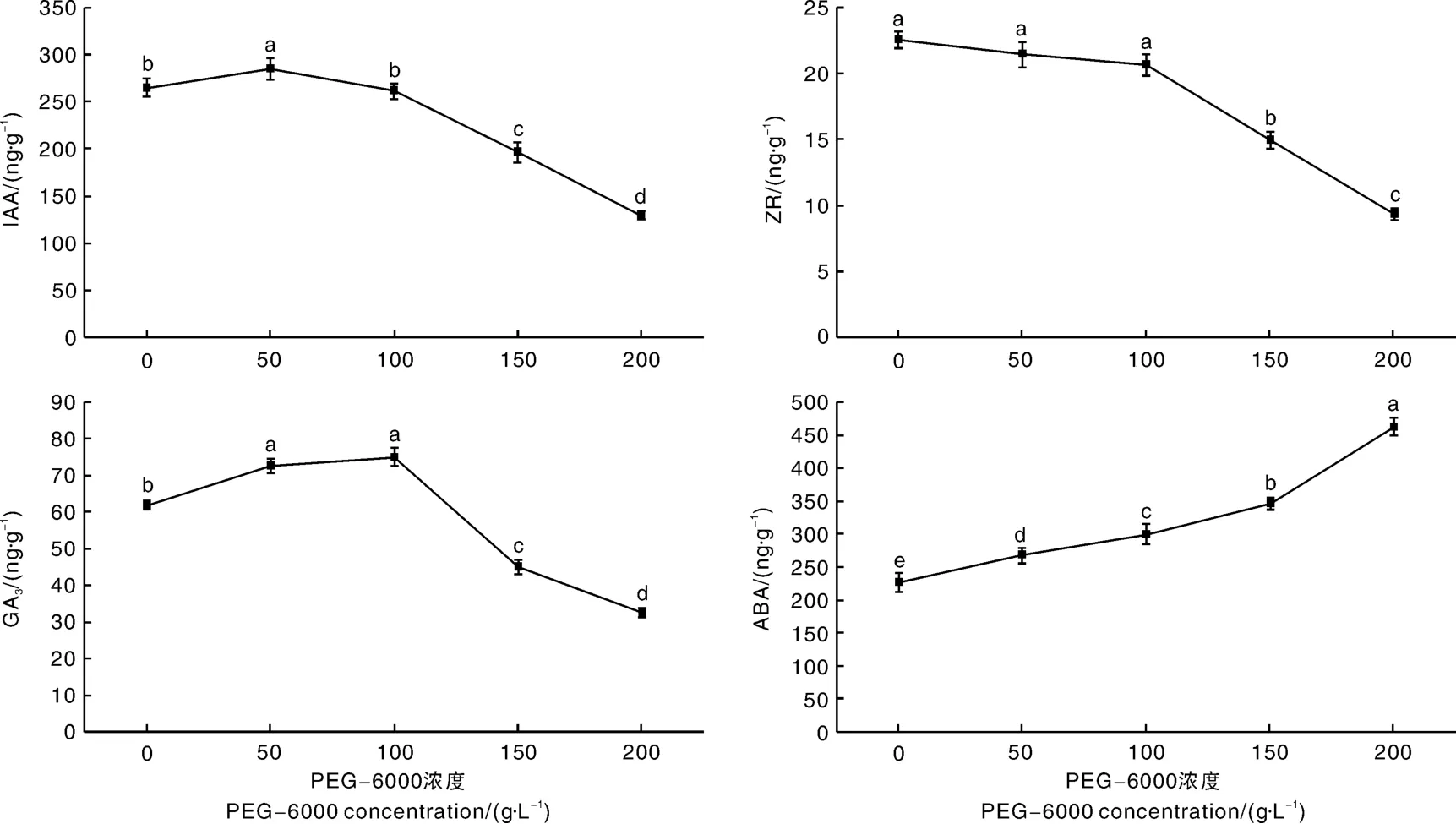
图7 PEG干旱胁迫对广丰千金薯移栽驯化苗叶片内源激素含量的影响Fig.7 Effect of PEG drought stress on the contents of leaf endogenous hormones of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
从表1可知,广丰千金薯移栽驯化苗叶片ZR/ABA随着 PEG-6000浓度的增加而显著下降,其中,50 g·L-1PEG-6000处理组与对照组相比无显著差异,表明干旱胁迫条件下,这2种内源激素的拮抗作用是向着气孔关闭的方向进行的。ZR/IAA也随着PEG-6000浓度的增加而下降,各PEG-6000处理组之间无显著差异,表明干旱胁迫下,这2种内源激素的协同作用是向着有利于广丰千金薯移栽驯化苗根系发展的方向进行的。ABA/(IAA+GA3+ZR)则随PEG-6000浓度的增大而显著提高,其中,50和100 g·L-1PEG-6000处理组与对照组相比无显著差异,表明在干旱胁迫下,4种激素之间的协调是向着抑制生长的方向进行的。
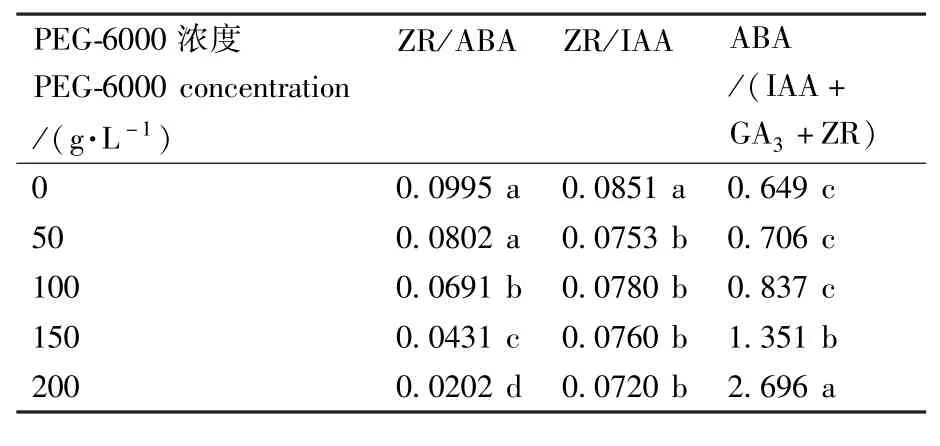
表1 干旱胁迫下广丰千金薯移栽驯化苗叶片ZR/ABA、ZR/IAA以及ABA/(IAA+GA3+ZR)比值的变化Table 1 The ratio change of ZR/ABA,ZR/IAA and ABA/(IAA+GA3+ZR)in leaves of Dioscorea opposite Thunb. cv.Guangfeng Qianjin acclimated and transplanted seedlings under PEG drought stress
2.7 PEG干旱胁迫对广丰千金薯移栽驯化苗DNA含量的影响
利用FCM技术对广丰千金薯移栽驯化苗DNA含量进行检测,结果见图8。在干旱胁迫下,对照组和各PEG-6000处理组的PI荧光值曲线相似,峰值相同,没有发现明显差异。因此,干旱胁迫下广丰千金薯移栽驯化苗叶片没有发生变异,其倍性是稳定的。

图8 PEG干旱胁迫对广丰千金薯移栽驯化苗DNA含量的影响Fig.8 Effect of PEG drought stress on DNA content of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings
2.8 PEG干旱胁迫对广丰千金薯移栽驯化苗的DNA ladder观察分析
从图9可知,对照组叶片细胞的总DNA表现为一条完整的带。50~150 g·L-1PEG-6000处理时,叶片细胞的总DNA也表现为一条完整的带;PEG-6000浓度达到200 g·L-1,电泳图谱上出现了明显的DNA片段,即DNA梯(DNA ladder),说明,200 g·L-1PEG-6000处理下,广丰千金薯移栽驯化苗叶片发生了细胞程序性死亡或细胞凋亡。

图9 PEG干旱胁迫下广丰千金薯移栽驯化苗叶片DNA的琼脂糖电泳图Fig.9 DNA band patterns in leaves of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted seedlings under PEG drought stress
3 讨论
移栽驯化苗移入大田成活率低一直是农业生产中普遍存在的问题,可能是移栽驯化苗移入大田时水分供应不足引起干旱胁迫造成的。植物受到干旱胁迫后首先会发生生长状态的变化,干旱胁迫下,黄瓜[21]、降香黄檀[22]、吉首蒲儿根[23]、香樟[24]和槭叶草[25]幼苗的生长受到明显抑制,植株总干质量和叶片相对含水量显著减小,根冠比显著增大。但本试验结果表明,适当的干旱胁迫(50和100 g·L-1PEG-6000)可显著增加广丰千金薯移栽驯化苗的生物量和根冠比,但较高浓度(150和200 g·L-1)的PEG-6000处理会显著减少广丰千金薯移栽驯化苗的生物量和根冠比。
气孔是控制CO2进入叶肉细胞和水分蒸腾散失的重要门户,干旱胁迫容易引起气孔特性变化。干旱胁迫下,黄瓜幼苗叶片的气孔无法正常发育,上下表皮的气孔密度、气孔大小和开度均显著减少[21]。但大豆[15]和德国补血草[26]幼苗叶片在干旱胁迫条件下,气孔密度会逐渐增加,气孔开度呈减少的趋势。水稻品种秋光和沈农265在轻度干旱胁迫时,两者叶片气孔密度差异不大,但干旱胁迫逐渐增强时,两者的气孔密度均会出现严重紊乱[27]。本研究结果也表明,用50和100 g·L-1PEG-6000处理时,广丰千金薯移栽驯化苗的气孔开度和气孔密度无显著变化;PEG-6000浓度达到150和200 g·L-1,气孔开度显著下降,气孔密度显著增加。因此,在干旱胁迫下,气孔特性的变化因植物种类而异。
干旱胁迫是限制作物光合作用的最主要环境因子之一,而叶绿素含量是决定作物光合作用和物质生产的重要因素。植物遭受干旱胁迫时,叶片叶绿素含量也会发生显著的变化,而且不同植物对干旱的响应也有较大差异。干旱胁迫下,黄瓜[21]、槭叶草[25]和文冠果[28]幼苗的叶绿素和光合色的含量均显著降低。白木通幼苗在轻度干旱下叶绿素含量无显著变化,在中度和重度干旱下叶绿素含量显著下降[29]。而香樟幼树在干旱胁迫下叶片叶绿素含量呈先升后降的趋势[24]。本研究结果与此一致。
光合作用是植物最重要的生理过程之一,直接影响植物的生长状况和最终产量,而干旱胁迫对植物的光合作用会产生较大的影响,其中最显著的是干旱胁迫能降低植物的P n。干旱胁迫下,植物叶片净光合速率降低的因素包括气孔限制因素[30]和非气孔因素[28-31],前者是指干旱胁迫导致气孔导度下降,CO2难以进入叶片而使光合速率下降,但随着干旱胁迫强度的增大,光合速率下降有一个从气孔限制向叶肉细胞光合活性限制的转变过程,即从气孔因素向非气孔因素转变,表现为光合机构活性的下降[32]。干旱胁迫下,文冠果[28]、香樟[24]和吉首蒲儿根[23]幼苗的P n、G s和T r显著下降。轻度干旱对白木通幼苗的所有光合生理指标无显著影响,中度干旱使其P n、T r、C i显著下降,而对Gs影响不显著,重度干旱则使其P n、T r、G s显著下降,而使C i和WUE显著升高[29]。随着干旱胁迫时间的延长,黄瓜[21]、宁夏枸杞[33]和槭叶草[25]幼苗叶片P n、G s和T r显著下降,C i先降后升,WUE和L s先升后降。在本研究中,用50和100 g·L-1PEG-6000处理时,广丰千金薯移栽驯化苗T r无显著变化,P n、G s、L s、WUE、CUE显著增加,C i显著下降;当PEG-6000浓度达到150和200 g·L-1,广丰千金薯移栽驯化苗P n、G s、L s、T r、WUE、CUE、F o、F m、F v/F o、ΦPSⅡ、F v′/F m′和qP显著下降,C i显著增加。结合前面提到的气孔和叶绿素含量的测定结果,推测在干旱胁迫下,广丰千金薯移栽驯化苗叶片净光合速率降低的因素也包括气孔限制因素和非气孔因素,这与上述结果一致。
叶绿素荧光参数能反映PSⅡ对环境条件的反应,与气体交换相比,能更具体地反映PSⅡ的活性。应用叶绿素荧光动力学方法可以快速、灵敏、无损伤探测干旱胁迫对植物光合作用的影响[34]。在干旱胁迫下,黄瓜幼苗F v′/F m′、ΦPSⅡ和qP均显著下降,NPQ显著提高[21]。在中度干旱胁迫下,白木通幼苗叶片的F v/F m、F v/F o和qP显著下降,ΦPSⅡ和F m无显著变化;而在重度干旱胁迫下,白木通幼苗叶片F v/F m、ΦPSⅡ、F v/ F o、F m和qP均显著下降,F o和NPQ却显著提高[29]。在干旱处理下,吉首蒲儿根[23]和文冠果[28]幼苗的F v/F m、F v/F o和qP均显著降低,而NPQ则显著增大。本试验结果也表明,在50~200 g·L-1PEG-6000模拟干旱胁迫下,广丰千金薯移栽驯化苗的F o、F m、F v/F m、ΦPSⅡ显著下降,NPQ显著增加,F v/F o、F v′/F m′和qP则均呈先升后降的趋势,表明广丰千金薯移栽驯化苗在干旱胁迫下,PSⅡ受体侧受到抑制,PSⅡ原初光能转换效率、潜在活性降低,进而影响光合电子传递的正常进行,光化学效率随之下降。
植物在适应干旱的过程中,内源激素含量会发生变化。在干旱胁迫下,随着干旱胁迫强度的增加,降香黄檀幼苗ABA呈现出递增趋势,IAA和ZR含量随着干旱胁迫强度增加而降低,GA含量却呈现出先增后减的趋势[22]。在干旱胁迫下,陇东、BL-02-329 2种紫花苜蓿[35]以及胶质苜蓿[36]叶片的ABA、IAA含量均有不同程度的上升,而GA3和ZR的含量却呈下降趋势。而嫩江云杉和红皮云杉在干旱胁迫下,其根、茎、叶中的ABA含量均有上升的趋势;而红皮云杉IAA含量在轻度甚至中度干旱时显著上升,在严重干旱时显著下降;嫩江云杉IAA含量基本呈下降趋势;干旱对嫩江云杉和红皮云杉GA含量的影响不显著,但可导致2种云杉中的 ZR含量显著下降[37]。在干旱胁迫下,油茶组培苗和实生苗ABA含量升高,ZR、GA3含量下降,IAA含量则是先升后降[38]。本试验也表明,当PEG-6000浓度为50和100 g·L-1时,其ZR含量无显著变化,GA3和ABA显著增加。当PEG-6000浓度达到150和200 g·L-1,其GA3、ZR和IAA含量显著下降,ABA含量显著增加。
IAA、GA3和ZR都是促进植物生长发育(如细胞分裂、伸长等)的植物激素,ABA是抑制植物生长的激素。Griffin等[39]研究认为干旱胁迫造成根中ABA含量以及IAA/ABA和ZR/ABA的比率发生显著变化,在植物抗旱过程中发挥着重要作用。2种紫花苜蓿[3]、3种胶质苜蓿[36]和降香黄檀[22]幼苗随干旱胁迫强度的增加,其 ZR/ ABA和ZR/IAA呈下降趋势。本试验结果与此一致。在干旱胁迫下,广丰千金薯移栽驯化苗叶片ZR/ABA和ZR/IAA随着PEG-6000浓度的增加而显著下降。但油茶组培苗与实生苗在干旱胁迫下,ZR/ABA呈降低趋势,而ZR/IAA先降后升[38]。在干旱胁迫下,陇东苜蓿[35]的 ABA/(IAA+GA3+ZR)在轻度干旱胁迫下变化不大,在中度干旱胁迫下显著降低,在重度干旱胁迫下显著增加;而BL-02-329苜蓿[36]以及油茶组培苗与实生苗[38]在轻度、中度和重度干旱胁迫时,ABA/(IAA+GA3+ZR)均显著升高,本试验结果与此相一致。在干旱胁迫下,广丰千金薯移栽驯化苗叶片ABA/(IAA+GA3+ZR)随PEG-6000浓度的增大而显著提高。而2个胶质苜蓿品种XY 06P-2533和ZXY 06P-2658的ABA/(IAA+ GA3+ZR)随着干旱胁迫强度的增大也呈增加趋势,而胶质苜蓿另外一个品种ZXY 06P-2636在中度干旱胁迫下,ABA/(IAA+GA3+ZR)显著降低,在重度干旱胁迫下,则显著增加[36]。这些结果均表明,受试植株可能在干旱胁迫下,建立了新的激素平衡。
细胞程序性死亡(programmed cell death,PCD)作为一种普遍的生命现象,不仅在植物正常生长发育中发挥重要作用,而且是抵御不良环境(如病原体、高盐、水分亏缺等)的重要手段[40-41]。谭冬梅等[42]和曹慧等[43]用20%PEG-6000分别对苹果属植物平邑甜茶、新疆野苹果和八棱海棠幼苗进行水分胁迫处理,结果发现,干旱处理后,苹果属植物叶片中都有DNA Ladder产生,说明干旱胁迫可以诱导苹果属植物发生细胞程序性死亡。林久生等[44]也用 20%PEG-6000对小麦根系进行渗透胁迫,在DNA琼脂糖凝胶电泳图谱上也观察到明显的DNA Ladder条带,表明PEG-6000所造成的渗透胁迫也能有效地诱导小麦叶片细胞发生程序性死亡。本试验结果与上述结果相一致。在干旱胁迫下,广丰千金薯移栽驯化苗叶片倍性稳定,但当PEG-6000浓度达到200 g·L-1,电泳图谱上出现了明显的DNA ladder,表明其发生了细胞程序性死亡。
(
):
[1] 邱翠金,何鸿弘,叶为波,等.广丰千金薯高产栽培主要技术措施[J].现代园艺,2009(6):27-27.
QIU C J,HEH H,YEW B,et al.Themain technical measures for high yield of Dioscorea opposite Thunb.cv.Guangfeng Qianjin[J].Xiandai Horticulture,2009,(6):27,31.(in Chinese)
[2] 方利平,尤玉英,邱翠金,等.广丰千金薯高产栽培技术[J].安徽农学通报,2009,15(6):147-148.
FANG L P,YOU Y Y,QIU C J,et al.The cultivation techniques for high yield of Dioscorea opposite Thunb.cv.Guangfeng Qianjin[J].Anhui Agricultural Science Bulletin,2009,15(6):147-148.(in Chinese)
[3] 韩晓勇,闫瑞霞,殷剑美,等.铁棍山药组织培养快繁及试管珠芽离体再生体系研究[J].西北植物学报,2013,33(10):2120-2125.
HAN X Y,YAN R X,YIN JM,et al.Research on tissue culture for rapid propagation and in vitro bulbils regeneration system of Dioscorea opposita Thunb[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(10):2120-2125.(in Chinese with English abstract)
[4] 井大炜,邢尚军,杜振宇,等.干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响[J].应用生态学报,2013,24(7):1809-1816.
JING D W,XING S J,DU Z Y,et al.Effects of drought stress on the growth,photosynthetic characteristics,and active oxygen metabolism of poplar seedlings[J].Chinese Journal of Applied Ecology,2013,24(7):1809-1816.(in Chinese with English abstract)
[5] 徐澜,高志强,安伟,等.冬麦春播条件下旗叶光合特性、叶绿素荧光参数变化及其与产量的关系[J].应用生态学报,2016,27(1):133-142.
XU L,GAO ZQ,ANW,et al.Flag leaf photosynthetic characteristics,change in chlorophyll fluorescence parameters,and their relationships with yield of winter wheat sowed in spring[J].Chinese Journal of Applied Ecology,2016,27(1):133 -142.(in Chinese with English abstract)
[6] 周宇飞,王德权,陆樟镳,等.干旱胁迫对持绿性高粱光合特性和内源激素ABA、CTK含量的影响[J].中国农业科学,2014,47(4):655-663.
ZHOU Y F,WANG D Q,LU Z B,et al.Effects of drought stress on photosynthetic characteristics and endogenous hormone ABA and CTK contents in green-stayed sorghum[J]. Scientia Agricultura Sinica,2014,47(4):655-663.(in Chinese with English abstract)
[7] 张彦妮,李博,何淼.PEG干旱胁迫对大花飞燕草幼苗生理特性的影响[J].草业科学,2014,31(3):446-449.
ZHANG Y N,LIB,HE M.Physiological characteristics of Delphinium grandiflorum under drought stress[J].Pratacultural Science,2014,31(3):446-449.(in Chinese with English abstract)
[8] 张云贵,谢永红.PEG在模拟植物干旱胁迫和组织培养中的应用(综述)[J].亚热带植物通讯,1994,23(2):61 -64.
ZHANG Y G,XIE Y H.Application of PEG in simulating plant drought stress and tissue culture(review)[J].Subcrop. Plant Res.Commun,1994,23(2):61-64.(in Chinese)
[9] 何玮,蒋安,王琳,等.PEG干旱胁迫对红三叶抗性生理生化指标的影响研究[J].中国农学通报,2013,29(5):5 -10.
HEW,JIANG A,WANG L,et al.Study on the effects of PEG stress on physiological and biochemical indexes of five red clovers[J].Chinese Agricultural Science Bulletin,2013,29(5):5-10.(in Chinese with English abstract)
[10] MICHEL B E,KAUFMANN M R.The osmotic potential of polyethylene glycol 6000[J].Plant physiology,1973,51(5):914-916.
[11] 徐萍,李进,吕海英,等.干旱胁迫下水杨酸对银沙槐子叶表皮气孔开度的影响[J].植物生理学报,2014,50(4):510-518.
XU P,LIJ,LYU H Y,et al.Effect of salicylic acid on stomata aperture of epidermis in Ammodendron argenteum cotyled under drought srress[J].Plant Physiology Journal,2014,50(4):510-518.(in Chinese with English abstract)
[12] 马富举,李丹丹,蔡剑,等.干旱胁迫对小麦幼苗根系生长和叶片光合作用的影响[J].应用生态学报,2012,23(3):724-730.
MA F J,LID D,CAIJ,et al.Responses of wheat seedlings root growth and leaf photosynthesis to drought stress[J]. Chinese Journal of Applied Ecology,2012,23(3):724-730.(in Chinese with English abstract)
[13] 杨颖丽,杨宁,王菜,等.盐胁迫对小麦幼苗生理指标的影响[J].兰州大学学报(自然科学版),2007,43(2):29 -34.
YANG Y L,YANG N,WANG C,et al.Effect of salinity on the physiological characteristics in two wheat cultivars[J]. Journal of Lanzhou University(Natural Sciences),2007,43(2):29-34.(in Chinese with English abstract)
[14] 陈佰鸿,李新生,曹孜义,等.一种用透明胶带粘取叶片表皮观察气孔的方法[J].植物生理学通讯,2004,40(2):215-218.
CHEN B H,LIX S,CAO Z Y,et al.A method for observing stoma by transparent gummed tape to tear epidermis from leaf[J].Plant Physiology Communications,2004,40(2):215-218.(in Chinese with English abstract)
[15] 王春艳,庞艳梅,李茂松,等.干旱胁迫对大豆气孔特征和光合参数的影响[J].中国农业科技导报,2013,15(1):109-115.
WANG C Y,LANG Y M,LIM S,et al.Effects of drought stress on soybean stomatal characteristics and photosynthetic parameter[J].Journal of Agricultural Science and Technology,2013,15(1):109-115.(in Chinese with English abstract)
[16] WISE R R,SASSENRATH-COLE G F,PERCY R G.A comparison of leaf anatomy in field-grown Gossypium hirsutum and G.barbadense[J].Annals of Botany,2000,86(4):731-738.
[17] INAMULLAH I,ISODA A.Adaptive responses of soybean and cotton to water stress:I.Transpiration changes in relation to stomatal area and stomatal conductance[J].Plant Production Science,2005,8(1):16-26.
[18] GENTY B,BRIANTAISJM,BAKERNR.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochim Biophys Acta,1989,990(1):87-92.
[19] 龙雯虹,王琼,肖关丽,等.黄独珠芽生长期内源激素及糖类物质含量的变化[J].云南农业大学学报,2013,28(2):283-286.
LONGW H,WANG Q,XIAO G L,et al.Variation of endogenous hormone and carbohydrate contents in growing bul-bils of Dioscorea bulbifera[J].Journal of Yunnan Agricultural University,2013,28(2):283-286.(in Chinese with English abstract)
[20] 尹明华,洪森荣.黄独微型块茎胚性愈伤组织超低温保存及遗传稳定性研究[J].中草药,2015,46(17):2623 -2631.
YIN M H,HONG SR.Study on cryopreservation and genetic stability of embryogenic calli induced from Dioscorea bulbifera microtuber[J].Chinese Traditional and Herbal Drugs,2015,46(17):2623-2631.(in Chinese with English abstract)
[21] 王玉珏,付秋实,郑禾,等.干旱胁迫对黄瓜幼苗生长、光合生理及气孔特征的影响[J].中国农业大学学报,2010,15(5):12-18.
WANG Y J,FU Q S,ZHENG H,et al.Effects of drought stress on growth,photosynthetic physiological features and stomata characters of cucumber seedlings[J].Journal of China agricultural University,2010,15(5):12-18.(in Chinese with English abstract)
[22] 贾瑞丰,杨曾奖,徐大平,等.干旱胁迫对降香黄檀幼苗生长及内源激素含量的影响[J].生态环境学报,2013,22(7):1136-1140.
JIA R F,YANG Z J,XU D P,et al.Growth and endogenous hormone content of Dalbergia odorifera seedlings under drought stress[J].Ecology and Environment Sciences,2013,22(7):1136-1140.(in Chinese with English abstract)
[23] 周强,向芬,田向荣,等.干旱胁迫对吉首蒲儿根光合机构的影响[J].西北植物学报,2014,34(7):1404-1410.
ZHOU Q,XIANG F,TIAN X R,et al.Effects of drought stress on photosynthetic apparatus in Sinosenecio jishouensis[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(7):1404-1410.(in Chinese with English abstract)
[24] 胡义,胡庭兴,胡红玲,等.干旱胁迫对香樟幼树生长及光合特性的影响[J].应用与环境生物学报,2014,20(4):675-682.
HU Y,HU T X,HU H L,etal.Effects of drought stress on growth and photosynthetic characteristics of Cinnamomum camphora saplings[J].Chinese Journal of Applied and Environmental Biology,2014,20(4):675-682.(in Chinese with English abstract)
[25] 张爽,董然,董妍,等.干旱胁迫对槭叶草生长及光合生理特性的影响[J].西北农林科技大学学报(自然科学版),2014,42(11):69-74.
ZHANG S,DONG R,DONG Y,et al.Effect of drought stress on growth and photosynthetic physiological characteristics of Mukdenia rosii[J].Journal of Northwest A&F University(Natural Science Edition),2014,42(11):69-74.(in Chinese with English abstract)
[26] 胡妍妍,白利娟,张婷,等.干旱胁迫对德国补血草气孔特征及生理特性的影响[J].湖北农业科学,2015,54(20):5066-5069.
HU Y Y,BAIL J,ZHANG T,et al.Effect of drought stress on stomatal and physiological characteristics of Limonium tataricum[J].Hubei Agricultural Sciences,2015,54(20):5066-5069.(in Chinese with English abstract)
[27] 田鑫,于广文.干旱胁迫对水稻叶片气孔密度的影响[J].辽宁农业科学,2010(2):26-28.
TIAN X,YU GW.Effects of drought stress on stomatal density in rice leaves[J].Liaoning Agricultural Sciences,2010(2):26-28.
[28] 邬佳宝,马明科,张刚,等.文冠果对干旱胁迫的光合生理响应[J].干旱地区农业研究,2014,32(5):55-60.
WU JB,MA M K,ZHANGG,etal.Photosynthetic physiological response of Xanthoceras sorbifolia under drought stress[J].Agricultural Research in the Arid Areas,2014,32(5):55-60.(in Chinese with English abstract)
[29] 吴玲利,雷小林,龚春,等.干旱胁迫对白木通光合生理特性的影响[J].中南林业科技大学学报,2015,35(11):68 -73.
WU L L,LEIX L,GONG C,et al.Effects of drought stress on photosynthetic physiological characteristics of Akebia trifoliate[J].Journal of Central South University of Forestry& Technology,2015,35(11):68-73.(in Chinese with English abstract)
[30] BRUGNOLIE,LAUTERIM.Effects of salinity on stomatal conductance,photosynthetic capacity,and carbon isotope discrimination of salt-tolerant(Gossypium hirsutum L.)and salt-sensitive(Phaseolus vulgaris L.) C3non-halophytes[J].Plant Physiology,1991,95(2):628-635.
[31] MEYER S,KOUCHKOVSKY Y.Electron transport,Photosystem-2 reaction centers and chlorophyll-protein complexes of thylakoids of drought resistant and sensitive Lupin piants[J].Photosynthesis research,1993,37(1):49-60.
[32] 姚庆群,谢贵水.干旱胁迫下光合作用的气孔与非气孔限制[J].热带农业科学,2005,25(4):80-85.
YAOQQ,XIEGS.The photosynthetic stomatal and nonstomatal limitation under drought stress[J].Chinese Journal of Tropical Agriculture,2005,25(4):80-85.(in Chinese with English abstract)
[33] 赵建华,李浩霞,安巍,等.干旱胁迫对宁夏枸杞叶片蔗糖代谢及光合特性的影响[J].西北植物学报,2013,33(5):970-975.
ZHAO JH,LIH X,AN W,et al.Sugar metabolism and photosynthetic characteristics in leaf of Lycium barbarum Lunder drought stress[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(5):970-975.(in Chinese with English abstract)
[34] 陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.
CHEN JM,YU X P,CHENG JA.The application of chlorophyll fluorescence kinetics in the study of physiological responses of plants to environmental stresses[J].Acta Agriculturae Zhejiangensis,2006,18(1):51-55.(in Chinese with English abstract)
[35] 韩瑞宏,张亚光,田华,等.干旱胁迫下紫花苜蓿叶片几种内源激素的变化[J].华北农学报,2008,23(3):81-84.
HAN R H,ZHANG Y G,TIAN H,et al.Study on changes of endogenous hormones in the leaves of Alfalfa under drought stress[J].Acta Agriculturae Boreali-Sinica,2008,23(3):81-84.(in Chinese with English abstract)
[36] 李源,王赞,刘贵波,等.干旱胁迫下胶质苜蓿内源激素及解剖结构的研究[J].华北农学报,2010,25(6):211 -216.
LIY,WANG Z,LIU G B,et al.Study on endogenesis hormones and anatomical structures of Medicago glutinosa under drought stress[J].Acta Agriculturae Boreali-Sinica,2010,25(6):211-216.(in Chinese with English abstract)
[37] 敖红,王炎.干旱胁迫下云杉内源激素的响应及其气孔调节[J].经济林研究,2011,29(3):28-34.
AO H,WANG Y.Response of endogenous hormones and stomatal regulation of spruce to drought stress[J].Nonwood Forest Research,2011,29(3):28-34.(in Chinese with English abstract)
[38] 陈博雯,刘海龙,蔡玲,等.干旱胁迫对油茶组培苗与实生苗内源激素含量的影响[J].经济林研究,2013,31(2):60 -64.
CHEN B W,LIU H L,CAI L,et al.Effects of drought stress on endogenous hormones contents in tissue culture seedling and seed seedling of Camellia oleifera[J].Nonwood Forest Research,2013,31(2):60-64.(in Chinese with English abstract)
[39] GRIFFIN DH,SCHAEDLEM,MANION PD,etal.Clonal variation in amino acid contents of roots,stems,and leavesof aspen(Populus tremuloides Michx.)as influenced by diurnal drought stress[J].Tree Physiology,1991,8(4):337 -350.
[40] RYERSON D E,HEATH M C.Cleavage of nuclear DNA into oligonucleosomal fragments during cell death induced by fungal infection or by abiotic treatments[J].The Plant Cell,1996,8(3):393-402.
[41] 李云霞,程晓霞,代小梅,等.植物在逆境胁迫中的细胞程序性死亡[J].生物技术通报,2009,25(4):7-11.
LIY X,CHEN X X,DAIXM,etal.Study on programmed cell death of plants in environmental stress[J].Biotechnology Bulletin,2009,25(4):7-11.(in Chinesewith English abstract)
[42] 谭冬梅,许雪峰,李天忠,等.干旱胁迫诱导苹果属植物细胞程序性死亡的研究[J].园艺学报,2007,34(2):275 -278.
TAN D M,XU X F,LIT Z,et al.The physiology and biochemistry analyzing of programmed cell death under drought stress in Malus hupehensis and M.sieversii[J].Acta Horticulturae Sinica,2007,34(2):275-278.(in Chinese with English abstract)
[43] 曹慧,李春霞,王孝威,等.水分胁迫诱导八棱海棠和平邑甜茶细胞程序性死亡的研究[J].园艺学报,2009,36(4):469-474.
CAO H,LI C X,WANG X W,et al.Research of programmed cell death under water stress in Malus robusta Rehd.and Malus hupehensis(Pamp.)Rehd[J].Acta Horticulturae Sinica,2009,36(4):469-474.(in Chinese with English abstract)
[44] 林久生,王根轩.渗透胁迫诱导的小麦叶片细胞程序性死亡[J].植物生理学报,2001,27(3):221-225.
LIN JS,WANGGX.Programmed cell death induced by osmotic stress in wheat leaves[J].Acta Phytophysiologica Sinica,2001,27(3):221-225.(in Chinese with English abstract)
(责任编辑 侯春晓)
Photosynthetic physiological responses of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted plantlets under PEG drought stress
KEWei-zhong,WANG Li,YANG Xing-peng,XU Yu-qin,WU Dan,JAING Xia,XIA Jin-hua,YIN Ming-hua,HONG Sen-rong∗
(College of Life Sciences,Shangrao Normal University,Shangrao 334001,China)
In order to explore the drought-resistant physiological mechanism of Dioscorea opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted plant lets,its photosynthetic physiological responses under drought stress were tested in this paper.The results showed that 50 and 100 g·L-1PEG-6000 could significantly promote the biomass and root-shoot ratio of D.opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted plant lets,while 150 and 200 g·L-1PEG-6000 could significantly reduced the biomass and root-shoot ratio.When PEG-6000 concentration was 50 and 100 g·L-1,the leaf relative water content,stomatal aperture,T r,F o,F v/F m,ΦPSⅡ,NPQ andZR had no significant changes,the chlorophyll content,stomatal density,P n,G s,L s,WUE,CUE,F m,F v/F o,F v′/F m′,IAA,GA3and ABA increased significantly,C i decreased significantly.When PEG-6000 concentration reached 150 and 200 g·L-1,the leaf relative water content,chlorophyll content,stomatal aperture,P n,G s,C i,T r,WUE,CUE,F o,F m,F v/F o,ΦPSⅡ,F v′/F m′,F v/F m,qP,GA3,ZR and IAA decreased significantly,stomatal density,L s,NPQ and ABA increased significantly.Under drought stress,ZR/ABA ratio and ZR/IAA ratio of D.opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted plantlets decreased significantly with the increase of PEG-6000 concentration,while the ABA/(IAA+GA3+ZR)increased significantly with the increase of PEG-6000 concentration.The FCM test results of DNA content showed that the ploidy of D.opposite Thunb.cv. Guangfeng Qianjin acclimated and transplanted plantlets under PEG drought stress was stable,but when PEG-6000 concentration reached 200 g·L-1,there were clear DNA ladders in the electrophoretic pattern.The results showed that D.opposite Thunb.cv.Guangfeng Qianjin acclimated and transplanted plantlets could adapt to a certain degree of drought stress,but with the aggravation of drought stress,its growth and development,photosynthesis and endogenous hormone regulation mechanism would be affected,which would lead to programmed cell death.
Dioscorea opposite Thunb.cv.Guangfeng Qianjin;acclimated and transplanted plantlets;drought stress;photosynthetic physiological responses
S632.1
A
1004-1524(2016)09-1462-14
10.3969/j.issn.1004-1524.2016.09.03
2015-12-28
江西省教育厅2014年度科学技术研究一般项目(GJJ14712);2015年江西省高等学校大学生创新训练计划项目(201510416007)
柯维忠(1976—),男,江西上饶人,实验师,主要从事植物生理学研究。E-mail:keweizhong1976@163.com
∗通信作者,洪森荣,E-mail:hongsenrong@163.com
浙江农业学报Acta Agriculturae Zhejiangensis,2016,28(9):1462-1475 http://www.zjnyxb.cn柯维忠,王丽,杨星鹏,等.广丰千金薯驯化移栽苗对PEG干旱胁迫的光合生理响应[J].浙江农业学报,2016,28(9):1462-1475.
