昆虫同性性行为的研究进展
2016-11-18明庆磊
明庆磊,程 超
(江苏师范大学生命科学学院,江苏徐州221116)

昆虫同性性行为的研究进展
明庆磊*,程 超
(江苏师范大学生命科学学院,江苏徐州221116)
从自然选择和性选择角度分析,同性性行为的存在是一个进化悖论,其成因和意义是当今进化生物学研究的重要科学问题。本文综述了昆虫同性性行为的发生、进化意义和遗传基础等方面的研究进展,分析了研究中存在的问题,并展望了未来的研究方向,以期为昆虫同性性行为的进一步研究提供参考。同时,希望本文能引起更多科学工作者关注昆虫同性性行为,并积极投身到此项研究中来,为该研究领域的发展做出贡献。
昆虫;同性性行为;进化悖论;成因;基因
性行为是两性生殖昆虫繁殖后代的必然环节和基础,是延续生命的最原始、最本质和最重要的行为。昆虫性行为可分为同性性行为和异性性行为;从生物学来说,这两种性行为是一个事情的两个方面,探究同性性行为不仅有助于理解异性性行为,也有助于理解性行为的功能、机制及其进化(Scharf and Martin,2013)。同性性行为是昆虫行为学研究中一个非常有趣的领域,其成果不仅在理论上有重大意义,在实际应用中也有重要的价值,可为害虫的防治奠定基础(Andersson and Simmons,2006)。例如,通过促进害虫同性交配或抑制害虫异性交配使其种群繁殖受到影响,减少其后代的数量,从而达到生物防治的目的。
定义昆虫同性性行为是很复杂的,因为不清楚昆虫这种行为的目的是否为性,也可能看起来是性,实际上另有其它的功能。根据Bagemihl(1999)的定义,同性性行为是指同性之间有接触、爬跨和交配行为产生。大约有100多种昆虫存在着同性性行为(Scharf and Martin,2013)。需要指出的是,还应对有同性性行为的两个个体进行区分,因为其中一个为主动,另一个为被动,它们潜在的发生和进化机制可能不同。
生物都有将自身基因保存并传递给后代的强烈欲望,从这个角度来说,生物进化的动力在于成功交配与繁殖。昆虫选择异性作为交配对象,即异性性行为,是成功繁衍的前提。然而,对具有同性性行为的昆虫来说,选择同性交配的最大、最显而易见的不利在于它将失去繁衍后代的机会。依照生物进化论,只有具备生殖和生存优势的性状才能在自然选择中不被淘汰,从而被保留下来。但问题在于:既然昆虫同性性行为不能繁殖后代,那为什么自然选择和性选择没有将同性性行为这一性状淘汰呢? 任何有损繁殖能力的性状,哪怕程度轻微,从进化的角度讲都应该被淘汰。因此,从自然选择和性选择角度分析,昆虫同性性行为的存在是一个进化悖论。
同性性行为没有被进化所淘汰,却还在有些昆虫中继续存在,显然,昆虫同性性行为是进化的产物。其进化意义是什么?其产生的遗传基础是什么?这是目前昆虫同性性行为研究中主要回答的两个问题,该论题是当前进化生物学领域中的重要科学问题和研究热点(Bailey and Zuk,2009)。
1 同性性行为的进化意义
昆虫同性性行为是在自然选择和性选择这一最基础的进化机制中形成的,也就是说这种行为是自然选择和性选择的产物,它一经形成,也必然成为一种力量,能够推动物种其他方面的进化,其最终结果则是促进种群的生存和繁衍(Andersson and Simmons,2006)。研究人员推测,昆虫同性性行为并不是一种绝对浪费,对其有如下几种适应性解释(表1)。
1.1 交配技巧的训练与学习功能
来自果蝇的证据表明,年轻雄性果蝇同性交配行为的经历提高了其以后的异性交配成功率(McRobert and Tompkins,1988)。
1.2 替代性生殖
研究表明赤拟谷盗的同性性行为不是由于性别识别和选择错误造成的(Arnaud and Haubruge,1999)。雄赤拟谷盗进行同性性行为时将精液射在另一只雄性的外生殖器上。外生殖器上沾有另一个体精液的雄赤拟谷盗在与雌赤拟谷盗交配时,把其外生殖器上沾有的精子也带入雌性体内并完成了受精(Levanetal.,2009)。也就是说,赤拟谷盗借助同性性行为实现了精子间接转移到雌体内。由此可见,赤拟谷盗的同性性行为并非浪费精力和体力,反而具有生殖优势,先前那只雄赤拟谷盗通过同性性行为间接完成了繁殖过程。研究人员还提出赤拟谷盗通过同性性行为可以释放储精囊内的老精子,有利于新精子的产生(Levanetal.,2009;Shimomuraetal.,2010)。但也有研究发现,雄性赤拟谷盗的同性性行为使其寿命变短(Spratt,1980)。
1.3 性内竞争
雄蝇常常需要通过性内竞争才能使雌蝇受精,在这种情况下,为了抢在竞争者之前得到雌蝇,一个策略是雄蝇趴到其他雄蝇身上并保持这个姿势,这样,当雌蝇飞过来时,上面的雄蝇最先飞到雌蝇身边并与其交配(Preston-Mafham,2006)。在一雌多雄多次交配制的昆虫中,粪蝇和茧蜂等雄性个体间要竞争与雌性个体的交配机会,往往采取先与雄性进行交配并对其造成损伤,以阻止其他雄性与雌性进行交配(Wendelken and Barth,1985;Preston-Mafham,2006;Kurecketal.,2011;Caballero-Mendieta and Cordero,2012;Kantetal.,2012)。又如,蝗虫间的雄性同性交配会使它们各自付出代价,这种代价或许增加了选择压力并促使其进化,因为雄性蝗虫释放出一种被称作panacetylnitrile的化学物质,这种化学物质能阻止其他雄性与其进行交配(Ronoetal.,2008)。
1.4 防御机制的进化
雄性非洲蝙蝠臭虫身上长有类似雌性的“扮异性”外生殖器,这种生殖器不具有生育能力;雌性非洲蝙蝠臭虫也具有“扮异性”特征,它们中只有六分之一的个体拥有雌性外生殖器,其余的则长有类似雄性的外生殖器。因为在交配过程中,雄性非洲蝙蝠臭虫的生殖器常会刺穿雌性臭虫的腹部,鉴于其交配行为常导致雌虫受伤,通过这种“扮异性”策略可以减少性吸引力,从而尽量避免交配带来的伤害(Reinhardtetal.,2007)。另外,研究表明白蚁同性串联追逐中被猛蚁捕食的风险低于单头爬行白蚁被捕食的风险,其同性性行为是一种防御策略(Matsuuraetal.,2002;Wenetal.,2012)。
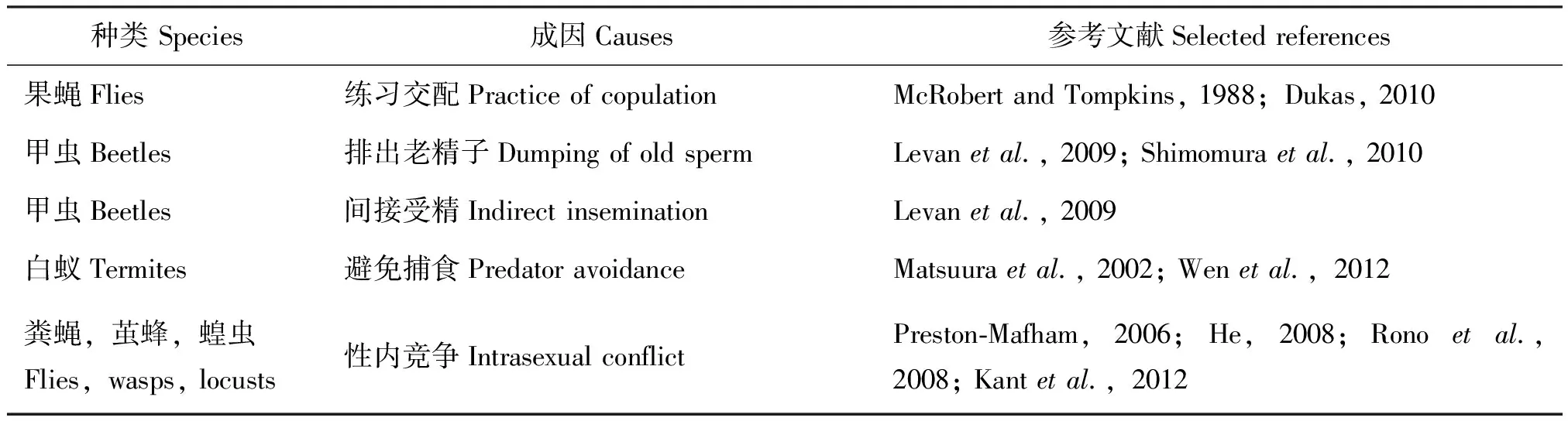
表1 昆虫同性性行为的适应性解释
另外,有些昆虫的同性性行为只能用非适应性进化进行解释(表2)。例如,昆虫若通过个体大小来判断潜在交配对象的雌雄,这很容易导致性别错误识别(Aiken,1981;Bland,1991;Solensky,2004)。身体大小可以反应个体的身体质量状况,通常大的个体其身体状况比小的要好,在交配过程中它们具有更强的竞争优势。有的雄性昆虫分辨雌雄靠个体活动能力进行判断,活动力高的个体具有更高的性吸引力,这种雌雄活跃程度的差异也很容易导致性别错误识别(Hemptinneetal., 1998)。另一种性别识别错误,可能是因为与雌性交配过的雄性昆虫沾有雌性信息素,或因雌性信息素在空气中扩散到雄性身体上而误被雄性昆虫错误识别(Keepingetal.,1986;Rasa,1995)。还有研究发现,若只允许豆娘的雄性与雄性在一起,这种“囚禁”会导致雄性豆娘同性性行为的发生(van Gossumetal., 2005)。有时雄性信息素也会引起雄性间相互吸引而导致昆虫同性性行为的发生(Curcillo and Tompkins, 1987;Lealetal., 1998)。
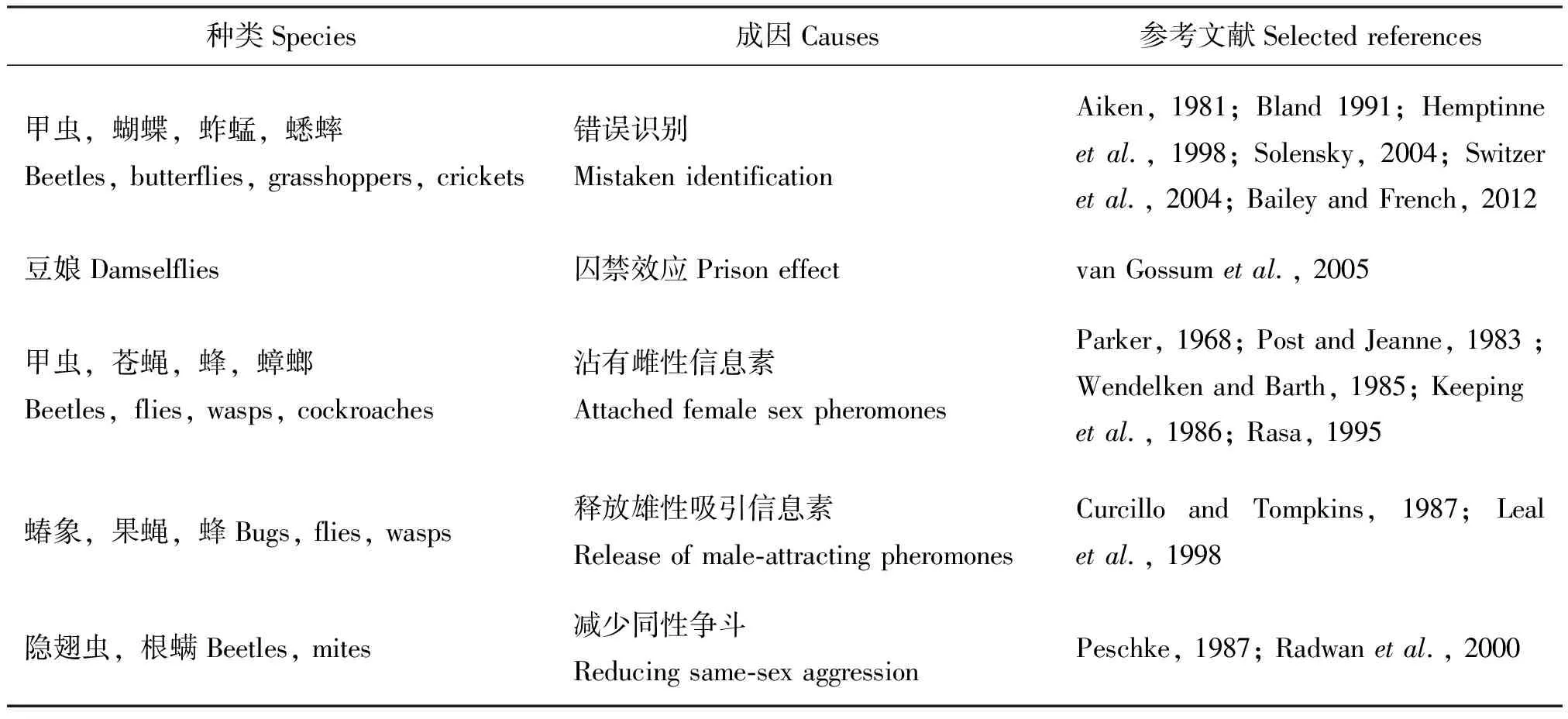
表2 昆虫同性性行为的非适应性解释
昆虫同性性行为在进化中可能有优势,从而被保留下来,即“同性性行为有进化优势”,这个表面上看很奇怪,不过有这种可能。因为,同性性行为这种自身不进行直接繁殖的行为也可以通过亲缘选择来传递自己的基因(饶毅,2012)。亲缘选择主要是对支配行为的基因起作用,它所增进的不一定是个体适合度,而是个体的广义适合度,所以,即使一个个体没有留下后代,它的广义适合度也不等于零,它的基因也可以靠旁系个体传递下去。
2 同性性行为的遗传基础
所有行为都一定有基因参与,只是不清楚多少基因参与某一特定行为、某个基因参与多大的程度、它参与的具体步骤和方式(饶毅,2012)。同性性行为是否有基因参与,答案是肯定的,越来越多的证据表明昆虫同性性行为的发生存在遗传基础。
2.1 神经递质水平的改变
郭爱克研究组以果蝇为模式动物,在研究多巴胺水平在帕金森病的神经基础中扮演的角色时,十分偶然地发现提高神经元中多巴胺水平可以诱发雄性果蝇间很强的同性性行为(Liuetal., 2008)。多巴胺是一种重要的神经递质,在果蝇雄性同性求偶中的作用呈倒“U”规律,即过高或过低都会导致雄性果蝇同性性行为发生,前者诱发的是主动的果蝇雄性同性求偶,即雄蝇自身的求偶倾向性发生改变;而后者诱发的是被动的果蝇雄性同性求偶,即雄蝇自身的吸引力发生改变(Liuetal., 2008)。通过改变几个基因可导致果蝇同性性行为的发生,有些基因是控制脑中谷氨酸和多巴胺的水平(Grosjeanetal., 2008)。饶毅研究组发现,当把两个同样含有五羟色胺相关基因突变的雄蝇放在一起时,雄性之间有爬跨和交配;当把基因突变的雄蝇与基因未突变的雄蝇放在一起,发现突变的雄蝇追逐未突变的雄蝇,而未突变的雄蝇并不追逐突变的雄蝇,可见,五羟色胺相关基因突变造成雄蝇同性性行为的发生(饶毅,2012)。
2.2 基因突变或基因表达的改变
Gill(1963)发现了第一个造成雄果蝇性取向变化的基因,他发现的基因以后被称为无果或无后基因(Fruitless),“无果或无后”是基因突变造成的,雄蝇突变体对雌性索然无味,但却对雄性兴趣盎然并试图与其交配(Ryneretal., 1996)。上世纪90年代以来,在果蝇中还发现了其它几个同性性行为相关基因。
Zhang和Odenwald(1995)发现导致果蝇红眼白化的基因(白化基因)影响果蝇体内五羟色胺的合成,而五羟色胺对果蝇的性取向起到一定的作用,将这一基因植入果蝇胚胎,胚胎发育成熟后,基因的植入导致了受试果蝇的性取向改变,它们疯狂地追逐同性,并试图与同性交配,这表明,该基因的植入能导致果蝇同性性行为的发生。
研究人员通过对果蝇进行遗传改造,使其脑细胞中产生一个叫做Shibire-ts的基因突变,Shibire-ts是一种与循环使用神经递质有关的蛋白,其正常工作温度是19℃,但在30℃时,它会失活;当为一个被称为C309的果蝇品系提供30℃环境温度时,雄果蝇在几分钟之内开始向雄果蝇求偶和交配,当把环境温度降低到19℃时,雄果蝇便抛下同性并自行离开(Kitamoto,2002;Murpheyetal.,2003)。
Demir和Dickson(2005)通过改变果蝇的Fruitless基因,即可改变果蝇的性取向。正常雄果蝇大脑中存在一种神经细胞,这种神经细胞决定了果蝇的性取向,“无果”基因发生突变的雄果蝇都无法产生一种名为Fru的蛋白质,缺少了Fru蛋白的雄果蝇就会缺少这种神经细胞,导致性取向发生变化。
雄性果蝇因为缺失某一特异的气味受体基因而导致其对雌性的求爱信号无动于衷,但对雄性果蝇表现出暧昧的倾向,引发这一异常的求偶表现主要是由于这些雄性果蝇会错误地感受雌性果蝇和雄性果蝇释放的性信息素(Miyamoto and Amrien,2008)。
Featherstone等(2008)发现了一种被称为“性盲”(Genderblind)的基因,该基因与将谷氨酸盐运输出神经胶质细胞有关,利用遗传手段和药物改变果蝇的神经突触,结果发现,它们能够在几小时之内开启或关闭果蝇的同性性行为。
3 总结与展望
同性性行为存在着进化悖论,备受人们的关注。经过国内外学者几十年的探索,昆虫同性性行为的成因、进化意义和遗传基础等研究取得了可喜进展。然而,昆虫同性性行为研究仍存在一些问题。
3.1 研究不系统
同性性行为虽已在一些昆虫(主要是鞘翅目、双翅目和膜翅目昆虫)里有过研究,但大部分研究仅仅是报道发现存在昆虫同性性行为并推测了其成因和进化意义,而对昆虫同性性行为的发生率和潜在代价(如能量消耗、寿命和时间损失等)研究很少,缺乏系统的调查与实验验证。
3.2 研究不平衡
对昆虫同性性行为的进化意义研究较多且研究对象广泛,而对其遗传基础研究较少且研究对象单一,主要集中在果蝇。除果蝇外,赤拟谷盗也是研究昆虫同性性行为的模式生物。赤拟谷盗的性行为包括接触、爬跨和交配三步(沈加飞等,2016),在此过程中基本不飞,性行为简单且易观察,是研究昆虫性行为的理想系统。尽管已有很多研究表明,雄性赤拟谷盗间存在同性性行为(Wool,1967;Taylor and Sokoloff,1971;Rich,1972, 1989;Serranoetal.,2000),且其同性性行为是可遗传的(Graur and Wool,1982;Serranoetal.,1991;Castroetal.,1994),但关于赤拟谷盗同性性行为产生的遗传基础和分子机制尚不清楚,需尽快开展此研究。
3.3 研究有待深入
虽然对昆虫同性性行为的遗传基础已有一些认识,但还是知之甚少。作为神经递质,多巴胺和五羟色胺是如何通过其合成、释放和受体介导的信号转导通路调控果蝇性取向改变的呢?应进一步筛选参与果蝇同性性行为的神经递质相关基因,寻找神经通路,阐明其分子机制。另外,昆虫同性性行为有基因参与,但也不能排除环境的作用,因为环境和基因之间可相互作用;随着分子生物学技术的迅猛发展,相对而言比较容易研究基因参与,但很多环境因素迄今较难控制和观察从而不便研究(饶毅,2012)。
3.4 研究有待交叉
对同性性行为的研究,通常采用遗传学和分子生物学的方法,未来应不局限于这两种方法,利用其它方法(如电生理和成像等),并根据需要建立新方法,进行系统性研究。在自然界中,存在同性性行为的动物已发现约有450种,包括哺乳类、鸟类、爬行类、两栖类、鱼类和昆虫等(Sommer and Vasey,2006)。研究昆虫同性性行为的科学家与研究其它动物同性性行为的科学家应携起手来,搭建一个高水平的学术交流平台,启迪思维,碰撞智慧,促进学科交叉与融合,共同解决同一科学问题。
References)
Aiken RB. The relationship between body weight and homosexual mounting inPalmacorixananaWalley (Heteroptera: Corixidae)[J].FloridaEntomologist,1981,64: 267-271.
Andersson M, Simmons LW. Sexual selection and mate choice[J].TrendsinEcology&Evolution, 2006, 21: 296-302.
Arnaud L, Haubruge E. Mating behavior and male mate choice inTriboliumcastaneum(Coleoptera, Tenebrionidae)[J].Behavior, 1999, 136: 67-77.
Bagemihl B. Biological Exuberance: Animal Homosexuality and Natural Diversity[M]. New York: St. Martin’s Press, 1999.
Bailey NW, French N. Same-sex sexual behavior and mistaken identity in male field crickets,Teleogryllusoceanicus[J].AnimalBehavior, 2012, 84: 1031-1038.
Bailey NW, Zuk M. Same-sex sexual behavior and evolution[J].TrendsinEcologyandEvolution, 2009, 24: 339-446.
Bland RG. Mating behavior ofPhaulacridiumvittatumSjöstedt (Orthoptera: Acrididae)[J].JournaloftheAustralianEntomologicalSociety, 1991, 30: 221-229.
Caballero-Mendieta N, Cordero C. Enigmatic liaisons in Lepidoptera: A review of same-sex courtship and copulation in butterflies and moths[J].JournalofInsectScience,2012,12:138.
Castro L, Toro MA, Lopez-Fanjul C. The genetic properties of homosexual copulation behavior inTriboliumcastaneum: Artificial selection[J].GeneticsSelectionEvolution,1994,26: 361-367.
Curcillo PG, Tompkins L. The ontogeny of sex appeal inDrosophilamelanogastermales[J].BehaviorGenetics, 1987, 17: 81-86.
Demir E, Dickson BJ. Fruitless splicing specifies male courtship behavior inDrosophila[J].Cell, 2005, 121: 785-794.
Dukas R.Causes and consequences of male-male courtship in fruit flies[J].AnimalBehavior, 2010, 80: 913-919.
Featherstone DE, Yanoga F, Grosjean Y. Accelerated bang recovery inDrosophilagenderblind mutants[J].CommunitativeandIntegrativeBiology, 2008, 1: 14-17.
Gill KS. A mutation causing abnormal courtship and mating behaviour in males ofDrosophilamelanogaster[J].AmericanZoologist, 1963, 3: 507.
Graur D, Wool D. Dynamics and genetics of mating behavior inTriboliumcastaneum(Coleoptera: Tenebrionidae)[J].BehaviorGenetics, 1982, 12: 161-179.
Grosjean Y, Grillet M, Augustin H,etal. A glial amino-acid transporter controls synapse strength and courtship inDrosophila[J].NatureNeuroscience, 2008, 11: 54-61.
He XZ. Reproductive Behavior ofAphidiuserviHaliday (Hymenoptera: Aphidiidae)[D]. PhD Thesis, Massey University, 2008.
Hemptinne JL, Lognay G, Dixon AFG. Mate recognition in the two-spot ladybird beetle,Adaliabipunctata: Role of chemical and behavioral cues[J].JournalofInsectPhysiology, 1998, 44: 1163-1171.
Kant R, Minor MA, Trewick SA. Reproductive strategies ofDiaeretiellarapae(Hymenoptera: Aphidiinae) during fluctuating temperatures of spring season in New Zealand[J].BiocontrolScienceandTechnology, 2012, 22:1-9.
Keeping MG, Lipschitz D, Crewe RM. Chemical mate recognition and release of male sexual behavior in polybiine wasp,Belonogasterpetiolata(DeGeer) (Hymenoptera: Vespidae)[J].JournalofChemicalEcology, 1986, 12:773-779.
Kitamoto T.Targeted expression of temperature-sensitive dynamin to study neural mechanisms of complex behavior inDrosophila[J].JournalofNeurogenetics, 2002, 16: 205-228.
Kureck IM, Neumann A, Foitzik S. Wingless ant males adjust mate-guarding behavior to the competitive situation in the nest[J].AnimalBehavior, 2011, 82: 339-346.
Leal WS, Kuwahara S, Shi X,etal. Male-released sex pheromone of the stink bugPiezodorushybneri[J].JournalofChemicalEcology, 1998, 24: 1817-1829.
Levan KE, Fedina TY, Lewis SM. Testing multiple hypotheses for the maintenance of male homosexual copulatory behavior in flour beetles[J].JournalofEvolutionaryBiology, 2009, 22: 60-70.
Liu T, Dartevelle L, Yuan CY,etal. Increased dopamine level enhances male-male courtship inDrosophila[J].JournalofNeuroscience, 2008, 28: 5539-5546.
Matsuura K, Kuno E, Nishida T. Homosexual tandem running as selfish herd inReticulitermessperatus: Novel antipredatory behavior in termites[J].JournalofTheoreticalBiology, 2002, 214:63-70.
Mcrobert SP, Tompkins L. Two consequences of homosexual courtship performed byDrosophilamelanogasterandDrosophilaaffinismales[J].Evolution, 1988, 42: 1093-1097.
Miyamoto T, Amrien H. Suppression of male courtship by aDrosophilapheromone receptor[J].NatureNeuroscience, 2008, 11: 874-876.
Murphey RK, Froggett SJ, Caruccio P,etal. Targeted expression ofshibiretsandsemaphorinlareveals critical periods for synapse formation in the giant fiber ofDrosophila[J].Development, 2003, 130: 3671-3682.
Parker GA.The sexual behaviour of the blowfly,ProtophormiaterraenovaeR.D[J].Behavior, 1968, 32: 291-308.
Peschke K. Cuticular hydrocarbons regulate mate recognition, male aggression, and female choice of the rove beetle,Aleocharacurtula[J].JournalofChemicalEcology,1987,13:1993-2008.
Post DC, Jeanne RL. Venom: Source of a sex pheromone in the social waspPolistesfuscatus(Hymenoptera: Vespidae)[J].JournalofChemicalEcology, 1983, 9: 259-266.
Preston-Mafham K. Post-mounting courtship and the neutralizing of male competitors through homosexual mountings in the flyHydromyzalivensF. (Diptera: Scatophagidae)[J].JournalofNaturalHistory, 2006, 40: 101-105.
Radwan J, Czyz M, Konior M,etal. Aggressiveness in two male morphs of the bulb miteRhizoglyphusrobini[J].Ethology, 2000, 106: 53-62.
Rao Y.To understand heterosexuality, one must know homosexuality[J].ScienceandCultureReview, 2012, 9(5): 63-74. [饶毅.欲解异性恋, 须知同性恋[J].科学文化评论, 2012, 9(5): 63-74]
Rasa OAE. Ecological factors influencing burrow location, group size and mortality in a nocturnal fossorial Kalahari detritivore,ParastizopusarmaticepsPeringuey (Coleoptera: Tenebrionidae)[J].JournalofAridEnvironments, 1995, 29: 353-365.
Reinhardt K, Harney E, Naylor R,etal. Female-limited polymorphism in the copulatory organ of a traumatically inseminating insect[J].TheAmericanNaturalist, 2007, 170: 931-935.
Rich E. Homosexual behavior in three melanic mutants ofTriboliumcastaneum[J].TriboliumInformationBulletin, 1989, 29: 99-101.
Rich E. Homosexual behavior related to a melanic mutant inTriboliumcastaneum[J].TriboliumInformationBulletin, 1972, 15: 97.
Rono E, Njagi PG, Bashir MO,etal. Concentration-dependent parsimonious releaser roles of gregarious male pheromone of the desert locust,Schistocercagregaria[J].JournalofInsectBehavior, 2008, 54: 162-168.
Ryner LC, Goodwin SF, Castrillon DH,etal. Control of male sexual behavior and sexual orientation inDrosophilaby the fruitless gene[J].Cell, 1996, 87: 1079-1089.
Scharf I, Martin OY. Same-sex sexual behavior in insects and arachnids: Prevalence, causes, and consequences[J].BehavioralEcologyandSociobiology, 2013, 67: 1719-1730.
Serrano JM, Castro L, Toro MA,etal. Inter- and intraspecfic sexual discrimination in the flour beetlesTriboliumcastaneumandTriboliumconfusum[J].Heredity, 2000, 85: 142-146.
Serrano JM, Castro L, Toro MA,etal. The genetic properties of homosexual behavior inTriboliumcastaneum: Diallel analysis[J].BehaviorGenetics, 1991, 21: 547-558.
Shen JF, Cheng C, Ming QL. Study on reproductive isolation betweenTriboliumcastaneumandT.confusum[J].JournalofEnvironmentalEntomology, 2016, 38(3): 508-513. [沈加飞, 程超, 明庆磊. 赤拟谷盗和杂拟谷盗的生殖隔离研究[J]. 环境昆虫学报, 2016, 38(3): 508-513]
Shimomura K, Mimura T, Ishikawa S,etal. Variation in mate recognition specificities among fourCallosobruchusseed beetles[J].EntomologiaExperimentalisetApplicata, 2010, 135: 315-322.
Solensky MJ. The effect of behavior and ecology on male mating success in overwintering Monarch butterflies (Danausplexippus)[J].JournalofInsectBehavior, 2004, 17: 723-743.
Sommer V, Vasey PL. Homosexual Behaviour in Animals[M]. Cambridge University Press, 2006.
Spratt EC. Male homosexual behaviour and other factors influencing adult longevity inTriboliumcastaneumandT.confusum[J].JournalofStoredProductsReserch, 1980, 16: 109-114.
Switzer PV, Forsythe PS, Escajeda K,etal. Effects of environmental and social conditions on homosexual pairing in the Japanese beetle (PopilliajaponicaNewman)[J].JournalofInsectBehavior, 2004, 17: 1-16.
Taylor C, Sokoloff A. A review of mating behavior inTribolium[J].TriboliumInformationBulletin, 1971, 14: 88-91.
Van Gossum H, De Bruyn L, Stoks R. Reversible switches between male-male and male-female mating behavior by male damselflies[J].BiologyLetters, 2005, 1: 268-270.
Wen P, Ji BZ, Liu SW,etal. Sex-pairing pheromone in the Asian termite pest speciesOdontotermesformosanus[J].JournalofChemicalEcology, 2012, 38: 566-575.
Wendelken PW, Barth RH. On the significance of pseudofemale behavior in the neotropical cockroach generalBlaberus,ArchimandritaandByrsotria[J].Psyche, 1985, 92: 493-503.
Wool D. Some observations on mating frequencies inTriboliumcastaneumstrains[J].TriboliumInformationBulletin, 1967, 10: 182-186.
Zhang SD, Odenwald WF. Misexpression of the white (w) gene triggers male-male courtship inDrosophila[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1995, 92: 5525-5529.
The progress of studies on homosexual behavior in insects
MING Qing-Lei*,CHENG Chao
(School of Life Sciences, Jiangsu Normal University, Xuzhou 221116, Jiangsu Province, China)
In the view of natural and sexual selection, homosexual behavior represents an evolutionary paradox. The topic on causes and significances of homosexual behavior is an important research issue in evolutionary biology. Here we reviewed the ethology, causes, evolutionary implications and genetic bases of homosexual behavior in insects. Not only were the existed problems analyzed, but research directions were also proposed, which was expected to provide references for the future study. At the same time, we hope that more and more researchers pay attention to the homosexual behavior in insects, focus on it, devote themselves to the great job and make a great contribution to the research area.
Insects; homosexual behavior; evolutionary paradox; causes; genes
国家自然科学基金(31172159);教育部留学回国人员科研启动基金(教外司留[2012]1707号)
明庆磊,男,山东聊城人,博士,教授,主要从事昆虫遗传与进化方面的研究
*通讯作者Author for correspondence, E-mail: mingqinglei@jsnu.edu.cn
Received:2016-06-17;接受日期Accepted:2016-07-21
Q968.1
A
1674-0858(2016)05-0877-06
