甘草对大鼠体内雷公藤甲素和雷公藤内酯酮代谢物水平的影响Δ
2016-11-18刘建群张国华余昭芬王雪梅江西中医药大学现代中药制剂教育部重点实验室南昌330004
刘建群,张国华,余昭芬,王雪梅(江西中医药大学现代中药制剂教育部重点实验室,南昌 330004)
甘草对大鼠体内雷公藤甲素和雷公藤内酯酮代谢物水平的影响Δ
刘建群*,张国华,余昭芬,王雪梅(江西中医药大学现代中药制剂教育部重点实验室,南昌330004)
目的:研究甘草对大鼠体内雷公藤甲素(TPL)和雷公藤内酯酮(TPN)内源代谢物水平的影响。方法:取160只大鼠ig甘草[30 g(生药)/kg]2 h后ip TPN(2.8 mg/kg),连续30 d,收集24 h尿液,合并30 d尿液,采用柱色谱技术和波谱技术分离鉴定其内源代谢物;并采用超高效液相色谱-高分辨飞行时间质谱联用法(UPLC-Q-TOF/MS)确定TPL给药后是否具有共同代谢物。将60只大鼠随机分为TPL空白组、TPL组、甘草+TPL组、TPN空白组、TPN组、甘草+TPN组,各给药组大鼠给药方式及剂量同上,TPL空白组和TPN空白组大鼠分别ip相应溶剂,每天1次,连续7 d;采用UPLC-Q-TOF/MS法研究甘草对大鼠体内TPL、TPN内源代谢物水平的影响。结果:从TPN给药大鼠尿液中共分离出5个内源代谢物,分别鉴定为1-甲基海因、4-氨基烟酸甲酯、3,4-二氢-6-羟基-2-喹啉酮、2,6-二羟基喹啉、2-喹啉酮;TPL给药后大鼠尿液中同样存在这5种代谢物。TPL组大鼠尿液中1-甲基海因水平较TPL空白组显著升高(P<0.05),TPN组大鼠尿液中2,6-二羟基喹啉水平较TPN空白组显著升高(P<0.05);TPL或TPN联合甘草用药后血清中1-甲基海因、2,6-二羟基喹啉水平均降低,较其空白组差异无统计学意义(P>0.05)。结论:本实验首次从TPL和TPN给药大鼠尿液中分离鉴定出了5个内源代谢物;甘草能回调TPL给药大鼠尿液中1-甲基海因水平以及TPN给药后大鼠尿液中2,6-二羟基喹啉水平。
甘草;雷公藤甲素;雷公藤内酯酮;内源代谢物;大鼠
雷公藤(Tripteryginum Wilfordii Hook.F)属卫茅科植物,临床上常用于治疗类风湿性关节炎、慢性肾炎、红斑狼疮等难治性免疫功能亢进疾病,其良好的临床疗效已得到国内外的一致肯定,但是雷公藤也是不良反应报道最多的中草药之一[1]。雷公藤甲素(Triptolide,TPL)和雷公藤内酯酮(Triptonide,TPN)是雷公藤的主要活性成分,是一类环氧二萜内酯化合物,具有显著的免疫抑制、抗炎、抗肿瘤和抗生育等活性;但同时也是其主要毒性成分,具有很强的肝脏、肾、心脏和生殖系统等毒性[1]。虽然其毒副作用制约了雷公藤类药物的临床应用,但是从治疗类风湿性关节炎疗效来看,目前还没有其他药物能够取代雷公藤类药物。据研究报道,甘草对雷公藤类药物具有确切的减毒作用,但是其减毒作用机制尚不清楚[2]。笔者在前期研究中发现,甘草能显著降低TPL和TPN的最大血药浓度和药时曲线下面积,增加清除率,加速其体内代谢和排泄,降低组织分布浓度[3-4]。甘草具有肝药酶诱导作用[5],而体内酶系是药物代谢变化的本质因素,故甘草还可能通过干预内源性代谢物通路,即干预药物代谢组学,从而影响TPL和TPN的毒性。因此,在本文中笔者拟从干预内源性代谢物通路的角度来探讨甘草对TPL和TPN的减毒机制。
1 材料
1.1仪器
AE-240十万分之一分析天平(瑞士梅特勒公司);TL-5.0W台式离心机(上海市离心机械研究所);Agilent 1260自动超高效液相色谱(UPLC)仪(美国Agilent公司);Triple TOF 5600+高分辨飞行时间质谱(Q-TOF/MS)仪(美国AB Sciex公司);2-16K台式高速冷冻离心机(德国Sigma公司);Microfuge 16台式微量离心机(美国Beckman公司);Bruker AV-500核磁共振波谱(NMR)仪(瑞士Bruker公司)。
1.2药材、对照品与试剂
甘草(购自亳州市长生中药饮片有限公司,批号:130902,经刘建群教授本人鉴定为甘草的干燥根和根茎);TPL、TPN对照品(郑州丰耀农业科技有限公司,批号:FY140320、FY140325,纯度:≥99%);聚氧乙烯氢化蓖麻油(RH40,德国BASF公司);乙腈(美国ACS公司,色谱纯);2-氯-L-苯丙氨酸(美国阿拉丁公司,批号:C105993,纯度:≥98.5%);甲酸为色谱纯,其余试剂均为分析纯。
1.3动物
SD大鼠220只,SPF级,♀♂各半,体质量200~220 g,购自湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2013-0004]。
2 方法与结果
2.1溶液的制备
2.1.1甘草溶液精密称取甘草药材800 g,切片,加4倍量水煎煮2次,每次1 h,过滤,合并滤液,减压蒸干,得甘草浸膏约80 g,用适量蒸馏水将浸膏制备成以生药量计质量浓度为10 g/ml的甘草溶液,备用。
2.1.2TPL溶液精密称取TPL对照品2.0 mg,置于10 ml量瓶中,用20%丙二醇生理盐水溶液溶解并稀释至刻度,即得质量浓度为0.2mg/ml的TPL溶液,备用。
2.1.3TPN溶液精密称取TPN对照品3.0 mg,置于10 ml量瓶中,加入无水乙醇1 ml,超声溶解后,加入1 ml RH40,混匀后,加入生理盐水溶液至刻度,即得质量浓度为0.3 mg/ml的 TPN溶液,备用。
2.1.4内标溶液称取2-氯-L-苯丙氨酸50 mg,用甲醇定容于50ml量瓶中,备用。
2.2内源代谢物的提取、分离与鉴定
2.2.1内源代谢物提取与分离取大鼠160只,以30 g(生药)/kg的剂量ig甘草溶液2 h后ip TPN溶液,放入代谢笼中,自由饮水,连续给药30 d。收集24 h尿液,将30 d内收集的尿液合并。尿液减压浓缩后用甲醇沉淀蛋白,过滤,将滤液减压浓缩得浸膏;浸膏用水溶解后,依次用乙酸乙酯和正丁醇萃取,减压浓缩回收溶剂,得乙酸乙酯部位71 g。将乙酸乙酯部位经MCI色谱柱层析,甲醇-水梯度洗脱(0∶1、1∶9、1∶3、2∶3、11∶9、7∶3、17∶3、1∶0,V/V),得8个流份。将MCI色谱柱甲醇-水(1∶9)流份经ODS色谱柱层析,甲醇-水梯度洗脱(0∶1、3∶7、1∶1、7∶3、1∶0),得甲醇-水(3∶7)流份再经硅胶色谱柱层析,氯仿-甲醇梯度洗脱(50∶1、40∶1、30∶1),氯仿-甲醇(30∶1)流份析出化合物1。将MCI色谱柱甲醇-水(1∶3)流份经ODS色谱柱层析,甲醇-水梯度洗脱(0∶1、3∶7、1∶1、7∶3、1∶0),得甲醇-水(1∶1)流份再经硅胶色谱柱层析,氯仿-甲醇梯度洗脱(1∶0、20∶1、5∶1、1∶1、0∶1),氯仿-甲醇(20∶1)流份析出化合物2。将MCI色谱柱甲醇-水(2∶3)流份经中性氧化铝色谱柱层析,依次用二氯甲烷、二氯甲烷-乙酸乙酯(1∶1)洗脱,得二氯甲烷-乙酸乙酯(1∶1)流份再经高效液相色谱法制备[Diamonsieuil C18(250 mm×4.6 mm,5 μm),流速:1 ml/min,柱温:30℃,检测波长:218 nm,流动相:乙腈-水,梯度条件:0 min→30 min(12%乙腈)→31 min(100%乙腈)→35 min(100%乙腈)],收集保留时间为7.2~7.9 min的流份,析出化合物3和化合物4。将MCI色谱柱甲醇-水(11∶9)流份经ODS色谱柱层析,甲醇-水梯度洗脱(0∶1、10∶1、5∶1、1∶1、1∶0),甲醇-水(1∶1)流份析出化合物5。化合物均采用甲醇重结晶纯化。
2.2.2内源代谢物结构的鉴定化合物1,无色方晶(甲醇)。ESI-MS m/z:[M+H]+115、[M+Na]+137、[M-H]-113,HR-TOF/ MS m/z:[M+H]+115.050 9,分子式为C4H6N2O2。1H-NMR(300 MHz,CD3OD)δH:3.96(2H,s,H-5)、2.91(3H,s,CH3)。13C-NMR(75 MHz,CD3OD)δ:157.0(C-2)、173.8(C-4)、53.9(C-5)、29.2(CH3)。以上波谱数据与文献[6]报道基本一致,并进一步通过单晶X衍射图谱确定化合物1为1-甲基海因。晶体参数如下:C4H6N2O2,M=114.11,T=293(2)K,l=0.710 73 Å,单斜晶系,P21/C,a=5.6170(11),b=12.173(2),c=8.096 0(16)Å,V=533.02(18)Å3,z=4,Dc=1.422 mg/m3,(Mo Ka)=0.074 mm-1,F(000)=240。化合物1单晶X衍射结构图见图1。

图1 化合物1单晶X衍射结构图Fig 1 X-ray crystal structure of compound 1
化合物2,白色针状结晶(甲醇)。ESI-MS m/z:[M+H]+153、[M+Na]+175、[M+Cl]-187,HR-TOF/MS m/z:[M+H]+153.066 4,分子式为C7H8N2O2。1H-NMR(500 MHz,CD3OD)δH:8.55(1H,d,J=2.4 Hz,H-2)、6.52(1H,d,J=7.4 Hz,H-5)、7.72(1H,dd,J=7.4、2.4 Hz,H-6)、3.81(3H,s,H-CH3);13C-NMR(125 MHz,CD3OD)δ:147.7(C-2)、119.7(C-3)、168.3(C-4)、121.3(C-5)、143.7(C-6)、178.8(C=O)、44.8(CH3)。以上波谱数据与文献[7]报道基本一致,故确定化合物2为4-氨基烟酸甲酯。
化合物3,白色针状结晶(甲醇)。ESI-MS m/z:[M+H]+164、[M+Na]+186、[M+Cl]-198,HR-TOF/MS m/z:[M+H]+164.071 0,分子式为C9H9NO2。1H-NMR(300 MHz,CD3OD)δH:2.51(2H,t,J=7.7 Hz,H-3)、2.86(2H,t,J=7.7 Hz,H-4)、6.57(1H,d,J=2.4 Hz,H-5)、6.62(1H,dd,J=8.4,2.4 Hz,H-7)、6.69(1H,d,J=8.4 Hz,H-8)。13C-NMR(75 MHz,CD3OD)δ:173.6(C-2)、31.5(C-3)、26.4(C-4)、115.7(C-5)、154.5(C-6)、114.8(C-7)、117.5(C-8)、126.6(C-9)、131.2(C-10)。以上波谱数据与文献[8]报道基本一致,故确定化合物3为3,4-二氢-6-羟基-2-喹啉酮。
化合物4,淡黄色粉末(甲醇)。ESI-MS m/z:[M+H]+162、[2M+H]+323、[M+Na]+184、[M+Cl]-196,HR-TOF/MS m/z:[M+H]+162.055 4,分子式C9H7NO2。1H-NMR(300 MHz,CD3OD)δH:6.60(1H,d,J=9.6 Hz,H-3)、7.86(1H,d,J=9.6 Hz,H-4)、7.03(1H,d,J=2.0 Hz,H-5)、7.10(1H,dd,J=9.0、2.0 Hz,H-7)、7.25(1H,d,J=9.0 Hz,H-8)。13CNMR(75 MHz,CD3OD)δ:164.8(C-2)、121.8(C-3)、142.3(C-4)、112.6(C-5)、154.4(C-6)、121.6(C-7)、117.8(C-8)、122.4(C-9)、133.3(C-10)。以上波谱数据与文献[9]报道基本一致,故确定化合物4为2,6-二羟基喹啉。
化合物5,白色粉末(甲醇)。ESI-MS m/z:[M+H]+146、[M+Na]+168,HR-TOF/MS m/z:[M+H]+146.060 6,分子式为C9H7NO。1H-NMR(300 MHz,CD3OD)δH:6.61(1H,d,J=9.5 Hz,H-3)、7.96(1H,d,J=9.5 Hz,H-4)、7.67(1H,d,J=7.8 Hz,H-5)、7.26(1H,dd,J=7.8、7.6 Hz,H-6)、7.55(1H,dd,J=8.2、7.6 Hz,H-6)、7.36(1H,d,J=8.2 Hz,H-8)。13CNMR(75 MHz,CD3OD)δ:161.9(C-2)、121.8(C-3)、142.8(C-4)、129.2(C-5)、124.0(C-6)、132.0(C-7)、116.7(C-8)、138.8(C-9)、119.0(C-10)。以上波谱数据与文献[10]报道基本一致,故确定化合物5为2-喹啉酮。
因TPL与TPN具有相似的结构和毒性机制,笔者推测TPL在大鼠体内可能产生与TPN相似的内源代谢物,经UPLC-QTOF/MS测定发现TPL给药组同样具有化合物1~5的内源代谢物(具体检测条件见“2.3.2”项下)。
2.3内源代谢物检测
2.3.1大鼠分组、给药及样品处理 (1)分组与给药。SD大鼠60只,随机分为TPL空白组、TPL组、TPL+甘草组、TPN空白组、TPN组和TPN+甘草组,每组10只。TPL空白组大鼠ip 20%丙二醇生理盐水溶液;TPL组大鼠按0.7 mg/kg的剂量ip TPL溶液;TPN空白组大鼠ip 10%乙醇+10%RH40生理盐水溶液:TPN组大鼠按2.8 mg/kg的剂量ip TPN溶液;联合给药组大鼠在ip TPL或TPN溶液之前2 h以30 g(生药)/kg的剂量ig甘草溶液。TPL和TPN的给药剂量均约为其半数致死量,以造成急性毒性模型。各组大鼠均在每天早上固定时间给药,连续给药7d。
(2)尿样采集。采用大鼠代谢笼法收集6组大鼠每天10:30到16:30的尿液。给药及收集尿液期间大鼠自由饮水,但每天从22:30到第2天16:30禁食。
(3)样品处理。将“2.3.2”项下收集的各组大鼠尿液以4 300× g离心10 min,取上清液1 ml,加入1 ml甲醇,混匀,静置,然后再次在4℃、21 920×g条件下离心10 min。取上清液1.5 ml,加入0.1 ml 2-氯-L-苯丙氨酸内标参比溶液,混匀,置-20℃冰箱保存,用于UPLC-Q-TOF/MS分析。
(4)5个内源代谢物混合对照品溶液制备。精密称取各对照品,用甲醇制备成质量浓度为0.1mg/ml的混合对照品溶液。2.3.2UPLC-Q-TOF/MS测定 (1)色谱条件。色谱柱:Thermo C18(100 mm×2.1 mm,2.2 μm);流动相A:0.1%甲酸水溶液,B:乙腈(梯度洗脱:0~4 min,5%→5%B;4~19 min,5%→21%B;19~25 min,21%→100%B;25~30 min,100%B;30~30.1 min,100%→5%B;30.1~35 min,5%B);流速:0.3 ml/ min;柱温:30℃;进样量:2μl。
(2)质谱条件。正离子源喷雾电压:5 500V;离子源温度:600℃;裂解电压(DP):100 V;碰撞能量(CE):55 eV;碰撞能量扩展(CES):20 eV;雾化气体:氮气,辅助气(GS)1、2均为60 Psi,气帘气(CUR)为35 Psi;一级质谱母离子扫描范围为50~500,信息关联数据采集(IDA),设置响应值超过10 cps的6个最高峰进行二次质谱扫描,子离子扫描范围为50~500。
(3)数据处理。计算各组5个内源代谢物分子离子峰([M+H]+)面积与内标峰面积的相对比值,以表示各内源代谢物的水平。采用SPSS 11.5软件进行统计分析,组间差异比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2.3.3UPLC-Q-TOF/MS分析结果随着给药天数的增加,TPL组大鼠尿液中1-甲基海因水平呈上升趋势,到给药第5、6天达到最高水平,与TPL空白组比较差异有统计学意义(P<0.05);而TPL与甘草联合给药后,大鼠尿液中1-甲基海因的水平回落,与TPL空白组比较差异无统计学意义(P>0.05)。随着给药天数的增加,TPN组大鼠尿液中2,6-二羟基喹啉的水平升高,与TPN空白组比较差异有统计学意义(P<0.05);而TPN与甘草联合给药后,大鼠尿液中2,6-二羟基喹啉的水平回落,与TPN空白组比较差异无统计学意义(P>0.05)。以上结果提示,1-甲基海因和2,6-二羟基喹啉可能分别为TPL和TPN的毒性生物标志物,预先给予甘草溶液后这2个内源代谢物水平得到回调。然而各组中其余内源代谢物的水平差异均无统计学意义(P>0.05),这提示这些未有变化的内源代谢物可能与TPL或TPN的毒性无关,故其图略。TPL 3个组大鼠尿液中1-甲基海因随给药天数变化的趋势见图2,TPN 3个组大鼠尿液中2,6-二羟基喹啉随给药天数变化的趋势见图3。
3 讨论
采用柱色谱和核磁共振等技术从大鼠尿液中分离鉴定了5个内源代谢物,这5个内源代谢物均为首次从大鼠尿液中分得。通过对空白组与TPL或TPN单独给药组组间大鼠尿液中内源代谢物的差异性分析,发现1-甲基海因和2,6-二羟基喹啉可能分别为TPL和TPN毒性生物标记物。与空白组相比,TPL组或TPN组大鼠尿液中这2个毒性生物标记物的水平均上调,预先给予甘草后这2个内源代谢物水平又得到回调。
其中,1-甲基海因具有良好的平喘镇咳和抗抑郁等活性[11-12]。1-甲基海因是肌酐的体内代谢物,对人肾小管上皮细胞具有一定的细胞毒和诱导凋亡作用,其是肌酐降解成甘氨酸的中间产物[13]。1-甲基海因还涉及精氨酸、脯氨酸、脲循环等代谢途径[14]。肌酐是肾损伤的重要生化指标之一。TPL具有较强肾毒性,能导致肌酐显著升高[15],从而可能导致其中间代谢物1-甲基海因水平的上调,因此1-甲基海因可能为TPL的肾毒性生物标志物。甘草能回调1-甲基海因,说明甘草对TPL造成的肾损伤具有一定的保护作用。2,6-二羟基喹啉即6-羟基-2(1H)-喹啉酮及其衍生物具有抗菌和正性肌力活性,是合成强心、降压、治疗糖尿病、促进脑循环、抗哮喘和抗溃疡药物的重要中间体,是细菌降解喹啉的中间代谢物之一,也是动物体内喹啉和色氨酸的代谢物[16],由于体内的色氨酸95%以上由肝细胞代谢,肝功能障碍可明显影响色氨酸在体内的代谢状态[17]。研究结果表明,TPN能诱导2,6-二羟基喹啉上调,甘草能起回调作用。TPN的毒性以及甘草的解毒作用可能与色氨酸代谢有关。
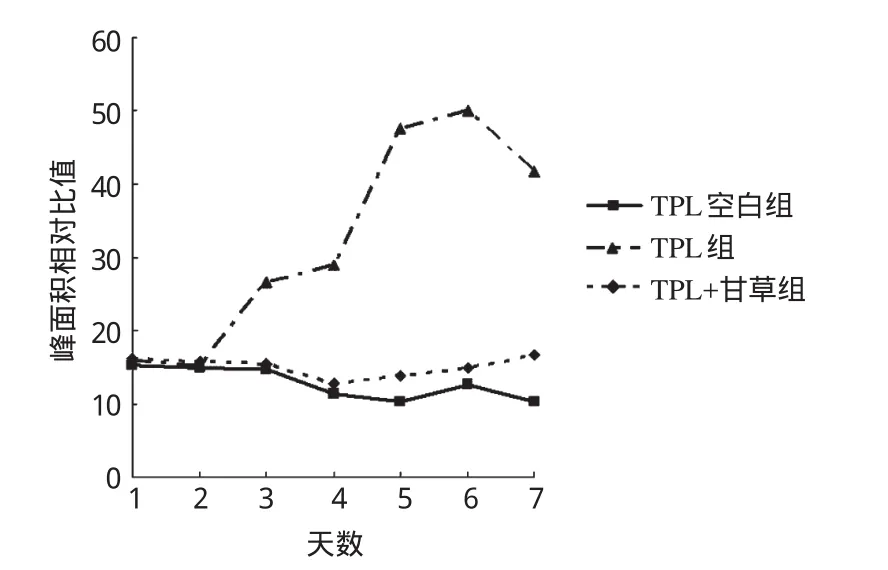
图2 TPL空白组、TPL组、TPL+甘草组大鼠尿液中1-甲基海因随给药天数变化的趋势Fig 2 Trend of 1-methylhydantoin in urine of rats in TPL blank group,TPL group,TPL+G.uralensis group with the days of administration

图3 TPN空白组、TPN组、TPN素+甘草组大鼠尿液中2,6-二羟基喹啉随给药天数变化的趋势Fig 3 Trend of 2,6-quinolinediol in urine of rats in TPN blank group,TPN group,TPN+G.uralensis group with the days of administration
综上所述,TPL和TPN的毒性以及甘草的解毒作用可能与其干扰了肌酐、精氨酸、脯氨酸、脲循环以及色氨酸等代谢途径有关。
[1]贾歌刘畅,庞晶瑶,马致洁,等.雷公藤肝毒性化学成分、毒性机制及减毒方法研究进展[J].中国药房,2016,27(13):1857.
[2]曹玲娟,颜苗,李焕德,等.雷公藤致肝损伤及与甘草配伍减毒机制的研究进展[J].中国中药杂志,2015,40(13):2537.
[3] 刘建群,李青,张锐,等.LC-MS/MS法研究甘草对雷公藤甲素药代动力学及组织分布与排泄的影响[J].药物分析杂志,2010,30(9):1664.
[4] 张锐,李青,刘芳,等.LC-MS/MS法研究甘草对雷公藤内酯酮药代动力学及组织分布与排泄的影响[J].中国实验方剂学杂志,2010,16(7):151.
[5]景欣悦,彭蕴茹,王新敏,等.甘遂与甘草合用对大鼠肝药酶CYP1A2、CYP2C19和CYP2E1的影响[J].中国药理学通报,2015,31(11):1625.
[6]雷羽,熊亮,王霞.海蛇干体的化学成分研究[J].时珍国医国药,2010,21(5):1127.
[7]Smrčková S,Juricová K,Prutianov V.Study of aminoimino tautomerism in derivatives of 2-,4-and 6-aminonicotinic acid[J].Cheminform,1994,59(9):2057.
[8] 袁加程,刘长春.离子液体中6-羟基-3,4-二氢-2(1H)-喹啉酮的合成[J].精细化工,2014,31(5):603.
[9]Rouge P,Cornu A,Biesse-Martin AS,et al.Identification of quinoline,carboline and glycinamide compounds in cow milk using HRMS and NMR[J].Food Chem,2013,141(3):1888.
[10]National Institute of Advanced Industrial Science and Technology(AIST).Spectral database for organic compounds:2-quinolone[DB/OL].[2015-11-16].http://sdbs.db. aist.go.jp/sdbs/cgibin/direct-frame-top-cgi.
[11]韩冬,董雪莲,邱智东.1-甲基海因对哮喘大鼠模型的平喘作用及其机制[J].吉林大学学报:医学版,2014,40(3):543.
[12]游杰舒,张瑞睿,王春国,等.1-甲基海因对抑郁大鼠行为学的影响及机制初探[J].中国药理学通报,2013,29(8):1104.
[13] 杨波,邓薇,蒋云生,等.肌酐代谢产物对人肾小管上皮细胞毒性作用的比较研究[J].中国医师杂志,2011,13(6):738.
[14]Martin-Lorenzo M,Zubiri I,Maroto AS,et al.KLK1 and ZG16B proteins and arginine-proline metabolism identified as novel targets to monitor atherosclerosis,acute coronary syndrome and recovery[J].Metabolomics,2015,11(5):1056.
[15] 杨帆,卓荦,李上勋,等.雷公藤甲素诱发大鼠急性肾损伤的机制[J].中国中药杂志,2011,36(16):2281.
[16]朱顺妮,樊丽,倪晋仁.两株喹啉降解菌代谢途径的分析[J].中国环境科学,2008,28(5):456.
[17]曾民德,江绍基.肝病与卟啉代谢紊乱[J].国外医学内科学分册,1980(9):391.
(编辑:林静)
Effects of Glycyrrhiza uralensis on Metabolites Levels of Triptolide and Triptonide in Rats
LIU Jianqun,ZHANG Guohua,YU Zhaofen,WANG Xuemei(Key Lab of Modern Preparation of TCM,Ministry of Education,Jiangxi University of TCM,Nanchang 330004,China)
OBJECTIVE:To study the effects of Glycyrrhiza uralensis on endogenous metabolites levels of triptolide(TPL)and triptonide(TPN)in rats.METHODS:160 rats were given G.uralensis[30 g(crude drug)/kg]intragastrically,2 h later given TPN(2.8 mg/kg)intraperitoneally for consecutive 30 d.24 h urine were collected for 30 days,and then endogenous metabolites were separated and identified by column chromatograph and spectrum technology.UPLC-Q-TOF/MS was used to determine the common metabolites after giving TPL.60 rats were randomly divided into TPL blank group,TPL group,G.uralensis+TPL group,TPN blank group,TPN group,G.uralensis+TPN group.Route of administration and dosage of treatment groups were same as above groups.TPL blank group and TPN blank group were given corresponding solvent,once a day,for consecutive 7 d.UPLC-QTOF/MS was used to determine the endogenous metabolites of TPL and TPN in rats.RESULTS:Five endogenous metabolites were isolated and identified from urine of rats after given TPN,as 1-methylhydantoin,methyl 4-aminonicotinate,3,4-dihydro-6-hydroxy-2(1H)-quinolinone,2,6-quinolinediol,2-quinolone,respectively.Those five metabolites were also found in urine of rats after giving TPN.1-methylhydantoin in TPL group and 2,6-quinolinediol in TPN group were significantly increased,compared with TPL blank group or TPN blank group(P<0.05);while urine levels of 1-methylhydantoin and 2,6-quinolinediol decreased after TPL or TPN combining with G.uralensis,compared with TPL/TPN blank group,with no significant difference(P>0.05).CONCLUSIONS:The above five endogenous metabolites were isolated from rat urine after given TPL or TPN for the first time.The levels of 1-methylhydantoin after giving TPL and 2,6-quinolinediol in urine after giving TPN can be recovered by G.uralensis.
Glycyrrhiza uralensis;Triptolide;Triptonide;Endogenous metabolite;Rats
R917
A
1001-0408(2016)28-3914-04
10.6039/j.issn.1001-0408.2016.28.08
国家自然科学基金资助项目(No.81160541);江西省卫生厅中医药科研计划项目(No.2011A143)
*教授,博士。研究方向:中药药效物质基础及质量评价。电话:0791-87119027。E-mail:liu5308@sina.com
(2016-02-02
2016-05-31)
